La reabsorción del hueso crestal en la primera rosca coronal del primer implante coronal de un implante dental de dos piezas se observa con frecuencia tras la inserción del pilar. Se ha reconocido que el implante dental con carga funcional tiene como promedio una pérdida ósea de 1,0 mm durante el primer año, y posteriormente un mínimo de 0,10 mm por año de funcionamiento1-4. Se especula que los posibles factores causales son traumatismos quirúrgicos inadvertidos, sobrecarga oclusal que provoca una gran tensión en la interfaz implante-hueso, la presencia de microgrietas que provocan una infiltración bacteriana en la unión implante-pilar, y el establecimiento apical resultante de la acomodación del tejido conjuntivo supracrestal en la anchura biológica. Los problemas asociados a la continua reabsorción del hueso crestal son la formación de un surco periimplantario imposible de limpiar con presencia de inflamación, la recesión que conduce a una pérdida de tejido blando interproximal, y el potencial de pérdida ósea que puede comprometer la estabilidad del implante.
El tejido conjuntivo periimplantario que se establece tras la cirugía implantológica con implantes Laser-Lok (BioLock International, ahora fabricados por Biohorizons) actúa como una barrera eficaz frente a la migración apical de la unión epitelial5. Esto se traduce en la protección del nivel óseo en 1 mm de tejido conjuntivo. En comparación, el diente natural dispone de tejido conjuntivo unido a través de las fibras de Sharpey a la superficie del cemento en un plano perpendicular. Las observaciones anteriores con implantes osteointegrados describen estas fibras de colágeno paralelas al implante6-14. La unión física de las fibras de tejido conjuntivo a los microcanales Laser-Lok del cuello del implante se ha demostrado claramente mediante histología humana, microscopía de luz polarizada y microscopía electrónica de barrido5. El uso de microcanales Laser-Lok dio lugar a una unión física funcional y perpendicular que permitió estabilizar el nivel óseo y reducir la pérdida de hueso crestal5,15.
El objetivo de este estudio radiográfico retrospectivo fue revisar la eficacia del cuello Laser-Lok para preservar el nivel de hueso crestal en una amplia variedad de situaciones que se presentan en la clínica privada. Se consideró que la evaluación radiográfica era adecuada porque los cambios en el nivel de hueso crestal observados en las radiografías periapicales estandarizadas son muy exactos en comparación con las histologías no calcificadas16.
Materiales y métodos
Este estudio se realizó en una única consulta privada en 41 pacientes tratados de forma consecutiva (promedio de edad, 62 años) a los que se colocó un total de 50 implantes dentales Laser-Lok entre febrero de 2005 y enero de 2007. Se colocaron 37 implantes en el maxilar superior y 13 en el maxilar inferior (35 con conexión interna y 15 con hexágono externo). Se revisaron los historiales clínicos y dentales, se realizaron exámenes clínicos y radiográficos y cada paciente firmó el consentimiento informado. Los pacientes seleccionados fueron aquellos visitados por una clínica periodontal privada de referencia sin antecedentes médicos o tratamientos significativos que impidiesen realizar la mayor parte de las intervenciones quirúrgicas periodontales. Los pacientes se prepararon para la cirugía según las guías de práctica dental aceptadas, y la cirugía implantológica se realizó de forma ambulatoria. Se elevaron colgajos de espesor total con una incisión horizontal para revelar la superficie ósea tras administrar anestesia local (lidocaína al 2 % con adrenalina 1:100.000). Se utilizaron incisiones verticales para mejorar la visibilidad. Se prepararon las osteotomías para los implantes según las instrucciones del fabricante y se colocaron los implantes. Se realizó el cierre del colgajo primario con suturas reabsorbibles y no reabsorbibles y se procedió a la realización de las radiografías periapicales utilizando una técnica en paralelo para registrar el nivel óseo exacto en el momento inicial (Gendex Dental Systems, KaVo). Se instruyó a los pacientes para que no cepillasen o pasasen el hilo dental en las zonas intervenidas hasta la retirada de los puntos que se produjo a los 14 días. También se les enseñó a realizar enjuagues con clorhexidina al 0,12% diariamente durante 1 semana y se les recetaron los antibióticos y analgésicos adecuados.
Se realizaron las evaluaciones postoperatorias rutinarias hasta el momento de la segunda fase de la intervención y la conexión del pilar. Los tornillos de cierre se sustituyeron por pilares de cicatrización utilizando la técnica del sacabocados si la encía presentaba una adecuada queratinización alrededor del aspecto facial del implante. En las zonas con una encía no adecuada se elevó un colgajo mucoperióstico de espesor total, se colocaron pilares de cicatrización, y el colgajo se reposicionó apicalmente para crear una zona gingival más amplia. Después de eso se realizó una radiografía periapical. El promedio de tiempo entre la cirugía inicial de colocación del implante hasta la conexión del pilar de conexión fue de 4,8 meses.
Se realizaron radiografías poco después de la restauración y al cabo de 1, 2 y 3 años aproximadamente. Estas radiografías digitales se importaron a PhotoShop CS3 mediante Analysis Toolkit (Adobe). Se obtuvieron 3 mediciones de cada implante: longitud del implante en el eje medio, y longitud ósea perpendicular a la cresta mesial y distal hasta el borde apical del implante (utilizado como punto de referencia). Todas las mediciones se exportaron a una hoja Excel (Microsoft 2007) para su análisis. La longitud ósea mesial y distal perpendicular a la cresta se estandarizó con la longitud conocida del eje medio del implante y posteriormente se realizó el promedio de la longitud ósea perpendicular a la cresta mesial y distal y se registró el promedio del cambio de nivel óseo. Cada zona del implante se serializó y se codificó para realizar mediciones objetivas y no sesgadas.
Resultados
Se colocaron 50 implantes en una amplia variedad de situaciones clínicas que se presentan de forma habitual en la consulta periodontal. Los implantes se colocaron en zonas edéntulas, zonas sometidas con anterioridad a injertos óseos e inmediatamente tras la extracción (figuras 1 a 3). Treinta y nueve de los 50 implantes se colocaron en la región anterior (78 %) y los 11 restantes se colocaron en zonas molares (22 %) (figuras 4 y 5). Un implante fracasó como consecuencia de un absceso endodóncico en un diente adyacente, de forma que el número total de implantes para su análisis radiográfico fue de 49.
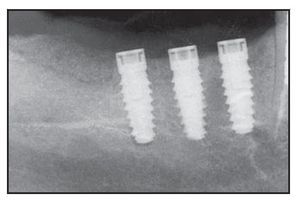
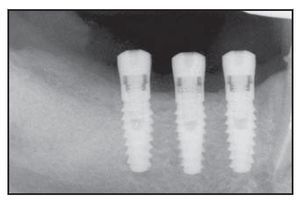
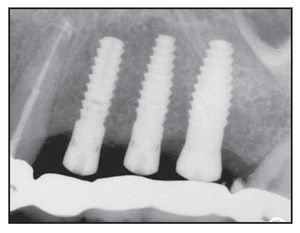
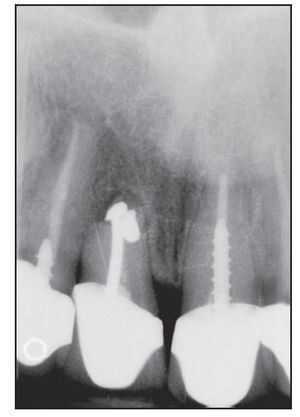
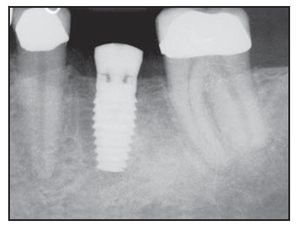
Figura 1a Colocación inicial de 3 implantes Laser-Lok en una mujer de 75 años con bruxismo.
Figura 1b Pilares de cicatrización colocados 5 meses después de la cirugía.
Figura 1c Radiografía de los implantes Laser-Lok restaurados con 2 años de funcionamiento.
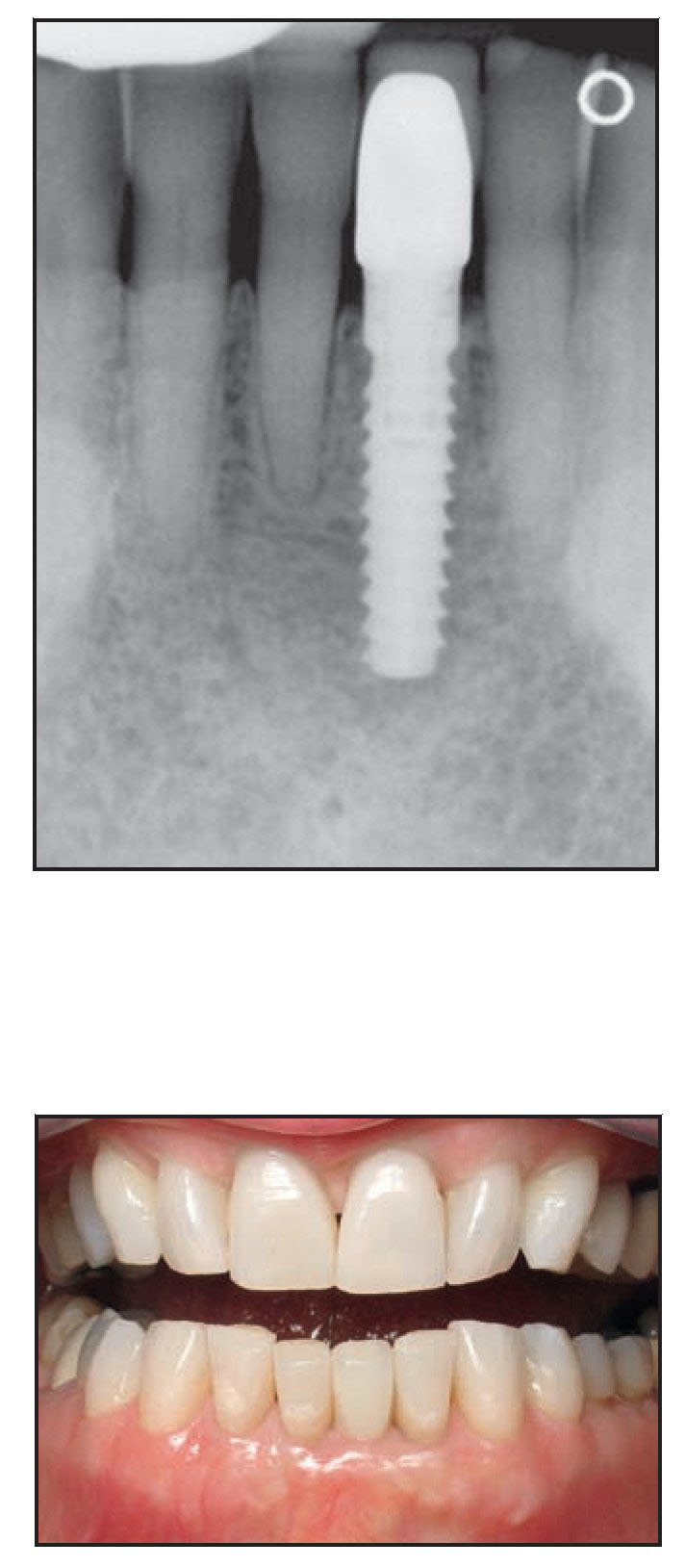
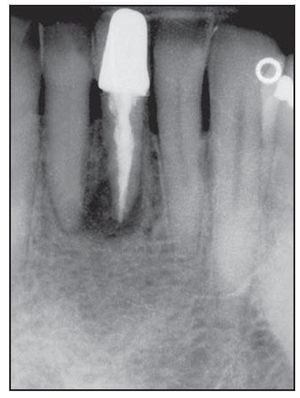
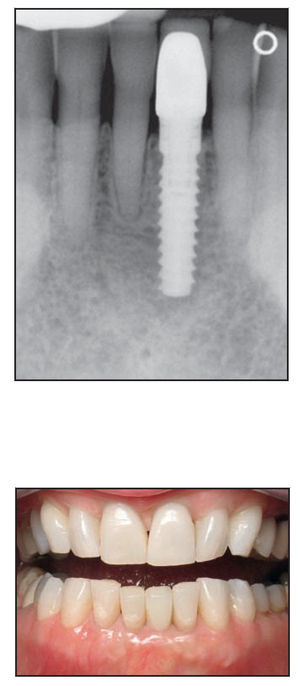
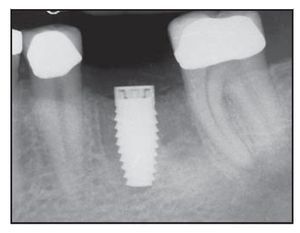
Figura 2a Radiografía inicial de un defecto alrededor del incisivo central izquierdo del maxilar inferior. La zona mostró una pérdida completa de la placa vestibular y el implante se colocó utilizando un injerto óseo y una membrana de barrera reabsorbible.
Figura 2b Pilar de cicatrización colocado 5 meses después del implante con injerto óseo simultáneo.
Figuras 2c (superior) y 2d (inferior) Radiografía (c) y fotografía clínica (d) a los 2 años de la pieza restaurada. Obsérvense los niveles estables de hueso crestal.
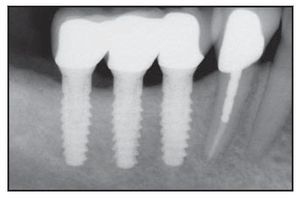
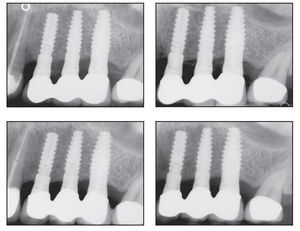
Figura 3a (izquierda) Radiografía inicial del fracaso de una prótesis parcial fija en la región posterior izquierda del maxilar superior. Una tomografía computerizada reveló una anchura de la cresta de 4 a 5 mm que requirió una técnica de cresta dividida en el momento de la colocación del implante.
Figura 3b (derecha) Pilares de cicatrización colocados 3,5 meses después de la división de la cresta y la colocación del implante.
Figuras 3c a 3f Radiografías digitales realizadas al cabo de (superior izquierda) 1 año, (superior derecha) 2 años, (inferior izquierda) 3 años, y (inferior derecha) 4 años tras la restauración mostrando la estabilidad del hueso crestal.
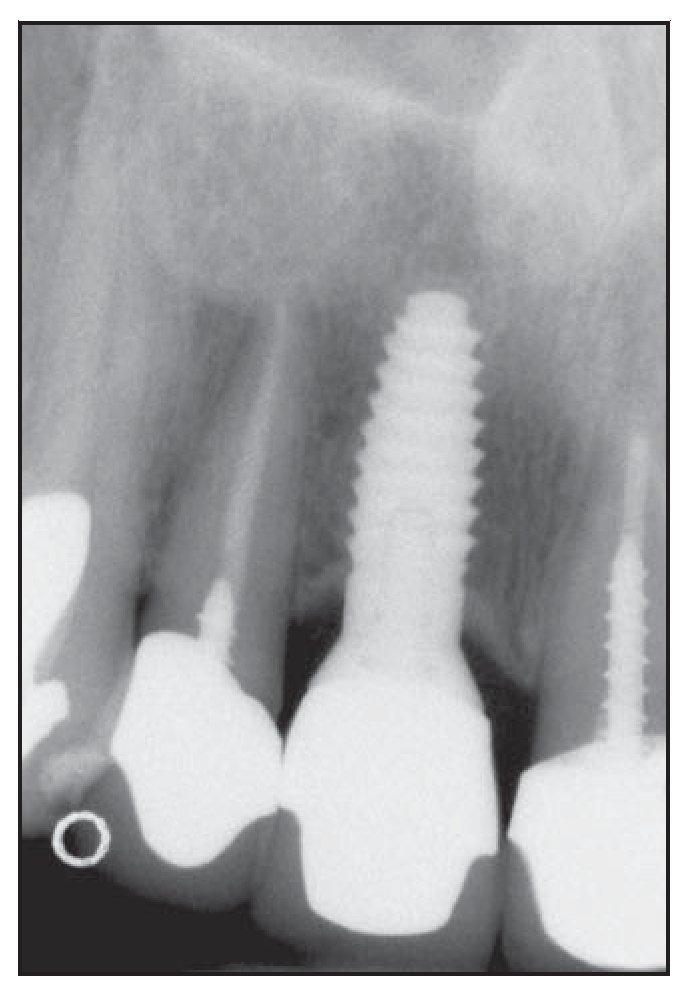
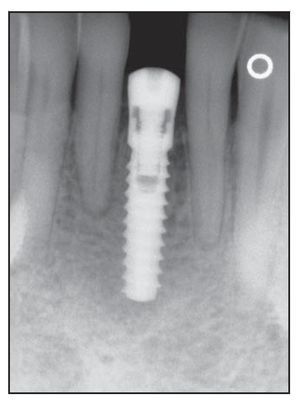
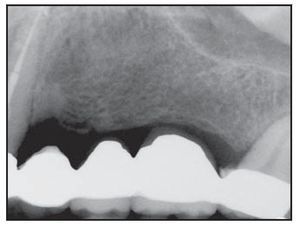
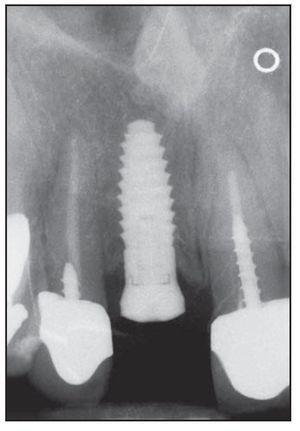
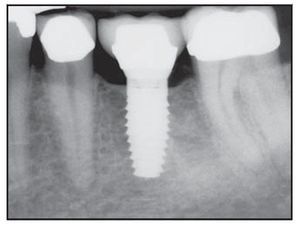
Figura 4a Radiografía inicial de in incisivo central derecho inviable en el maxilar superior.
Figura 4b Pilar de cicatrización colocado 6 meses después del implante y del injerto óseo en el alveolo.
Figura 4c Radiografía digital del implante Laser-Lok de 5 mm de ancho 2 años después de la restauración.
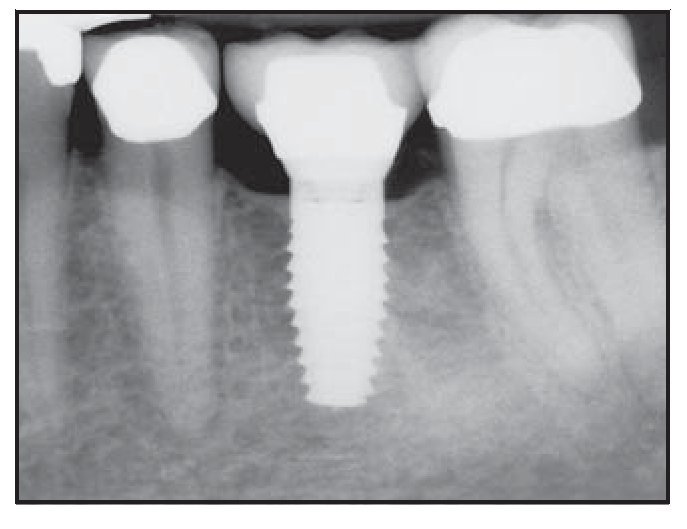
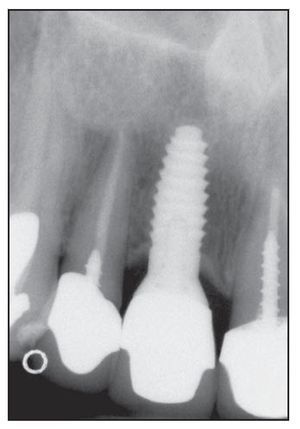
Figura 5a Colocación inicial de un implante Laser-Lok de 5 mm en la zona injertada 5 meses antes tras extraer el diente fracturado.
Figura 5b Colocación de un pilar de cicatrización 3 meses después de la colocación del implante.
Figura 5c Seguimiento de 3 años del implante Laser-Lok. Obsérvese la estabilidad de hueso crestal y el aumento de la densidad del hueso crestal adyacente al cuello microtexturizado.
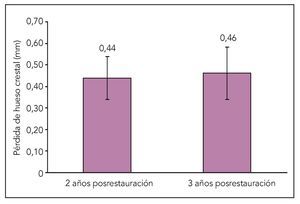
Figura 6 Promedio de la variación en el nivel de hueso crestal durante 2 marcos temporales diferentes.
El nivel radiográfico de hueso crestal se expresó en mm desde la parte más coronal de la plataforma del implante hasta el primer contacto hueso-implante. En 41 de los 49 implantes originales se realizaron radiografías posrestauración al cabo de 2 años (figuras 1, 2 y 4), y en 30 de esos implantes se realizaron radiografías al cabo de 3 años (figuras 3 y 5). Se pudo realizar el seguimiento radiográfico durante un período de tiempo más largo en un número reducido de implantes (figura 3f). El promedio de la variación en el nivel de hueso crestal del grupo posrestauración a los 2 años fue de -0,44 ± 0,10 mm, mientras que el promedio de variación en el nivel de hueso crestal del grupo posrestauración a los 3 años fue de -0,46 ± 0,12 mm (figura 6). No existieron diferencias estadísticamente significativas en el promedio de variación en el nivel de hueso crestal entre estos dos grupos (p > 0,05). Además, los resultados de los implantes colocados en las zonas edéntulas, zonas injertadas con anterioridad, o inmediatamente tras la extracción no presentaron diferencias estadísticamente significativas entre ellos y, por tanto, los implantes se analizaron de forma colectiva.
Discusión
La preservación de los tejidos duros y blandos adyacentes a un implante depende en parte de las características de la superficie física de los implantes para favorecer la unión de las células y los tejidos. Se han investigado varias modificaciones de las propiedades de la superficie, como topografía, estructura, química, carga de superficie e hidrofilia en un intento por mejorar la integración marginal de los tejidos blandos y duros con las diferentes superficies del implante15,17-20. La microtopografía de la superficie permite mostrar los diferentes grados de adhesión, proliferación, organización y diferenciación en diferentes topografías de los diferentes tipos celulares18,19. La investigación con células progenitoras mesenquimatosas humanas sobre superficies de titanio rugoso tratadas para proporcionar superficies nanotopográficas demostró una destacada osteoinducción y osteogénesis de las células adherentes21. Colectivamente, estos estudios demostraron la necesidad de superficies con micro y nanotopografías. Los microcanales de superficie con una forma y profundidad específica han demostrado controlar de forma específica la función de las células osteoblásticas y fibroblásticas22-25 dado que limitan de forma simultánea la invasión y la proliferación de las células epiteliales5,20.
El éxito relativo de un implante dental está correlacionado directamente con el nivel de hueso y de tejido conjuntivo unido al implante. La micro y nanotopografía de la superficie de un implante se ha identificado como factor clave en la unión y diferenciación de muchos tipos celulares, como los fibroblastos epiteliales, que son responsables de la producción del tejido conjuntivo rico en colágeno que rodea los implantes dentales. Algunos investigadores han descrito la orientación funcional de las fibras de colágeno del tejido conjuntivo insertadas en el cuello del implante, pero al parecer, la orientación se ve afectada por la calidad de la mucosa7,26,27. Las fibras tendieron a estar paralelas en la mucosa alveolar y organizadas de forma más perpendicular en la mucosa queratinizada28. Las evaluaciones preclínicas y clínicas han demostrado de forma rutinaria fibras de tejido conjuntivo paralelas a la superficie del implante6,8,13,14,17. Un estudio publicado recientemente comparó la orientación histológica de las fibras de colágenos alrededor del cuello de implantes de metal liso con el de superficies recubiertas de circonio. Las fibras de colágeno se orientaron predominantemente de forma paralela o paralelo-oblicua, independientemente del material del implante29.
La concentración de tensión alrededor de los implantes en el hueso crestal depende del diseño del implante y de su capacidad para unirse al hueso adyacente30. Un estudio reciente sobre análisis de elemento finito en ingeniería reveló que el diseño Laser-Lok presentó una menor tensión en el hueso crestal, en particular, la tensión asociada con la carga fuera del eje que suele producirse en la zona del cuello31. Un estudio realizado en animales que comparó el cuello microtexturizado por láser con el cuello mecanizado demostró que éste último sufrió una invasión epitelial mayor y una mayor actividad osteoclástica con aumento de la reabsorción ósea20. Además, se produjo una adaptación más estrecha del hueso al cuello microtexturizado por láser, así como evidencias de una invasión epitelial limitada y la presencia de una unión de tejido conjuntivo al cuello microtexturizado por láser. Así pues, los resultados de ese estudio apoyaron la hipótesis de que un cuello microtexturizado por láser puede limitar la invasión epitelial, mejorar la inserción del tejido blando al hueso, y simular la anchura biológica observada en la dentición natural. Nevins y cols.5 también han demostrado, a través de la microscopía electrónica de barrido y el análisis histológico en humanos, que el Laser-Lok produce una inserción de tejido conjuntivo alrededor de la zona del cuello de los implantes tratados por láser. Las rugosidades de 12 micras demostraron el mejor potencial para inhibir el crecimiento de tejido fibroso en relación al crecimiento de las células óseas, y las rugosidades de 8 micras demostraron la inhibición más eficaz de la migración de las células epiteliales a lo largo de las rugosidades20,24,25. Estos resultados son similares a los de un estudio realizado in vitro por Boyan y Scwartz32, que sugería unos rangos específicos de distancia y altura de la microestructura de superficie para obtener una respuesta celular óptima. Otros sistemas de implantes dentales han anunciado superficies de microtextura en el aspecto coronal del implante. Sin embargo, estas microtexturas son mucho más grandes (200 a 250 µm) y a nivel celular representan superficies que no modulan la morfología de los osteoblastos de forma tan eficaz como los microcanales Laser-Lok de 8 y 12 µm33.
En este análisis radiográfico retrospectivo, realizado en una clínica privada, se evaluaron radiográficamente 49 implantes dentales Laser-Lok durante un período de hasta 3 años tras la restauración para determinar el cambio en los niveles de hueso crestal en relación a la parte más coronal de la plataforma del implante. Los resultados demostraron una pérdida promedio de 0,44 ± 0,10mm y 0,46 ± 0,12 mm de altura de hueso crestal desde la cirugía inicial hasta 2 y 3 años después de la restauración, respectivamente. Un estudio piloto publicado con anterioridad en 2000 por Shapoff en 6 pacientes con implantes BioLok de hexágono externo de 1 mm y cuello de microcanales Laser-Lok demostró niveles muy estables de hueso crestal que se mantuvieron durante 8 años.
Entre las limitaciones del actual estudio radiográfico destaca su naturaleza retrospectiva y el uso de radiografías no estandarizadas. Sin embargo, los resultados son compatibles con un estudio prospectivo controlado realizado por Pecora y cols.15. En ese estudio, el implante Laser-Lok redujo la pérdida de hueso crestal a aproximadamente 0,6 mm a los 3 años, en comparación con un implante de cuello mecanizado que presentó una pérdida de hueso crestal de 1,9 mm. Además, el implante Laser-Lok fue comparable al implante de cuello mecanizado con respecto a los criterios de valoración de seguridad del índice de placa e índice de sangrado sulcular.
Se han realizado otros intentos por reducir al mínimo la pérdida esperada de hueso crestal de entre 1,5 y 2,0 mm, como el uso de implantes de una pieza o el concepto de plataforma modificada34-38. Por ejemplo, Cappiello y cols.36 evaluaron la pérdida ósea alrededor de 75 implantes de dos piezas que se restauraron según el protocolo de plataforma modificada. Su análisis radiográfico de 12 meses reveló una pérdida ósea entre 0,6 y 1,2 mm (promedio, 0,95 ± 0,32 mm). Un estudio prospectivo de 5 años publicado recientemente sobre implantes de plataforma modificada demostró una pérdida de hueso crestal de 0,6 mm desde el borde apical del cuello metálico liso, en comparación con los 0,9 mm del diámetro del pilar correpondiente39. Debe destacarse que este estudio utilizó un implante de hexágono externo con una dimensión mínima del cuello, y en muchos casos los implantes se colocaron 1 mm subcrestalmente. Los resultados obtenidos fueron comparables a los resultados del estudio aquí descrito.
Conclusión
La presencia de la superficie Laser-Lok provocó la estabilidad de la cresta ósea sin pérdida de hueso hasta la primera rosca. Los implantes Laser-Lok presentaron una menor pérdida de hueso crestal a los 3 años de la restauración que la aceptada habitualmente de 1,5 a 2,0 mm. Esto probablemente sea resultado de una inserción fija del hueso, el tejido conjuntivo fibroso y la inserción epitelial al cuello de implante, lo que dio lugar a un sellado estable del tejido blando que protegió el hueso crestal.
Agradecimientos
Los autores desean agradecer al Dr. Soo Woo Kim la realización de los análisis radiográficos.
Correspondencia: Dr Cary A.
Shapoff, 71 Beach Road, Fairfield, CT 06430;
e-mail: cas@shapoff.com.