El objetivo de utilizar un injerto de sustitución ósea para tratar los defectos óseos causados por la enfermedad periodontal es la regeneración de nuevo hueso, cemento y ligamento periodontal. Los materiales aloplásticos son muy aconsejables porque su cantidad es ilimitada, no presentan riesgo de enfermedades infecciosas, y eliminan la morbilidad de la zona donante. Hasta la fecha, ningún material aloplástico ha provocado regeneración periodontal1-8.
Se ha desarrollado un nuevo material aloplástico (Norian Periodontal Dental Cement [PDC], Shofu), un cemento óseo de fosfato cálcico inyectable, moldeable y de fraguado rápido, para uso periodontal9-11. Este cemento está formado por dos fosfatos de calcio diferentes: carbonato de calcio y fosfato de sodio. Estos componentes se mezclan en el momento de la intervención para formar una pasta que puede inyectarse o aplicarse manualmente. Una vez mezclada, la pasta puede trabajarse hasta 5 min y puede modelarse como se desee. Después de 10 min la pasta se endurece isotérmicamente formando un producto de pH neutro y no tóxico. El PDC fragua en una apatita carbonatada similar a la hidroxiapatita, con la excepción de un grupo carbonato que sustituye a un grupo hidroxilo12. Los estudios ortopédicos y del material han demostrado que el PDC es biocompatible in situ9-13. Un estudio realizado en animales indicó que el PDC actúa como armazón para la formación ósea en el tratamiento de los defectos periodontales14. El PDC se ha evaluado clínicamente en pacientes sometidos a cirugía craneomaxilofacial y ha demostrado ser un sustitutivo mineral óseo adecuado12,15-18. Puesto que la regeneración solamente puede confirmarse mediante análisis histológicos, el objetivo de este estudio fue evaluar los resultados clínicos e histológicos de este nuevo cemento óseo inyectable de fosfato cálcico en el tratamiento de los defectos óseos interproximales en seres humanos.
Materiales y método
En este estudio participaron 4 pacientes que presentaban una periodontitis crónica severa y un pronóstico periodontal imposible. La profundidad al sondaje de todas las piezas era de cómo mínimo 7 mm y existían indicios radiográficos de pérdida de hueso vertical mayor de 4,0 mm. Todos los pacientes recibieron y firmaron el consentimiento informado aprobado por el Institutional Board of the University of Texas Health Science Center de San Antonio. Además cada paciente recibió explicaciones verbales sobre todas las ventajas e inconvenientes de participar en este estudio.
Se seleccionó para el tratamiento una zona de cada paciente. Se proporcionaron instrucciones sobre higiene oral a los pacientes pero no se realizaron desbridamientos ni ajustes oclusales antes de la cirugía. El día de la intervención (inicial) se registró la profundidad al sondaje, la recesión gingival y el nivel de inserción clínica mediante una sonda periodontal de 15 mm de la Universidad de Carolina del Norte (UNC 15) (Hu-Friedy). Las incisiones sulculares se extendieron como mínimo entre una y tres piezas mesiales y distales al diente tratado para asegurar la visualización del defecto y permitir un mejor manejo y colocación del material estudiado. Se elevaron colgajos mucoperiósticos vestibulares y linguales. Antes de realizar el raspado y alisado radicular se realizó una muesca a través y a lo largo de la extensión apical del cálculo19. Esto actuó como marca distintiva histológica y cumplió el criterio de superficie radicular contaminada sobre la que basar la regeneración periodontal. Posteriormente se rasparon y alisaron de forma exhaustiva las superficies radiculares y se retiró todo el tejido de granulación. No se utilizó la biomodificación de la superficie radicular. El material de injerto se preparó mezclando el polvo de fosfato monocálcico monohidrato, el fosfato tricálcico alfa y el carbonato de calcio con una solución de fosfato sódico. El polvo y el líquido se mezclaron en una cápsula con un triturador de amalgama durante 20 s. La pasta resultante se inyectó en el defecto periodontal con un aplicador diseñado especialmente y se alisó. Los colgajos tisulares se colocaron coronalmente y se suturaron. Se dieron instrucciones postoperatorias a los pacientes y se solicitó que realizaran enjuagues con una solución de clorhexidina al 0,12 % dos veces al día. Se recetó hiclato de doxicilina (100 mg/día durante un mínimo de 10 días) e ibuprofeno (800 mg cada 8 h). Los puntos se retiraron de 10 a 21 días más tarde.
La evaluación de los individuos se realizó a intervalos de 2 semanas durante 6 meses, e incluyó la retirada de la placa bacteriana, el raspado y alisado radicular y el ajuste oclusal, en función de las necesidades. A los 6 meses de la cirugía se obtuvieron radiografías periapicales. Las mediciones clínicas se repitieron utilizando la misma sonda UNC de 15 mm. Se realizó una incisión submarginal bajo anestesia local dejando un cuello de 1,0 a 2,0 mm de margen gingival adyacente al diente y se elevaron colgajos de espesor total en los aspectos facial y lingual. El diente y la zona de interés se extirparon en bloque. Las dimensiones generales del bloque fueron tales que se dejaron 2,0 mm o menos de hueso adyacente al diente en la zona de interés. Una vez se liberó por completo la muestra deseada, se extirpó con cuidado y de forma atraumática, se lavó con una solución salina y se colocó en formalina al 10 % con tampón neutro. El defecto residual se reconstruyó con un aloinjerto óseo mezclado con un derivado de la matriz del esmalte y se cubrió con una membrana reabsorbible. Tras un período adecuado de cicatrización, el paciente fue remitido para su rehabilitación protésica.
Los cortes tisulares fijados en formalina neutra se lavaron con agua y se deshidrataron en una serie gradual de concentraciones incrementales de etanol. Cada muestra se procesó para su preparación utilizando el método Exakt. Las muestras se infiltraron en una resina de metilmetacrilato y después de su polimerización se cortaron longitudinalmente para obtener cortes histológicos de aproximadamente 150 mm. Los cortes se redujeron mediante microtriturado y pulido hasta un grosor final de 20 a 30 mm. Cada muestra produjo de 4 a 5 cortes histológicos por bloque.
Se realizó el análisis histomorfométrico de todos los cortes de cada bloque. Se utilizó un microscopio óptico con cámara para el examen de las muestras y todas las imágenes obtenidas se guardaron como archivo .tiff en un ordenador y se analizaron mediante un programa especializado de análisis de imágenes (Image-Pro Plus, versión 6.0, Media Cybernetics). Antes de registrar ningún dato, el programa se calibró para obtener un cociente 1,0:1,0 mm. El examinador desconocía el tipo de material injertado. Se obtuvieron las mediciones lineales de los siguientes parámetros desde la base de la muesca de la raíz: formación de hueso nuevo, cemento nuevo, nueva inserción de tejido conjuntivo y epitelio de unión. Se anotaron y se describieron otros parámetros presentes tales como reabsorción radicular, anquilosis, dirección de las fibras del ligamento periodontal y grado de inflamación.
Resultados
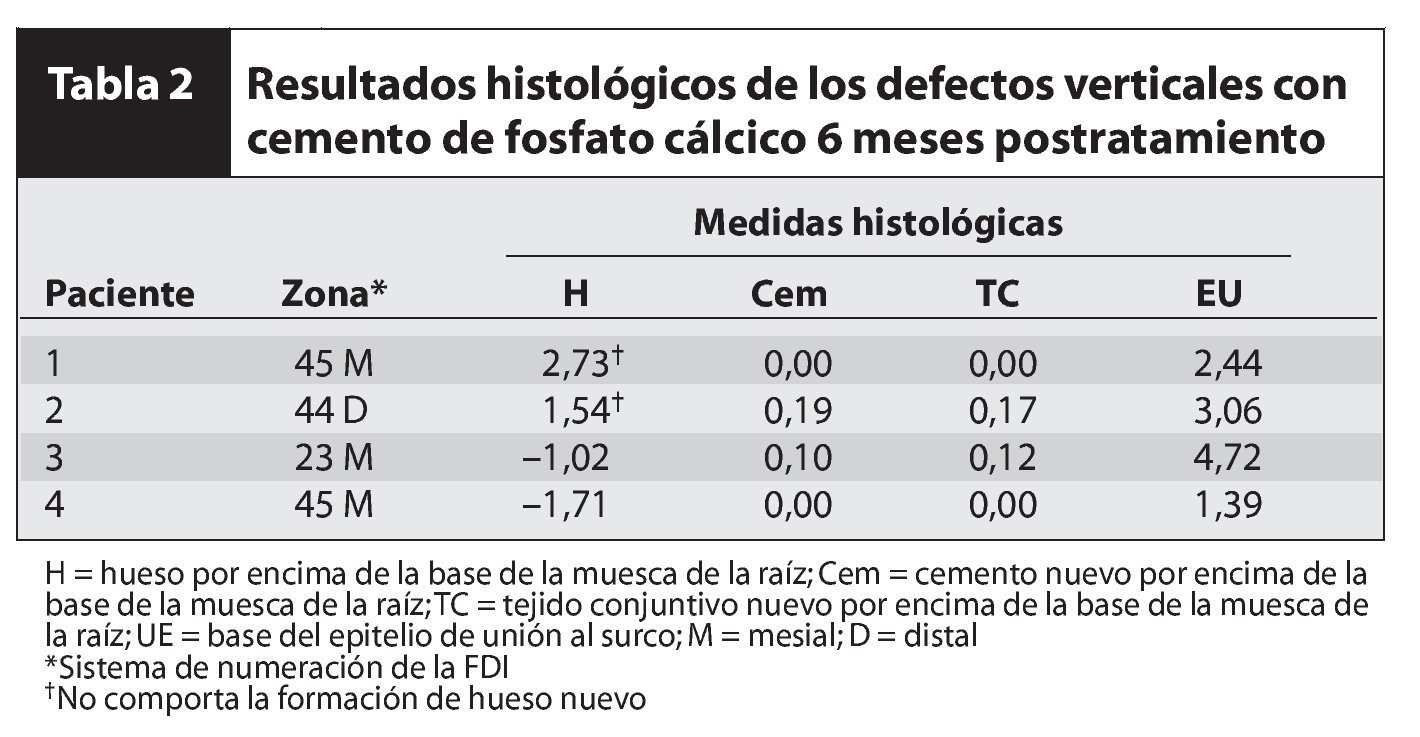
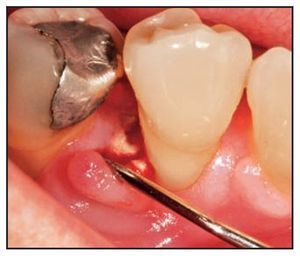
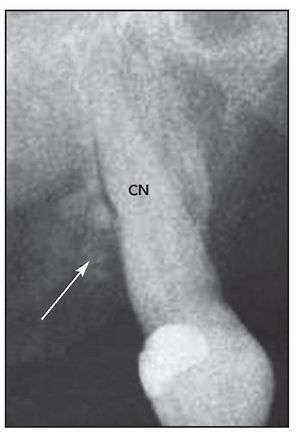
Los resultados de este estudio indican que si bien se produjo una mejoría clínica en todas las zonas, no se observó regeneración periodontal. La tabla 2 muestra los resultados de las mediciones clínicas iniciales y postratamiento. La tabla 1 también muestra el sexo y la edad de los pacientes. Ninguno de ellos era fumador y en todos ellos la cicatrización durante el primer mes fue mala. El tejido gingival estuvo muy inflamado y pudo observarse PDC entre los colgajos. Tras el primer mes, la cicatrización de la herida mejoró de forma espectacular, y hacia los 6 meses se situó dentro de los límites normales (figuras 1a a 1e). La evaluación radiográfica mostró el PDC como pequeños o grandes grupos de material radiolúcido en todas las muestras (figura 2).
Figura 1a Paciente 2. Se aprecia una profundidad al sondaje de 8,0 mm en la visita inicial.
Figura 1b Defecto amplio de dos o tres paredes con una profundidad de 7,0 mm.
Figura 1c El defecto intraóseo se rellena con el cemento óseo de fosfato cálcico.
Figura 1d Encía inflamada 2 semanas postratamiento. Se observa la dehiscencia de la herida y el cemento óseo de fosfato cálcico.
Figura 1e Después de 6 meses, los tejidos ocupan los límites normales a pesar de la acumulación marginal de placa bacteriana.
Figura 2 (derecha) Radiografía del canino superior izquierdo del paciente 3 seis meses después de la cirugía. Se observan partículas de cemento óseo de fosfato cálcico (flecha). CN = muesca en el cálculo.
Los resultados histológicos se describen en la tabla 2. La cicatrización histológica fue evidente a través del epitelio de unión en todos los casos excepto en uno (figuras 3 y 4). En dos muestras se observó una pequeña cantidad de cemento e inserción de tejido conjuntivo nuevos (0,1 a 0,2 mm) en la base de la muesca de la raíz. Esta cantidad era tan pequeña que se consideró insignificante. En todos los cortes se pudieron observar partículas grandes y pequeñas de PDC encapsuladas en tejido conjuntivo. Hacia los 6 meses se había producido una ligera reabsorción del PDC. En dos muestras, el nivel óseo fue de 1,5 a 2,8 mm coronales a la muesca de la raíz. Este hueso estaba situado a 1,0-3,0 mm de la superficie de la raíz y tenía relación con las paredes del defecto óseo original. En dos muestras se observó un tejido inflamatorio infiltrado predominantemente por linfocitos alrededor del material del injerto. No se observó reabsorción radicular ni anquilosis.
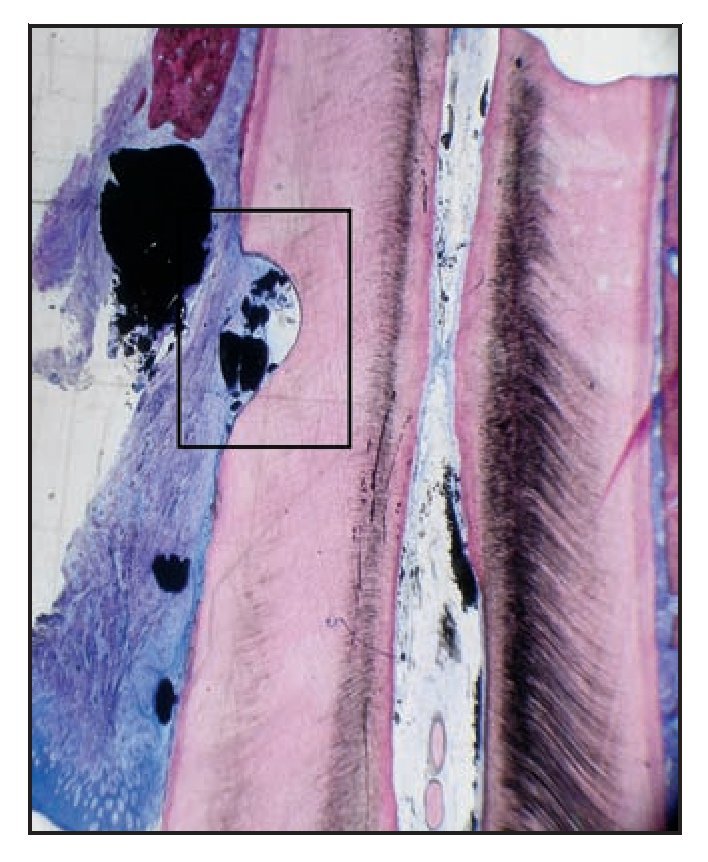
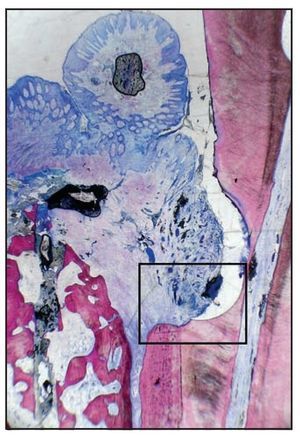
Figura 3a (izquierda) Imagen a bajos aumentos del corte histológico en el paciente 2. Se observa la muesca en el cálculo radicular, las partículas del cemento óseo de fosfato cálcico y el defecto óseo residual (hematoxilina-eosina; x1).
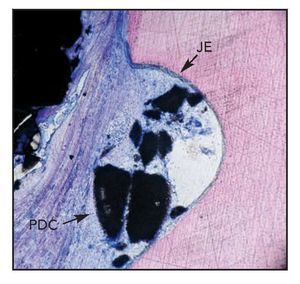
Figura 3b (derecha) Imagen a grandes aumentos del corte histológico de la figura 3a. Se aprecia una capa delgada de cemento nuevo (NC) en la base de la muesca del cálculo radicular. Se aprecia claramente el borde terminal del epitelio de unión (JE) y el cemento óseo de fosfato cálcico (PDC) (hematoxilina-eosina; x10).
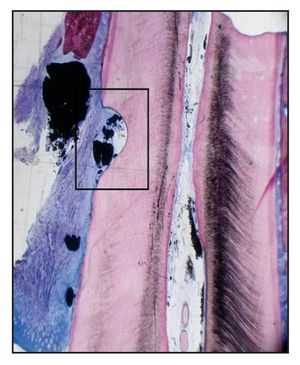
Figura 4a (izquierda) Imagen a bajos aumentos de un corte histológico del aspecto mesial del canino inferior izquierdo del paciente 3. Se observan grandes partículas del cemento óseo de fosfato cálcico (hematoxilina-eosina; x1).
Figura 4b (derecha) Imagen a grandes aumentos de la zona de la muesca radicular del corte histológico de la figura 4a. JE = epitelio de unión, PDC = cemento óseo de fosfato cálcico (hematoxilina-eosina; x10).
Discusión
El PDC inyectable y moldeable, si bien demostró una reducción de la profundidad al sondaje de 2,0 a 7,0 mm y una ganancia del nivel de inserción clínica de 2,0 a 4,0 mm, no se vio acompañado por la regeneración de hueso, cemento o ligamento periodontal nuevos. Las cuatro muestras cicatrizaron por el epitelio de unión (figura 3). El PDC permaneció en forma de partículas de pequeño o gran tamaño encapsuladas en el tejido conjuntivo, de forma que, en su mayor parte, no presentó inflamación (figura 4). Estos resultados son compatibles con otras observaciones histológicas de una variedad de materiales aloplásticos1-8.
La cicatrización inicial de la herida del tejido blando fue mala ya que los tejidos gingivales estaban muy inflamados. En todos los casos, una vez que se retiraron los puntos se formaron cráteres en el tejido blando y se expuso el fosfato cálcico del cemento óseo. En estas zonas la placa se eliminó de forma meticulosa y se instruyó a los pacientes en el uso de un cepillo interproximal empapado en clorhexidina. La mala cicatrización de la herida persistió durante 2 o 3 semanas y luego fue mejorando de forma gradual. Hacia los 6 meses las zonas ya no presentaban inflamación ni sangrado al sondaje, a pesar de una cierta acumulación marginal de placa bacteriana.
Debe hacerse énfasis en que todos los pacientes fueron visitados para realizar el mantenimiento periodontal cada 2 semanas hasta el momento de la biopsia a los 6 meses. El mantenimiento consistió en un raspado con instrumental ultrasónico para eliminar la placa bacteriana y el cálculo supragingival y realizar los ajustes oclusales necesarios. Todas las piezas presentaron una movilidad de Miller inicial de grado 1 o 2. El control de la movilidad de las piezas se consideró extremadamente importante ya que un exceso de movilidad afecta de forma negativa a la cicatrización de la herida20,21.
Las zonas de las que se extrajeron las resecciones en bloque cicatrizaron sin complicaciones y con la reconstrucción de la cresta alveolar completa. Se proporcionaron todos los cuidados restauradores necesarios sin ningún coste adicional para los pacientes, y eso incluyó los implantes dentales endoóseos para estabilizar las prótesis en caso necesario.
En las intervenciones de injerto óseo de sustitución realizadas en la práctica clínica, sin una finalidad investigacional, se utiliza rutinariamente la biomodificación de la superficie radicular. Con anterioridad se ha descrito, aunque nunca se ha confirmado, que es posible un resultado regenerador gracias a la aplicación de ácido cítrico en la superficie radicular antes del cierre del colgajo19. En el estudio aquí descrito no se utilizó la biomodificación de la superficie radicular ya que supondría la adición de otra variable y podría dar lugar a resultados confusos.
Un comentario reciente cuestionó la necesidad de la resección en bloque para su análisis histológico, por razones humanitarias o incluso éticas22. Un comité institucional de evaluación autorizó el protocolo de este estudio y todos los pacientes que participaron leyeron y firmaron el consentimiento informado. Además, cada paciente recibió información y asesoramiento adicional sobre los detalles de su participación, riesgos incluidos, y dispuso de libertad para abandonar el estudio en cualquier momento. En este comentario también se sugirió que «un estudio bien diseñado que utilizase imagenología dental y resultados clínicos durante un período de tiempo adecuado permitiría evaluar el éxito de una intervención regeneradora»22. La regeneración periodontal solamente puede confirmarse mediante análisis histológicos.
Lieb y Kowalski22 creyeron que los estudios histológicos de las resecciones en bloque deben evaluarse exclusivamente por sus méritos en investigación y que no cumplen el gold standard de la investigación basada en la evidencia. La histología humana para evaluar la regeneración periodontal es el nivel más alto disponible de investigación basada en la evidencia. Hasta que la metodología científica no permita analizar el hueso, cemento y ligamento periodontal de nueva formación, la histología humana deberá seguir siendo el gold standard como estudio demostrativo preliminar de cualquier producto regenerativo en seres humanos.
Conclusión
Este estudio, así como otros que han utilizado una variedad de materiales aloplásticos, indica que la profundidad al sondaje y la inserción clínica mejoraron de forma significativa en comparación con los valores iniciales. Sin embargo, ningún material aloplástico ha demostrado la regeneración periodontal en seres humanos1-8. Este estudio demostró que Norian Periodontal Dental Cement indujo una cicatrización histológica similar a la de otros materiales aloplásticos: encapsulación fibrosa del material aloplástico acompañada por epitelio de unión.
Correspondencia: Dr James T. Mellonig,
Periodontics Department, The University of Texas Health Science Center at San Antonio, 7703 Floyd Curl Drive, San Antonio, Texas 78229-3900;
e-mail: mellonig@uthscsa.edu.