Los clínicos han utilizado autoinjertos gingivales e injertos de tejido conjuntivo además de aloinjertos de piel liofilizada y matriz dérmica acelular para incrementar la zona de encía insertada con diferentes resultados12-17. Los autoinjertos tienen un excelente rendimiento, pero requieren una zona de extracción secundaria que se suma a las molestias del paciente y a las complicaciones post-operatorias, y ofrece una cantidad limitada de tejido donante. Los sustitutos de injertos de tejidos blandos desarrollados mediante ingeniería se ven limitados por el elevado coste de producción, poco margen de uso, y la naturaleza compleja de la obtención de productos por ingeniería de tejidos18-2. Obviamente, una intervención de aumento gingival que pueda realizarse en una sola zona quirúrgica (el receptor) es preferible a cualquier procedimiento que requiera dos zonas quirúrgicas cuando los resultados del tratamiento son comparables.
El objetivo de este estudio aleatorizado y controlado, de boca partida, fue evaluar la seguridad, viabilidad y eficacia de una membrana de matriz extracelular (DynaMatrix, Keystone Dental) con el fin de proporcionar una técnica sencilla de utilizar para el aumento gingival. El estudio de boca partida comparó los resultados clínicos e histológicos con el uso de una membrana DynaMatrix y el de un autoinjerto gingival. La membrana de matriz extracelular Dynamatrix se obtiene de la submucosa del intestino delgado de porcinos mediante un proceso que retiene la composición natural de las moléculas de la matriz, como colágenos (tipo I, III, IV y VI), glucosaminoglicanos, glicoproteínas, proteoglicanos y factores del crecimiento23,24. Se sabe que desempeñan papeles importantes en la reparación y la remodelación tisular. Así pues, la hipótesis fue que la membrana DynaMatrix puede favorecer la epitelización sobre la membrana e integrarse en la mucosa oral circundante.
Materiales y métodos
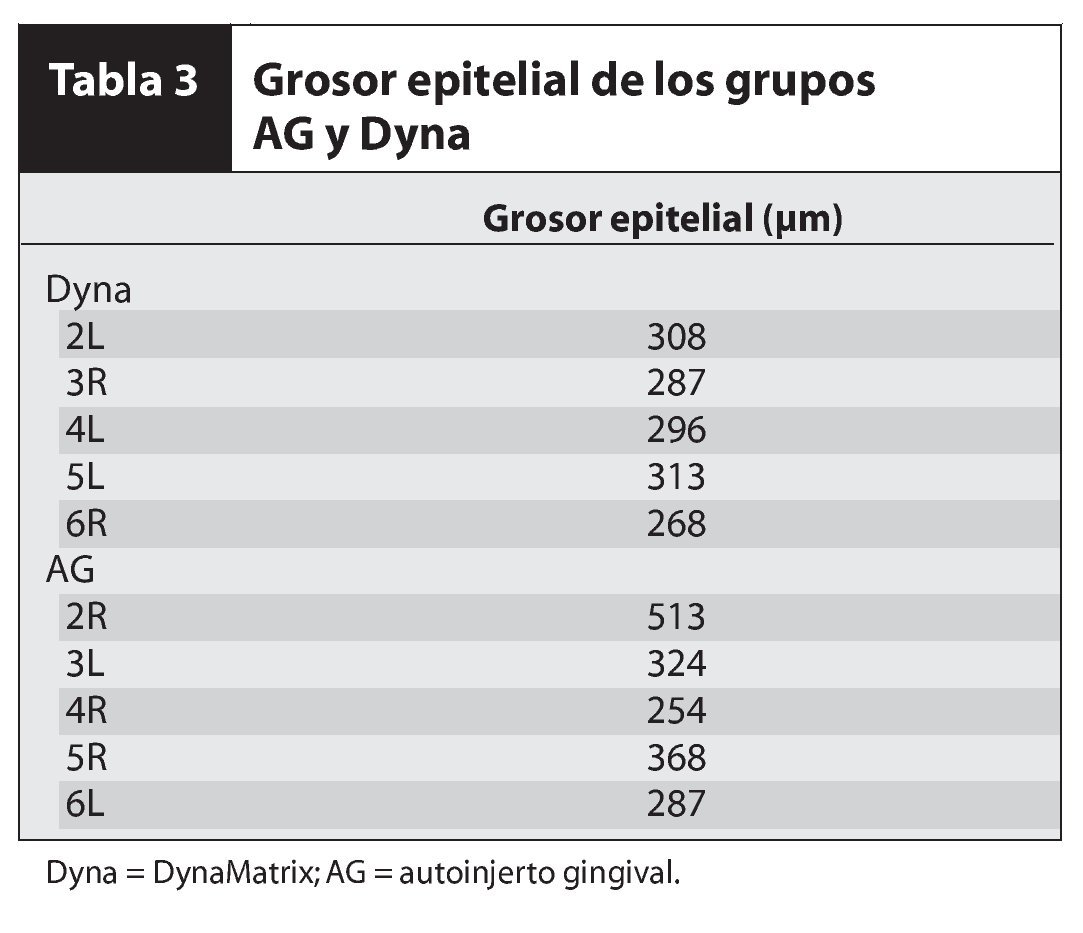
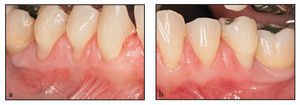
En el estudio participaron 6 pacientes (5 mujeres, 1 hombre) con un promedio de edad de 41 años y sin antecedentes médicos significativos. Los pacientes presentaban menos de 2 mm de encía queratinizada insertada bilateralmente en el aspecto vestibular de los dientes posteriores del maxilar inferior (figuras 1a, 2a y 2b). Los individuos se prepararon y fueron sometidos a una intervención de aumento gingival según las prácticas dentales aceptadas, previa revisión y firma del consentimiento informado. Antes de la cirugía se realizó un tratamiento periodontal inicial, con instrucciones para la higiene y la profilaxis oral.
Figura 1a (izquierda) Este paciente presentó una zona inadecuada de encía queratinizada insertada en el aspecto vestibular del molar y los premolares derechos inferiores.
Figura 1b (derecha) La incisión horizontal inicial se hizó con una hoja de bisturí del n. 15 en la unión mucogingival extendiéndose a lo largo de toda la zona del defecto mucogingival y se levantó un colgajo de espesor parcial mediante disección apical nítida para crear el lecho receptor.
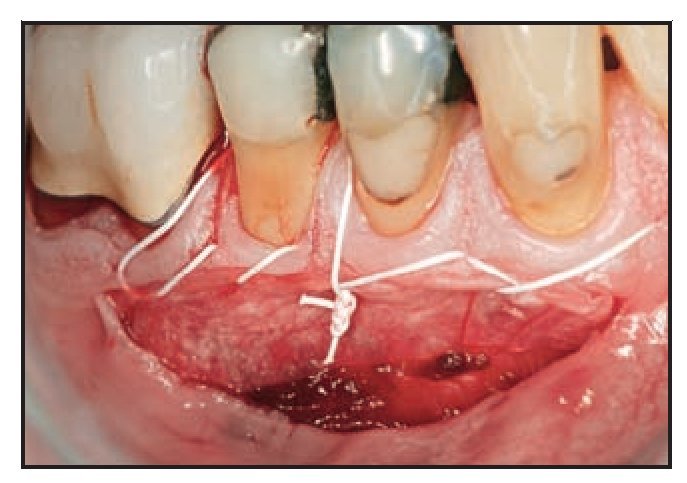
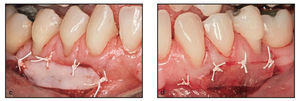
Figura 1c Se utilizaron técnicas de sutura suspensoria y de puntos simples para lograr una adaptación estrecha de la membrana Dynamatrix a la zona receptora.
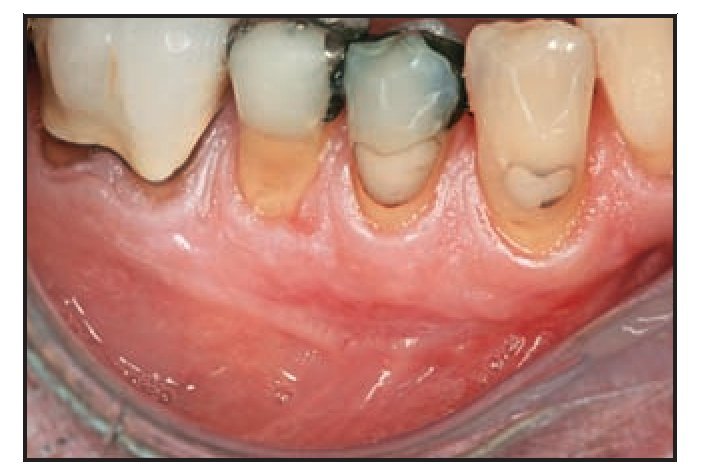
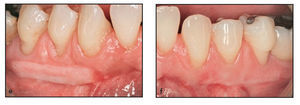
Figura 1d La evaluación un mes después de la intervención reveló una cicatrización clínica óptima, así como una excelente fusión de color y textura.
Figura 1e La evaluación a los 11 meses de la intervención demostró la estabilidad del resultado observado al cabo de 1 mes.
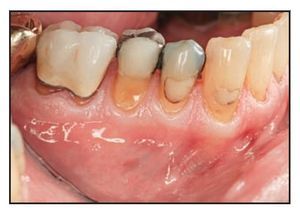
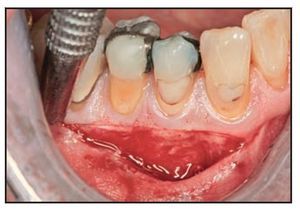
Figuras 2a y 2b Este paciente presentó menos de 2 mm de encía queratinizada insertada bilateralmente en el aspecto vestibular de los premolares inferiores: a) lado derecho, autoinjerto gingival; b) lado izquierdo, DynaMatrix.
Evaluación clínica
Las evaluaciones periodontales incluyeron la determinación del índice de placa25, índice gingival26, profundidad al sondaje, recesión gingival y encía queratinizada, y se realizaron en el aspecto vestibular de cada diente, al inicio y después de 13 semanas, por parte de un clínico entrenado para asegurar la reproducibilidad del examinador. Se determinó la unión mucogingival enrollando la mucosa alveolar coronalmente con el lado de una sonda, y todas las mediciones se redondearon al milímetro más cercano utilizando una sonda periodontal (UNC 15, Hu-Friedy). Además se tomaron fotografías clínicas con una cámara digital en la visita inicial y las posteriores visitas de seguimiento. Las diferencias en las mediciones clínicas entre los valores iniciales y a las 13 semanas de la cirugía se evaluaron mediante la prueba de Wilcoxon de rangos signados. Se utilizó la prueba U de Mann-Whitney para analizar las diferencias entre los grupos tratados con DynaMatrix y con autoinjerto gingival.
Intervención de aumento gingival
Las intervenciones de aumento gingival se realizaron de forma ambulatoria bajo anestesia local (lidocaína al 2 % con adrenalina 1:100.000). Previamente se realizó un raspado y alisado radicular exhaustivo. Los tratamientos prueba (membrana Dynamatrix) y control (autoinjerto gingival) se realizaron en la misma cita quirúrgica. La incisión horizontal inicial se realizó con una hoja de bisturí del n. 15 en la unión mucogingival y se extendió por toda la zona del defecto mucogingival, y se elevó un colgajo de espesor parcial mediante una disección apical nítida para crear el lecho receptor (figura 1b). Las zonas receptoras recibieron de forma aleatoria el tratamiento prueba o el control. Se obtuvo un injerto gingival de grosor uniforme del paladar duro del mismo lado que la zona receptora y la matriz DynaMatrix se recortó convenientemente. Para una de las zonas de la prueba se utilizó una membrana Dynamatrix de doble capa en lugar de una aplicación monocapa (muestra 2L). Ambos materiales de injerto se estabilizaron en el lecho perióstico firme con puntos simples de politetrafluoroetileno expandido (CV-5. Gore-Tex, W.L. Gore) en los bordes coronal y lateral (figuras 1c, 2c y 2d). Se utilizaron estas suturas monofilamento para prevenir el arrastre de bacterias durante un período de 2 semanas, y las zonas se cubrieron con un apósito periodontal (Coe-Pack, GC America). Todos los pacientes recibieron instrucciones sobre higiene oral y se les enseñó cómo evitar las zonas tratadas. Se recetaron analgésicos (ibuprofeno, 800 mg tres veces al día durante 5 días). Dos semanas después de la intervención se retiraron los apósitos periodontales y los puntos y las zonas injertadas se evaluaron clínicamente y se limpiaron cuidadosamente con una solución de clorhexidina. Los pacientes fueron visitados 2, 4, 6, 8 y 13 semanas después de la cirugía para controlar la cicatrización y realizar el control de la placa.
Figuras 2c y 2d Ambos materiales de injerto se estabilizaron en el firme lecho perióstico con puntos simples de politetrafluoroetileno expandido en los bordes coronal y lateral. c) lado derecho, autoinjerto gingival; d) lado izquierdo, DynaMatrix.
Preparación histológica
Se obtuvo una biopsia del tejido blando bajo anestesia local en cada paciente a las 13 semanas de la intervención de aumento gingival. La muestra se obtuvo mediante punch de 4 mm (Uni-Punch, Premier Medical) de la porción injertada cicatrizada tanto de la zona tratada como de la zona control (n = 12 biopsias). La zona de la biopsia se compactó con un agente hemostático (Hemostop, Technew) para facilitar la hemostasia y la cicatrización. Todas las muestras se fijaron en una solución de formalina neutra tamponada al 10 % y se enviaron a un histopatólogo para su análisis histológico.
Las biopsias de tejido blando obtenidas mediante punch se fijaron en formalina al 4 %. Tras un lavado con 0,185 mol/l de cacodilato de sodio tamponado, las muestras se posfijaron con tetraóxido de osmio al 1,33 % en 0,185 mol/l de cacodilato de sodio tamponado. Posteriormente se lavaron con el mismo tampón, se deshidrataron con etanol y se incrustaron en medio epoxi de incrustación (Fluka). Se prepararon cortes semifinos (2 µm) para su examen al microscopio óptico con un microtomo de ultracorte Leica y se tiñeron con azul de metileno-Azure II.
Resultados
Los 6 pacientes cicatrizaron sin efectos adversos importantes tras la cirugía de aumento gingival y volvieron para las visitas rutinarias de seguimiento.
Mediciones clínicas
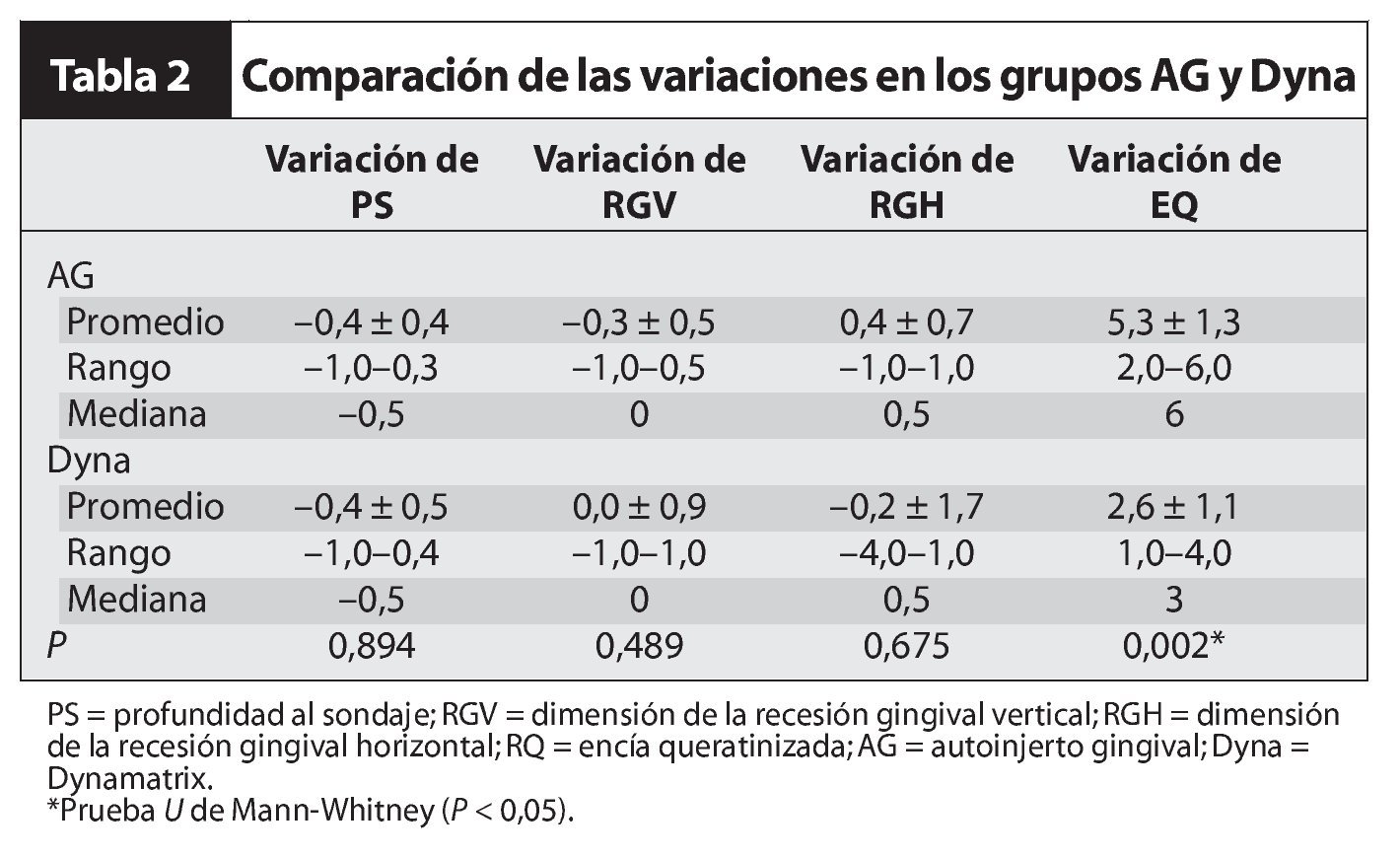
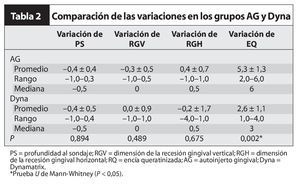
La prueba de Wilcoxon de rangos signados de las mediciones pre y postoperatorias tanto de las zonas tratadas como las zonas control reveló una reducción significativa de la profundidad al sondaje (p = 0,035 para el control y p = 0,049 para la zona tratada) y un aumento significativo en la cantidad de encía queratinizada (P = 0,006 para la zona control y p = 0,007 para la zona tratada) (tabla 1). La prueba U de Mann-Whitney, utilizada para comparar los valores de las zonas de prueba y tratada no detectó diferencias estadísticamente significativas (p > 0,05) en ninguna de las variables (índice de placa, índice gingival, profundidad al sondaje o recesión gingival) exceptuando la variación en la cantidad de encía queratinizada (p = 0,002) entre los grupos tratado y control, tanto en el preoperatorio como 13 semanas después de la intervención (tabla 2). La variación promedio de las dimensiones de la encía queratinizada tras la cirugía fue de 5,3 ± 1,3 mm en las zonas con autoinjertos gingivales y de 2,6 ± 1,1 mm en las zonas con DynaMatrix. A pesar de que la dimensión de la encía queratinizada obtenida fue menor en la zona Dynamatrix que en la zona del autoinjerto gingival, pareció que Dynamatrix fue más eficaz para aumentar la zona de encía queratinizada en presencia de un vestíbulo profundo.
Observaciones clínicas
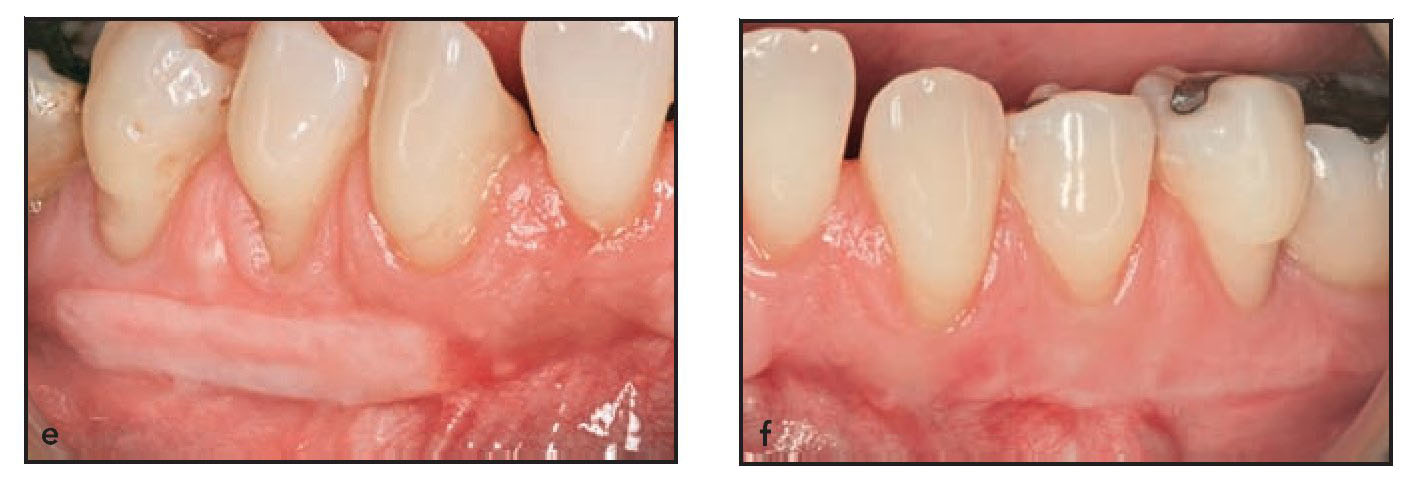
Cuando los pacientes acudieron a la visita 2 semanas después de la intervención se evidenció la revascularización del injerto dado que aparecieron numerosas zonas eritematosas en el lecho cicatricial de la herida tanto en la zona control como en la zona testada. Ambas zonas presentaron una cicatrización clínica completa, y se observó un color excelente y una buena fusión de la textura en las zonas tratadas con la membrana Dynamatrix a las 4 semanas de la cirugía (figura 1d). La maduración tisular a las 4 semanas de las zonas tratadas con DynaMatrix pareció ser similar a la observada en las zonas tratadas con autoinjerto gingival. Los resultados a las 8 semanas de la intervención se mantuvieron de forma estable hasta la semana 13 en ambas zonas. Cuando se examinaron en el momento de la biopsia, ambas zonas injertadas presentaron maduración y estabilidad a las 13 semanas (figuras 2e y 2f).
Figuras 2e y 2f Ambas zonas injertadas mostraron madurez y estabilidad a las 13 semanas. e) lado derecho, autoinjerto gingival; f) lado izquierdo, DynaMatrix.
La unión mucogingival fue muy diferente en las zonas con autoinjerto gingival debido a una diferencia en la calidad de los tejidos adyacentes y su aspecto típico de "parche de rueda". Las zonas tratadas con la membrana DynaMatrix se fusionaron bien con el tejido circundante, y resultaron estéticamente más agradables. La demarcación entre el injerto y el tejido circundante se notó mucho menos, ya que el nuevo tejido fue similar en color y textura (figura1e).
Evaluación histológica
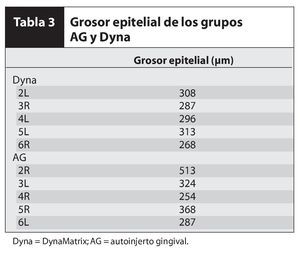
La evaluación histológica se realizó en los 5 pares de muestras control y tratadas en lugar de en 6 porque una de las muestras control no se incrustó en la orientación correcta. No se observaron restos de membrana en la visita a las 13 semanas de la intervención en las zonas tratadas con Dynamatrix. Las biopsias de las zonas control y tratada parecieron ser similares desde el punto de vista histológico, con tejido conjuntivo maduro cubierto por epitelio queratinizado (figura 3). Clínicamente pareció que las zonas tratadas con Dynamatrix lograron la queratinización sobre la membrana, y la evaluación histológica confirmó que el tejido suprayacente estaba queratinizado. El grosor del epitelio fue uniforme en todo el tejido obtenido. El grosor promedio del epitelio se presenta en la tabla 3 y fue de 349 ± 100 µm en el caso de las zonas tratadas con autoinjerto gingival y de 294 ± 17,9 µm en las zonas tratadas con injerto Dynamatrix. Una muestra (2R) del grupo autoinjerto gingival presentó crestas interpapilares significativamente más largas, lo que aumentó el promedio de este grupo. Las crestas interpapilares de ambos grupos no presentaron una morfología uniforme, pero existió similitud entre las crestas de las muestras correspondientes tratadas y control, es decir, crestas papilares largas y pequeñas en el par 2L y 2R, estrechas y cortas en el par 3L y 3R, largas y anchas en el par 4L y 4R, estrechas en el par 5L y 5R, cortas y estrechas en el par 6L y 6R. El epitelio fue de tipo queratinizado. Se apreció una pequeña banda de ortoqueratinización densa en la parte superior del epitelio de todas las muestras. Se observó una densidad moderada de la matriz de colágeno en todas las muestras excepto en la 2L (zona con doble capa de la membrana DynaMatrix), que presentó una configuración de la matriz de colágeno más densa. Ninguna muestra presentó signos de respuesta inflamatoria.
Figuras 3a a 3d Las biopsias de las zonas con autoinjerto gingivales (a y c) y membrana DynaMatrix (b y d) parecen similares desde el punto de vista histológico, con tejido conjuntivo maduro cubierto por epitelio queratinizado. En todas las muestras se apreció una pequeña banda de ortoqueratinización densa en la parte superior del epitelio. El tamaño y el aspecto de las crestas interpapilares fueron comparables individualmente. a) muestra 4R, b) muestra 4L, c) muestra 6L, d) muestra 6R. KE = epitelio queratinizado, CT = tejido conjuntivo.
Discusión
La existencia y preservación de la encía queratinizada insertada alrededor de los dientes naturales y los implantes dentales parece desempeñar un papel importante en la salud periodontal y periimplantaria. La anchura de la encía queratinizada insertada en el aspecto vestibular difiere en las distintas zonas de la boca; suele ser mayor en la zona de los incisivos y disminuye en la dentición posterior27. Los investigadores clínicos siguen buscando fuentes tisulares alternativas para sustituir los autoinjertos sin la morbilidad concomitante de la zona de extracción. Hasta la fecha no se ha descubierto ningún material óptimo que sustituya el autoinjerto gingival.
Se ha investigado una matriz dérmica acelular en un intento por sustituir el autoinjerto gingival, con resultados clínicos contradictorios16,17,28-33. Se han demostrado sus limitaciones y complicaciones, como la cantidad insignificante de encía queratinizada obtenida y un encogimiento significativo del injerto17,30-33. Wei y cols. observaron menos predictibilidad al compararla con el autoinjerto debido al encogimiento de la matriz dérmica acelular y a la respuesta inflamatoria, que se asemejó histológicamente a una reacción de cuerpo extraño30,31.
El estudio aquí descrito se realizó para comprobar la viabilidad de una membrana de matriz extracelular (DymaMatrix) comparada con un autoinjerto gingival para aumentar la anchura del tejido queratinizado insertado. El éxito del tratamiento de aumento gingival se evaluó tanto clínicamente como histológicamente. Se ha observado que la epitelización y queratinización de un autoinjerto gingival se produce hacia el día 2834. Así pues, los autores seleccionaron el tiempo de biopsia unas 13 semanas después de la cirugía. La membrana DynaMatrix se maneja fácilmente cuando se recorta y se coloca en el lecho receptor. Los pacientes refirieron menores molestias en relación a la extracción palatina con la técnica DynaMatrix que con el injerto autógeno. Los resultados de este estudio indican que ambas intervenciones fueron eficaces y predecibles para incrementar la encía queratinizada. Sin embargo, el tejido se fusionó mejor con el tejido nativo cuando se utilizó DynaMatrix. No se observaron diferencias significativas en relación a la epitelización inducida y al resultado del tejido conjuntivo.
Se ha postulado que solamente el tejido conjuntivo de la encía y el ligamento periodontal tienen capacidad para crear epitelio queratinizado35. Los autores emitieron la hipótesis de que el epitelio que pobló la membrana DynaMatrix migró desde el epitelio desnudo que indujo la epitelización secundaria «reptando» por el lecho de la herida. Esto probablemente sea consecuencia de la matriz única que permitió la repoblación de fibroblastos, vasos sanguíneos y epitelio desde los tejidos circundantes31. Se asumió que la membrana Dyna-Matrix probablemente se incorporó al lecho receptor y se remodeló a causa de los componentes biológicos esenciales de cicatrización que contiene: matriz estructural (matriz extracelular), y señales (factores del crecimiento y lugares de unión mediados por receptores de la matriz extracelular)24. Los factores del crecimiento como el factor de crecimiento de fibroblastos 2, el factor de crecimiento transformante 1, y el factor de crecimiento de tejido conjuntivo son importantes estimuladores de la angiogénesis, la invasión capilar y la regeneración tisular36-38. Estudios preclínicos han documentado que la membrana Dynamatrix 1) estimula la diferenciación de las células epidérmicas y la formación de una membrana basal39, 2) apoya la angiogénesis in vitro e in vivo40, y 3) apoya la adhesión celular y estimula la diferenciación y la profileración39,41,42. Así pues, estas propiedades únicas probablemente indujeron la queratinización sobre la membrana de forma similar a la cicatrización del autoinjerto.
Entre las ventajas del uso de la membrana DynaMatrix destacan evitar una zona donante secundaria, el aporte ilimitado de injerto y el aspecto estético natural. Los riesgos de una intervención quirúrgica prolongada han sido demostrados por Griffin y cols.43, quienes compararon la frecuencia de complicaciones postoperatorias entre las diferentes intervenciones de injerto de tejidos blandos. Por cada minuto de intervención aumentó un 4 % la probabilidad de desarrollar dolor moderado o severo y un 3 % la inflamación moderada o severa.
Son necesarios más estudios, entre ellos un ensayo clínico multicéntrico, a gran escala y a largo plazo, para confirmar estos resultados. Además, en el futuro debe considerarse la viabilidad de la membrana DynaMatrix en pacientes con defectos de tipo recesivos.
Conclusión
Dentro de los límites de este estudio, la membrana DynaMatrix puede suponer un sustitutivo viable del autoinjerto gingival para aumentar las dimensiones de la encía queratinizada insertada. El uso de la membrana Dynamatrix puede proporcionar una fuente ilimitada de tejido donante, reduciendo así los desafíos quirúrgicos para el clínico y la morbilidad para el paciente.
Agradecimientos
Este estudio ha sido financiado por Keystone Dental.
Correspondencia: Dr David M. Kim,
Harvard School of Dental Medicine, 188 Longwood Avenue, Boston, Massachusetts 02115;
fax: 617-432-1897;
e-mail: dkim@hsdm.harvard.edu.