La parte posterior del maxilar edéntulo suele presentar una calidad y una cantidad ósea insuficientes para llevar a cabo una rehabilitación predecible con implantes orales intraóseos1-3. La reabsorción de la cresta alveolar y la neumatización del seno maxilar acostumbran a ser visibles tras la pérdida ósea de dientes posteriores4,5. El éxito clínico se ha logrado alcanzar con la ayuda de injertos en el seno maxilar a base de diferentes materiales2,6,7, como, por ejemplo, de hueso autógeno en bloque de zonas dadoras extraorales8 o injerto óseo autógeno particulado2,4,9. Los procedimientos para realizar el injerto sinusal se pueden llevar a cabo antes o en el momento de colocar el implante2,9,11. Tras el injerto del seno maxilar se ha demostrado mediante histología en animales12 y en humanos13-15 la neoformación ósea. En la conferencia de consenso celebrada en 1996 sobre el tema de la elevación del suelo del seno maxilar, basada en la experiencia clínica de 38 cirujanos que habían colocado 3.554 implantes en 1.007 maxilares posteriores, se llegó a la conclusión de que el injerto sinusal es un procedimiento eficaz.
La investigación dental emplea la histomorfometría cualitativa y cuantitativa como un método para evaluar la integración ósea de los implantes dentales, los biomateriales y los procedimientos regenerativos16,17. La histomorfometría ósea18-21 permite evaluar numerosos parámetros de estructura y volumen óseos, incluido el grosor trabecular (GTr) la separación trabecular (STr) y el número trabecular (NTr). También pueden evaluarse parámetros dinámicos como la formación ósea, el índice o tasa de reabsorción y el equilibrio óseo marcando el hueso con tetraciclina. Estos parámetros proporcionan información valiosa acerca del desarrollo del tejido óseo durante el período de cicatrización o tras realizar la carga funcional18-23.
Tradicionalmente, el análisis morfométrico del hueso se ha valorado a partir de secciones histológicas en dos dimensiones (2D) a la que se añadió una tercera dimensión (3D) sobre la base de la estereología. En un intento por mejorar la evaluación de la conectividad ósea, se han ido proponiendo otros procedimientos en 3D24,25. La microtomografía computarizada (microTC) constituye un abordaje alternativo no cruento para destacar y cuantificar el hueso en 3D, permitiendo obtener imágenes tridimensionales de alta resolución y mediciones cuantitativas de la estructura trabecular ósea26,27. El proceso histológico descrito previamente es un procedimiento destructivo y que además consume una gran cantidad de tiempo29, pero que proporciona imágenes en alta resolución, de contraste y un gran número de distintas evaluaciones, incluido el análisis celular30. El empleo de la histología junto a la microTC ha dado como resultados una mejora en el conocimiento de los biomateriales31-34. Recientemente se ha utilizado la microTC para una evaluación cuantitativa en 3D de biopsias óseas que contenían biomateriales rígidos en el seno maxilar33 y para aplicarlos a distintos parámetros histomorfométricos, siendo los resultados comparables a los obtenidos con la histomorfometría tradicional (estándar).
El desarrollo de la regeneración tisular ósea en el seno maxilar sigue teniéndose que aclarar por medios biomecánicos, especialmente cuando se emplean biomateriales como sustitutos óseos. Por ello, el empleo de la microTC para analizar la arquitectura ósea en 3D y su interacción con los biomateriales es de extrema importancia para clarificar mejor las implicaciones biomecánicas del hueso recientemente regenerado, dado que este hueso debe ser capaz de proporcionar un anclaje funcional potente a los implantes. El biomaterial cerámico enriquecido con magnesio utilizado en el presente estudio demostró ser, ya anteriormente, el más soluble cuando se lo compara con la hidroxiapatita35-38 y demostró ser, mediante pruebas histológicas, un sustituto óseo óptimo para rellenar los defectos originados tras una exodoncia en humanos39.
El objetivo del presente estudio consistió en evaluar, mediante microTC, la neoformación ósea de biopsias obtenidas de injertos sinusales con hueso autógeno mezclado con biomaterial cerámico enriquecido con magnesio.
Método y materiales
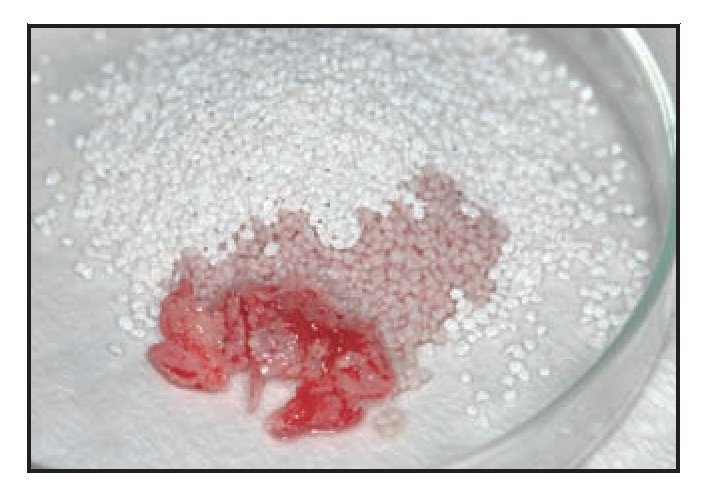
Se realizaron injertos óseos en el seno maxilar de 11 pacientes en perfecto estado de salud general, quienes requerían la colocación de implantes dentales en el maxilar posterior atrófico. Todos los pacientes habían dado su consentimiento informado. Para el injerto se utilizó un sustituto óseo de base cerámica (SINTlife, Finceramica) mezclado con un 10 % de fragmentos de hueso autógeno extraídos de zonas dadoras intraorales (figura 1). Se practicó una ventana quirúrgica lateral para acceder al seno maxilar, preservando cuidadosamente la membrana sinusal5-9,15,33, y se insertó el injerto óseo a través de la ventana para obtener de 15 a 20 mm de aumento óseo, según la medición obtenida con una sonda periodontal. Se empleó una membrana de colágeno (Paroguide, Vebas) para cerrar el acceso quirúrgico al seno, y se añadió un antibiótico (metronidazol) al injerto (Deflamon). Se utilizó el hueso autógeno para añadir los componentes celulares a los gránulos de cerámica osteoconductores. El volumen de injerto requerido se determina a partir de una cuidadosa y rigurosa planificación del tratamiento.
Figura 1 (izquierda) Sustituto óseo a base de cerámica mezclada con un 10 % de hueso autógeno.
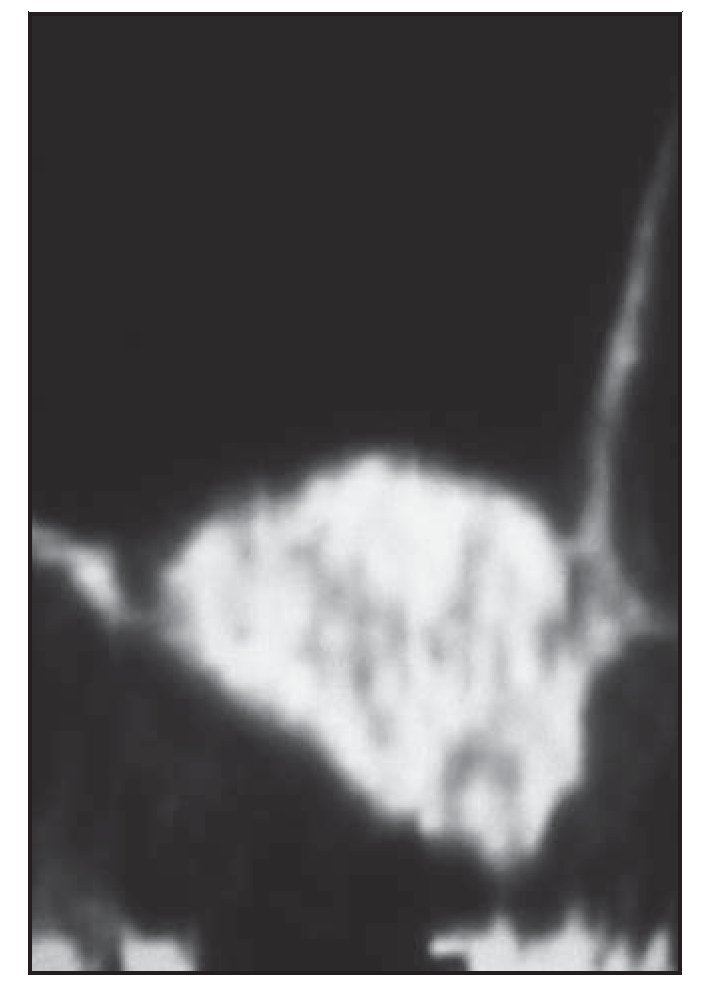
A los 8 meses de haberse realizado el injerto óseo se tomó una TC para examinar la osteogénesis (figura 2). Se practicó una segunda intervención quirúrgica para colocar los implantes, y se llevó a cabo una biopsia de los especímenes de hueso cilíndrico extraídos de los senos maxilares tratados con una trefina a lo largo del eje de inserción del implante. Una vez habían sido fijados para el análisis histológico, los especímenes se enviaron a la Biomaterials Clinical Research Association y fueron procesados para su examen con microTC.
Figura 2 (derecha) Tomografía computarizada obtenida a los 8 meses de haber realizado el injerto de seno maxilar.
Preparación de la muestra
Las biopsias óseas se irrigaron inmediatamente con solución salina, se fijaron con formol al 10 %, se deshidrataron en series de irrigaciones a base de alcohol de graduación ascendente y se sumergieron en resina Remacryl (Istituto Sant'Orsola, Universidad de Boloña). Tras la polimerización, las muestras estaban listas para ser evaluadas mediante microTC y, subsecuentemente, para proceder a su examen histológico no descalcificado.
Procesado mediante microTC
Los especímenes se examinaron utilizando un sistema de microTC de alta resolución (mCT40, Scanco Medical) en módulo multicortes. Cada grupo de datos de una imagen en 3D estaba formado por 400 cortes de microTC aproximadamente (1.024 x 1.024 píxeles con niveles/ escalas de grises de 16 bits)27,31-34. Las imágenes de cada corte permiten realizar un examen morfológico y un análisis morfométrico en dos dimensiones (corresponden a una proyección bidimensional). Los especímenes se escanearon en los ejes x, y y z a una resolución de 20 µm aproximadamente. El tamaño del vóxel era de 15 x 15 x 15 µm3. El tiempo de escaneado para cada espécimen fue de aproximadamente 6 horas. Las mediciones con MicroTC de la interfase huesoinjerto se realizaron ajustando los umbrales de la escala de grises33.
El conjunto de datos en 3D se segmentó utilizando dos umbrales diferentes para el hueso y el biomaterial de cerámica para separar los distintos materiales. El primer umbral se determinó para observar tanto el hueso como el injerto, y el segundo, para visualizar las partículas de cerámica del injerto33. Al restar la medida obtenida de las partículas de injerto residual de las medidas obtenidas del volumen tisular mineralizado (hueso neoformado + volumen del injerto) fue posible medir el volumen de hueso neoformado.
Mediciones morfométricas
Los parámetros morfométricos de interés, calculados automáticamente mediante la microTC, fueron los siguientes: volumen del espécimen total (VT), volumen de tejido mineralizado (VM), volumen de las partículas de injerto residual (VI), densidad de la conectividad, TbN, TbTh y TbSp. El VM representa la cantidad de volumen de tejido mineralizado, de hueso e injerto presente en los especímenes, mientras que el VI representa la cantidad de partículas de cerámica del injerto residual, que sigue presente en los especímenes. La densidad de la conectividad y los índices de conectividad (TbN, TbTh y TbSp) se calcularon para obtener un indicador de la potencia ósea. El contacto del hueso con el injerto (CHI) se calculó manualmente a partir de 3 secciones por muestra con objeto de medir la capacidad de conducción ósea de los gránulos.
Resultados
Todos los senos cicatrizaron sin ninguna complicación. La TC efectuada a los 6 y 8 meses tras la cirugía mostró, consecuentemente, una cantidad ósea satisfactoria por cada lecho del implante, pero el nuevo tejido formado parecía haberse reducido en altura entre un 10-30 % aproximadamente, frente a las medidas obtenidas el mismo día de la cirugía. De hecho, la diferencia media de la altura del injerto fue de 0,84 ± 0,466 mm (pérdida ósea).
Resultados morfométricos mediante microTC
El VT medio (VM + VI) fue de 66,63 % (± 15,95 %), el valor medio de VI fue de 31,55 % (± 12,40 %) y el valor medio de VM fue de 35,08 % (± 5,87 %). La densidad de conectividad media fue 219,42 (± 18,17). Los índices de conectividad medios de TbN, TbTh y TbSp fueron 5,52 (± 1,23), 0,22 (± 0,03) y 0,14 (± 0,01), respectivamente. El valor medio del CHI fue del 68 %.
Descripción morfológica de las imágenes en 3D y 2D obtenidas mediante microTC
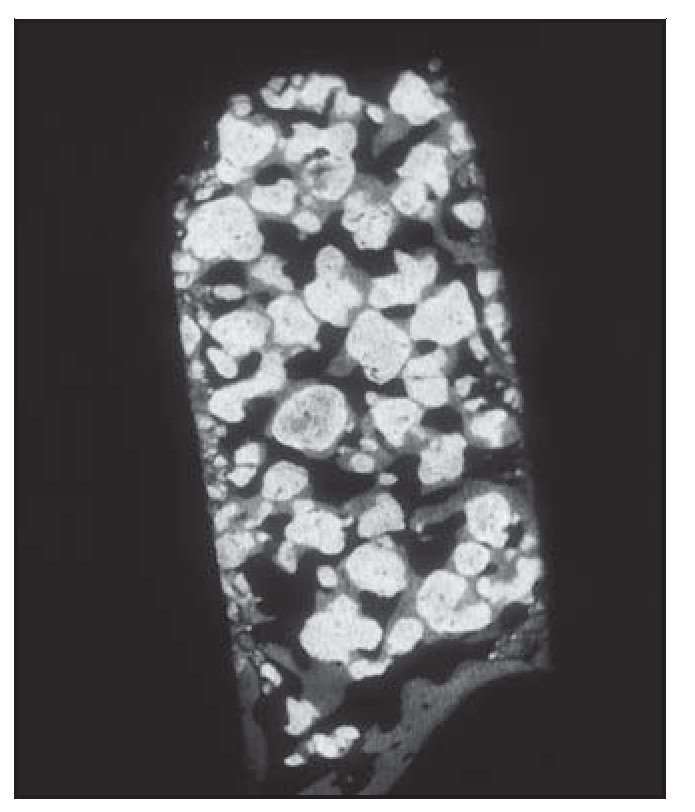
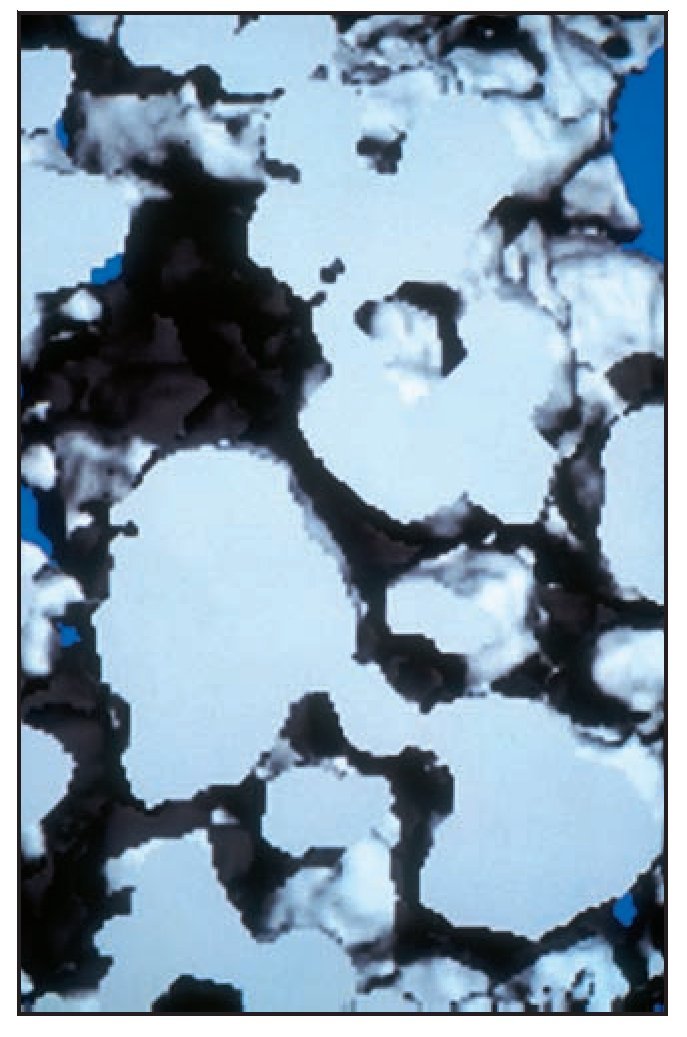
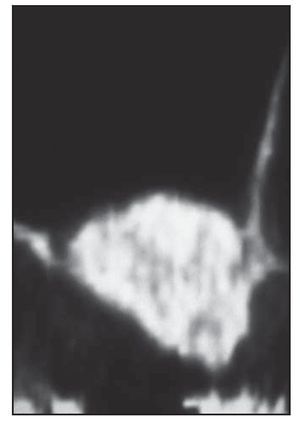
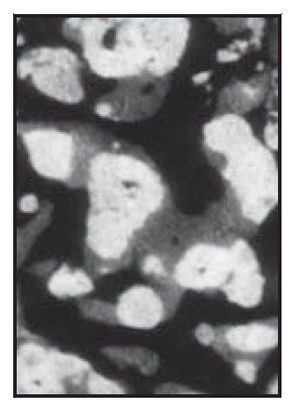
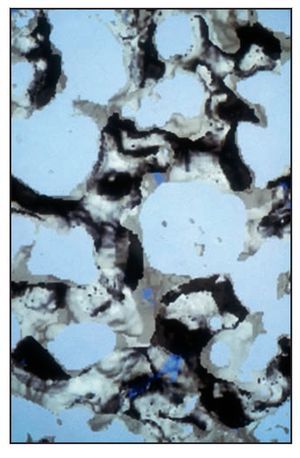
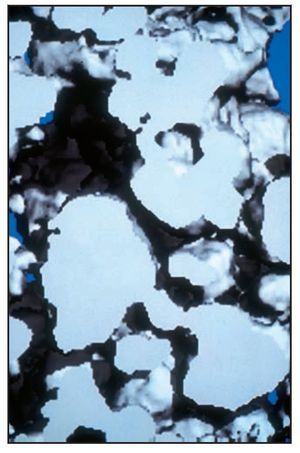
El análisis bidimensional mediante microTC mostró un hueso denso compuesto de trabéculas gruesas, perfectamente conectadas entre sí (figura 3). Los cortes bidimensionales distinguían los gránulos de SINTlife del hueso, dado que los huesos eran más radioopacos que las trabéculas óseas (figura 4). En la parte coronal de las muestras biopsiadas se hallaron, con frecuencia, trabéculas de gran tamaño entre los gránulos de SINTlife, allí donde el hueso tenía la apariencia de un hueso maduro y denso (compacto) y con un elevado CHI (figura 5). En la parte apical de las muestras, alrededor de los gránulos de biocerámica, había tejido medular blando cruzado por unas pocas y muy finas trabéculas mineralizadas similares a las que suele presentar el hueso fibrilar, con un escaso CHI (figura 6).
Figura 3 (izquierda) Análisis bidimensional mediante microTC de una muestra biopsiada. Las partículas de biomaterial se han desarrollado como parte de las trabéculas que forman la estructura ósea. Las trabéculas óseas parecen ser más gruesas hacia coronal, y más delgadas en sentido apical (x8 aumentos).
Figura 4 (derecha) Análisis bidimensional mediante microTC de una muestra de biopsia. Radiográficamente podían observarse tres densidades: una densidad elevada con una forma granular, que representa los gránulos de biocerámica (blanco); una densidad menor, con una morfología típica de trabéculas óseas mineralizadas (gris), y una densidad muy baja, que representa el tejido óseo hemopoyético desmineralizado. La mayor parte de las partículas de cerámica se hallaban incluidas en el hueso mineralizado nuevo ( 324 aumentos).
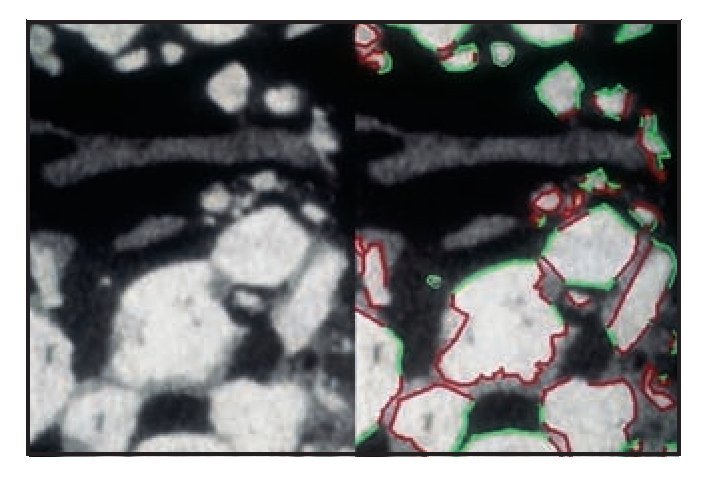
Figura 5 (izquierda) Parte coronal de la muestra biopsiada. Conectados a los gránulos de biocerámica se observan trabéculas de gran tamaño de hueso neoformado maduro y relativamente denso (compacto), que se hallan completamente rodeadas de hueso y parece que no ha sido reabsorbido. Línea roja = gránulos en contacto con el hueso mineralizado; línea verde = gránulos en contacto con tejido óseo hematopoyético desmineralizado (médula ósea) (x30 aumentos).
Figura 6 (derecha) Parte apical de la muestra biopsiada. Las partículas del injerto parecen reabsorbidas y se han reducido a minúsculas piezas. Línea roja = gránulos en contacto con el hueso mineralizado; línea verde = gránulos en contacto con tejido óseo hemopoyético desmineralizado (médula ósea) (x30 aumentos).
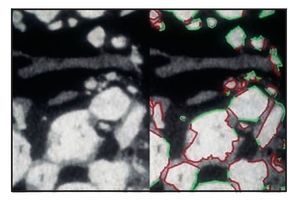
El análisis tridimensional mediante microTC (figura 7) mostró un hueso denso (compacto) compuesto de trabéculas gruesas, perfectamente conectadas entre sí y a las partículas del injerto. En la parte coronal de las muestras biopsiadas los gránulos parecían menos densos (compactos), de menor tamaño o desmenuzados (figura 8), mientras que en la parte apical, los gránulos parecían más densos, no habían sido reabsorbidos y se hallaban prácticamente intactos (figura 9). Mediante una técnica de retoque de la imagen32,33 se «escondió» el hueso, de manera que se pudo apreciar mejor la distribución de los gránulos en el espacio. La parte central de las muestras biopsiadas mostraban gránulos gruesos y densos (compactos), aparentemente no reabsorbidos (figura 10), mientras que en las partes coronal y apical de las muestras, los gránulos solían ser menos densos y de un tamaño más reducido o desmenuzados (figura 11).
Figura 7 (izquierda) Imagen tridimensional obtenida mediante microTC de una muestra biopsiada. Una red de trabéculas óseas gruesas, conectadas mediante finas columnas de hueso, se ha organizado en una estructura en placa orientada oblicua o paralelamente a la superficie ósea de la cresta alveolar. La estructura mineralizada era densa y se observan pequeñas lagunas de médula. Azul claro = trabéculas de hueso maduro; gris = trabéculas de neoformación ósea; blanco = gránulos de biocerámica (x8 aumentos).
Figura 8 (derecha) Parte coronal de la muestra biopsiada. En la imagen puede verse hueso denso (compacto) compuesto de trabéculas gruesas, maduras y perfectamente conectadas entre sí (azul claro). Alrededor de algunos gránulos de cerámica también son visibles trabéculas finas, menos maduras (gris). Las partículas de biocerámica (blanco) de bordes redondeados son visibles en la estructura ósea. En esta parte de la biopsia parecía que las partículas de cerámica habían reducido su volumen (x25 aumentos).
Figura 9 Parte apical de la muestra. Las trabéculas óseas (gris) eran más delgadas y su orientación poco organizada. Una gran cantidad de partículas de biocerámica (blanco) se hallaron encastadas en la matriz ósea, principalmente en contacto con el hueso mineralizado (x30 aumentos).
Figura 10 Análisis de la parte central de la muestra biopsiada utilizando una técnica de substracción. El material del injerto se separó virtualmente del hueso para permitir ver únicamente el injerto de cerámica (forma, dimensión y distribución en 3D de las partículas en el espacio) (x30 aumentos).
Figura 11 Análisis de la parte apical de la muestra biopsiada utilizando la técnica de substracción. Si se compara con el análisis de la parte central (ver figura 10) los gránulos de biocerámica son más pequeños y menos densos (x30 aumentos).
Discusión
A los pocos meses de producirse la cicatrización, la densidad del hueso regenerado suele ser muy baja, dependiendo del tiempo empleado en la cicatrización40 y de la densidad del hueso preexistente40-42. Las cargas aplicadas sobre el maxilar posterior son extremadamente elevadas dado que los dientes posteriores se hallan situados muy cerca de la articulación temporomandibular33. Por ello, los análisis tridimensionales del hueso regenerado tras el injerto de seno maxilar y la confirmación del soporte mecánico podría determinar con más acierto el tiempo ideal de cicatrización del injerto y las condiciones de carga. La microTC, técnica introducida en 198926, ha experimentado un reciente desarrollo27,43 y ha sido validada44 para la representación en 3D de la arquitectura del hueso trabecular gracias a una serie de estudios que han demostrado la excelente correlación que mantiene con la histología bidimensional convencional31-34,45. Las propiedades mecánicas del hueso dependen en gran medida de su estructura tridimensional27,44-46, que se mide a partir del volumen óseo y los índices de conectividad. El objetivo final de toda medición ósea llevada a cabo en pacientes es el de estimar la dureza del hueso33,42,47. En algunas muestras, era evidente que el hueso era ideal para la colocación y carga de los implantes, pero los valores de conectividad se calcularon, en cualquier caso, para todo el material mineralizado existente, incluidos los gránulos de biomaterial duro. En futuros estudios será muy importante determinar, a través de pruebas biomecánicas, las propiedades del hueso regenerado con biomateriales de cerámica y, a través de estudios clínicos e histológicos, la capacidad funcional de estos gránulos, puesto que el hueso se halla sujeto a un continuo remodelado y adaptación a las fuerzas mecánicas aplicadas16,18,19,22,23,40,42,47,48. Es sobradamente conocido que cuando se comparan con el hueso natural vital, los sustitutos óseos disponibles y comercializados en el mercado presentan diferentes propiedades mecánicas, así como ausencia de células, una estructura distinta y un comportamiento biológico atípico. Por ello, es preferible, en teoría, un sustituto óseo completamente reabsorbible42. El presente estudio muestra que, a los 8 meses de haber practicado la cirugía, una gran cantidad de gránulos seguían sin haber sido reabsorbidos. Este hecho es particularmente visible en la parte central de la muestra biopsiada, donde existe una gran cantidad de hueso neoformado. Por el contrario, en la parte coronal de la muestra, donde existía una gran cantidad de hueso neoformado, y apicalmente, donde la cantidad ósea presente era inferior, los gránulos de biocerámica parecían haberse reducido a fragmentos minúsculos. Probablemente, los gránulos atrapados en las grandes trabéculas óseas habían sido más rápidamente reabsorbidos por la actividad remodeladora del hueso, aunque esto mismo habría ocurrido en la parte apical, donde las trabéculas óseas eran muy finas y delgadas. Será necesario realizar un examen histológico convencional que explique este intrigante resultado.
El volumen de hueso mineralizado neoformado fue del 35,08 %, considerado suficiente para la colocación de un implante predecible15,33,49. Se trata de resultados que deben tenerse en cuenta y que pueden explicarse gracias a los efectos positivos que ejerce el biomaterial actual sobre la regeneración ósea; también pueden haber sido influidos positivamente por el efecto del antibiótico, por el hueso autógeno y por la membrana de colágeno que cubre el injerto. El hueso autógeno ha demostrado poseer propiedades osteoinductoras cuando se añade al material de relleno gracias a sus células vitales, a los factores de crecimiento y a su actividad quimiotáctica18,19,22,47,50. Por este motivo, no es posible afirmar con toda certeza que la adición de hueso autógeno al injerto puede haber ensombrecido la contribución del material de injerto en sí mismo. Son necesarios más estudios para resolver este problema. Otro tema intrigante referente al injerto del seno maxilar es la tendencia de la mayor parte de sustitutos óseos a presentar una reducción en el volumen del injerto tras la cicatrización4. En el presente grupo de pacientes la TC mostró una ligera reducción de la altura del injerto (de 1 a 2,4 mm) debida a la reabsorción o al ajuste de las partículas bajo la presión fisiológica de la membrana sinusal durante su funcionamiento.
Los valores obtenidos tras la medición coinciden con los cambios en la altura del injerto registrados por Jensen y cols. en 19984, aunque las mediciones de estos estudios previos se habían tomado sobre radiografías panorámicas, siendo el período de evaluación de 3 años. En el presente estudio, la altura del injerto se midió durante la cirugía mediante una sonda periodontal y los niveles óseos se examinaron sobre imágenes por TC, y cuando tan sólo habían transcurrido 8 meses de su cicatrización. Por esta razón, no es posible comparar la reducción de la altura ósea, siendo necesarios más estudios para llegar a entender este interesante fenómeno.
Aun a pesar de que el presente estudio se realizó con un reducido número de muestras analizadas, los resultados han demostrado que la biocerámica enriquecida con magnesio combinada con hueso autógeno generó, en los injertos de seno maxilar, hueso neoformado de una elevada calidad y transcurridos únicamente 8 meses, de la misma manera que redujo el tiempo necesario para la cicatrización del injerto. Puesto que los sustitutos óseos suelen emplearse para injertos de seno maxilar se hace evidente la necesidad de llevar a cabo más estudios, especialmente para aclarar su capacidad de conducción ósea, su habilidad para ser reabsorbidos tras la cicatrización, su comportamiento funcional cuando el hueso se halla sujeto a diferentes estados o condiciones de carga, y el comportamiento de estos materiales en caso de infección.
Correspondencia: Dr Alberto Rebaudi,
Via Fieschi 3, Genova, 16121, Italy;
fax: +39(0)-10-5304903;
e-mail: al.reb@tin.it.