Hace unos 20 años, los implantes dentales endoóseos satisfacían con éxito una demanda funcional. En la actualidad, con la predictabilidad de la osteointegración bien establecida, el desafío consiste en obtener resultados estéticos óptimos en un tiempo de tratamiento reducido. La implantación inmediata en los lugares de extracción1,2 ha respondido parcialmente a esta demanda, pero la necesidad de cirugías repetidas y de utilizar prótesis removibles durante un período de cicatrización prolongado puede desalentar a algunos pacientes. En el caso de pacientes completamente edéntulos, la carga inmediata3,4 ha permitido reducir el tiempo de tratamiento a la vez que evita el uso de una prótesis removible, lo que no suele ser bien aceptado por los pacientes. En el caso de implantes unitarios colocados en las zonas cicatrizadas se ha sugerido el método de provisionalización inmediata5-9 como medio para lograr una tasa de éxito que oscila entre el 80 y el100 % tras un período de seguimiento de 1 a 5 años. Esto incluye la entrega de una corona provisional que no tiene contacto oclusal durante los movimientos centrales o laterales.
Recientemente también se ha demostrado la validez de esta técnica en zonas de extracción10,11 con pequeños defectos periimplantarios, que no requieren el uso de técnicas regenerativas. Después de la extracción generalmente se observan dos tipos de defectos periimplantarios: un defecto circunferencial como consecuencia de la discrepancia entre el implante y la fosa ósea residual, y una dehiscencia vestibular, bien como consecuencia de una fractura radicular que comporta la necesidad de extracción, o como resultado de una extracción traumática.
El objetivo de este artículo fue evaluar la validez de la colocación de implantes en zonas de extracción reciente combinada con técnicas de provisionalización inmediata y regeneración ósea, expresada según las tasas de supervivencia del implante. Los autores también quisieron evaluar los resultados estéticos determinando la pérdida de hueso marginal y la preservación de las papilas tras 1 año de seguimiento.
Materiales y métodos
Esta evaluación clínica incluyó a pacientes sanos citados para la colocación de coronas implantosoportadas tras la extracción de una o dos piezas no viables y no adyacentes en la zona estética del maxilar superior. Además, el implante debía colocarse con un torque de como mínimo 40 Ncm, ya que esto provoca una estabilidad primaria suficiente para una provisionalización inmediata. Entre septiembre de 2000 y abril de 2004 se trataron de forma consecutiva 90 pacientes que presentaban una o dos piezas anteriores que debían ser sustituidas de forma inmediata o en el plazo máximo de una semana tras la extracción; se colocaron un total de 94 implantes. De entre ellos, 43 implantes (TiOblast, Astra Tech) se colocaron en 40 pacientes con un torque ≥ 40 Ncm. Estos implantes no estaban situados de forma adyacente a ningún otro implante y, por tanto, se incluyeron en este estudio.
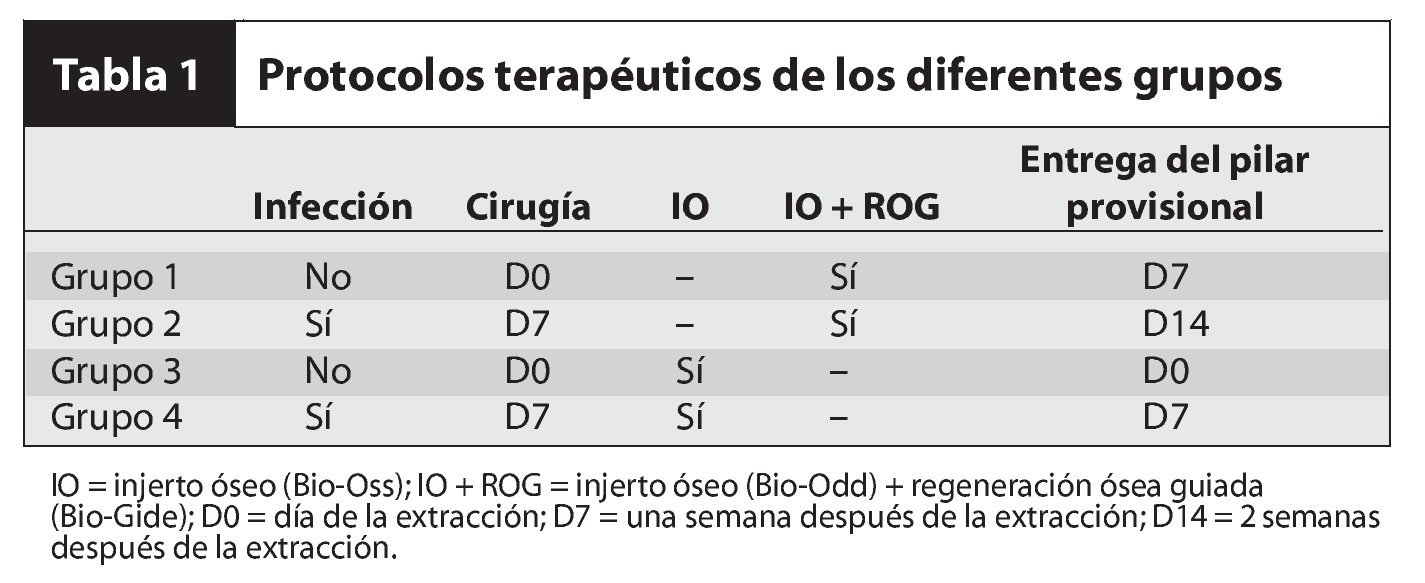
La presencia de infección local activa impidió la colocación inmediata del implante en algunos pacientes. En estos casos se inició un tratamiento antibiótico (1 g/día durante 14 días, Birodogyl, Aventis) el día de la extracción y el implante se colocó una semana más tarde. En las zonas sin infección local, el implante se colocó inmediatamente tras la extracción. El tratamiento antibiótico (1 g/día Birodogyl) se inició el día de la intervención y se mantuvo durante una semana. Toda la intervención se realizó con anestesia local. Los dientes, que se extrajeron por diversos motivos (caries, problemas endodóncicos, traumatismos o fracturas) fueron premolares, caninos, incisivos laterales e incisivos centrales del maxilar superior. Los premolares incluidos estaban situados en la zona estética. Los implantes colocados se asociaron con dos tipos de defectos óseos: defectos circunferenciales y dehiscencias. Los implantes se dividieron en 4 grupos según el tratamiento utilizado, la presencia o ausencia de infección y el día de la entrega de la corona provisional (tabla 1).
Intervención quirúrgica y protésica
Las extracciones se realizaron de forma atraumática en todos los grupos utilizando un periostotomo. Sin embargo, si la extracción provocó la pérdida de hueso vestibular, el implante se clasificó como grupo 1 o 2.
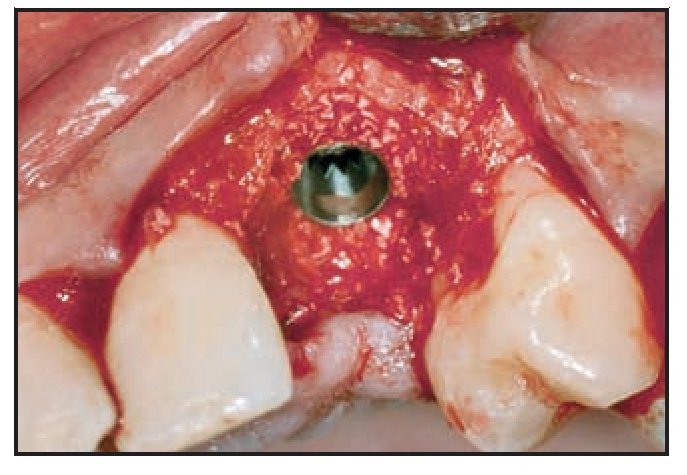
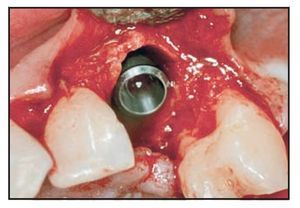
La incisión sulcular preservando la papila se extendió mesial y distalmente. Se elevó la mucosa vestibular unos 2 o 3 mm para comprobar la integridad de la tabla externa. Si se apreció algún defecto vestibular se realizó una incisión de descarga distal al diente distal. En presencia de un defecto circunferencial (grupos 3 y 4, figuras 1a y 1b) se realizó un fresado más allá del ápice ligeramente palatino al eje del diente para evitar perforar la tabla vestibular. Se buscó el anclaje cortical en el suelo de la fosa nasal, prefiriéndose los implantes Astra Tech ST mayores de 13 mm de longitud y con un diámetro de 4,5 o 5 mm. El fresado final se redujo unos 0,3 mm para permitir la colocación del implante con un torque igual o mayor de 40 Ncm. Llegados a este punto, todo implante inestable fue excluido de la evaluación.
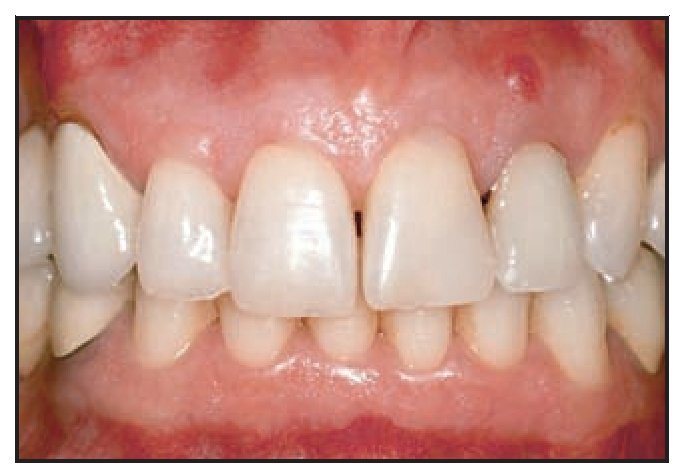
Figura 1a (izquierda) Canino inferior izquierdo fracturado.
Figura 1b (derecha) Defecto circunferencial.
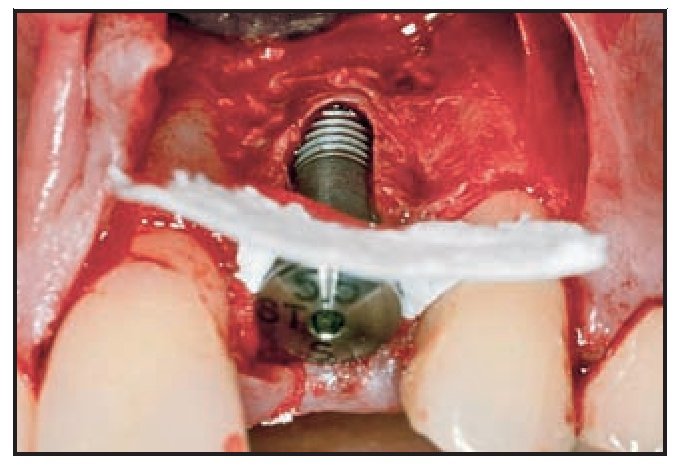
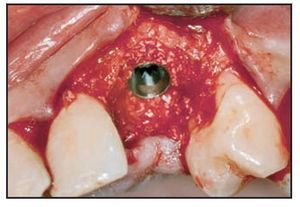
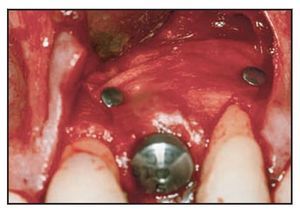
Los implantes se colocaron aproximadamente 3 mm por debajo del margen gingival libre. El defecto circunferencial se rellenó con un sustituto óseo (Bio-Oss, Gesitlich) con un tamaño de partícula mínimo (0,25 a 1 mm). El material se compactó inicialmente alrededor del implante y la superficie ósea circundante, especialmente en el aspecto vestibular (figura 2). Se colocó el pilar protésico (0,0 mm, ST, Astra Tech) y se ajustó de forma manual. En 7 casos se utilizó un pilar ST de 1 mm, en el resto se colocó un pilar de 0 mm. Una vez realizado el ajuste manual, el pilar no se extrajo. Esto se realizó para evitar alterar la cicatrización del tejido blando y la posterior invasión apical del tejido conjuntivo12. En caso necesario se compactó material adicional de relleno adyacente a la zona coronal del pilar. Una cofia de impresión a fricción se despojó de su parte aflautada, se redujo y modeló para crear un muñón. Tras colocarlo en el pilar, una corona preformada acrílica (Ion, GACD) se rebasó con resina acrílica.
Figura 2 Material de relleno compactado en el defecto.
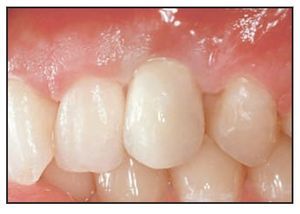
Los límites de esta corona provisional se recortaron sobre una réplica del pilar; la corona se pulió y se colocó en el pilar sin cemento para asegurar que no se producía el contacto durante la oclusión central o los movimientos laterales. Las papilas se suturaron con puntos de colchonero vertical y la sutura se retiró una semana más tarde. La pieza provisional se cementó con cemento temporal (figura 3). El punto de contacto interproximal se rehizo a una distancia máxima de 5 mm utilizando las coronas preformadas13.
Figura 3 Corona provisional 2 semanas tras la cirugía implantológica.
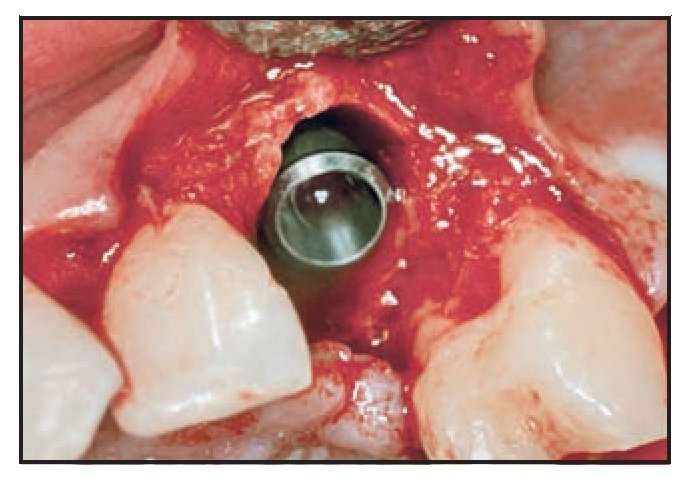
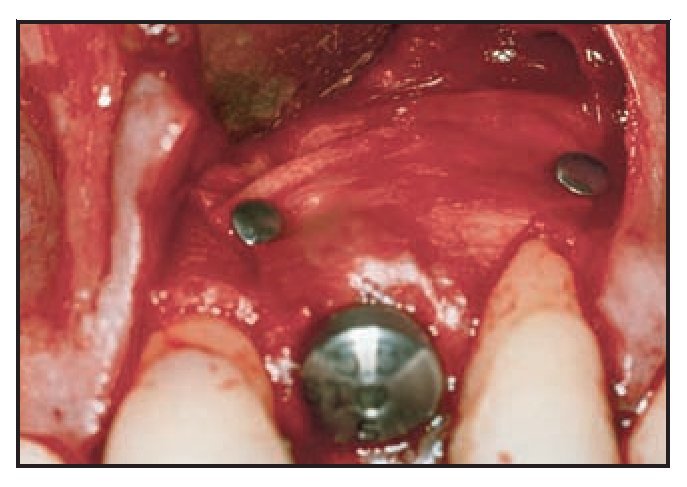
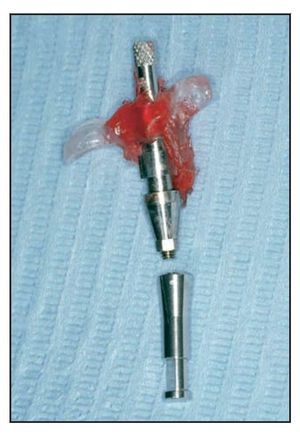
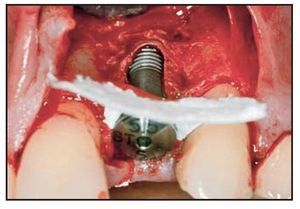
En casos de defecto vestibular (grupos 1 y 2) se realizó una incisión de descarga vertical distal una pieza más allá de la zona de extracción y se realizó el fresado de la misma manera. El implante se colocó utilizando el mismo torque, buscando el anclaje cortical. Llegados a este punto, todo implante que no logró un torque de inserción de 40 Ncm fue excluido de la evaluación. El cuello del implante se situó 2 mm por debajo de la unión amelocementaria de la pieza vecina, lo que dictó la colocación de la altura del implante. Se tomó una impresión utilizando una cofia de impresión pick-up conectada a un índice fabricado en el modelo maestro (figura 4). Una vez fraguó la resina acrílica, se retiró toda la pieza, se colocó un análogo del implante y se resituó en el modelo en el laboratorio, facilitando la fabricación del diente provisional. En esta fase, el defecto periimplantario se trató con una membrana de colágeno reabsorbible (Bio-Gide, Geistlich) que se fijó con un pilar de cicatrización de 5 mm (figuras 5a y 5b). El defecto óseo se rellenó según el mismo protocolo utilizado para el defecto circunferencial, y la membrana se colocó sobre el defecto (figura 6). La membrana se fijó apicalmente mediante un pin reabsorbible (Resor Pin, Geistlich) o pins de titanio (Frios, Friadent). Posteriormente se suturaron las papilas con puntos de colchonero vertical y la incisión de descarga vertical se cerró con puntos reabsorbibles de colchonero horizontal.
Figura 4 Cofia de impresión e índice conectado al análogo del implante.
Figura 5a Fístula relacionada con la fractura radicular.
Figura 5b Dehiscencia vestibular tratada con una membrana de colágeno reabsorbilble, que se fija mediante un pilar de cicatrización.
Figura 6 Colocación de la membrana sobre el material del injerto y fijación con pin de titanio.
En todos los casos se instruyó al paciente para que cepillase suavemente la zona suturada con un cepillo suave (Inava Post-op 7/100e, Lab Inava) impregnado con colutorio de clorhexidina (Eludril, Médicadent). Una semana después, una vez se consideró que la membrana era estable, el pilar para el que se había fabricado la pieza dental provisional se esterilizó, se colocó y se ajustó de forma manual (grupos 1 y 2). Entonces se colocó la pieza provisional y se cementó temporalmente, comprobándose de nuevo la ausencia de contacto oclusal en la oclusión central y los movimientos laterales. Se instruyó al paciente para que evitara masticar sobre la prótesis durante 3 meses.
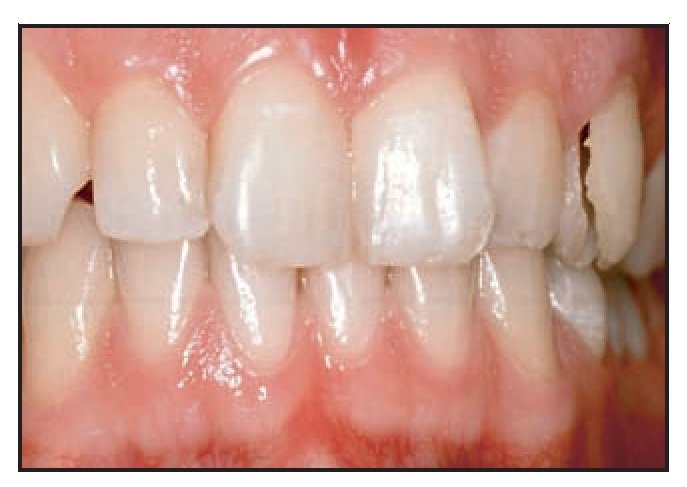
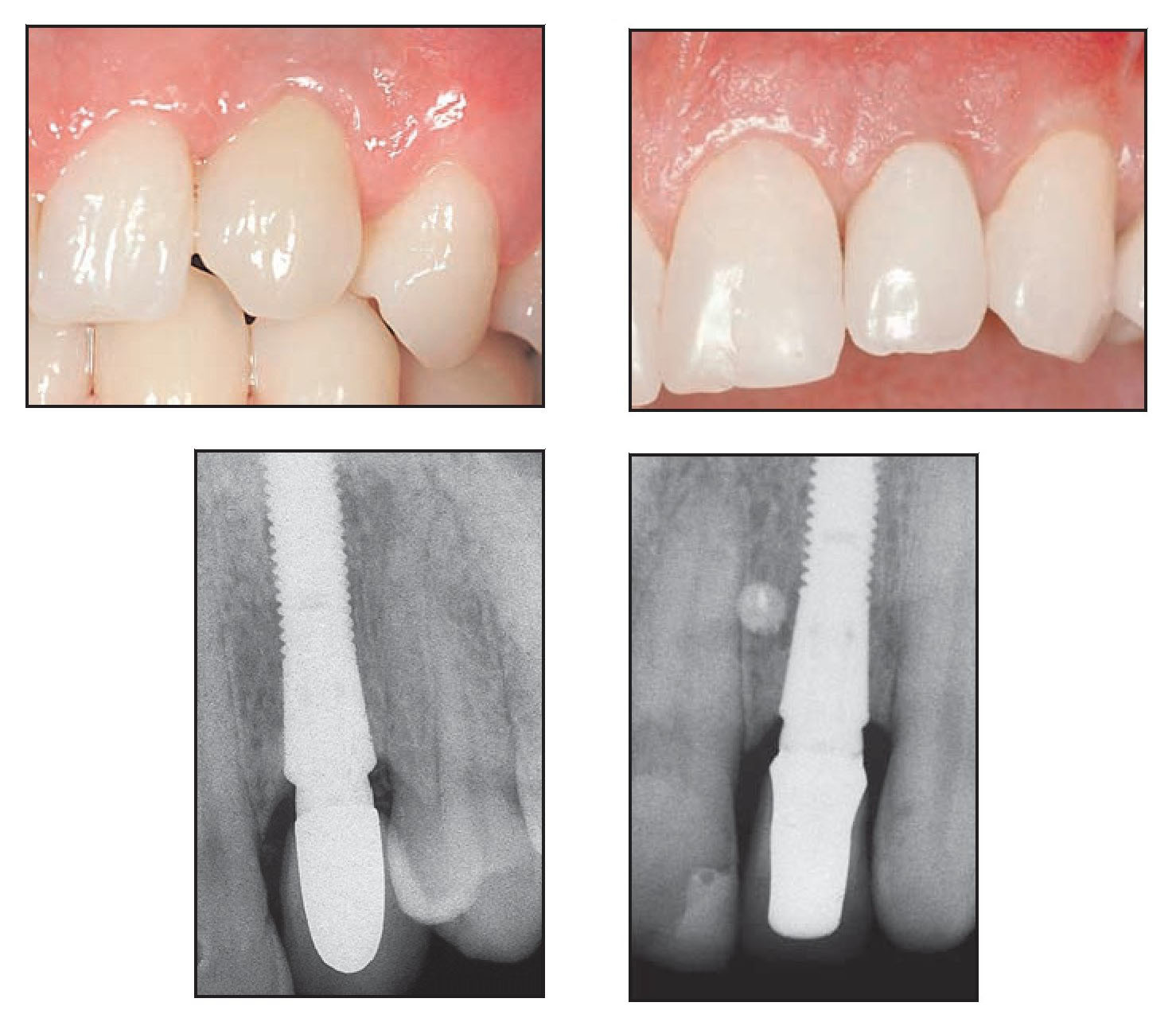
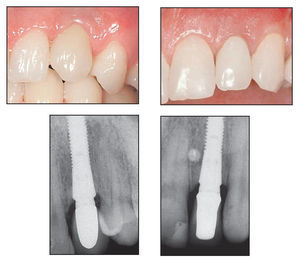
En todos los grupos, la ausencia de contactos oclusales en la pieza provisional se confirmó semanalmente a lo largo del período de cicatrización de 3 meses. Se realizó una radiografía periapical estándar utilizando un posicionador Rinn (GACD) el día de la entrega de la corona provisional (figuras 7a y 7b). Transcurridos 3 meses se tomó una impresión para la fabricación de la corona definitiva, que se cementó después de ajustar el pilar a 25 Ncm utilizando una llave de torque. Un año después se realizó una nueva radiografía periapical utilizando un angulador Rinn para evaluar el nivel de hueso interproximal (figuras 8a a 8d). El resultado estético se evaluó en todos los pacientes después de 1 año de seguimiento utilizando el índice de Jemt14, que mide la reconstrucción papilar.
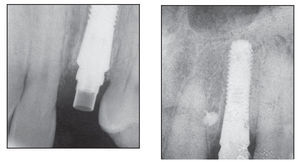
Figuras 7a y 7b Radiografías obtenidas del defecto circunferencial (izquierda) y del defecto vestibular (derecha) el día de la colocación de la corona provisional.
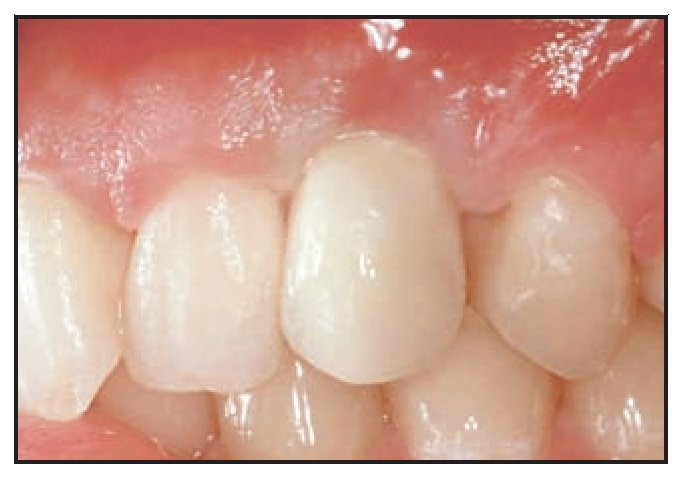
Figuras 8a a 8d Radiografías y aspecto clínico del defecto circunferencial (izquierda) y del defecto vestibular (derecha) un año después de colocar la corona definitiva.
Fracaso del implante
Como se sugiere en la literatura15, se consideró que los implantes habían fracasado si existió una pérdida significativa de hueso marginal, radiolucidez periimplantaria, movilidad, dolor, molestia o alteración neurosensitiva. Se consideró que los implantes restantes sobrevivieron.
Modificaciones en el hueso marginal
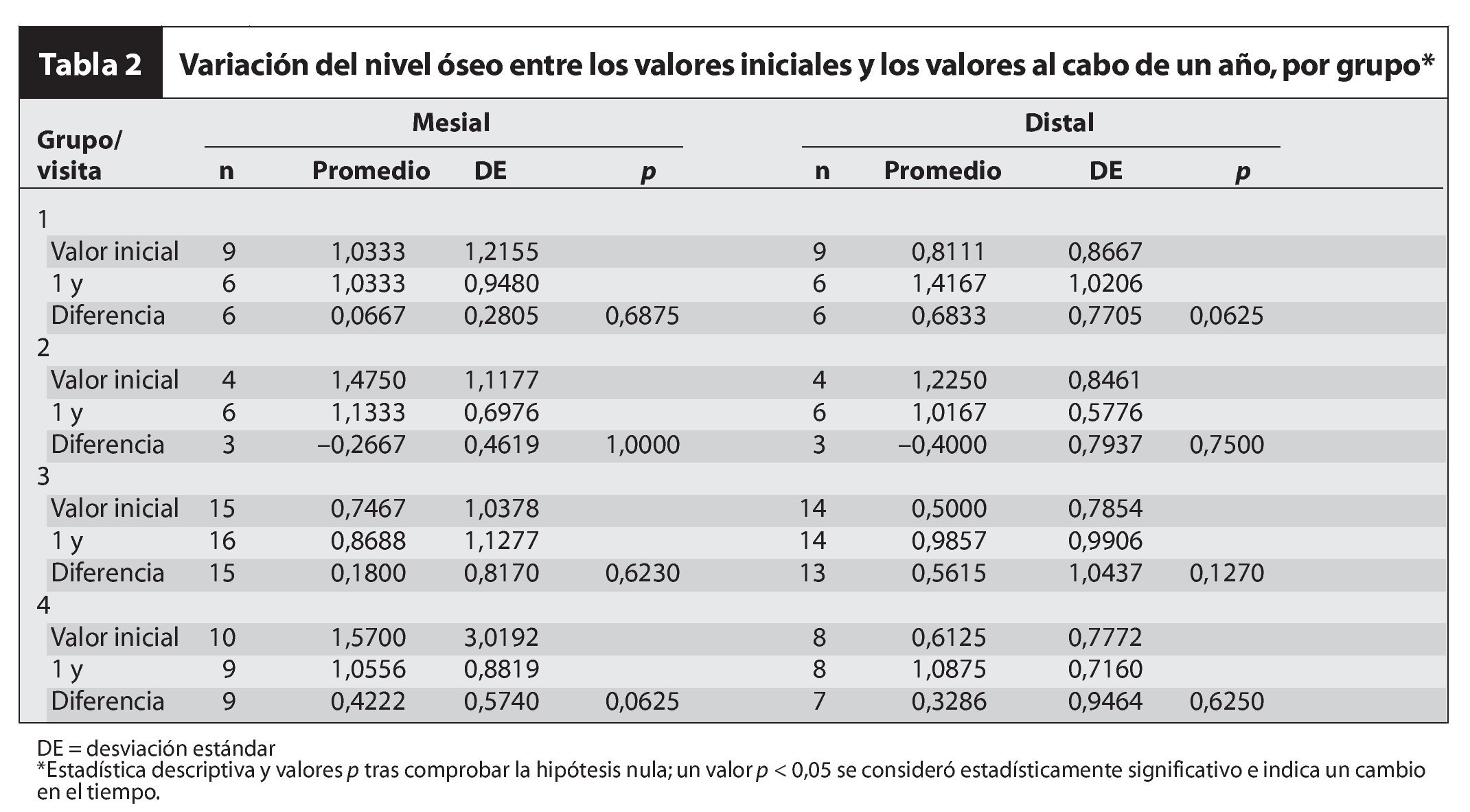
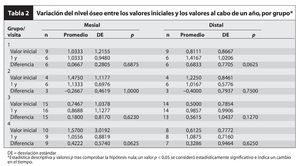
En 38 pacientes, la pérdida de hueso marginal se determinó comparando las radiografías en dos momentos puntuales: inicial, que correspondió al día de la entrega de la corona provisional, y durante el seguimiento, 52 semanas después. La unión entre el implante y el pilar sirvió como punto de referencia. En algunos pacientes no se pudo determinar el nivel óseo debido a la mala calidad de las radiografías.
Análisis estadístico
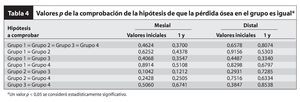
En conjunto se comprobó la hipótesis nula de que la pérdida de hueso sería la misma en los cuatro grupos utilizando el test de Kruskal-Wallis (cálculo exacto de Monte Carlo).
Se realizaron las comparaciones de grupo con datos aparejados utilizando el test de la suma de rangos de Wilcoxson (cálculo exacto). Entre grupos, se comprobó la hipótesis de que la variación entre los valores iniciales y los valores tras 1 año de seguimiento era 0 utilizando el test de Wilcoxon de rangos signados (cálculo exacto). Se consideró estadísticamente significativo un valor p inferior a 0,05.
Resultados
Los implantes colocados medían 9 mm de longitud (1 implante), 11 mm (6 implantes) o 13 mm (36 implantes), con un diámetro que osciló entre los 4 mm (3 implantes), 4,5 mm (38 implantes) y 5 mm (2 implantes).
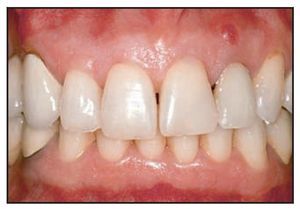
En la muestra general, las coronas definitivas fueron funcionales durante un período promedio de 2,8 ± 2,6 años (intervalo, 1 a 4,1 años). Dos pacientes refirieron dolor tras 2 semanas y se retiraron sus implantes respectivos. Estas dos pérdidas de implantes dieron lugar a una tasa de supervivencia acumulativa de los implantes del 95,3 % tras 1 año de carga. Los dos implantes fallidos pertenecían al grupo 2 (es decir, dehiscencia vestibular con infección local). El primer implante se perdió una semana después de su colocación; sustituía a un incisivo lateral, cuya fosa contenía una raíz que había soportado un perno para corona fracturado durante 6 meses, incluidos varios episodios infecciosos. El segundo era un implante de 11 mm que sustituía a un primer premolar fracturado. En ambos casos, los pacientes masticaron sobre la corona provisional al día siguiente de la intervención. La tasa de supervivencia de los implantes al cabo de 1 año fue del 80 %. No se produjeron fracasos diferidos.
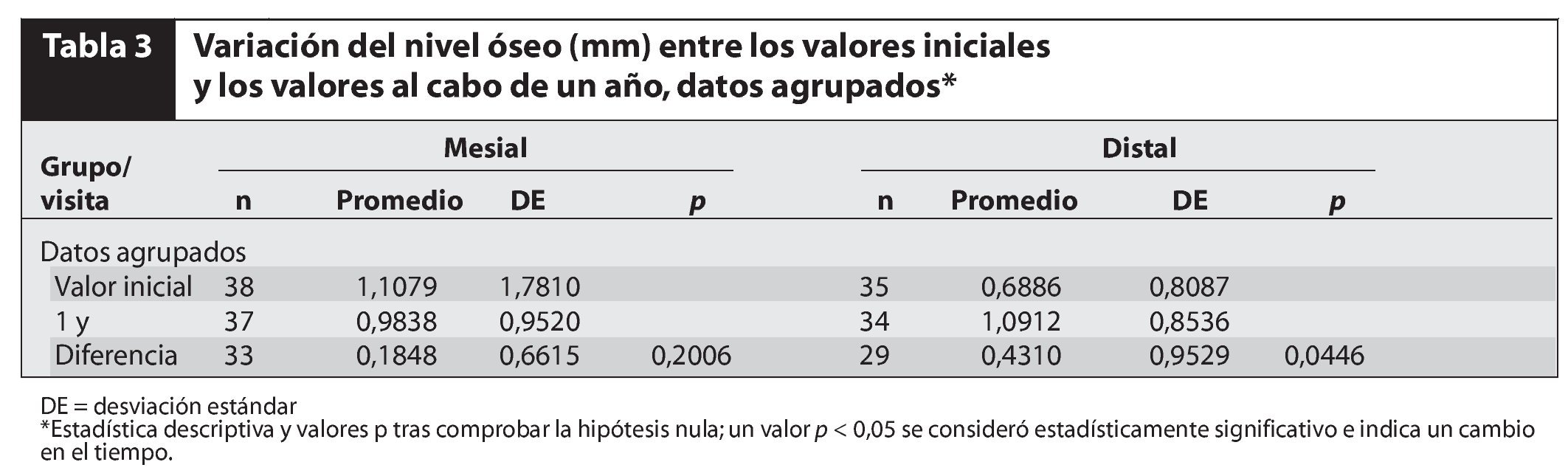
El promedio de pérdida de hueso marginal total tras 1 año de seguimiento (tablas 2 a 4) fue de 0,18 ± 0,66 mm mesialmente (no significativa) y de 0,43 ± 0,95 mm distalmente. No se detectaron diferencias estadísticamente significativas al comparar la pérdida de hueso marginal entre grupos. Dado que la variación global en el hueso marginal desde los valores iniciales hasta los valores al cabo de 1 año no fue estadísticamente significativa (p > 0,05), no sorprendió la ausencia de diferencias entre grupos. Por último, el test de variación del hueso marginal intragrupos desde los valores iniciales hasta los valores tras 1 año de seguimiento tampoco mostró diferencias significativas. De hecho, algunos pacientes presentaron crecimiento óseo (pérdida ósea negativa).
Con respecto al tejido blando, el 77,7 % de los implantes conservaron al máximo las papilas (índice 3); cerca de un 6 % presentaron hiperplasia. En el resto, la preservación no fue completa porque los defectos periodontales en las piezas adyacentes pudieron haber comprometido su preservación. El promedio del índice de la muestra global, excluyendo las papilas que presentaron hiperplasia, fue de 2,81 ± 0,5.
Discusión
Estudios anteriores sobre implantes colocados en zonas de extracción arrojaron tasas de éxito del 100 %10 o del 96,4 %11. En esos estudios, sin embargo, solamente se consideraron los implantes que mostraron defectos completamente circunferenciales, no se incluyeron dehiscencias vestibulares. Estas tasas de éxito corresponden a las obtenidas en los grupos 3 y 4 de este estudio. Respecto al grupo 1, la tasa de éxito también fue del 100 %, probablemente debido a que el tamaño de los defectos fue menor que en el grupo 2. Ciertamente, los defectos vestibulares causados por la extracción suelen ser menores que los causados por la infección local.
En el primer fracaso, el defecto representó el 80 % de la longitud del implante. En el segundo fracaso se había utilizado un implante relativamente corto debido a la proximidad del seno maxilar; el defecto era grave y la validez de la estabilidad primaria, cuestionable, a pesar de que se logró un torque de inserción de 40 Ncm. En estas dos zonas, la gravedad del defecto y la proximidad de las limitaciones anatómicas restringieron la estabilidad primaria a una parte reducida del implante, lo que puede explicar su fracaso.
En general, este protocolo permite el tratamiento de zonas edéntulas simples inmediatamente o, en caso de infección, en un período de tiempo ligeramente diferido tras la extracción, ya existan defectos vestibulares o no. La tasa de éxito del 95,2 % corresponde a la de una técnica convencional. Cuando se utiliza el mismo sistema de implantes en implantes unitarios colocados en zonas cicatrizadas mediante la técnica convencional, la literatura informa de una pérdida de hueso de 0,5 mm como promedio al año de seguimiento16,17. En el estudio aquí descrito, el nivel de hueso marginal permaneció estable en la mayoría de los casos, y en algunos pacientes se observó crecimiento óseo, independientemente del grupo al que pertenecían. En otros, una pérdida ósea relativamente grave se pudo correlacionar con la presencia de un defecto óseo periodontal en un diente adyacente.
Es interesante tratar de explicar las razones de esta estabilidad, o de esta ganancia ósea. En 1892, Wolff18 afirmó que «el hueso adapta su forma externa y su estructura interna como respuesta a las fuerzas mecánicas necesarias para el soporte». Esta adaptación es posible gracias a la formación de hueso intersticial. Actualmente son bien conocidas las consecuencias de la carga en el hueso periimplantario19,20.
Una micromotilidad excesiva evita la reparación ósea alrededor del implante21. Es más, se ha demostrado22 que la remodelación ósea se produce por la distorsión del microentorno óseo y que la mineralización del colágeno está directamente relacionada con su distorsión23,24. De hecho, según Frost25, «se ha identificado que el umbral de micromotilidad tolerada que conduce a una regeneración ósea anabólica se sitúa en torno a 500 y 3.000 mS (0,05 % < S < 0,3 %)». La tensión (S) se define como el cociente entre la longitud celular inicial y la longitud final obtenida tras aplicar una carga en ella. Se demostró in vitro26 que el movimiento del líquido intracanalicular tras la carga genera una distorsión de los osteocitos y de las células de revestimiento que actúan como mecanoreceptores y produce óxido nitroso y prostaglandina E2, que influyen en el reclutamiento de los osteoblastos y los osteclastos y, por tanto, en la remodelación ósea. Esto se ha demostrado recientemente en un estudio realizado en animales22 en el que se han detectado osteoblastos en la superficie de implantes de carga inmediata ya durante el primer día. Clínicamente, cuando se coloca una corona provisional de forma inmediata o tras un corto período de tiempo después de la colocación del implante, la presión de los labios y la lengua sobre la corona provisional genera tensión en el cuello del implante. Esta tensión generará distorsiones celulares directamente en el hueso periimplantario. Si oscilan entre 500 y 3.000 mS25, se producirá la remodelación ósea en la superficie del implante y, por tanto, la osteointegración. Tras una revisión de la literatura, Bertram y Swartz27 afirmaron que «la adaptación de la forma del hueso a los nuevos requerimientos funcionales supone una respuesta regenerativa o reparadora», lo que convierte a las zonas de extracción en las mejores zonas para aplicar este concepto.
En general, las zonas de extracción presentan defectos óseos, y las discrepancias periimplantarias resultantes imposibilitan que la tensión generada en el cuello del implante se transfiera al hueso circundante. Para preservar este defecto es esencial rellenarlo con un material que tenga las mismas propiedades físicas que el hueso humano, especialmente el módulo de elasticidad. Esta técnica puede aplicarse si estamos seguros de que el hueso periimplantario o el que limita el defecto está sometido a la micromotilidad incluida en el intervalo definido por Frost25. Esto es posible utilizando una característica de superficie exclusiva en el cuello del implante. Es el microrroscado el que anula28 los efectos de la carga en el hueso periimplantario circundante.
La estabilidad ósea también podría ser consecuencia del hecho de que el pilar colocado a la entrega de la corona provisional nunca se retira, lo que evidentemente es importante para preservar la unión conjuntiva12. En un estudio similar10, el implante seleccionado tenía un cuello liso y no se utilizó ningún material para rellenar el defecto circunferencial. La pérdida de hueso tras 1 año de seguimiento fue de 0,24 mm, pero pareció desarrollarse al mismo tiempo que el nivel de tejido blando. En otro estudio en el que se utilizaron implantes Astra Tech ST11, el promedio de pérdida ósea tras 1 año de seguimiento fue de 0,4 mm. Este resultado tiene que ser en cierto modo erróneo ya que, de forma análoga a este estudio, algunos implantes mostraron crecimiento óseo, pero el autor no los contabilizó.
La colocación temprana de una pieza provisional también influye en la cicatrización del tejido blando y la preservación de las papilas29. El tejido blando, al igual que el hueso, se remodela alrededor de una pieza protésica según la remodelación de la morfología del hueso subyacente.
Conclusión
Los pacientes con rehabilitación de piezas unitarias pueden tratarse de forma predecible mediante la técnica de provisionalización inmediata, incluso en alveolos post-extracción reciente con defectos óseos. La principal ventaja de esta técnica es la reducción significativa del tiempo de tratamiento y la necesidad inexistente de llevar una prótesis removible. En caso de que deba aplicarse la técnica de regeneración ósea guiada, es necesario utilizar una prótesis removible durante unos días. La pérdida de hueso tras un año de seguimiento no fue estadísticamente significativa, lo que significa que el resultado estético es predecible. Esta ausencia de pérdida ósea es consecuencia del enfoque biológico a la consolidación ósea, que reconoce la necesidad de estimular el hueso mientras se está formando, de manera que se remodela para soportar la tensión a la que será sometido. La tasa de supervivencia del implante del 95,2 % es comparable con la observada a corto plazo tras un protocolo convencional en dos fases30. No obstante, la presencia de infección local en la zona planificada para el implante puede hacer peligrar el resultado. Deben realizarse estudios multicéntricos para confirmar la eficacia de este protocolo.
Correspondencia: Dr Pascal Valentini,
2 avenue Hoche, 75008 Paris, France;
fax: + 33 1 47 66 85 03;
e-mail: pascalvalentini@aol.com.