Los pacientes que requieren tratamiento mucogingival lo suelen posponer a menudo debido a la disponibilidad limitada de injertos o porque quieren evitar los inconvenientes asociados al injerto autólogo1-3. A pesar de que se han desarrollado varias intervenciones de cirugía plástica periodontal para aumentar la zona de la encía queratinizada e insertada4,5, las heridas de la zona donante y la necesidad de múltiples intervenciones quirúrgicas hacen que los pacientes busquen otras opciones terapéuticas. Por tanto, sería ventajoso encontrar una opción terapéutica que eliminase el dolor de la obtención de tejido donante palatino y permitiese tratar múltiples dientes en una única intervención.
Los clínicos han utilizado injertos alogénicos y biomateriales sintéticos en cirugía mucogingival con resultados variables6,7. Investigaciones recientes han explorado la posibilidad de utilizar derivados de tejido vivo obtenidos mediante ingeniería (tratamiento con células vivas [TCV]) como alternativa a los injertos palatinos para dientes8-10. El objetivo de este artículo es presentar el uso del TCV como alternativa para tratar los defectos de la mucosa oral. El TCV examinado en esta serie de casos se ha utilizado para tratar heridas dérmicas resistentes al tratamiento, incluidas las úlceras cutáneas diabéticas y venosas, en más de 200.000 pacientes. El TCV es una formación bilaminar de células neonatales viables y alogénicas formado por una capa inferior de fibroblastos y una capa superior de queratinocitos que facilitan la cicatrización proporcionando a la herida la matriz extracelular y las citoquinas de expresión11. Las dos capas de la estructura parecen actuar de forma sinérgica, presentando un mayor abanico de quinas que las que presentaría cada capa por separado12,13.
En esta serie de casos se examina un tratamiento con un tejido bilaminar de células vivas (TCV) obtenido mediante ingeniería como alternativa a los injertos gingivales libres en individuos con defectos de la mucosa oral. Las zonas se trataron y se evaluó la cicatrización de la herida, el aspecto histológico de la mucosa regenerada, y la persistencia del ADN del TCV. Para establecer las características del tejido regenerado en las zonas tratadas se obtuvieron biopsias mediante incisión circular (2,5 mm de diámetro) a las 3 y 7 semanas del tratamiento y se remitieron para su estudio. La mitad de cada biopsia se procesó para su estudio histológico y en la otra mitad se comprobó la persistencia de los implantes de TCV comparando el ADN de las biopsias extraídas con las muestras de ADN de los participantes del estudio.
Materiales y métodos
Se seleccionaron 4 individuos procedentes de una clínica privada en base a su necesidad de tratamiento quirúrgico mucogingival (1 hombre, 3 mujeres; edad: 30 a 60 años) (tabla 1). Requerían un injerto gingival libre para tratar los defectos mucogingivales pero, o bien tenían un aporte limitado de la zona donante o no estaban dispuestos a someterse a una extracción de injerto palatino. Todos los individuos estaban sanos y no tenían problemas conocidos de cicatrización, aunque un individuo había sido fumador de medio paquete de cigarrillos diarios durante los últimos 20 años y siguió fumando durante el tratamiento y el período de observación. Se trataron cinco zonas, incluida una zona edéntula bajo una prótesis parcial fija soportada por 4 implantes provisionales.
Todos los individuos recibieron un TCV bicapa obtenido mediante ingeniería (CelTx, Organogenesis) en lugar de un injerto gingival libre. El TCV es un producto vivo formado por una bicapa de queratinocitos y fibroblastos humanos (aislados del joreskin) construido sobre una matriz de colágeno bovino tipo I y suministrado en una bandeja bioinerte con un medio de soporte gelificado (agarosa). El producto se envía en un dispositivo diseñado y validado para mantener la viabilidad a temperatura ambiente. El TCV se utilizó, como se especifica, en los 10 días posteriores al envío.
Se utilizaron incisiones horizontales en la unión mucogingival para crear lechos tisulares receptores a espesor parcial. Se liberaron las inserciones del frenillo y se suturaron para proporcionar hemostasia y reducir la extensión de la herida. La bandeja bioinerte del TCV se abrió en condiciones estériles y se sacó el TCV del envase de polivinilo y se dobló en cuatro capas para proporcionar el grosor adecuado para la sutura y una «dosis» del tratamiento celular. El TCV en capas se recortó para adaptarse a las dimensiones del lecho de tejido conectivo preparado y se colocó con el lado basal (fibroblastos) en contacto con el lecho del injerto y el lado epitelial orientado a la superficie. Entonces se suturó con polipropileno o catgut y se colocó un cemento quirúrgico sobre las zonas quirúrgicas (mepitel, Mölnlycke Health Care; Coe-Pak, GC America). Se recetaron antibióticos (amoxicilina, 500 mg tres veces al día durante 5 días, o clindamicina, 300 mg tres veces al día durante 5 días) durante el postoperatorio. Los individuos volvieron a cepillarse los dientes mediante la técnica modificada de Stillman transcurridos 7 días y volvieron a utilizar el hilo dental en la zona quirúrgica después de 4 semanas. Fueron citados de nuevo y se evaluaron al cabo de 1, 2 y 3 semanas y 1, 2, 3 y 6 meses.
La cicatrización y la apariencia del tejido se monitorizaron a lo largo de todo el estudio y se registró cualquier reacción adversa o suceso destacado referente a la cicatrización. Se registró la recesión y la profundidad de la bolsa al milímetro más cercano (UNC Probe, Hu-Friedy) al inicio y a los 6 meses para obtener las mediciones de los niveles de inserción clínica. Se midió el grosor del tejido queratinizado al inicio y a los 6 meses.
Para determinar el carácter del tejido generado en las zonas tratadas se obtuvieron muestras de biopsia mediante sacabocados (2,5 mm de diámetro) a las 3 y 7 semanas postratamiento y fueron remitidas para su análisis. La mitad de cada muestra se colocó en formalina y se procesó para su análisis histológico, y la otra mitad se congeló y se comprobó la persistencia de los injertos de TCV comparando el ADN de la muestra biopsiada con muestras de ADN salivar de los individuos. Se realizó la amplificación y el tipaje del ADN de las muestras salivares y tisulares y se obtuvieron los resultados utilizando un análisis de microsatélites.
Resultados
Las cinco zonas quirúrgicas cicatrizaron sin problemas, con epitelización completa hacia los 14 días del postoperatorio y sin efectos adversos significativos. Las intervenciones lograron los objetivos de aumento de la anchura de la encía queratinizada sin necesidad de un injerto palatino, y las zonas tratadas presentaron la misma textura y color que el tejido adyacente. Los tejidos estaban sanos desde el punto de vista periodontal y no presentaron sangrado al sondaje.
Informe de los pacientes
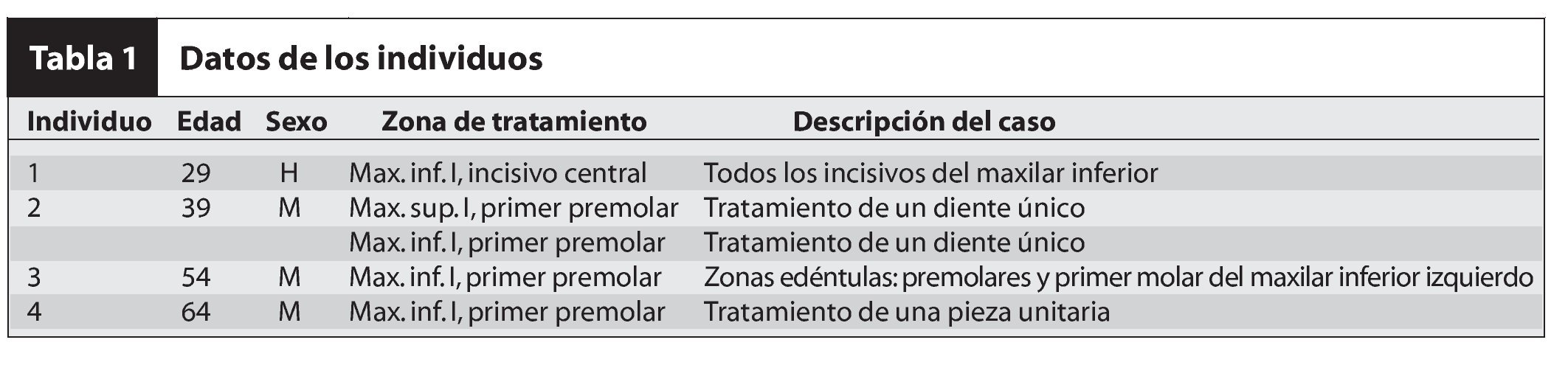
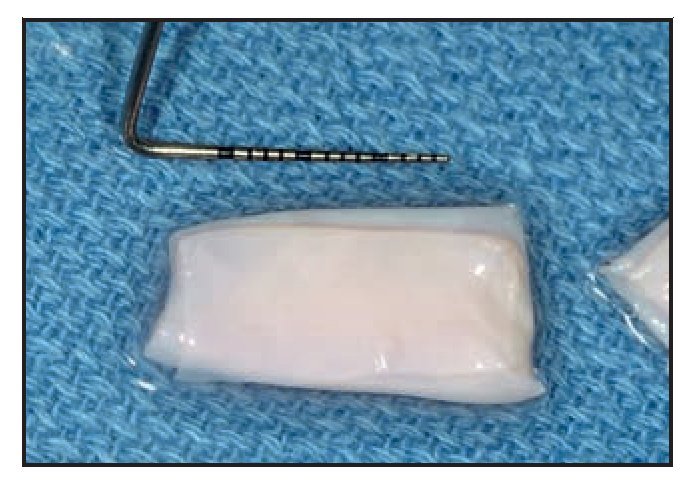
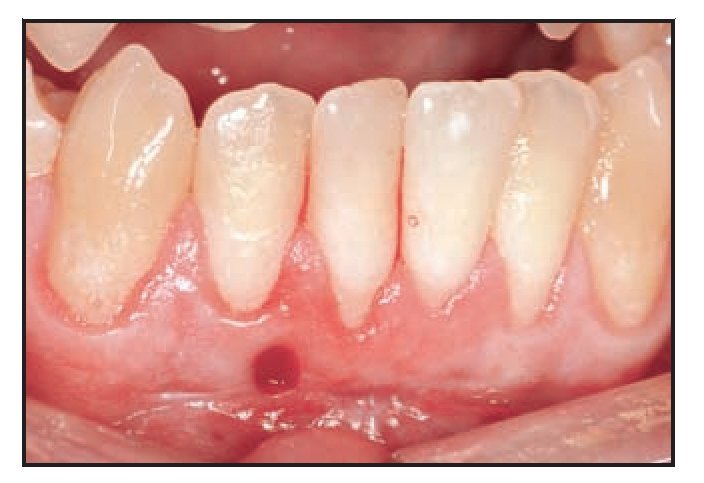
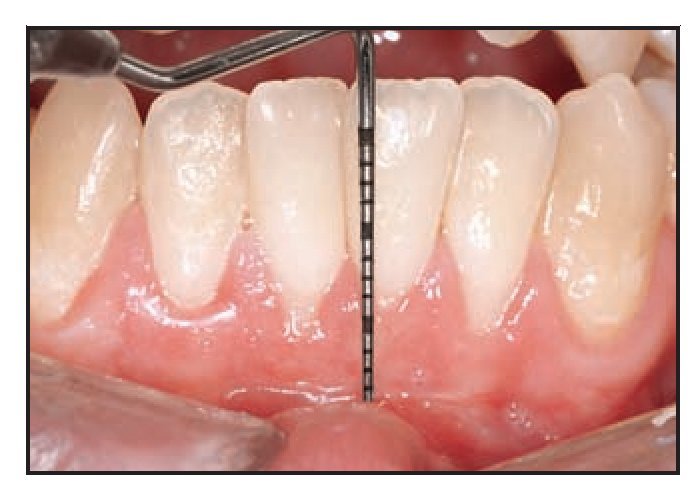
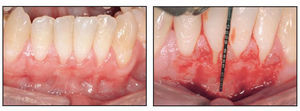
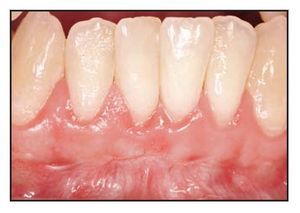
El paciente 1 presentó una encía no adherida (0 a 2 mm de encía queratinizada) y una inserción elevada del frenillo en el margen gingival de los incisivos inferiores (figura 1a). La zona quirúrgica se preparó de acuerdo a la preparación del lecho receptor para un injerto gingival libre creando una incisión horizontal en la unión mucogingival directamente a través del frenillo. Posteriormente se colocaron suturas de catgut de 6-0 en la mucosa labial en la zona de inserción del frenillo reseccionado (figura 1b). Un trozo de 20 x 10 mm2 de TCV de cuatro capas (figuras 1c a 1e) se fijó mediante suturas de polipropileno de 7-0 utilizando la técnica suspensoria continua y puntos sueltos (figura 1f). La herida quirúrgica se protegió con un apósito de dos capas (Mepitel, Coe-Pak). El apósito y las suturas se retiraron a los 3 días de la intervención (figura 1g).
Figuras 1a (izquierda) y 1b (derecha) Preparación de la zona para recibir el TCV.
Figuras 1c (izquierda) y 1d (derecha) Bandeja de biorreacción con el TCV doblado en cuatro capas para proporcionar grosor y suministrar una dosis suficiente del tratamiento.
Figura 1e (izquierda) TCV doblado y del tamaño adecuado para el tratamiento. Las células epiteliales están en la superficie y las células dérmicas deberán colocarse directamente en el lecho de la herida.
Figura 1f (derecha) Colocación del TCV sobre el lecho de tejido conjuntivo.
Figura 1g (izquierda) Zona del TCV a los 3 días de la intervención.
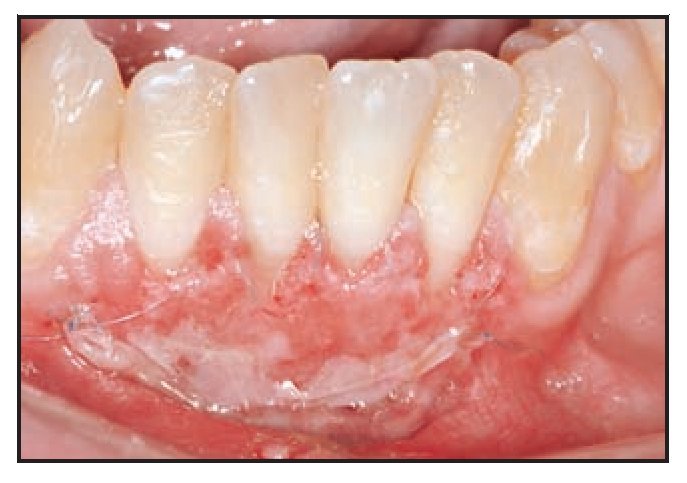
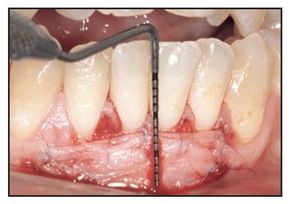
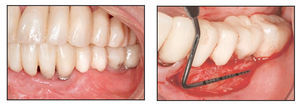
El paciente fue citado para evaluar la cicatrización de la herida, controlar la placa supragingival y recibir instrucciones sobre higiene oral los días 3, 7, 14 y 28 tras la intervención. Durante la visita del día 28 (figuras 1h y 1i) se obtuvo una biopsia mediante punch de la zona tratada y se obtuvieron muestras de ADN tanto del tejido cicatrizado como de la saliva de los individuos para su análisis comparativo.
Figura 1h (derecha) Zona del TCV a las 4 semanas.
Figura 1i (izquierda) Obtención de una muestra de biopsia de 2,5 mm mediante punch a las 4 semanas.
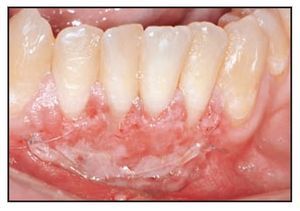
La cicatrización transcurrió sin problemas y el tratamiento con TCV provocó un aumento de la anchura de la encía queratinizada con un tejido clínicamente sano, una profundidad al sondaje mínima y sin sangrado durante el mismo. El seguimiento a largo plazo (26 meses) reveló la estabilidad de la zona tratada (figura 1j).
Figura 1j (derecha) Zonas tratadas a los 26 meses, mostrando un resultado estable.
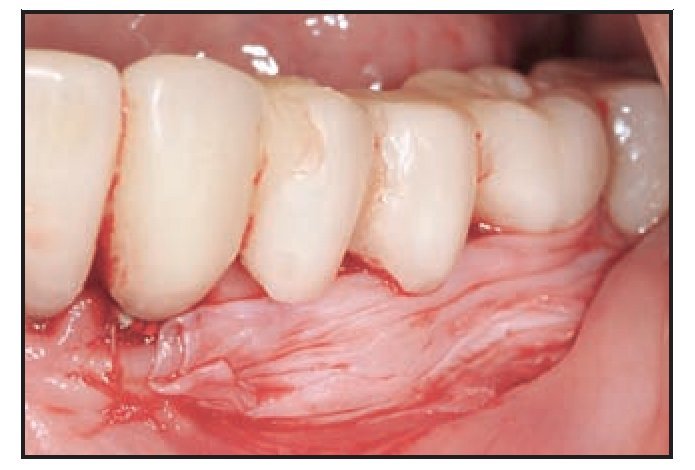
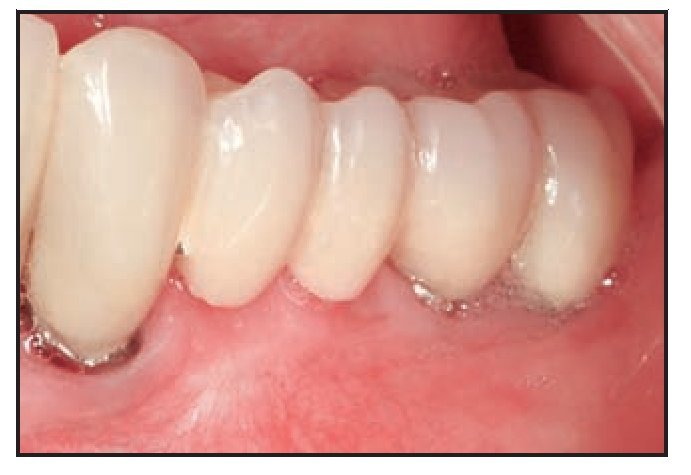
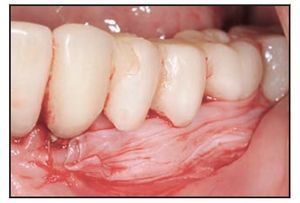
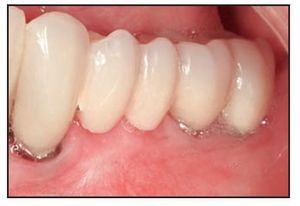
El paciente 3 presentó edentulismo en la zona premolar izquierda y sobrecrecimiento de la mucosa alveolar que se extendió al aspecto coronal de la cresta edéntula tras los procedimientos de extracción y preservación de la cresta (figura 2a). La zona edéntula se trató con implantes dentales que soportaron una prótesis parcial fija provisional, y el paciente necesitó un aumento gingival con vestibuloplastia para aumentar la zona de mucosa queratinizada y normalizar la línea mucogingival previamente desplazada. Se realizó una incisión horizontal apical a la unión mucogingival, y se eliminó la mucosa coronal a la incisión mediante una disección de espesor parcial a fin de preparar el lecho receptor para aplicar el TCV (figura 2b), que se suturó con catgut del 5-0 (figura 2c). La cicatrización se produjo sin incidencias, aunque pareció existir una ligera migración coronal de la unión mucogingival durante la fase de maduración de la cicatrización desde la semana 4 a la 12 del postoperatorio. El resultado a los 7 meses del postoperatorio muestra que el tratamiento clínico fue satisfactorio (figura 2d).
Figuras 2a (izquierda) y 2b (derecha) Aspecto inicial del paciente 3 mostrando la zona edéntula y la preparación de la zona donante.
Figura 2c (izquierda) Aplicación quirúrgica del TCV.
Figura 2d (derecha) Aspecto de la zona 7 meses después de la intervención.
Análisis histológico
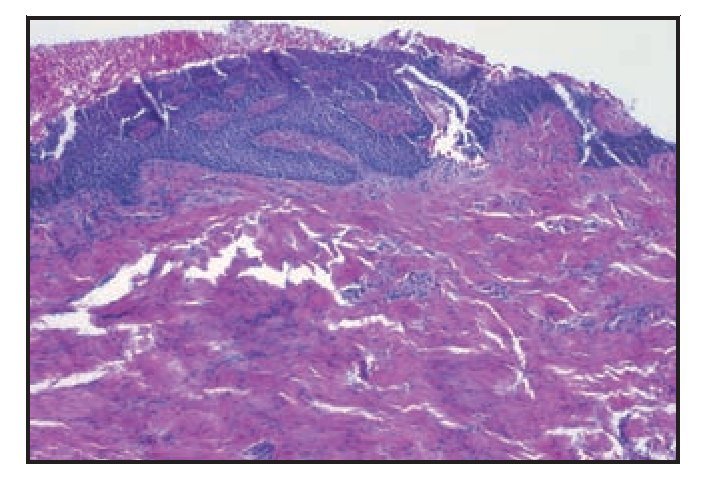
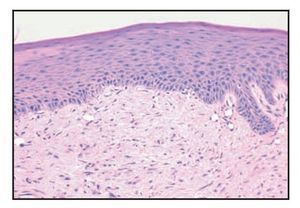
Las muestras histológicas obtenidas mediante biopsia con punch 3 y 7 semanas después de la intervención revelaron un tejido gingival caracterizado por un epitelio paraqueratinizado con una respuesta inflamatoria crónica en el tejido conjuntivo muy escasa y difusa (figura 3). En conjunto, todas las muestras presentaron un epitelio superficial normal. Una de las muestras (figura 3) presentó una capa epitelial delgada y de color rosado compatible con una transición temprana a un epitelio ortoqueratinizado. Esto podría representar una fase temprana de maduración hacia un epitelio mucho más queratinizado.
Figura 3 (izquierda) La muestra de biopsia tomada el día 35 revela un epitelio paraqueratinizado con una estructura y organización normal del tejido (hematoxilina y eosina). El tejido conjuntivo presenta un escaso infiltrado inflamatorio crónico más destacado en el tejido conjuntivo papilar inmediatamente adyacente al epitelio ( 10).
Una biopsia de seguimiento de la zona edéntula a los 26 meses (figura 4) mostró un epitelio paraqueratótico sano de grosor normal con crestas interpapilares elongadas. El estroma no presentó inflamación y pareció estar formado por tejido conjuntivo fibroso normal.
Figura 4 (derecha) Biopsia de la zona edéntula a los 26 meses (hematoxilina y eosina, 10).
Persistencia del ADN
El examen de la persistencia del ADN indicó que cada par de muestras (frotis y biopsia) obtenida de cada individuo presentó el mismo ADN identificativo, sin evidencia de ninguna otra fuente. Esto demostró que en el momento de la realización de la biopsia (20, 29, 35 y 45 días), en las zonas injertadas solamente estuvo presente el ADN de cada uno de los 4 individuos.
Discusión
Esta serie de casos demostró el potencial de un tejido bicapa TCV obtenido por ingeniería para tratar defectos de la mucosa oral. Las cinco zonas tratadas cicatrizaron con una mucosa gingival histológicamente normal que demostró clínicamente un aumento en la anchura de la encía queratinizada. El uso de TCV está demostrado en zonas parcialmente edéntulas, y el tratamiento tiene como resultado un aumento del tejido queratinizado y una mejoría de la anatomía vestibular que facilitó las técnicas de higiene oral. El color y la textura del tejido resultante coincidieron con el tejido de la mucosa oral circundante. Con respecto a esto, la estética fue superior al aspecto esperado con los injertos gingivales libres, donde a menudo existen diferencias en cuanto al color y la textura de las zonas injertadas y los tejidos circundantes.
En la búsqueda de una alternativa al injerto gingival se han estudiado biomateriales y materiales alogénicos, pero estos materiales inertes han arrojado resultados variables, quizás debido a que no se revascularizan fácilmente o a que apenas proporcionan estímulo para una cicatrización activa14-17. Los factores de crecimiento, que estimulan la cicatrización de la herida y reducen de forma concomitante la duración de las molestias postoperatorias, parecen prometedores18,19. El TCV puede favorecer la cicatrización al proporcionar una matriz extracelular para la herida y la expresión de las citoquinas11. Las dos capas de la matriz parecen actuar de forma sinérgica proporcionando una muestra más amplia de factores de crecimiento que los proporcionados por cada capa por separado12,13. El TCV produce una variedad de factores de crecimiento angiogénicos, como el factor de crecimiento endotelial vascular y el factor de crecimiento fibroblástico básico, que son importantes inductores de la vascularización durante las fases iniciales de la cicatrización de la herida. El TCV también produce defensina B de forma continuada, que reduce potencialmente la carga bacteriana cerca del defecto y conduce a una cicatrización más rápida y sin sobresaltos20.
McGuire y cols.10 investigaron el TCV como alternativa a los injertos gingivales libres autólogos en un estudio piloto controlado de boca partida realizado en 25 pacientes. El TCV se comparó con los injertos gingivales libres en los cuadrantes contralaterales que presentaban zonas con una encía insertada deficiente y se comprobó que era seguro y capaz de regenerar tejido queratinizado de novo sin la morbilidad ni las potenciales dificultades clínicas asociadas a la cirugía de autoinjerto palatino. Se demostró un aumento del tejido queratinizado en 24 de las 25 zonas estudiadas después de 6 meses. Tres cuartas partes de las zonas produjeron bandas de encía queratinizada de cómo mínimo 2 mm de anchura. No se observaron diferencias entre las zonas control y las zonas test en cuanto al nivel de inserción clínica, recesión, inflamación o resistencia al estiramiento del músculo. Además, se observó que el TCV fue superior a los injertos gingivales libres en cuanto a la similitud del color y la textura. Comprensiblemente, los individuos prefirieron el tratamiento TCV que la cirugía palatina de autoinjerto.
En este informe, el estudio histológico mostró un tejido gingival clínicamente normal formado por un epitelio paraqueratinizado. A pesar de que el aspecto macroscópico del tejido «regenerado» se diferenciaba de la mucosa alveolar adyacente, en el momento de la biopsia inicial (20 a 45 días) no se observó la maduración completa hasta un tejido totalmente ortoqueratinizado. La evaluación histológica demostró la presencia de un epitelio paraqueratótico (retención de núcleos en las capas más superficiales y ausencia de estrato granuloso). Cualquier discrepancia entre el aspecto macroscópico y microscópico puede explicarse por la naturaleza regenerativa de este epitelio. Si los tejidos estaban en un estado hiperproliferativo y no presentaban aún una latencia total, es posible que los núcleos estuviesen retenidos en la capa más superficial del epitelio. Una posible muestra de esta maduración temprana a un epitelio ortoqueratinizado se puede apreciar en la figura 3. La última muestra, obtenida a los 26 meses (figura 4), reveló una queratinización más madura de epitelio de superficie.
El análisis de la persistencia del ADN indicó que el TCV no estuvo presente en el momento de la toma de muestra para biopsia (3 a 7 semanas). En otras aplicaciones para heridas dérmicas, una estructura similar de células vivas sufre una necrosis relativamente rápida tras el injerto (quizás a los 7-14 días). Esto no quiere decir que las células basales bien adaptadas no sean viables; probablemente sí lo sean y estén contribuyendo a la regeneración. Por este motivo también podría ser útil biopsiar los injertos en períodos más iniciales para verificar la viabilidad del tejido. Evaluar esta «ventana de viabilidad» permitiría esclarecer la respuesta biológica del tejido. Dado que el TCV se «disipa» del lugar de cicatrización, aparentemente actúa como agente cicatrizante, en oposición a un injerto.
Los resultados de esta serie reducida de casos, junto con otras evidencias para la aplicación de matrices de células vivas en heridas dérmicas que no responden al tratamiento, parecen indicar que el TCV podría favorecer la cicatrización de las heridas en mucosas gracias a una serie de factores de crecimiento suministrados en función de las necesidades de la herida en cicatrización. Las citoquinas favorecerían no sólo la proliferación celular, sino también la angiogénesis, un componente crítico de la cicatrización de heridas orales. Al parecer el TCV actúa como tratamiento cicatrizador más que como injerto, guiando quizás a las propias células del paciente a la zona de tratamiento para desarrollar nuevos tejidos. Dado que el TCV ya no está presente transcurridas las primeras semanas, es posible que se produzca una llamada inicial de citoquinas y la consiguiente cascada celular para la cicatrización.
Conclusión
Este artículo demuestra la cicatrización de los injertos en la mucosa oral tratados con TCV. La epitelización completa se produjo hacia el día 14 del postoperatorio, sin efectos adversos significativos. Las zonas tratadas presentaron el mismo color y textura que los tejidos adyacentes. Las muestras histológicas revelaron una arquitectura del tejido gingival caracterizada por la presencia de un epitelio paraqueratinizado. Los resultados de la persistencia del ADN indicaron que en el momento de la biopsia solamente estaba presente el ADN de cada individuo en las zonas de cicatrización, lo que demuestra la no persistencia del TCV. Las observaciones iniciales indican que el tratamiento puede ser útil en caso de defectos de la mucosa oral en zonas edéntulas. Son necesarios estudios clínicos e histológicos adicionales para evaluar la utilidad del TCV en la práctica clínica.
Agradecimientos
No se dispuso de ayuda económica directa para financiar esta serie de casos. Las consultas del Dr. Nevins y sus investigaciones clínicas han sido financiadas por Organogenesis, Canton, Massachusets. El autor agradece al Dr. Jonathan Garlick, de Tufts University, Boston, Massachusetts, la preparación histológica y su análisis.
Correspondencia: Dr Marc Nevins,
175 Cambridge Street Suite 310, Boston, MA 02114;
fax: +617-720-0836;
e-mail: marc_nevins@hms.harvard.edu.