La colocación de implantes osteointegrados como soporte para prótesis es una alternativa terapéutica válida en pacientes edéntulos, con una tasa de éxito elevada cuando existe una cantidad de hueso suficiente1-6. Sin embargo, la cantidad de hueso disponible en el maxilar inferior posterior al foramen mentoniano suele ser reducida como consecuencia de la reabsorción crestal tras la pérdida del diente7. Esto, junto con la presencia del nervio alveolar inferior (NAI), puede imposibilitar la colocación de implantes de longitud adecuada. En esos casos, la rehabilitación del implante necesita un aumento de la cantidad de hueso.
Entre las estrategias terapéuticas para tratar la atrofia avanzada del maxilar inferior existe la movilización del NAI con la colocación simultánea de implantes8,9. Esta técnica solamente requiere una única intervención quirúrgica, asegura la estabilidad bicortical del implante (se utiliza tanto la cortical crestal como la cortical inferior) y requiere un período total de tratamiento de solamente unos 6 meses. Su inconveniente es el riesgo de alteraciones neurosensitivas posquirúrgicas, como la lesión irreversible del nervio y consecuencias funcionales significativas.
Las alteraciones neurosensitivas incluyen, pero no se limitan a, anestesia, parestesia, hipoestesia y sensaciones de hormigueo y quemazón. El grado de alteración neurosensitiva puede evaluarse clínicamente y mediante pruebas neurosensitivas objetivas. Las respuestas del paciente a un cuestionario constituyen la mejor forma para conocer si una técnica quirúrgica es bien tolerada y beneficia la vida diaria del paciente.
La lesión del nervio puede producirse a causa de un estiramiento excesivo del colgajo mucoperióstico en la zona premolar, en un intento por lograr una visibilidad óptima de la zona quirúrgica. Para tratar de exponer mejor el paquete neurovascular y reducir al mínimo su posible traumatismo, varios autores han sugerido diseños alternativos para la osteotomía10-12. Si puede crearse una ventana ósea más pequeña para exponer el paquete y reducir el estiramiento excesivo del nervio mentoniano, disminuiría el riesgo de lesiones en el NAI.
Se desarrolló específicamente un dispositivo ultrasónico de cirugía ósea (piezocirugía) para simplificar la intervención y permitir el corte de tejido duro sin necesidad de lesionar los tejidos blandos adyacentes13,14. Este artículo informa sobre una serie de 10 casos en los que se utilizó el nuevo abordaje quirúrgico para la movilización del NAI y se evaluó ampliamente en 9 pacientes.
Materiales y métodos
Entre 2002 y 2006 nueve pacientes (6 mujeres y 3 hombres) de edades comprendidas entre los 40 y los 65 años, fueron sometidos a un tratamiento con una prótesis parcial fija distal soportada por dos implantes Biomet 3i colocados junto con una técnica de transposición del NAI. Se registró la condición médica de cada paciente, incluyendo las enfermedades y medicaciones previas. En este estudio no se incluyeron pacientes fumadores.
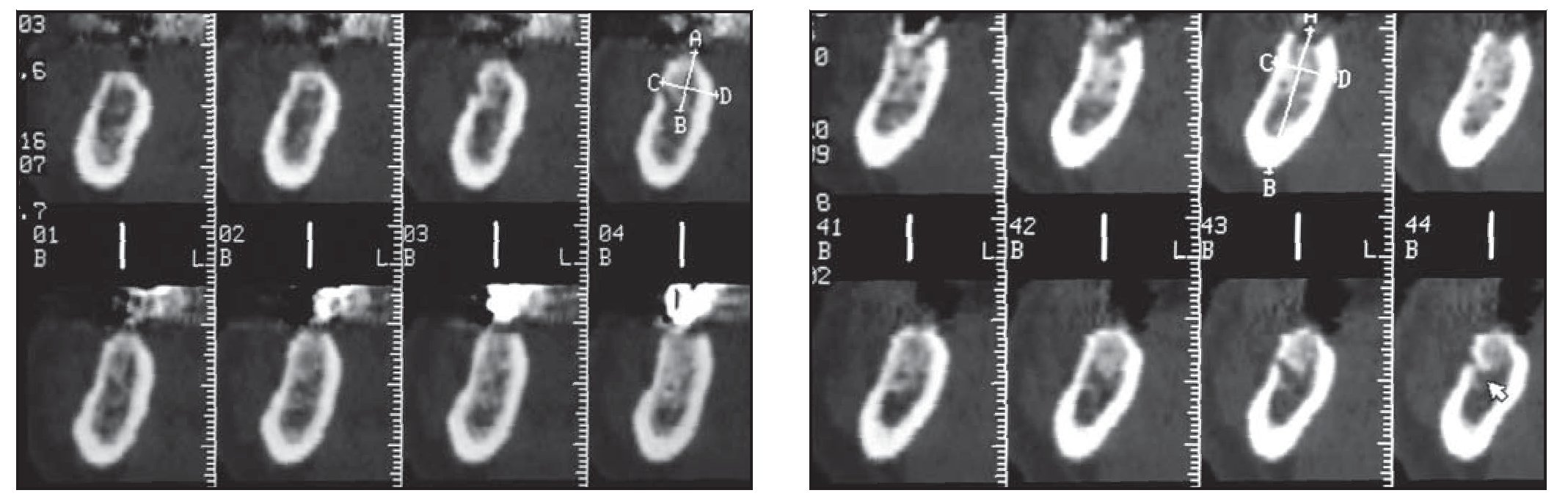
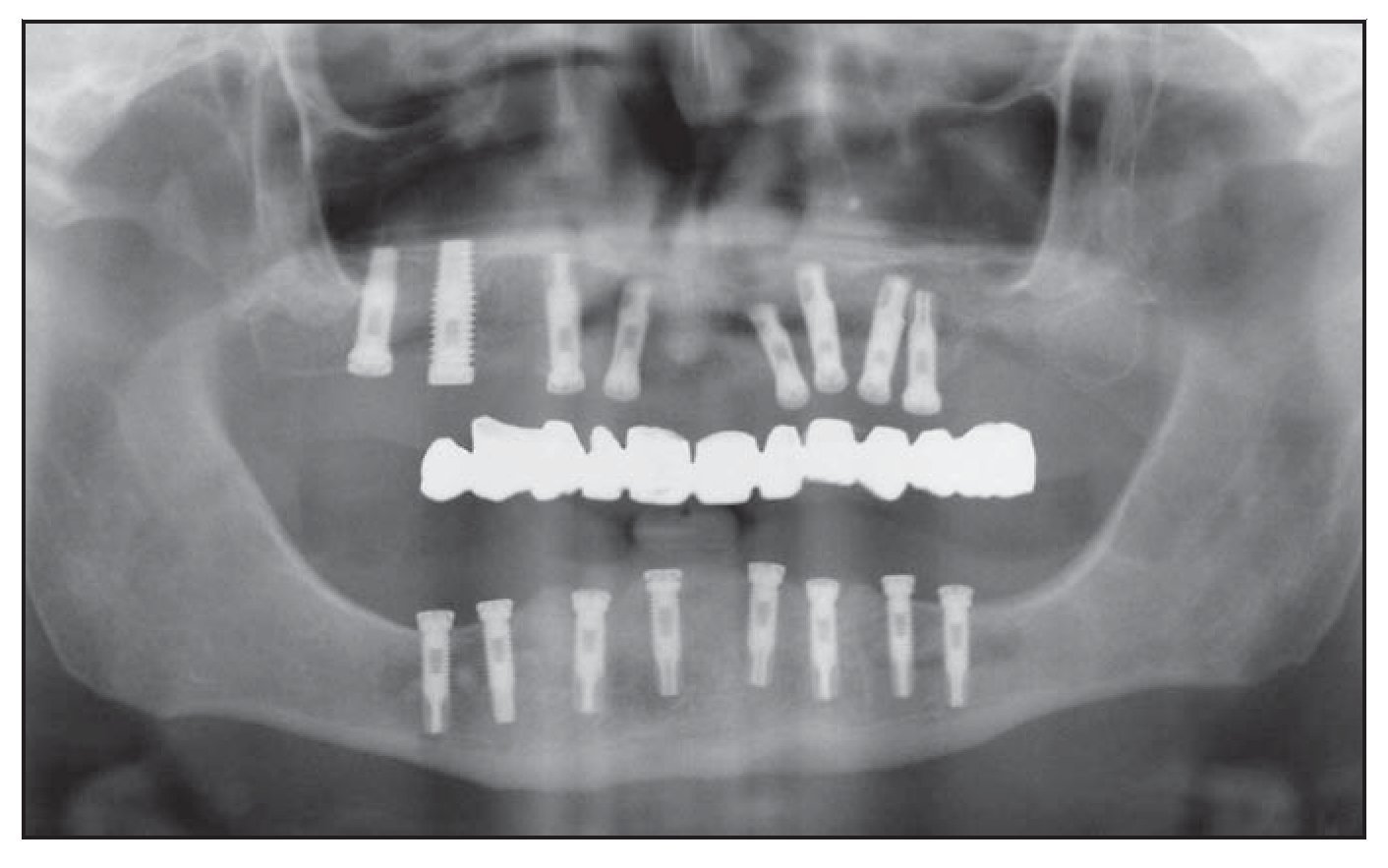
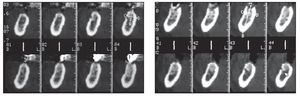
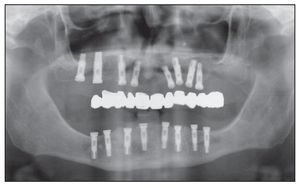
La tomografía computarizada de estos pacientes reveló la presencia de una cantidad de hueso insuficiente entre la cresta alveolar y el canal mandibular para permitir la colocación de un implante de longitud estándar (figuras 1 y 2). La distancia promedio entre la arista de la cresta y el canal mandibular fue de 6,4 mm.
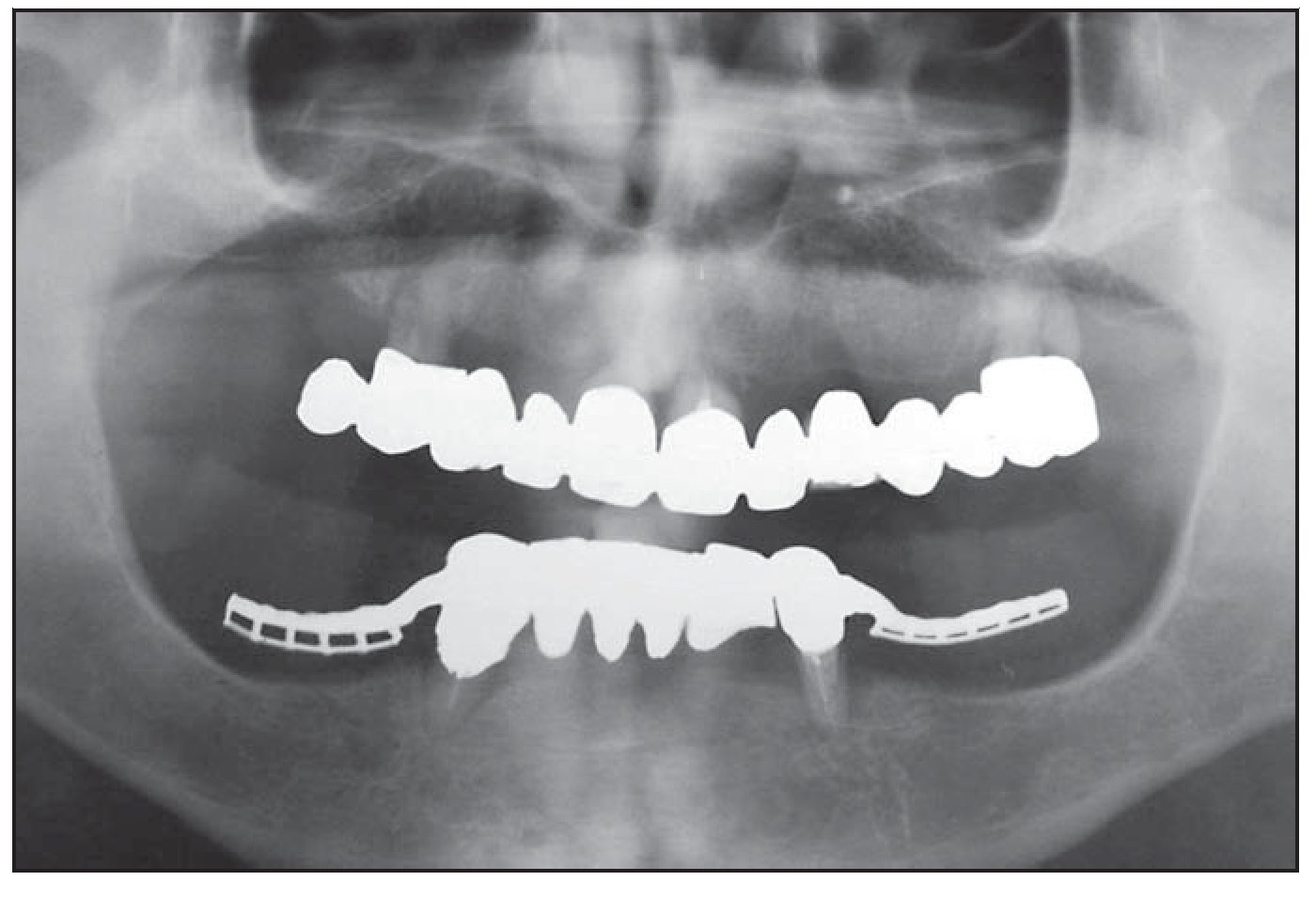
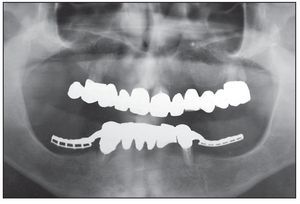
Figura 1 Radiografía panorámica preoperatoria.
Figuras 2a y 2b Tomografía computarizada pretratamiento (izquierda) del lado derecho y (derecha) del lado izquierdo del maxilar inferior.
Los pacientes tuvieron la opción de ser sometidos a una transposición del NAI mediante un dispositivo ultrasónico de cirugía ósea (Piezosurgery, Mectron o Piezon Master Surgery, EMS) y fueron informados de la posibilidad de experimentar ciertas alteraciones neurosensitivas tras la intervención.
Después de obtener el consentimiento informado se realizaron 10 intervenciones de movilización (8 unilaterales y 1 bilateral) bajo anestesia local mediante la infiltración de mepivacaína al 2 % sin vasoconstrictor. Se realizó una incisión crestal extendiéndose desde la zona retromolar hasta la zona premolar, donde se realizó un colgajo mucoperióstico a través de una incisión de descarga, exponiendo el foramen mentoniano.
Todos los dientes se trataron con la misma técnica de movilización9. En siete casos, las osteotomías se crearon utilizando el dispositivo Mectron Piezosurgery y cuatro puntas piezoquirúrgicos (OT1, OT2, OT5, OT6). En tres casos las osteotomías se crearon utilizando el instrumental piezoquirúrgico EMS y tres puntas (SC, SL1, SL2) (figuras 3 a 7).
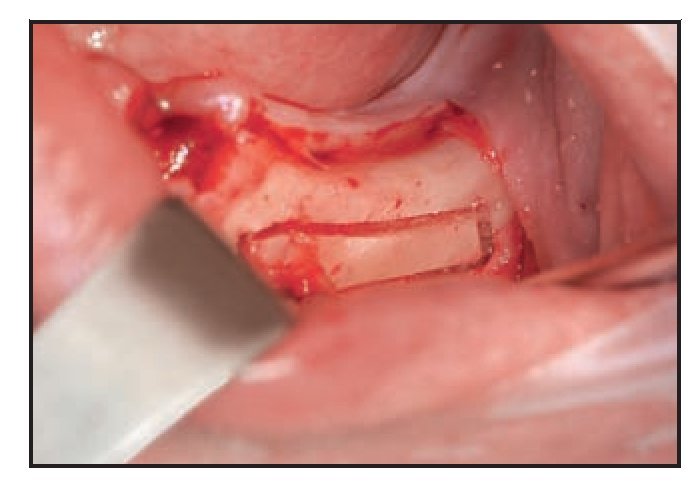
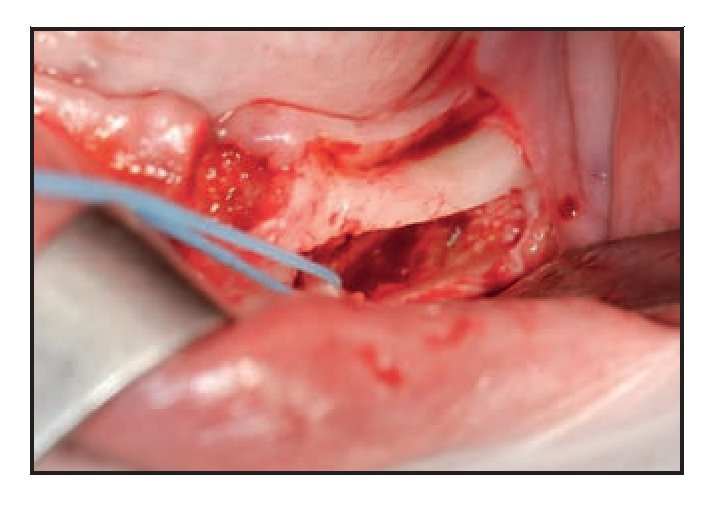
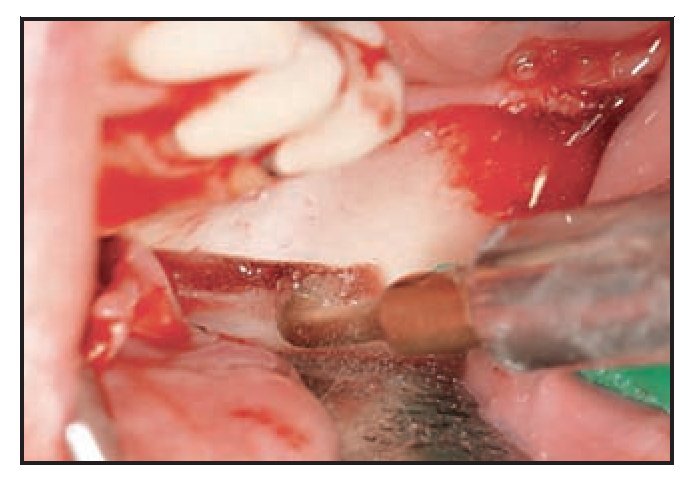
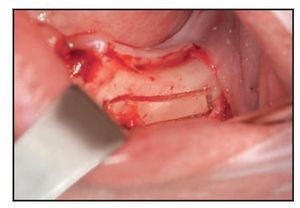
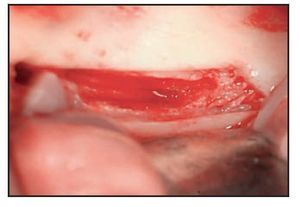
Figura 3 (izquierda) Osteotomía del hueso cortical con un dispositivo ultrasónico de cirugía ósea. Obsérvese la precisión del corte y el sangrado mínimo.
Figura 4 (derecha) El paquete vascular queda expuesto gracias al uso de un dispositivo plástico en neurocirugía. Obsérvese la presencia de hueso esponjoso en la zona posterior.
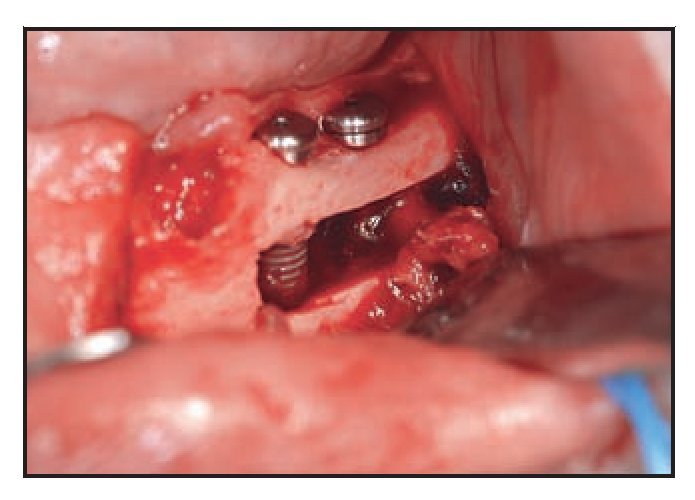
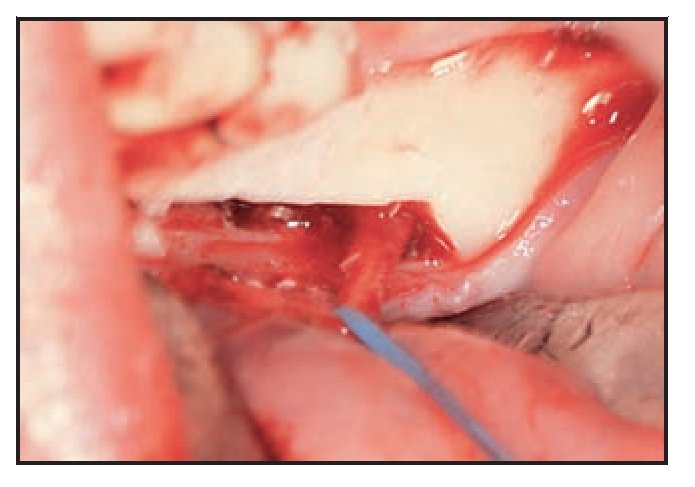
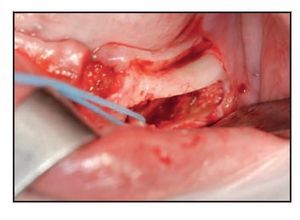
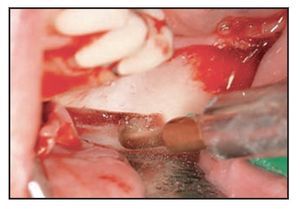
Figura 5 (izquierda) Tras el uso del dispositivo ultrasónico de cirugía ósea es posible mover el paquete neurovascular sin ninguna tensión.
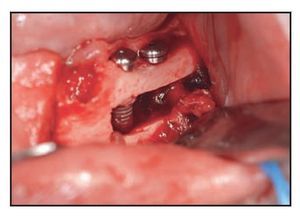
Figura 6 (derecha) Implantes Biomet 3i colocados en un intento por lograr la fijación biocortical. El paquete nervioso se lateraliza desde los implantes.
Figura 7 Radiografía panorámica postoperatoria.
Tanto los dispositivos Mectron como EMS consisten en una plataforma con un potente mango piezoeléctrico. La frecuencia funcional es de 25 a 29 Hz. Los puntas se mueven mediante oscilaciones lineales que oscilan entre 60 y 120 mm, proporcionando al mango una potencia que sobrepasa los 5 W9.
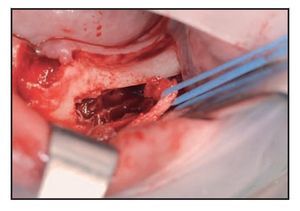
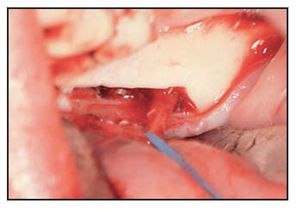
Para este estudio se introdujo un nuevo paso, aumentando la técnica original publicada9. Para reducir el grado de doblado necesario del paquete neurovascular se realizó una intervención osteoplástica distal al último implante utilizando una punta OT5 para la unidad Mectron o el SL2 para la unidad EMS (figuras 8 a 10).
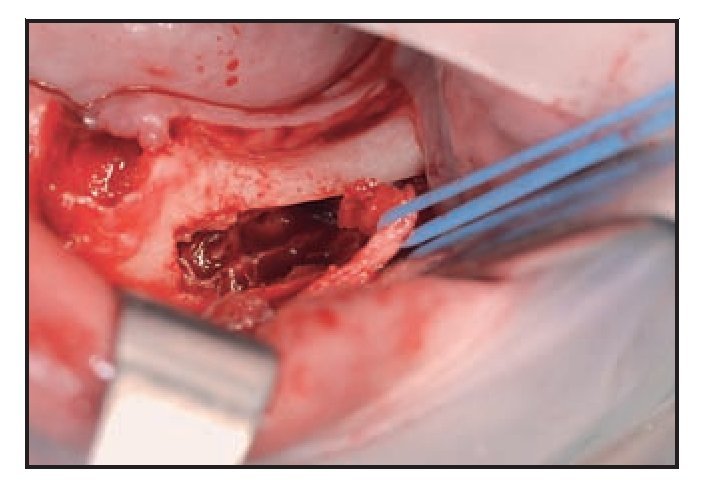
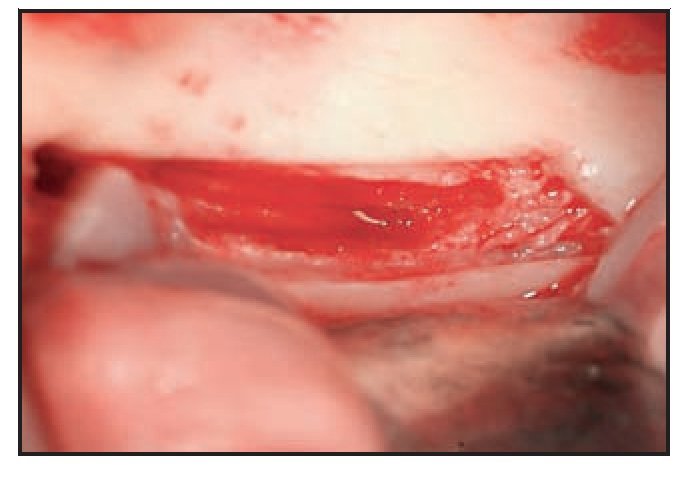
Figura 8 Tras retirar el hueso cortical externo sigue observándose hueso esponjoso en la zona posterior.
Figura 9 Inserto OT6 de piezocirugía (Mectron). Este inserto permite la retirada de hueso esponjoso sin lesionar el nervio.
Figura 10 Tras la cirugía, el nervio no está tensionado porque la osteotomía creó un espacio mayor.
Se colocaron un total de 20 implantes. Ninguno de los pacientes fue sometido a cirugía reconstructiva. Se realizó una radiografía tras la finalización inmediata de cada intervención.
Se recetó un tratamiento antibiótico durante 10 días junto con analgésicos durante 7 días. Se administró cortisona (4 mg por vía intramuscular) inmediatamente tras la cirugía y 12 h más tarde. Los puntos se retiraron al cabo de 10 días.
Después de un período de cicatrización de 4 meses se realizó una nueva radiografía antes de iniciar la intervención protésica.
Resultados clínicos
Cada paciente se evaluó semanalmente desde la fecha de la cirugía hasta la recuperación funcional completa del NAI, así como en los meses 1, 2, 3, 6, 12, 24 y 36 del postoperatorio. Todas las intervenciones y evaluaciones posquirúrgicas fueron realizadas por el mismo técnico.
Las pruebas de funcionalidad neurosensitiva se realizaron en una habitación en silencio. Se pidió a los pacientes que mantuvieran los ojos cerrados durante todo el procedimiento y se realizaron 3 pruebas separadas para evaluar la función del NAI15. Por un lado, se realizaron pruebas del roce y del dolor para discriminar de forma selectiva las grandes fibras alfa A mielinizadas y de adaptación rápida, que constituyeron el 90 % de los axones A, y por otro, se utilizó una prueba de discriminación de dos puntos para estudiar de forma selectiva las grandes fibras alfa A mielinizadas de adaptación lenta, que constituyen el 10 % restante de axones A16,17. Las pruebas se administraron del siguiente modo:
Prueba del roce
A intervalos de 10 s, se solicitó a los pacientes que identificasen si se rozaba con una pluma el labio inferior y posteriormente el tercio inferior de la barbilla en el mismo lado que la lateralización del nervio. Se estudió cada zona en bloques de 10 ensayos. Posteriormente se repitió en el lado contralateral del labio y la barbilla (control). Una respuesta global correcta del 80 % o más se consideró normal. Se registraron dos niveles de sensibilidad: 0 = sensibilidad normal, 1 = sensibilidad inferior a la normal.
Prueba del dolor
Esta prueba se realizó utilizando un instrumento puntiagudo. Se asumió un resultado positivo cuando el contacto con el instrumento provocó dolor. Como control, el instrumento se aplicó en primer lugar en el labio inferior y luego en el tercio inferior de la barbilla de la zona opuesta a la lateralización del nervio. Posteriormente, con la misma presión, se aplicó en el mismo lado de la lateralización del nervio.
Prueba de discriminación de dos puntos
Se abrió progresivamente un calibrador en incrementos de 2 mm y se aplicó al labio y a la barbilla del paciente hasta que pudo discernir los extremos del calibrador como dos puntos de contacto diferenciados. Se registraron las siguientes puntuaciones: 0 = sensibilidad normal (los pacientes pudieron discriminar entre los dos extremos a una distancia menor de 14 mm), 1 = sensibilidad disminuida (los pacientes pudieron diferenciar ambos extremos a una distancia entre 14 y 20 mm), 2 = ausencia de sensibilidad (los pacientes no pudieron diferenciar los dos extremos aún estando separados más de 20 mm).
En el paciente sometido a un tratamiento bilateral, el labio superior actuó como control.
En todos los pacientes se realizaron radiografías y se repitieron las pruebas de funcionalidad neurosensitiva a los 12, 24 y 36 meses de la intervención. Al evaluar la tasa de éxito de los implantes en todos los pacientes se utilizaron los criterios predefinidos establecidos por Albrektsson y cols.18. Tras la entrega de la restauración definitiva, cada paciente respondió un breve cuestionario, cuyas preguntas y respuestas se muestran en la tabla 1.
Resultados
Todos los pacientes presentaron cierto grado de disfunción neurosensitiva inmediatamente tras la cirugía, pero al final del período de tratamiento, todos ellos se habían curado sin complicaciones.
En 8 de las 10 zonas quirúrgicas se consideró que la función del NAI se había restaurado por completo durante la prueba realizada tras 2 semanas. En el caso del paciente sometido a una transposición bilateral, una zona estaba restaurada tras 2 semanas, pero la otra seguía presentando una ligera disminución de la sensibilidad a los 2 meses en la prueba de discriminación de dos puntos en el tercio inferior de la barbilla. La restauración de la funcionalidad completa de esa zona se produjo a los 3 meses.
En el último paciente, la restauración de la función neurosensitiva fue completa a las 8 semanas. La cantidad mínima de hueso esponjoso presente fue destacada en este caso. La preparación del nervio fue más difícil y el NAI estuvo sometido a más estrés que en otros pacientes. Sin la disponibilidad de la técnica de piezocirugía no hubiese sido posible realizar la lateralización del nervio en este paciente, según indicó el cirujano.
Tras 4 meses de cicatrización, todos los implantes estuvieron osteointegrados y no se evidenció ninguna pérdida ósea. La restauración se realizó en todos los pacientes mediante una prótesis parcial fija. Todos los dientes del maxilar inferior siguieron siendo vitales durante todo el período del estudio.
Discusión
Esta serie de casos constituye la primera evaluación de las consecuencias neurosensitivas del uso de piezocirugía para movilizar el NAI durante la preparación para la colocación de implantes dentales. A pesar de que la movilización del NAI se ha descrito en la literatura, no se ha utilizado de forma amplia debido a la preocupación por las posibles lesiones del NAI. Dichas lesiones se han descrito en la literatura como causa primaria de problemas legales para los odontólogos generales8.
Los resultados de esta serie de casos sugieren que la transposición quirúrgica del NAI mediante cirugía ósea con ultrasonidos es una opción segura, ya que todos los pacientes tratados con esta técnica recuperaron la totalidad de la función neurosensitiva tras un período mínimo de parestesia. Si bien toda la evaluación fue realizada por un único examinador, las respuestas de los pacientes a un cuestionario confirmaron los resultados de las pruebas neurológicas objetivas.
El NAI puede lesionarse durante 3 fases de la cirugía de transposición: 1) cuando se realiza la osteotomía para exponer el nervio, 2) durante la elevación del colgajo, o 3) durante la colocación del implante. Para que un nervio periférico funcione adecuadamente debe estar conectado al sistema nervioso central (es decir, debe existir una continuidad axonal) y tener una oxigenación suficiente. Durante la cirugía, el NAI puede lesionarse bien de forma directa (interrupción axonal) o indirecta debido al estiramiento. Este estiramiento produce una reacción inflamatoria que altera el compartimiento axonal interno por compresión (debido a la formación de un hematoma intraneuronal) y de forma electrovertical. Se ha descrito que la lesión provocada por el estiramiento del nervio periférico es reversible si el alargamiento no sobrepasa el 5-7 % de la longitud total del nervio19.
Algunos autores han postulado que la recolocación del nervio directamente contra los implantes dentales puede provocar que las espiras de los implantes causen una irritación crónica que podría inducir un edema y la formación de tejido cicatricial fibrótico durante largo tiempo. Este contacto directo entre el NAI y las roscas afiladas del implante tendría potencial para inducir los síntomas9,20-23.
Durante la elevación del colgajo, el nervio mentoniano está sometido a tensión. Al reducir el tamaño del colgajo, se reduce la distancia que debe estirarse el nervio. Los mejores resultados, en términos de alteraciones sensitivas, asociados con la movilización del NAI en la que no interviene el foramen mentoniano pueden deberse a la reducción de la necesidad de estirar el colgajo. De forma similar, para lograr la elasticidad suficiente del paquete del NAI es necesario realizar una osteotomía que tenga como mínimo 20 mm de longitud, evitando el estiramiento del paquete más de un 5 % y, por tanto, su lesión. Esta osteotomía no puede crearse fácilmente en las zonas más distales del maxilar inferior.
La técnica pìezoquirúrgica ayuda a remediar este problema. Permite reducir la dimensión vertical de la osteotomía (de 10 a 12 mm a 5 a 6 mm). Además, la inclinación apicocoronal del instrumental permite reducir la elevación del colgajo. Esta estrategia quirúrgica más conservadora también permite evitar las fracturas mandibulares tras la colocación del implante. Si la técnica se realiza sin la intervención del foramen, es posible que sea menos traumática durante la fase de osteotomía. Pero, no obstante, la lateralización del nervio comporta el riesgo de lesión.
Si la realización de la técnica supone la implicación del foramen mentoniano tiene la ventaja de una mayor flexibilidad del paquete nervioso. Asimismo, es posible crear un nuevo foramen posterior al último implante colocado, lo que evita volver a encontrar el nervio en caso de complicaciones con el implante.
Para la transposición del paquete neurovascular es necesario cortar la rama incisiva del NAI. Si el paciente presenta dentición residual en la zona anterior es posible que se produzcan alteraciones sensitivas y sea necesario un tratamiento endodóncico de los dientes restantes. La recolocación del paquete dentro de la médula ósea del maxilar inferior debe realizarse con especial atención, evitando provocar lesiones mecánicas con los instrumentos manuales.
Conclusiones
La reconstrucción de las piezas implantadas en caso de atrofia mandibular puede presentar varios problemas para el cirujano oral. Al contrario que en el injerto o la regeneración vertical, la lateralización del NAI es una solución que ofrece varias ventajas, como evitar la necesidad de una zona donante, un mejor manejo del tejido blando y un período de tratamiento más corto. Si bien esta estrategia comporta un riesgo elevado de lesión nerviosa temporal o permanente, el uso de la piezocirugía permite crear un colgajo y una osteotomía de menor tamaño, y reduce el tiempo de intervención. También permite tener un mejor control quirúrgico de la preparación del paquete neurovascular, y todas las intervenciones quirúrgicas pueden realizarse de forma más rápida.
Los resultados de este estudio sugieren que la lesión del nervio como consecuencia de su movilización durante la piezocirugía dura normalmente de 2 a 3 semanas. Estudios adicionales deben centrarse en la respuesta del NAI al uso de la técnica piezoeléctrica para la movilización de NAI.
Agradecimientos
Los autores agradecen la ayuda y contribución de Biomet 3i y Biomax SRL. También desean agradecer a Jeannette De Wyze su ayuda en la edición del manuscrito.
Correspondencia: Dr Renato Celletti,
Via Cola di Rienzo 217, 00192 Rome, Italy;
e-mail: celletti@unich.it.