La apnea obstructiva del sueño (AOS ) es un trastorno frecuente relacionado con el estrechamiento de las vías respiratorias altas. Se han propuesto muchas terapias a lo largo de los años para tratar los ronquidos y la AOS1. En la actualidad parece que tres estrategias son las más eficaces: 1) presión positiva continua nasal (PPCN), 2) técnicas quirúrgicas, y 3) uso de dispositivos intraorales (DO)2. Desde su introducción en la década de 1980, la PPCN se considera el método terapéutico principal para los casos leves y moderados de AOS3. Sin embargo, con frecuencia se han descrito efectos secundarios asociados al uso de la PPCN4. Estos problemas pueden derivar en la no colaboración del paciente, especialmente en jóvenes y en casos menos graves5.
Los DO están indicados en pacientes con ronquidos primarios o en pacientes con AOS leve que no responden o no son candidatos adecuados para el tratamiento con medidas conductuales, como pérdida de peso o cambios en la postura durante el sueño. Por otro lado, los DO se han aconsejado en pacientes con AOS de moderada a grave que no pueden tolerar o rechazan el tratamiento con PPCN, o en individuos que no son candidatos adecuados para la cirugía6,7. Los DO son un método terapéutico eficaz para los pacientes con AOS. Durante los últimos años se han desarrollado varios de estos dispositivos. Los DO se llevan en la boca durante el sueño para evitar que los tejidos orofaríngeos y la base de la lengua se colapsen y obstruyan las vías respiratorias. Existen tres formas básicas para crear y mantener una vía respiratoria alta permeable durante el sueño. En primer lugar, el dispositivo puede, de hecho, resituar determinadas zonas anatómicas que están causando la obstrucción. En función del dispositivo específico, la lengua, el maxilar inferior, el paladar blando, y el hueso hioides pueden resituarse para crear la permeabilidad de las vías respiratorias. En segundo lugar, el dispositivo permite estabilizar el maxilar inferior, la lengua y el hueso hioides para evitar que se colapsen durante el sueño. En tercer lugar, el dispositivo puede aumentar la actividad basal del músculo geniogloso gracias a la rotación hacia abajo y hacia delante del maxilar inferior, de manera que es menos probable que la lengua se relaje y caiga hacia atrás, provocando una obstrucción. Por tanto, los DO se clasifican según el mecanismo de acción en una de estas tres categorías mencionadas. Incrementan el espacio orofaríngeo al avanzar el maxilar inferior o la lengua. Estos dispositivos, pues, ayudan a reducir la obstrucción8-10.
Los reposicionadores mandibulares (RM) actúan resituando y manteniendo el maxilar inferior protrusionado durante el sueño. Se cree que esto sirve para abrir las vías respiratorias de formas diferentes: tirando indirectamente de la lengua hacia adelante gracias a su unión con los tubérculos geniales, incrementando la actividad basal del músculo geniogloso, o estabilizando el maxilar inferior y el hueso hioides para prevenir la apertura del maxilar inferior y la retrotracción de la lengua. Gran parte de las investigaciones disponibles que muestran la eficacia de los dispositivos orales se centran en los RM9-11.
El objetivo de utilizar una férula de avance mandibular (FAM), que es un dispositivo monobloque no ajustable (una pieza), y un RM es avanzar el maxilar inferior y la base de la lengua, y así incrementar el espacio entre la base de la lengua y la pared faríngea posterior en un paciente con AOS. La FAM actúa suspendiendo y manteniendo el maxilar inferior en una posición protrusionada y mantiene una apertura vertical entre 5 y 7 mm durante el sueño2,8,11-13.
Este estudio trató de investigar los efectos de una FAM en la actividad electromiográfica (EMG) de superficie de los músculos submentonianos y masetero durante la AOS, para comparar su eficiencia en pacientes con AOS leve y moderada que fueron sometidos a una polisomnografía (PSG) durante toda una noche, y para evaluar la colaboración del paciente en el intervalo de tiempo dado. Las hipótesis nulas comprobadas fueron que los valores promedio de la EMG de la actividad muscular sin una FAM serían menores que los obtenidos con una FAM en todos los grupos, y que el valor de la EMG del grupo con AOS leve sería mayor que la del grupo con AOS moderada.
Materiales y métodos
Diagnóstico
Se realizó un estudio del sueño con una PSG durante toda la noche para diagnosticar la gravedad de la AOS en el laboratorio del sueño del Department of Chest Diseases, Ege University, Izmir, Turquía, y reveló un índice de apnea-hipopnea (IAH) obstructiva entre 5 y 30 episodios por hora de sueño en los pacientes, sin incluir los pacientes con AOS central o mixta. Un total de 20 pacientes cuyos resultados del diagnóstico mediante PSG fueron seleccionados aleatoriamente14 y que fueron controlados según los criterios indicativos de la Academy of Dental Sleep Medicine (ADSM) y la American Academy of Sleep Medicine (AASM)14 fueron referidos al Department of Prosthodontics, Ege University, para el tratamiento con DO.
Según la ADSM y la AASM, los dispositivos orales se usan principalmente para tratar los simples ronquidos, la AOS leve y la AOS de moderada a grave cuando el tratamiento con PPCN no se tolera o el paciente lo considera como opción terapéutica secundaria14. Por tanto, 10 de los 20 pacientes seleccionados para este estudio presentaron AOS leve y los otros 10 pacientes presentaron una AOS moderada pero rechazaron o no toleraron el dispositivo de PPCN. Según la AASM9,13, un IAH de 5 a 15 indica una AOS leve y un IAH de 15 a 30 indica una AOS moderada. Los individuos (5 mujeres, 15 hombres) tenían edades comprendidas entre los 45 y 72 años (promedio: 54,0 ± 8,4).
Los criterios de inclusión fueron los siguientes: pacientes que solamente roncaban en posición de decúbito, no tomaban ningún sedante o alcohol, no eran fumadores, y no recibían tratamiento para la hipertensión o la diabetes mellitus tipo 2.
Los criterios de exclusión fueron: personas con enfermedades crónicas (diferentes de la AOS), un IAH por encima de 40 con síntomas fisiopatológicos, edentulismo, y personas con intentos anteriores de cirugía para corregir los ronquidos o la apnea. Otras personas excluidas fueron aquellas con trastornos del sueño significativos diferentes de la AOS, las que utilizaban medicación sedante o hipnótica de forma regular, y las que tenían turnos rotatorios o nocturnos.
El examen de las historias clínicas mostró que los pacientes presentaron ronquidos severos y somnolencia diurna. Refirieron sensación de no haber descansado al despertar, olvido crónico y fallos de concentración. Los pacientes refirieron apneas, sensación de bloqueo y transpiración durante el sueño e insomnio. También presentaron cefaleas matinales y sequedad de boca.
Los exámenes e inspecciones dentales, musculares y de la articulación temporomandibular no arrojaron resultados anormales. Todos los pacientes tenían más de 10 dientes en cada arcada y no presentaban síntomas relacionados con el trastorno temporomandibular, según el índice de disfunción-dolor clínico y anamnésico de Helkimo (índice de Helkimo: 0°)2,12,13. Los pacientes con problemas agudos completaron un tratamiento dental básico antes de participar en el estudio.
Otros parámetros examinados fueron el tamaño del cuello, la obesidad (determinada según el índice de masa corporal [IMC]), los tejidos orofaríngeos, el tamaño de la lengua (es decir, agrandamiento lingual), la longitud del paladar blando, el tamaño de la úvula y las amígdalas, y el hacinamiento de la zona orofaríngea. El IMC promedio fue de 32,3 ± 5,1 kg/m2 y el tamaño promedio del cuello fue de 42 ± 3,5 cm.
Tras explicar el objetivo y los procedimientos del estudio, los pacientes firmaron el consentimiento informado y el alta. El experimento se realizó según los principios de la Declaración de Helsinki para Experimentación en Humanos.
Fabricación de la FAM
Los dispositivos de FAM se diseñaron para incrementar el tamaño de las vías respiratorias altas mediante el avance del maxilar inferior (figura 1) y se fabricaron de forma individualizada para cada paciente como se ha descrito anteriormente2,8,11,13-15.
Figura 1 FAM fabricada como dispositivo intraoral.
Se aplicaron los procedimientos clínicos habituales para registrar las impresiones dentales y la posición terapéutica del maxilar inferior como se describe en la literatura2,8,11,13-15, y se enviaron a un laboratorio externo para la fabricación del dispositivo.
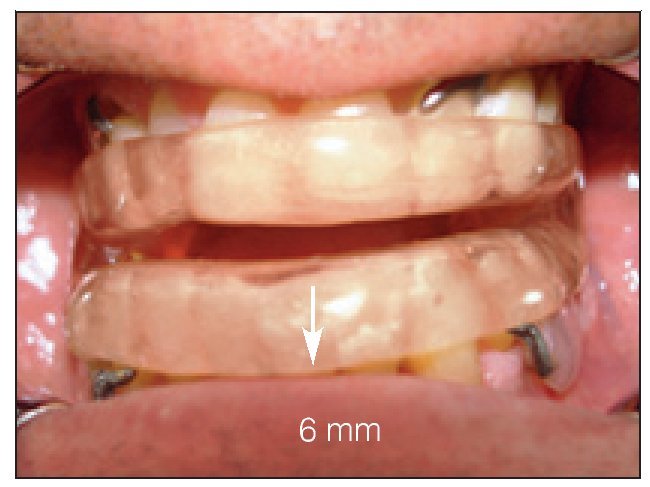
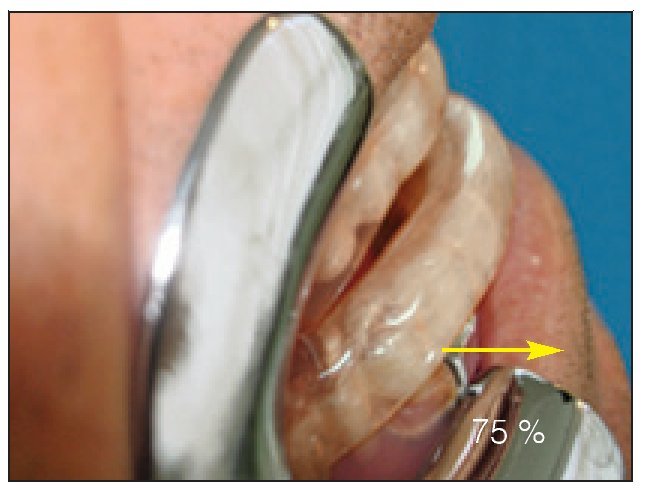
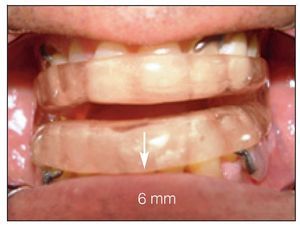
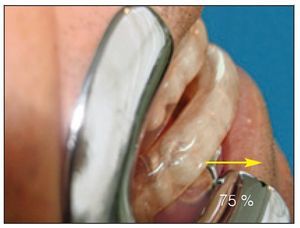
El dispositivo FAM se fabricó con un 75 a un 80 % de protrusión y una dimensión vertical y de las vías respiratorias anteriores de 5 a 7 mm (figuras 2a y 2b).
Figura 2a Vista frontal, FAM in situ. Obsérvese: distancia interincisal de 6-mm como abertura vertical.
Figura 2b Vista lateral, FAM in situ. Obsérvese: 75 % de la posición máxima de protrusión.
Durante la colocación de la FAM se proporcionaron instrucciones sobre su uso y cuidados. Se aconsejó a los pacientes que llevasen el dispositivo durante un mínimo de 6 h durante la noche y se les citó para realizar cualquier ajuste necesario un día después.
Protocolo
El experimento se realizó una semana después de que los pacientes comenzasen a llevar la FAM. Para evaluar la apnea del sueño y las EMG de los músculos submentonianos y masetero14, los pacientes fueron sometidos a dos PSG más para obtener una determinación objetiva de la respiración y la actividad muscular durante la obstrucción.
Los registros PSG del estudio se realizaron durante toda una noche. En otras palabras, se realizaron simultáneamente registros PSG durante la mitad de la noche. En el primer PSG, 20 pacientes con AOS pasaron la mitad de la noche sin el dispositivo para establecer las amplitudes iniciales de la actividad EMG de los músculos. En el segundo PSG, los registros EMG se obtuvieron durante la segunda parte de la noche en los mismos 20 pacientes tras la colocación de la FAM.
Rendimiento EMG
Los registros EMG de las puntuaciones rutinarias de los PSG se adquirieron utilizando un equipo de EMG de dos canales tanto en el primer como en el segundo PSG. Se registró de forma simultánea la actividad EMG de superficie en reposo del músculo masetero derecho y los músculos submentonianos según el diagrama en la literatura14,15. Los registros de las amplitudes EMG de cada músculo (submentonianos y masetero) durante la apnea obstructiva se obtuvieron sin (primer PSG) y con (segundo PSG) la aplicación del dispositivo.
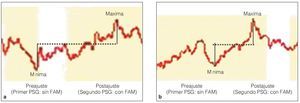
En todos los registros se utilizaron pares de electrodos de superficie desechables, autoadhesivos y pregelificados con un área de registro de 15 x 20 mm (Medtronic Dantec). En los músculos submentonianos, el electrodo activo se situó en la línea media sagital, a media distancia entre la protuberancia mentoniana y el labio inferior, y el electrodo de referencia se situó a media distancia entre el aspecto interno del maxilar inferior y el hueso hioides. Se colocaron dos electrodos sobre el músculo masetero en dirección de las fibras musculares separados 15 mm14 para registrar el potencial en los músculos estudiados, cada uno con respecto al electrodo de referencia. El valor de sesgo superior e inferior para las frecuencias del filtro de amplificación se estableció en 20 Hz y 3 kHz, respectivamente. La ganancia del amplificador se mantuvo entre 0,2 μV (± 4 μV) y 10 μV (± 4 μV) por división. El trazo del osciloscopio se estableció a una velocidad de barrido de 16 segundos por división, lo que permitió un tiempo de análisis aproximadamente de 160 s durante los períodos obstructivos. Todos los registros se digitalizaron, rectificaron, almacenaron y transformaron en una EMG integrada utilizando un software del dispositivo de EMG. Las amplitudes mayores se utilizaron para expresar la actividad EMG del músculo en μV (figuras 3a y 3b).
Figura 3 Ejemplo de actividad EMG de (a) músculo masetero y (b) músculos submentonianos.
Análisis estadístico
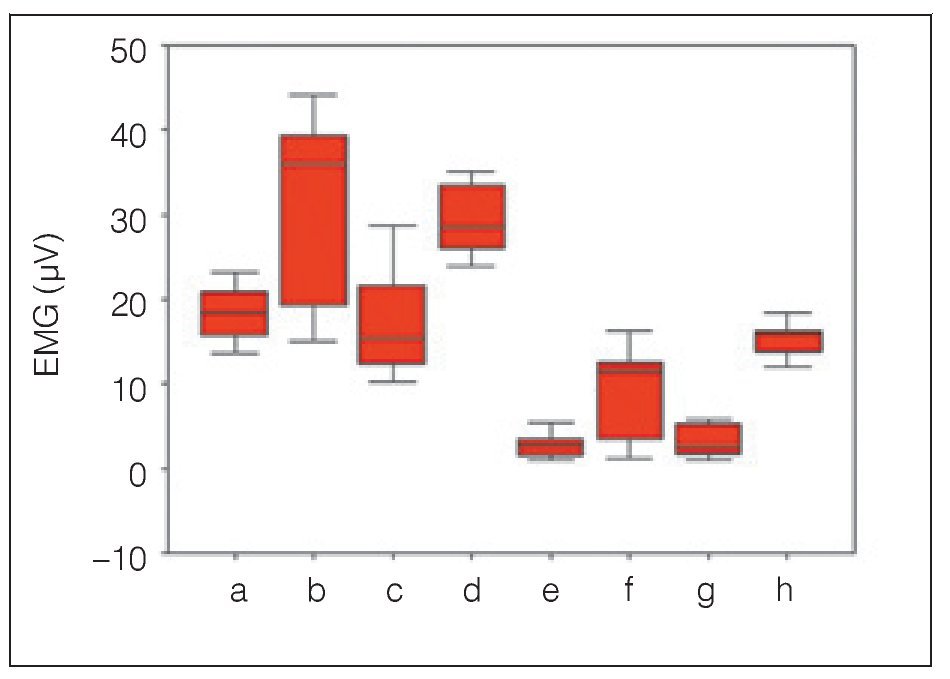
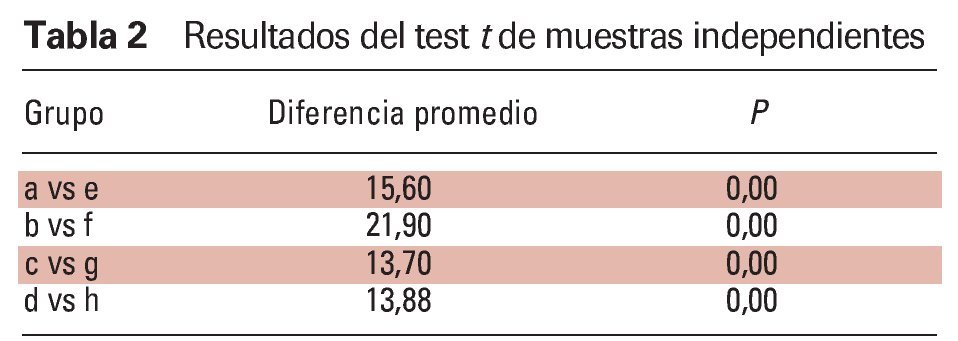
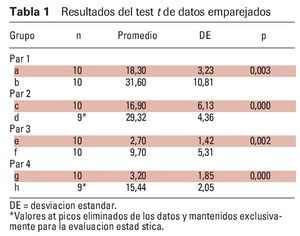
Se realizó el análisis estadístico de los datos (tensión EMG de la actividad muscular durante la obstrucción e IAH). Los datos se establecieron en los siguientes grupos: a = AOS leve sin FAM en el músculo masetero, b = AOS leve con FAM en el músculo masetero, c = AOS leve sin FAM en los músculos submentonianos, d = AOS leve sin FAM en los músculos submentonianos, e = AOS moderada sin FAM en el músculo masetero, f = AOS moderada con FAM en el músculo masetero, g = AOS moderada sin FAM en los músculos submentonianos, y h = AOS moderada con FAM en los músculos submentonianos.
En primer lugar se realizaron las estadísticas descriptivas de cada grupo y se prepararon los gráficos. Se utilizó el test Kolmogorov-Smirnov para examinar si la distribución de los grupos seguía la normal. Posteriormente se utilizaron los tests t de datos emparejados para investigar si existieron diferencias entre los pares de grupos (a y b, c y d, e y f, y g y h). Luego se utilizaron tests de muestras independientes para investigar si existieron diferencias entre cada grupo independiente (a y e, b y f, c y g, y d y h). Se utilizó el paquete SPSS 11.0 (SPSS) para todos los análisis (α = 0,05).
Resultados
El test Kolmogorov-Smirnov reveló que los datos se distribuyeron de forma normal.
Cada individuo fue sometido a dos estudios de sueño durante una noche; uno antes y otro después de colocar el dispositivo in situ.
Se analizó el IAH obstructivo durante el primer y el segundo PSG tras la colocación del dispositivo y se calculó con y sin el dispositivo in situ. El IAH promedio en los pacientes con AOS leve fue de 10,9 ± 4,5 y mostró una reducción significativa (2,8 ± 0,5) tras la colocación del dispositivo (p < 0,05). Cuando se compararon las determinaciones entre el primer y el segundo PSG se observó una reducción significativa del IAH del grupo leve (p = 0,01). El IAH promedio en los pacientes con AOS moderada fue de 18,6 ± 5,8 y se redujo de forma significativa (6,6 ± 1,8) tras la colocación del dispositivo (p < 0,05). Cuando se comparó la reducción del IAH en el segundo PSG con el IAH del primero, también se observó que los valores del segundo PSG fueron estadísticamente significativos en el grupo moderado (p = 0,009).
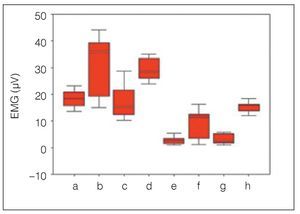
Los músculos presentaron una amplitud EMG significativamente menor sin la FAM (p < 0,05), y significativamente mayor con el dispositivo tanto en los pacientes con AOS leve como en los pacientes con AOS moderada (p < 0,05). En otras palabras, la amplitud EMG de los músculos submentonianos en los pacientes con AOS moderada (3,20 ± 1,85 μV) aumentó de forma significativa con el dispositivo (15,44 ± 2,05 μV) durante la apnea obstructiva (p < 0,05), y la amplitud EMG de los músculos submentonianos en los pacientes con AOS leve (16,90 ± 6,13 μV) también aumentó de forma significativa gracias al dispositivo (29,32 ± 4,36 μV) durante la apnea obstructiva (p < 0,05) (tabla 1, figura 4). De forma similar, la amplitud EMG del músculo masetero en los pacientes con AOS moderada fue significativamente más elevada con el dispositivo (9,70 ± 5,31 μV) que sin él (2,70 ± 1,42 μV) (p < 0,05), y el músculo masetero en los pacientes con AOS leve también mostró una amplitud EMG significativamente más elevada con el dispositivo (31,60 ± 10,81 μV) que sin él (18,30 ± 3,23 μV) (p < 0,05) (tabla 1, figura 4).
Figura 4 Diagrama de cajas de la actividad EMG de los músculos masetero y submentonianos en pacientes con AOS leve y moderada antes y después del uso de una FAM.
La tabla 1 muestra el test de datos emparejados, que reveló que el promedio de las muestras emparejadas fue el mismo y las actividades de ambos músculos aumentaron desde el primer PSG hasta el segundo (tras la colocación del dispositivo).
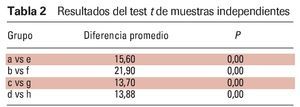
Los datos muestran una actividad significativamente menor en los músculos submentonianos y masetero en los pacientes con AOS moderada que en los pacientes con AOS leve. Por tanto, se utilizó el test de muestras independientes cuando se estudiaron estos dos grupos independientes. Resumiendo, los resultados del test de muestras independientes revelaron que los valores EMG de los grupos con AOS leve fueron mayores que los del grupo con AOS moderada (p < 0,05) (tabla 2).
El patrón de sueño favorable descrito por los pacientes fue el que proporcionó una sensación de descanso al despertar. Se redujeron las molestias como el número de despertares nocturnos, sofocos y ahogo, cefaleas matinales, gusto amargo en la boca, y boca seca. Los pacientes describieron que su sueño había mejorado durante la noche. El dispositivo no molestó a los pacientes y la colaboración fue muy alta.
Discusión
Este estudio mostró que las amplitudes EMG de los músculos masetero y submentonianos aumentaron de forma significativa con la aplicación de una FAM durante la apnea leve y moderada. Los resultados indican que el dispositivo activó los músculos en ambos grupos de pacientes durante la obstrucción. Las amplitudes EMG de los músculos submentonianos aumentaron de forma significativa con la aplicación de la FAM. El músculo masetero mostró una amplitud EMG significativamente más elevada con el dispositivo (figura 4). Los resultados sugieren que durante los episodios de apnea obstructiva leve y moderada, el tono de los músculos que protraen la lengua y el maxilar inferior se mantuvo con una FAM, como se describe en la literatura13,14,16-18. Por tanto, no se produjo la relajación de la contracción muscular, lo que provocó un aumento significativo en la amplitud EMG promedio durante la AOS leve y moderada. Por este motivo, se ha creído que la activación de los músculos que protraen la lengua y el maxilar inferior durante el uso de una FAM puede prevenir el colapso de las vías respiratorias altas13,14,16-18. Si bien la aplicación de una FAM aumenta las actividades EMG de los grupos con AOS leve y moderada, los valores EMG fueron mayores en los grupos con AOS leve que en los grupos con AOS moderada (tabla 2).
Según Meyer y Knudson17, el sueño induce la relajación de la musculatura de las vías respiratorias altas. Por consiguiente, la abertura de las vías respiratorias se contrae y la respiración resulta más laboriosa. La explicación más prevalente de la AOS es que la obstrucción se produce cuando la lengua se retrotrae contra la pared faríngea posterior. Si las vías respiratorias permanecen permeables o se colapsan depende de la cantidad de presión negativa en la vía respiratoria y del contrapeso del tono muscular de los músculos dilatadores de la orofaringe, en particular del geniogloso en la localización suprahioidea y submentoniana2,6,14,15. Se describió que el índice de apnea o los episodios apneicos por hora disminuyeron de forma significativa y aumentó la actividad EMG del músculo geniogloso entre las zonas submentoniana y suprahioidea tras la colocación de dicho dispositivo protésico2,6,13-16,19-26.
Varios autores13,14,16,25-27 afirmaron que los valores EMG pretratamiento de los músculos geniogloso y masetero fueron menores que después del tratamiento. Sin embargo, al parecer la FAM fue eficaz para lograr el nivel de contracción perdido. Se produjo un aumento de los niveles EMG de los músculos con una FAM, y los resultados del estudio aquí descrito apoyan los resultados de informes anteriores. Sin embargo, se evaluó la estabilidad del tono de ambos músculos durante las apneas gracias a la presencia de mediciones continuadas durante toda una noche de sueño. No se evaluó ni midió la actividad fásica de los músculos, ya que no se pudo registrar ningún movimiento durante la noche.
Remmers y cols.28 notificaron que la EMG del músculo geniogloso de los pacientes con AOS reveló una periodicidad constante y un bajo nivel de actividad durante la obstrucción. Hollowell y Suratt29 hallaron que el músculo masetero se activó en pacientes con AOS de forma similar a la de los músculos submentonianos. De forma análoga, en el estudio aquí descrito, los músculos masetero y submentonianos mostraron amplitudes EMG relativamente bajas sin el dispositivo durante la apnea obstructiva leve y moderada y amplitudes EMG elevadas con el dispositivo.
La FAM actúa aumentando el tamaño de la vía respiratoria faríngea o, de otro modo, reduciendo su tendencia al colapso2,6,16,24. Si bien sus efectos terapéuticos siguen sin estar claros14,15,25-29, puede llevarse una FAM para corregir el mal funcionamiento de los músculos geniogloso y masetero y para proteger e incluso favorecer el nivel de contracción del paciente durante la vigilia. Fundamentalmente, los electrodos de superficie pueden captar la actividad de los músculos faciales que influyen en la lectura del músculo masetero. Como han reconocido también los autores, la EMG de superficie no puede aislar la actividad del músculo suprahioideo, de forma que solamente puede suponerse que existe un incremento en la actividad del músculo geniogloso. En los pacientes con AOS, la literatura indica que se produce una disminución de la activación de los músculos geniogloso y masetero durante el período de relajación25. El mecanismo del tratamiento depende de la idea de mantener o aumentar el nivel de actividad de los músculos geniogloso y masetero26. Debe destacarse que, al igual que en el caso del músculo masetero, debe recuperarse la disminución de la actividad del músculo geniogloso27. Para evitar la contracción o la obstrucción, es necesaria la actividad simultánea de ambos músculos. Yoshida14 también halló que la FAM activó los músculos masticatorios y linguales y previno el colapso de las vías respiratorias altas.
Asimismo, en este estudio se postuló la coactivación de los músculos agonistas (músculos submentonianos) y antagonistas (músculo masetero) para estabilizar la posición del maxilar inferior y la lengua para evitar el colapso de las vías respiratorias altas.
Varios estudios han utilizado dispositivos intraorales para tratar el síndrome de apnea del sueño7,14,15,20,30-44. Los dispositivos intraorales sitúan el maxilar inferior en una posición abierta de forma más vertical y en protrusión7. La posición mandibular del dispositivo en este estudio, así como la técnica de fabricación y el diseño se basaron en los datos descritos por Yoshida14.
Por último, se asume que los bajos niveles de actividad registrados en ambas zonas musculares son la causa del colapso de las vías respiratorias, y por tanto de los ronquidos y la apnea del sueño. En los casos en que los pacientes presentaron una menor AOS y más actividad en dichos músculos tras llevar la FAM, puede asumirse que el aumento de la actividad muscular es la responsable de la mejora del patrón del sueño.
Sin embargo, existen limitaciones al método de este estudio. La región submentoniana incluye técnicamente a los músculos suprahioideos, como el geniogloso, geniohioideo, milohioideo, y el vientre anterior del músculo digástrico y el platisma. Por tanto, al contrario que en otros estudios14,30,31, los autores han preferido utilizar el término «músculos submentonianos» en lugar de músculo geniogloso o suprahioideo y músculos linguales en este estudio. Varios músculos, que se incluyen en los músculos suprahioideos, subyacen a cualquier electrodo de superficie colocado en la zona submentoniana, pero se cree que los genioglosos son los únicos medidos según la referencia14,31. El estudio se planificó con EMG de superficie. Se utilizaron los EMG de superficie en lugar de los EMG de gancho durante el sueño debido a su comodidad y a la colaboración del paciente. Sin embargo, Sauerland y cols.31 describieron que la actividad del músculo geniogloso puede seguirse de forma cercana por los registros de superficie del submentoniano en el estudio del sueño y los trastornos de la respiración. Yoshida14 también utilizó y apoyó el mismo proceso. Por tanto, en este estudio se aplicó un método similar para las mediciones de superficie de los registros EMG de los músculos submentonianos, como se describe en la literatura14,18,32,33. La franja de edad de los individuos fue una variable no controlada en este estudio para evitar que se diluyera el objetivo principal del estudio en un exceso de detalles. Por otra parte, la obesidad, confirmada mediante el IMC, y el tamaño del cuello no se planificaron en la etapa inicial del estudio. Son necesarias más investigaciones para evitar la influencia de estos parámetros en el IAH y la AOS, como la relación entre la franja de edad y la AOS y entre el IMC y el IAH. De forma separada y dentro de las limitaciones de este estudio, no deben olvidarse los siguientes comentarios:
El aumento de la actividad de los músculos masetero y submentonianos puede ser consecuencia de la profusión del maxilar inferior durante la noche.
Otros músculos, como el milohioideo o el vientre anterior del digástrico, pueden ser importantes a la hora de lograr el resultado deseado.
La mejoría de la permeabilidad de las vías respiratorias puede deberse a la simple acción mecánica de llevar el maxilar inferior hacia adelante.
Valió la pena aplicar la FAM porque el tratamiento con este dispositivo resultó de fácil aplicación, no invasivo, barato y fácil de producir y aplicar in situ.
Se citó a los pacientes para visitas de seguimiento cada 6 meses para evaluar la eficacia del dispositivo. En este estudio, se utilizaron los registros del PSG para monitorizar el éxito clínico del dispositivo. Las evaluaciones de la EMG y el IAH en los PSG fueron compatibles. Según estos resultados, se produjo una mejoría con la FAM. Y lo que es más importante, la evaluación mediante EMG confirmó las mediciones de la evaluación del IAH.
Conclusión
Una FAM es un método de tratamiento eficaz en casos de apneas leves y moderadas y puede utilizarse para tratar el síndrome de apnea del sueño, como AOS leve y moderada, de la forma descrita en la literatura32,36-41. Una FAM estimula los músculos masetero y submentonianos en los pacientes con AOS leve y moderada y evita el colapso de las vías respiratorias durante el sueño.
Correspondencia: Huseyin Kurtulmus,
Department of Prosthodontics, Faculty of Dentistry, Ege University, 35100, Bornova, Izmir, Turkey.
Fax: +902323880325.
e-mail: h_kurtulmus@yahoo.com