El cartílago es un tejido sensible propenso a la degeneración con la práctica continua de deporte y el proceso de envejecimiento, con baja capacidad de auto-reparación. Las enfermedades articulares degenerativas están entre las más profundamente invalidantes y limitantes en cuanto actividades diarias y calidad de vida. Las terapias biológicas se han vuelto disponibles para potencialmente tratar artrosis y lesiones condrales focales. Sin embargo, aun no hay manera eficiente de regenerar cartílago hialino nativo. Las terapias con células madre y la bioingeniería constituyen un terreno prometedor, el cual puede transformar los paradigmas en ortopedia. Esta revisión provee una visión en conjunto del corriente estado de las terapias con células madres y progenitoras. Resumimos opciones de células expandidas en cultivo y además, cuatro fuentes frecuentes de células madre adultas: medula ósea, tejido adiposo, tejido sinovial y sangre venosa periférica, junto a estudios clínicos reportando su eficacia. El propósito de esta revisión es resumir el potencial reportado de terapias con células madre adultas enfocándonos en lesiones condrales focales y artrosis.
Cartilage is a sensitive tissue prone to damage with the continuous practice of sports and ageing process, holding a low self repairing capacity. Degenerative joint diseases are among the most disabling and limiting in regards to life quality and daily activities. Biological therapies have become available to potentially treat osteoarthritis and focal chondral defects. However, there is still no efficient way to regenerate native hyaline cartilage. Stem cell therapy and bioengineering is a promising field which can transform the paradigms in orthopaedics. This review provides an overall view of the current state of biological therapies with stem and progenitor cells. We summarize cell therapy options with culture expanded cells and also four common sources of adult stem cells: bone marrow, adipose tissue, synovium and peripheral venous blood, along with clinical studies reporting their effectiveness. The purpose of this review is to summarize adult stem cells approaches for the treatment of focal chondral lesions and osteoarthritis.
Las terapias celulares están emergiendo como tratamientos prometedores para muchas condiciones musculoesqueléticas que afectan a atletas y a la población adulta1-3. Las terapias con células madre y progenitoras proveen potencial para beneficio clínico, mediante mecanismos de regeneración tisular e inmunomodulación4-9. En cirugía ortopédica, lesiones condrales focales, artrosis, fracturas y lesiones de tejido blando como: tendones, músculos y ligamentos son terrenos fértiles para terapias con células madre.
Las células progenitoras incluyen cualquier célula que puede proliferar para formar progenie y estas, a su vez, diferenciarse en un tejido adulto. Las células madre son un subconjunto de células progenitoras que poseen «capacidad de autorrenovación»10-14. Este es un proceso donde la célula se divide de forma asimétrica, produciendo 2 células hijas. Una célula hija es idéntica a la célula inicial y permanece disponible para otra división asimétrica de «autorrenovación». La segunda célula hija, una célula progenitora, que al contrario de la célula madre procede a dividirse y diferenciarse. Las células progenitoras son ampliamente más frecuentes que las células madre en los tejidos. A menudo, el término «célula madre» es usado incorrectamente para describir ambas células progenitoras y madre en conjunto15,16. El uso de nomenclatura precisa y estandarizada es crucial para el entendimiento del comportamiento biológico de células in vivo e in vitro, y mejora la comunicación científica.
Las células madre pueden ser clasificadas de varias maneras: 1) autólogas o alogénicas; 2) adultas, embrionarias o células madre pluripotentes inducidas (iPSC), y 3) nativas (tejido residente) o células expandidas. El propósito de esta revisión es determinar la utilidad de células madre adultas en ortopedia, con especial foco en lesiones condrales focales y artrosis, indicando fuentes, seguridad, eficacia y resultados objetivos y subjetivos17.
Las células madre embrionarias (ESC) tienen potencial de diferenciación pluripotente, hacia todos los tejidos, como derivados de: ectodermo, endodermo o mesodermo14. Se obtienen del embrión en sus primeros estadios18,19 y, frecuentemente, plantean condicionantes éticos18 y riesgo de transformación oncogénica20,21. Los avances en manipulación genética de las células fibroblásticas adultas, principalmente de la dermis, y de células fetales han generado iPSC, a través de mecanismos de reprogramación genética viral y no viral22-26. Son también células pluripotentes por naturaleza, y como pueden obtenerse de tejido adulto, no están asociadas con problemas éticos circundando ESC. Por el contrario, las células madre adultas tienen la capacidad de diferenciarse en uno o más fenotipos de tejidos embrionariamente relacionados; pueden obtenerse fácilmente de diversos tejidos, no presentan cuestiones éticas y usualmente no se han asociado con riesgos de transformación maligna27.
Nomenclatura de células madre adultas y células progenitorasSe han utilizado términos muy diferentes para describir las mismas poblaciones de células madre adultas y progenitoras en tejido nativo. En una aproximación para proveer esclarecimiento, fue propuesto el término progenitoras de tejido conectivo (CTP), que incluye la población heterogénea nativa (tejido residente) entera de células madre y progenitoras, con el potencial de activarse y generar progenie que puede contribuir hacia uno o más tejidos conectivos (p. ej., óseo, adiposo, cartílago, fibroso, sangre y músculo)10,11,28. Las CTP son residentes y pueden ser cosechadas de médula ósea, tejido adiposo o cartílago, entre otros tejidos. Sin embargo, las CTP en cada tejido tienen, a menudo, diferentes nichos, potencial y atributos biológicos. El término CTP reconoce que estas células derivadas de tejido no son una población uniforme, y hasta que se logre una detallada caracterización, las CTP podrán solamente ser detectadas por su capacidad de proliferar y formar colonias en una superficie 2D o en ensayos de medios viscosos 3D de unidades formadoras de colonias (UFC)10,11,28.
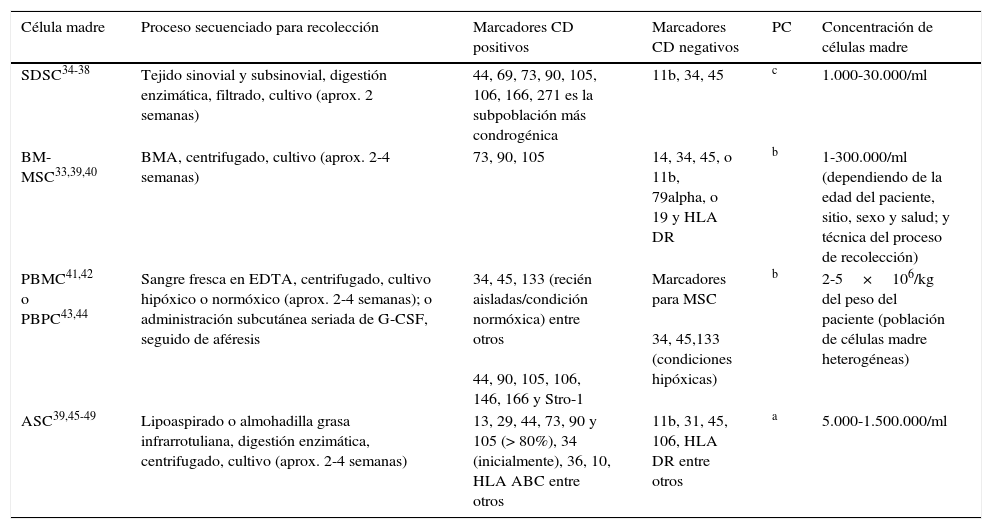
Por el contrario, las células cultivadas difieren de las células nativas y mínimamente manipuladas. Las células expandidas en cultivo proveen poblaciones más homogéneas y numerosas que las derivadas de tejido nativo. No obstante, los atributos celulares pueden cambiar rápidamente en un cultivo. El ejemplo más conocido y comercializado de células expandidas en cultivo son las células madre mesenquimales (MSC)29. Las MSC son células adultas, plásticas, adherentes y expandidas en medios de cultivo, que para ser clasificadas como células que retienen la capacidad de diferenciación trilineal (cartílago, óseo o tejido adiposo)30-32 deben expresar los siguientes marcadores de superficie CD105, CD73 y CD90, y la falta de expresión de CD45, CD34, CD14 o CD11b, CD79alpha o CD19 y HLA-DR moléculas de superficie33 (tabla 1).
Comparación de expresión de CD y potencial condrogénico
| Célula madre | Proceso secuenciado para recolección | Marcadores CD positivos | Marcadores CD negativos | PC | Concentración de células madre |
|---|---|---|---|---|---|
| SDSC34-38 | Tejido sinovial y subsinovial, digestión enzimática, filtrado, cultivo (aprox. 2 semanas) | 44, 69, 73, 90, 105, 106, 166, 271 es la subpoblación más condrogénica | 11b, 34, 45 | c | 1.000-30.000/ml |
| BM-MSC33,39,40 | BMA, centrifugado, cultivo (aprox. 2-4 semanas) | 73, 90, 105 | 14, 34, 45, o 11b, 79alpha, o 19 y HLA DR | b | 1-300.000/ml (dependiendo de la edad del paciente, sitio, sexo y salud; y técnica del proceso de recolección) |
| PBMC41,42 o PBPC43,44 | Sangre fresca en EDTA, centrifugado, cultivo hipóxico o normóxico (aprox. 2-4 semanas); o administración subcutánea seriada de G-CSF, seguido de aféresis | 34, 45, 133 (recién aisladas/condición normóxica) entre otros 44, 90, 105, 106, 146, 166 y Stro-1 | Marcadores para MSC 34, 45,133 (condiciones hipóxicas) | b | 2-5×106/kg del peso del paciente (población de células madre heterogéneas) |
| ASC39,45-49 | Lipoaspirado o almohadilla grasa infrarrotuliana, digestión enzimática, centrifugado, cultivo (aprox. 2-4 semanas) | 13, 29, 44, 73, 90 y 105 (> 80%), 34 (inicialmente), 36, 10, HLA ABC entre otros | 11b, 31, 45, 106, HLA DR entre otros | a | 5.000-1.500.000/ml |
ASC: células madre adiposas; BMA: aspirado de médula ósea; BM-MSC: células madre mesenquimales derivadas de médula ósea; EDTA: ácido etilenediaminetetraacético; G-CSF: factor estimulante de colonias de granulocitos; PBMC: células mononucleares de sangre periférica; PBPC: células progenitoras de sangre periférica; PC: potencial condrogénico; SDSC: células madre derivadas de tejido sinovial.
La Sociedad Internacional de Terapia Celular (ISCT) desarrolló los criterios que definen las MSC29,33. Sin estas características, el término MSC no debería usarse. La definición de las MSC, a pesar de no ser ideal, ha ayudado a ordenar el uso indiscriminado de «MSC» para describir todo fibroblasto expandido en medio de cultivo sin importar las características. Sin embargo, información reciente demuestra que una población de MSC, que cumple con estos criterios, puede variar ampliamente en cuanto a potencial biológico50. Todavía no disponemos del grupo de marcadores específicos que identifican las CTP de tejidos nativos. Pero, la concentración, la prevalencia y el potencial biológico pueden ser estimados con ensayos de UFC in vitro. Los ensayos de CTP se han mejorado usando criterios incorporados por la Sociedad Americana de Pruebas de Materiales (ASTM): «Ensayos de unidad formadora de colonias automatizada (UFC)-Adquisición de imágenes y método de análisis para la enumeración y caracterización de células y colonias de cultivo» para uso con sistemas automatizados para análisis de imágenes51. Tradicionalmente, los métodos utilizados para cuantificar colonias han demostrado estar sujetos a una amplia variación interobservador52.
Cuando el tejido está recién recolectado (p. ej., aspirado de médula ósea [BMA]) contiene CTP, pero la prevalencia y la función de estas CTP no puede calcularse sin ensayos de UFC. Por lo tanto, si son usadas células sin procesar ni cuantificar, deberían describirse de la medida métrica más cuantitativa posible, por ejemplo, células nucleadas mixtas derivadas de tejido (MTDNC)53, o células nucleadas mixtas de médula ósea (MBMDNC).
Como las CTP, son una población heterogénea de células madre y progenitoras residentes en tejido nativo, estas incluyen las células proliferativas de las cuales derivan las células expandidas MSC. No obstante, los atributos de las colonias formadoras de CTP difieren de los atributos que definen a las MSC de la ISCT. Se cree que ambas células madre y progenitoras están en casi cualquier tejido del cuerpo y tienen la habilidad para migrar hacia los lugares de la lesión y ser capaces de neoformar nuevos tejidos54-58 que asisten con regeneración tisular, ya sea directamente por medio de diferenciación hacia células adultas o indirectamente mediante citocinas, factores de crecimiento, quimiocinas para inmunomodulación, estimulando la angiogénesis y reclutando células progenitoras específicas del tejido nativo con el fin de crear un microambiente regenerativo59-62.
Fuentes de células madre y células progenitorasLas células madre y CTP pueden ser aisladas de cualquier tejido conectivo63-66. Las células obtenidas de cada fuente de tejido presentan variación intrínseca en cuanto a capacidad de proliferación y diferenciación hacia ciertas líneas celulares67. Se obtienen mejores resultados en la supervivencia del injerto cuando se cosechan células del mismo tejido o tejido vecino del cual se van a usar para regenerar68. Especial atención merece el destino del injerto, ya que este puede afectarse por el sitio del cual se colectan las células y de sus características.
Cuando las células se expanden en cultivo, la suplementación con factores de crecimiento asisten en la diferenciación de MSC hacia cualquiera de las 3 líneas celulares69-71 (tabla 2).
Factores de crecimiento para diferenciación trilineal
| Célula adulta deseada | Medio de cultivo que conduce | Tinción |
|---|---|---|
| Condrocito | Ácido ascórbico, BMP-6-7, TGF-β3, dexametasona, insulina, IGF-1, FGF | Azul alcián, safranina o/verde rápido |
| Osteoblasto | Ácido ascórbico, BMP-2, dexametasona, 1,25 OH vitamina D3 | Rojo alizarina/Picrosirius Red |
| Adipocito | Dexametasona, metilxantina de isobutilo, indometacina, insulina, tiazolidinediona | Oil red O o sudán |
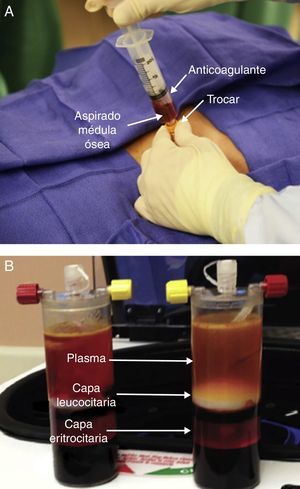
La médula ósea es una de las fuentes más comunes para la cosecha de células madre y progenitoras, usualmente por medio de aspiración de la cresta iliaca. Las CTP forman una población pequeña dentro de la médula ósea. Su concentración promedia entre 1.000 y 2.000 CTP/ml de aspirado, con una prevalencia estimada entre 1×10–4 a 1×10–6 células75, dependiendo de las variables del paciente y la técnica de aspirado40,76-78. El BMA es la fuente más utilizada en terapia celular por su fácil accesibilidad y la larga experiencia79-82. La técnica óptima estima, al menos, un aspirado de 2-4ml por punción y deben efectuarse las punciones necesarias hasta conseguir el volumen deseado, insertando el trocar profundamente en el hueso iliaco, retrayendo tras cada aspirado 5mm la aguja. Esto incrementa el rendimiento de CTP cosechadas, limitando la hemodilución por sangre periférica40,76,83,84. Si se aspira 10ml en una única vez, la concentración de CTP cae de 2 a 4 veces40. El procesamiento de la muestra puede incrementar la concentración y la prevalencia de CTP, por remoción de glóbulos rojos, suero y células no CTP de una población celular mixta77,85.
Hay diferentes alternativas para obtener un número superior de células madre/progenitoras de una muestra de BMA, expandirlas en medio de cultivo in vitro para obtener BM-MSC, o técnicas de procesamiento, como separación por densidad. Actualmente, se realizan preparaciones de concentrado de BMA (BMAC) autólogo para usar directamente intraoperatorio para implantar BMA con mínima manipulación86. Un defecto del BMAC es la población celular heterogénea encontrada en el preparado, incluyendo endotelial, hematopoyético y células inflamatorias. Las preparaciones también varían ampliamente entre individuos y debido a edad y sexo78,87-90, y por sitio de aspirado dentro de un mismo paciente. Los métodos de separación de densidad para preparar BMAC generalmente requieren al menos 60ml of BMA de la cresta iliaca anterior o posterior, pero este volumen no se aspira en un solo sitio. El BMA es idealmente aspirado en múltiples muestras de 2-4ml (para reducir hemodilución) a través de perforaciones corticales, yendo profundo dentro de la cavidad medular usando la misma incisión cutánea84. Esto es hecho en una técnica perpendicular (a la cresta iliaca): teniendo la aguja dentro de la cavidad medular, avanzando cada 5-10mm usando el obturador y en una proyección en abanico, una o 2 veces seguido de aspiración, permite 2 o 3 aspirados a través de la misma perforación cortical, y luego moverse hacia una nueva perforación cortical. Otro abordaje es la técnica en paralelo (a las tablas internas y externas de la cresta iliaca): avanzando cada 5-10mm usando el obturador entre ambas tablas y en una proyección en abanico, permite 3 o más aspirados10. La centrifugación (separación por densidad) es usada para remover plaquetas, granulocitos y glóbulos rojos. Este paso concentra el número de células y CTP, por lo tanto, las células que se van a utilizar intraoperatorio84 (fig. 1).
Tejido adiposoOtra fuente común de terapia con células madre y progenitoras es el tejido adiposo91,92. Es principalmente recolectado de aspirado o liposucción, o remoción quirúrgica (p. ej., una fuente emergente reciente es la almohadilla grasa infrarrotuliana)74,93,94. Es por lejos menos celular que el aspirado de médula ósea, pero la prevalencia de CTP es mayor, promediando 1 en 4.000 células. Algunos autores consideran el tejido adiposo como una reserva atractiva y fácilmente disponible para terapia con células madre95. Sin embargo, colonias formadoras de CTP derivadas de tejido graso y expandidas en cultivo presentan diferentes patrones de comportamiento, proliferación y diferenciación celular, comparadas con CTP de la médula ósea. Por consiguiente, una mejor categorización es necesitada91. Estas variables son, a su vez, afectadas con los mismos factores intrínsecos mencionados anteriormente, como individuales, edad y sexo. Estudios han reportado que células madre adiposas (ASC) tienen capacidad condrogénica y osteogénica reducida en las mismas condiciones estándar de cultivo96-99, a favor de una diferenciación más robusta hacia células musculares y cardiomiocitos100. Esto puede ser, en parte, debido a la baja expresión endógena del ARN mensajero de proteína morfogénica ósea (BMP) para los subtipos 2, 4 y 6, y por carecer de la expresión de factor de crecimiento transformante (TGF-β-receptor-1)96. Las BMP promueven diferenciación condrogénica y producción de cartílago y poseen estimulación autocrina sobre otras MSC para producir los mismos factores. Usando ASC cultivadas bajo factores condrogénicos, la diferenciación condrogénica y la formación de cartílago tienen lugar, siendo la combinación más potente la de TGF-β y BMP-6.
Diferentes nombres llevan a la confusión cuando se refieren a las células madre derivadas de tejido adiposo. La Federación Internacional de Terapéutica Adiposa y Ciencia determinó que el término a adoptar cuando se refiriere a células expandidas en cultivo aisladas, plástico adherente y multipotente debe ser el de «células madre derivadas de tejido adiposo (ASC)»72. Hay abundantes depósitos de tejido graso blanco subcutáneo para la recolección de células madre: brazo, muslo, abdomen y mama101. La secuencia estándar consiste sobre lipoaspirado tumescente, seguido de digestión enzimática usando colagenasa, tripsina, dispasa, entre otras enzimas, en combinaciones variadas, en determinado tiempo (30 a 60 min) y temperatura (37°C)45. Una vez que las enzimas son neutralizadas, continúa el centrifugado, permitiendo la separación de los adipocitos maduros flotantes de la fracción vascular estromal (SVF), una población celular heterogénea conformada por glóbulos rojos, fibroblastos, células endoteliales, linfocitos, pericitos, monocitos, células estromales adiposas, células madre hematopoyéticas y células progenitoras102,103. Finalmente, las células de la SVF son sembradas en cultivo y, luego de purificarlas a través de lavados y expandirlas en medio de cultivo sucesivamente, símil a las usadas con BM-MSC, con el fin de la depleción de la mayoría de las células hematopoyéticas, se obtienen las ASC. La cantidad usada también varía desde 5.000 a 1.500.000/ml de tejido colectado39. Diferentes métodos fueron propuestos para extraer ASC. Por ejemplo, la liposucción asistida por ecografía pareció prometedora comparada a la estándar liposucción tumenescente, pero estudios posteriores demostraron que la viabilidad de las células madre y la capacidad proliferativa parecen disminuir por estos medios104. Las ASC, similares a las BM-MSC, exhiben diferentes atributos y comportamiento, ya que el potencial de diferenciación tiende hacia tejido muscular y el inmunofenotipo es levemente diferente aunque más del 90% de los marcadores superficiales son idénticos72,93,105-107 (tabla 1).
SinovialLas células madre derivadas de tejido sinovial (SDSC) son reconocidas como una opción viable para reparar el cartílago108 y los estudios clínicos y experimentales han demostrado que el tejido sinovial tiene el mayor rédito109 celular comparando con células derivadas de tejido adiposo, muscular, médula ósea, periostio y sinovial y, no obstante, oscilando desde 1.000 a 30.000 células madre/ml por tejido colectado39. En términos de diferenciación, se ha reportado que poseen mayor potencial adipogénico y condrogénico que las BM-MSC35,109,110. Tras aislar SDSC, presentan un conjunto de marcadores identificables con subpoblaciones inmunofenotípicas que reflejan diferente potencial condrogénico y familiaridad con BM-MSC34,35 (tabla 1). La rodilla es el sitio más estudiado para la recolección de SDSC y el procedimiento estándar consiste en obtener tejido sinovial y subsinovial por artroscopia, seguido de digestión enzimática con una solución de colagenasa/dispasa, a 37°C durante 3 h, para ser después filtradas para dar suspensiones celulares que serán cultivadas en distintos medios dependiendo del tejido adulto deseado111.
Sangre periféricaLas células mononucleares de sangre periférica (PBMC)112 o células progenitoras de sangre periférica (PBPC)43 proveen nuevas perspectivas en terapia celular con células madre que no deben ser subestimadas, pues están involucradas en la regeneración tisular orgánica113-115. Las PBMC son una población heterogénea cosechada de sangre fresca periférica41 para lo cual tomamos una muestra de sangre venosa periférica que debe ser centrifugada. Las células nucleadas de la capa leucocitaria pueden ser congeladas y conservadas para ser utilizadas posteriormente o expandidas en cultivo. Cuando son recién colectadas, la citometría de flujo para PBMC muestra una expresión del 90% para marcadores hematopoyéticos CD34 y CD45, y negativo para conjunto de marcadores de MSC. La sangre periférica no contiene en circunstancias normales CTP o células símil-MSC. Estas se encuentran embebidas en nichos dentro de la médula ósea y sometidas a baja tensión de oxígeno. Las CTP se pueden presentar en el torrente sanguíneo luego de un traumatismo o de una estimulación medular116. Los estudios comparativos han demostrado diferentes patrones de crecimiento y marcadores celulares cuando se cultivan PBMC humanas en diferentes condiciones de tensión de oxígeno41 (tabla 1). En condiciones hipóxicas, similares a las de los nichos en la médula ósea, las células expresan más de 90% de marcadores de MSC y mantienen su potencial de diferenciación trilineal para tejidos condrogénicos, osteogénicos y adipogénicos41. Este fenómeno refleja el uso potencial para la reparación de cartílago, el cual es hipóxico por naturaleza. Por el contrario, en condiciones normóxicas, las PBMC producen células similares a los macrófagos adherentes, expresando menos del 50% de marcadores de MSC41.
Otro abordaje empleado para recolectar estas células con un mayor rendimiento, exige, la semana previa a la extracción de sangre, administrar subcutáneamente el factor estimulante de colonias de granulocitos pues regula y promueve la liberación de neutrófilos y monocitos desde la médula ósea hacia el torrente sanguíneo, incrementando la concentración circulante de PBMC. Estas PBMC movilizadas pueden ser recolectadas con un separador celular automatizado (aféresis), usando un acceso venoso central o periférico43,117-119. En los adultos sanos, dependiendo del protocolo utilizado, el rendimiento promedia 2-5×106 CD 34+ células por kilogramo de peso del paciente42,44. Cuando las PBMC son separadas en sus diferentes componentes celulares, para aislar las células madre y progenitoras (p. ej., monocitos CD14+, granulocitos, linfocitos), a través de CD14 y CD105, y son cultivadas en medio hipóxico y normóxico, todas se diferenciaron hacia células semejantes a macrófagos adherentes y evitando su diferenciación celular semejante a fibroblastos41. Esto sustenta la importancia de señalización intercelular a través de contacto directo y quimiocinas, en una población celular heterogénea120-123. El cocultivo celular de PBMC y ASC en un medio condrogénico muestra una diferenciación sinérgica y una potenciación migratoria hacia poblaciones de ASC121. Por ende, esto refleja la señalización celular como pieza central para la reparación de cartílago. Aparentemente, la hipoxia es una piedra angular para estimular la migración mononuclear desde los vasos sanguíneos (medio normóxico) hacia el tejido lesionado, y diferenciándose hacia células hematopoyéticas y no hematopoyéticas124. Estudios experimentales muestran resultados prometedores en la reparación de lesiones osteocondrales41,125-128 (tabla 1).
¿Por qué utilizar la terapia celular con células madre y células progenitoras?El cartílago articular es un tejido que soporta peso y fricción, y está compuesto de matriz extracelular, principalmente colágeno-2, proteoglicanos, agrecanos y condrocitos. El hueso subcondral es su único soporte vascular129. Su baja celularidad y avascularidad lo exponen a una capacidad limitada para la regeneración y restauración130. Los defectos en el cartílago pueden ser condrales o de grosor parcial, cuando está confinado a cartílago articular, u osteocondrales o de grosor completo, cuando el defecto es lo suficientemente profundo para afectar el hueso subcondral. Estas lesiones se pueden clasificar según la clasificación de Outerbridge, yendo de 0 a 4, dependiendo de cuán severa y profunda es la lesión131,132. Generalmente, mientras no hay reparación en defectos condrales, un intento se ve en los defectos osteocondrales debido al aporte sanguíneo subcondral, resultando un tejido subóptimo formado por células madre y progenitoras migrando desde la médula ósea133. Pequeñas lesiones de grosor completo son reparadas con cartílago hialino, pero las lesiones grandes son usualmente reparadas por formaciones de fibrocartílago57,134. Actualmente, múltiples tratamientos son usados para lesiones de cartílago. Estos incluyen microfractura, lavado artroscópico y desbridamiento, trasplante osteocondral autólogo o alogénico, e implantación de condrocitos autólogos135, entre otros. A pesar de que prometen resultados y alivio del dolor a plazos intermedios, la principal desventaja es que algunos de ellos son procedimientos que se realizan en 2 pasos, donde la colecta y la expansión de condrocitos se necesitan. Además, muchas de estas terapias generalmente llevan a la formación fibrocartílago136. Este último es un tejido tipo hialino, compuesto principalmente por colágeno 1 y que presenta por lejos menos resistencia a la carga y a la fricción, llevando eventualmente a la rotura y a artrosis secundaria a largo plazo137.
La artrosis es una enfermedad articular altamente prevalente que afecta s atletas luego de traumatismos y a población envejeciendo138. Múltiples factores forman parte de la fisiopatología de la artrosis, como el sexo, la edad, las lesiones, la obesidad, la desalineación articular y la predisposición genética. Características comunes incluyen inflamación crónica, con lesiones subcondrales y degeneración articular progresiva. La progresión lleva a la pérdida de función en estadios finales debido al dolor ascendente, la inflamación y la pérdida del rango de movimiento139. Puede afectar a múltiples articulaciones, siendo la rodilla y la cadera las más prevalentes e incapacitantes1. Los tratamientos actuales para la artrosis temprana a moderadamente avanzada incluyen analgésicos antiinflamatorios no esteroideos, corticoides, ácido hialurónico y fisioterapia; no obstante, ninguno parece detener la progresión degenerativa y en el mejor escenario proveen cierta analgesia y mejoran la función. Esto propone una oportunidad para que la terapia con células madre dé un paso adelante en investigación e innovación, debido a su perfil hipoinmunogénico140, actividad inmunosupresora, como también a su proliferación y capacidad de diferenciación hacia tejidos adultos.
Hasta la fecha, el BMAC obtenido por el proceso de separación por densidad (centrifugado) es una de las pocas terapias celulares que es autorizado por la Food and Drug Administration (FDA) para aplicar células progenitoras. Toda otra forma de manipulación superior está en las secciones 361 y 351 del Public Health Safety Act141. La FDA categoriza las terapias con células madre como células humanas, tisulares y celular, y productos a base de tejidos (HCT/Ps). La sección 361 encarga a la FDA regular HCT/Ps de bajo riesgo y provee seguridad en cuanto a su uso, sin requerir estudios preclínicos. Cuatro principios deben cumplirse para categorizarse de bajo riesgo: 1) manipulación mínima; 2) autólogo o sin efecto sistémico; 3) producto sin combinación, y 4) uso homólogo. Si un producto no cumple con todos estos 4 principios, debe ser regulado en la sección 351, que demanda estudios preclínicos, estudios clínicos y revisión previa a la comercialización. Poca o ninguna terapia con células madre está en la sección 361142.
Evidencia clínica y eficacia para lesiones condrales focales y artrosisMúltiples investigadores clínicos han reportado sobre la eficacia y la seguridad de las terapias con células madre en la reparación de cartílago para la artrosis y las lesiones condrales focales. Varios ensayos clínicos53,117,143-147 han presentado los resultados en terapias celulares. A pesar de que muestran heterogeneidad significante en las terapias celulares utilizadas, el común denominador es que la gran mayoría de ellos demostraron resultados positivos, con mínimos efectos adversos posquirúrgicos. En una revisión sistemática sobre terapias celulares intraarticulares para defectos condrales focales y artrosis de la rodilla16, se exponen estos trabajos publicados de forma precisa y comparativa. Contrariamente, podría ser prematuro generalizar que toda terapia celular provee beneficio para el tratamiento de pacientes comparada con otros tratamientos disponibles.
La eficacia debe ser testeada con rigurosos ensayos cegados y aleatorizados, muestras poblacionales grandes y mayor seguimiento a largo plazo. Los resultados evaluados con minuciosas mediciones estandarizadas, como las utilizadas en los estudios arriba mencionados148, y la inclusión de imágenes, artroscopia por «second look» con toma de biopsia, deberían ser el pilar. Estudios clínicos de alta calidad serán la respuesta a una población activa en busca de niveles más altos de mejoramiento149 y la importancia de ensayos cegados en estudios futuros debería sobrepasar el alto nivel de expectación de los pacientes enrolados, el cual constituye una fuente de sesgo150,151.
ConclusiónCélulas madre y progenitoras sostienen un futuro prometedor. Ha habido un avance significativo en las opciones de terapia celular para la artrosis y lesiones condrales focales. En conjunto, estas terapias mínimamente manipuladas de células autógenas parecen ser seguras. Se requiere una técnica rigurosa para identificar, conocer la concentración y el potencial terapéutico de las células madre y células progenitoras implantadas. Hay una necesidad para la estandarización comenzando con la nomenclatura de células madre, el procesamiento celular y la medición de resultados.
En los subsiguientes años, la terapia con células madre podría llegar a ser terapia de primera línea dentro de la ortopedia. Esto va a requerir un crecimiento paralelo de adjuntos para células madre como matrices o plataformas, plasma rico en plaquetas, factores de crecimiento solubles, entre otras técnicas de bioingeniería. Todos estos tienen potencial para un esfuerzo sinérgico sustancial.
Conflicto de interesesDr. Pascual Garrido recibe apoyo para la investigación a través de Biomet-Zimmer. Dr. Muschler recibe financiación de National Institutes of Health (NIH) y del Departamento de Defensa. Es consultor de la FDA y de NIH, y recibe financiación de Fortus para la investigación. Dr. LaPrade es consultor y recibe regalías de Arthrex, Ossur y Smith & Nephew. Los demás autores declaran no tener actual o potencial conflicto de interés en relación con este artículo.