El intestino delgado es el segmento más difícil de evaluar del tubo digestivo. Con el desarrollo tecnológico, nuevas modalidades de imagen como la Enteroclisis por Tomografía Computada y por Resonancia Magnética han permitido un mejor rendimiento y resolución en la evaluación de patologías intestinales como enfermedad de Crohn, tumores de intestino delgado, estudio de hemorragia digestiva y obstrucción intestinal parcial, entre otras. En el presente artículo se presenta una revisión de las indicaciones, aspectos técnicos y una revisión pictográfica de las principales patologías que afectan este segmento.
The small bowel is the most difficult segment of the gastrointestinal tract to be evaluated. With the development of new techniques such as CT and MR Enteroclysis, there is better accuracy and resolution in the study of Crohn’s disease, small bowel tumors, evaluation of gastrointestinal bleeding and partial small bowel obstruction, amog others. The aim of this article is to present a review of the indications, technique and images of the pathologies of the small bowel.
El intestino delgado es el segmento más largo y difícil de evaluar del tubo digestivo. Por años la modalidad de imagen más utilizada ha sido el tránsito de intestino delgado, que consiste en la ingestión de bario y su seguimiento a través de las asas intestinales. Sin embargo, éste presenta múltiples desventajas: utiliza radiación ionizante, tiene un bajo valor predictivo negativo (cercano a un 60%) (1, 2), es operador dependiente, usualmente en la pelvis menor hay asas intestinales difíciles de desproyectar, visualiza en forma indirecta la pared intestinal, no visualiza el mesenterio ni los órganos sólidos del abdomen, el examen puede durar horas y utiliza bario, que puede ser un problema si el paciente va a ser operado.
Con los nuevos avances tecnológicos, en especial el desarrollo de la Tomografía Computada (TC) y la Resonancia Magnética (RM), que permiten una mayor resolución espacial y por contraste respectivamente y un mayor rendimiento, sumado a la distensión de las asas de intestino delgado en forma artificial, ya sea por la ingestión de dos litros de agua o contraste entérico neutro, o por la administración de ésta a través de una sonda nasoenteral, se ha podido aumentar sustancialmente la sensibilidad y especificidad en la detección de patología de intestino delgado.
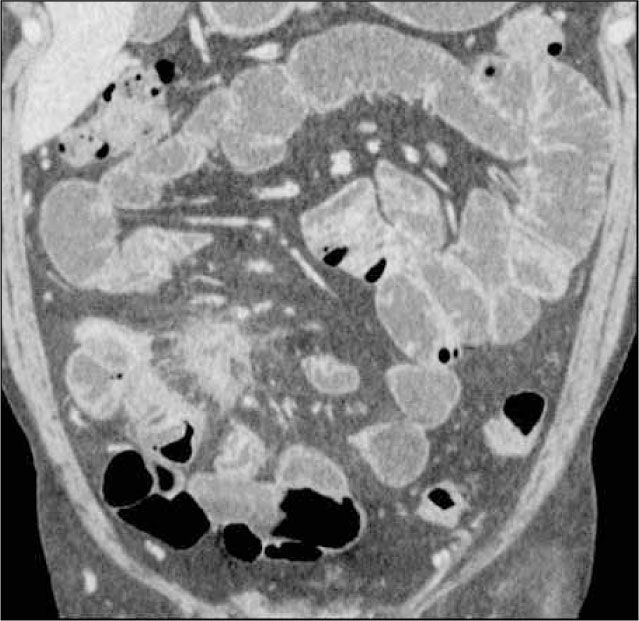
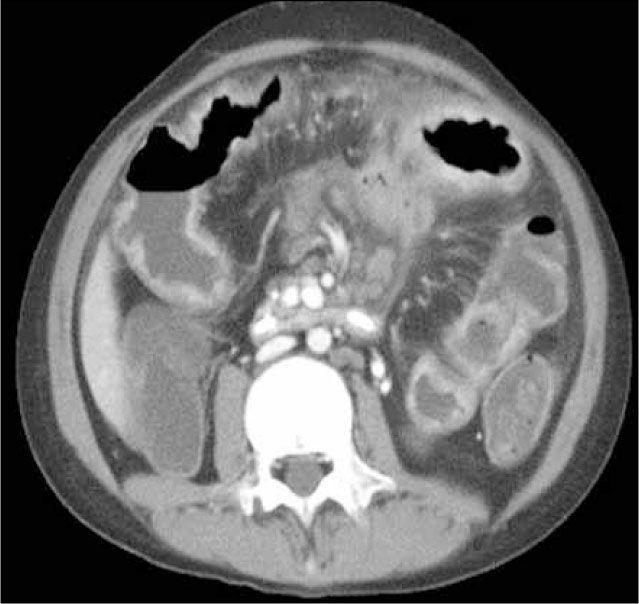
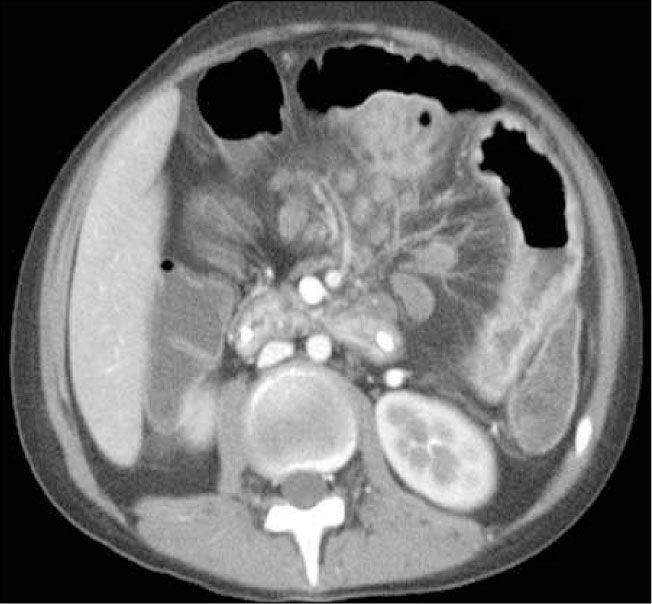
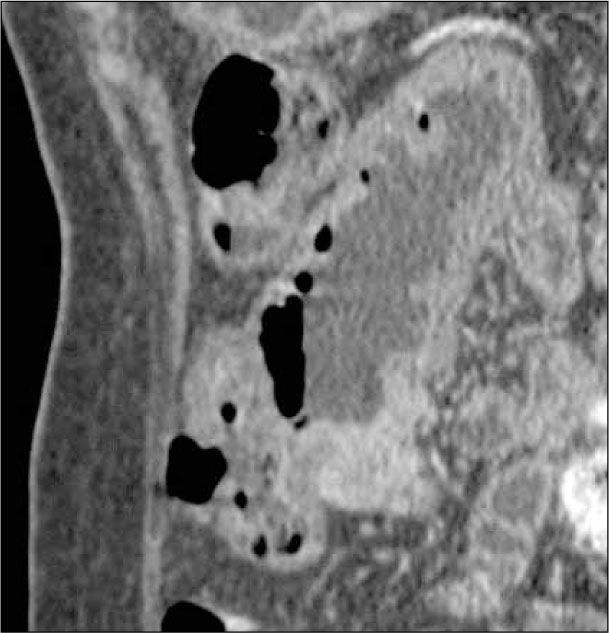
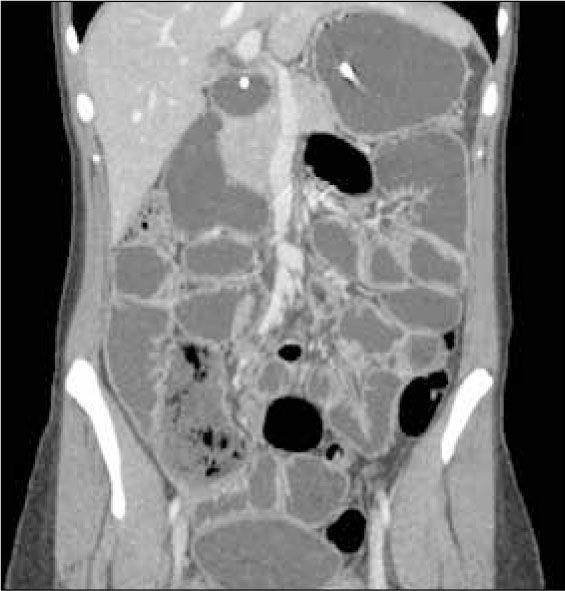
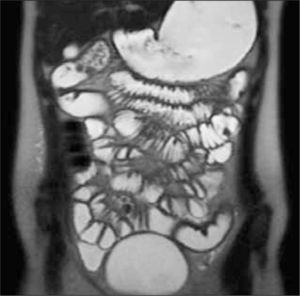
Enteroclisis por TCLa Enteroclisis por TC (ETC)(3-8) consiste en la realización de una TC de abdomen y pelvis multicorte, con al menos 16 filas de detectores, en fases arterial y portovenosa, tras la administración de dos litros de agua o contraste entérico neutro (polietilenglicol o sulfato de bario diluído al 0,1%) a través de una sonda nasoenteral. Esto permite una adecuada distensión de asas intestinales, en que el lumen es hipodenso y la pared hiperdensa por el contraste endovenoso administrado (Figura 1). Este examen es rápido, con alta resolución espacial isométrica (en los tres planos) dada su capacidad multiplanar, un alto rendimiento (valores predictivos negativo y positivo, sensibilidad y especificidad superiores al 90% (5), permite no sólo visualizar el lumen, sino que además la pared, el mesenterio y los órganos sólidos del abdomen (9). De esta forma, en caso de haber un proceso neoplásico, puede ser etapificado en el mismo examen, y también pueden ser detectados diagnósticos alternativos.
Las desventajas son el uso de radiación ionizante, la administración de contraste yodado endovenoso, la necesidad de utilizar una sala de fluoroscopía y la instalación de una sonda nasoenteral. En un 10% de los casos, el paciente no tolera la instalación de la sonda, por lo que debe ingerir los dos litros de agua o contraste entérico neutro.
Protocolo de ETCEl paciente es ingresado al Servicio de Radiología en forma ambulatoria u hospitalizada, en ayunas por al menos 4 horas. Se le instala bajo fluoroscopía una sonda nasoenteral 8 French, y posteriormente en forma manual (para evaluar tolerancia) se le administran dos litros de agua o contraste entérico neutro en 20 minutos. Previo al examen se administra 20 mg de escopolamina endovenosa.
Posteriormente se realiza una TC (al menos 16 detectores) de abdomen y pelvis en fases arterial y portovenosa, a 30 y 70 segundos post administración de 150 cc de contraste a una tasa de 4cc/seg, respectivamente. Se reconstruye el dato crudo y se envía a una estación de trabajo.
En caso de administrar vía oral bario diluído al 0,1%, se realiza el siguiente esquema: 450 cc de la solución 60 y 40 minutos antes del examen, posteriormente 225 cc 20 y 10 minutos antes, con un total de 1350 cc (9).
Las principales indicaciones de este examen son estudio o sospecha de enfermedad de Crohn, sospecha de tumores de intestino delgado, hemorragia digestiva baja con estudios endoscópicos alto y bajo negativos, obstrucción intestinal parcial y enfermedad celíaca (7, 8). Otras indicaciones menos frecuentes son sospecha de divertículo de Meckel, enteritis actínica y pseudo obstrucción intestinal crónica (CIPO).
Enteroclisis por RMLa Enteroclisis por RM (ERM) consiste en la realización de múltiples secuencias de RM tras la administración de agua o contraste entérico neutro a través de una sonda nasoenteral. Las ventajas de la ERM son: no utiliza radiación ionizante, lo que es muy significativo en pacientes jóvenes o niños, o en pacientes que requerirán múltiples estudios de seguimiento, como pacientes con fístulas u operados de enfermedad de Crohn; posee capacidad multiplanar inherente (sin necesidad de reconstruir imágenes); posee un mayor contraste entre tejidos blandos que la TC; puede ser utilizado con mayor seguridad en embarazadas y en pacientes con reacción alergoide al yodo; pueden evaluarse cambios temporales en la distensión de las asas intestinales sin necesidad de irradiar al paciente y en algunos casos el estudio puede ser diagnóstico sin necesidad de inyectar contraste endovenoso. Además, en caso de presentar el paciente fístulas perianales, se puede realizar un examen que incluya las asas de intestino delgado y la región perianal (10).
Las desventajas son el mayor costo, la menor disponibilidad de equipos en comparación con TC, el mayor tiempo de examen, una menor resolución espacial comparado con la TC y una mayor variabilidad en la calidad de examen dado que es más operador dependiente que la ETC.
Protocolo de ERMLuego de instalar la sonda nasoenteral, administrar el agua o contraste entérico (que puede ser negativo, positivo o bifásico) e inyectar escopolamina endovenosa, se realizan las siguientes secuencias:
- a)
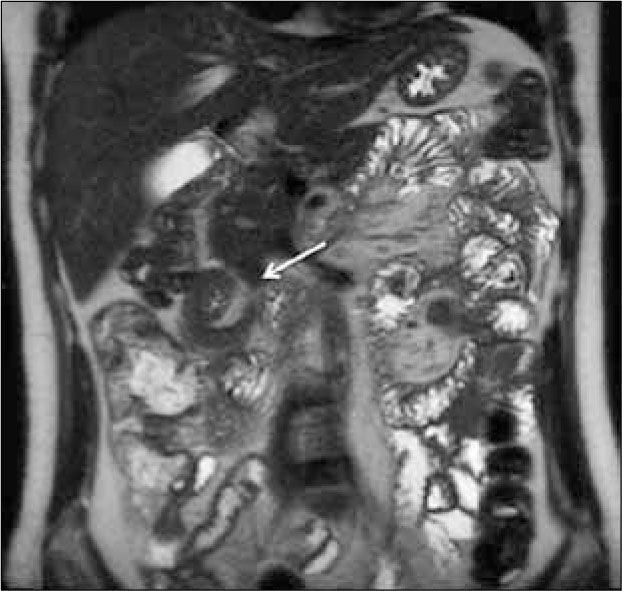
Secuencia Haif-Fourier single-shot Turbo spinecho (HASTE) coronal (Figura 2) y axial. Esta secuencia está ponderada en T2, tiene menos artefactos de susceptibilidad paramagnética, pero tiene artefacto de vacío de señal intraluminal que puede imitar una lesión nodular.
- b)
Secuencia de Estado Estacionario (steady state free precession) sin y con saturación grasa coronal y axial, que está ponderada tanto en T1 como T2. Posee la ventaja de visualizar muy bien el mesenterio (los vasos y las adenopatías) y la desventaja de tener artefactos de susceptibilidad paramagnética.
- c)
Secuencia 3D ultrafast gradient echo T1 con saturación grasa pre y postcontraste coronal y axial en al menos tres fases de contraste.
La principal indicación de este examen es evaluación por enfermedad de Crohn, en especial engrosamiento parietal, fístulas y obstrucción intestinal parcial.
Enfermedad de CrohnEsta es una enfermedad inflamatoria intestinal que puede afectar desde la boca hasta el ano. Se caracteriza por la presencia de compromiso transmural multisegmentario, que con alta frecuencia afecta el íleon distal y el colon.
Se han descrito cuatro subtipos de esta enfermedad: el inflamatorio, el fistulizante-perforante, el fibroestenótico y el reparativo.
Los hallazgos son los siguientes:
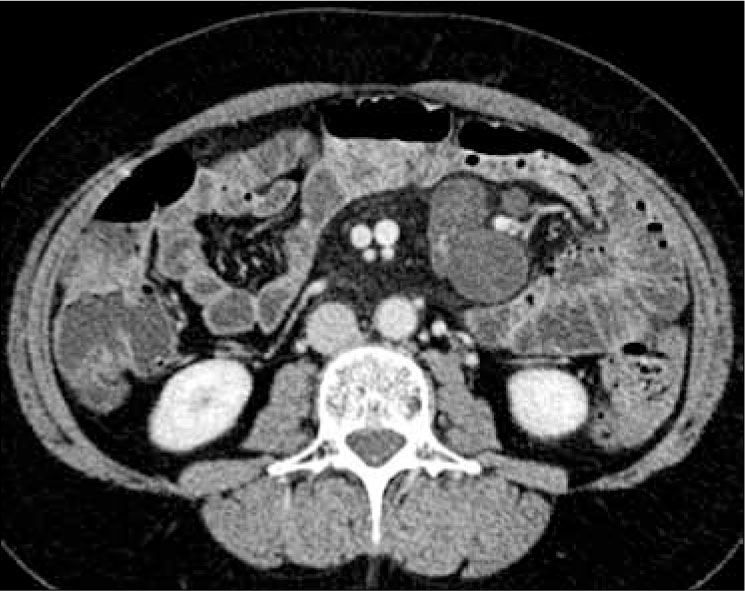
a) Engrosamiento parietal con estratificación de la pared e hiperrefuerzo mucoso (Figura 3), típico del subtipo inflamatorio. Puede observarse un patrón trilaminar tanto a la TC como a la RM, con mayor refuerzo de la mucosa y serosa, e hipodensidad de la submucosa a la ETC, hiposeñal de ésta en T1 postcontraste e hiperseñal en T2 a la ERM.
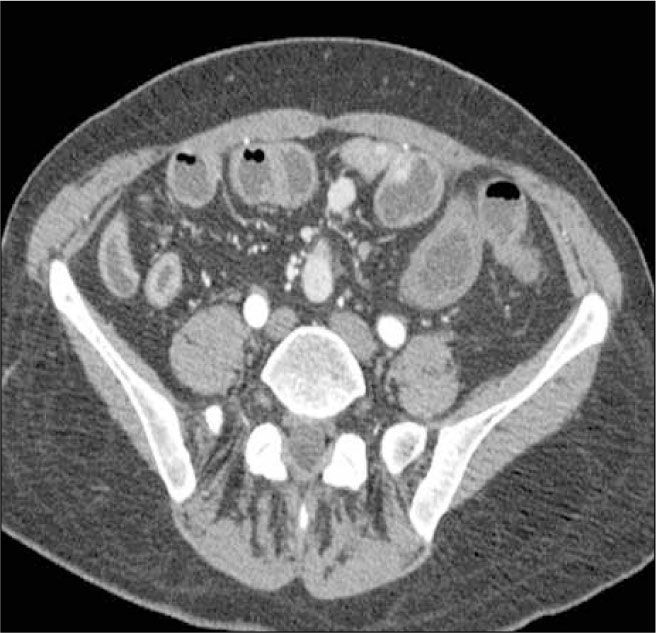
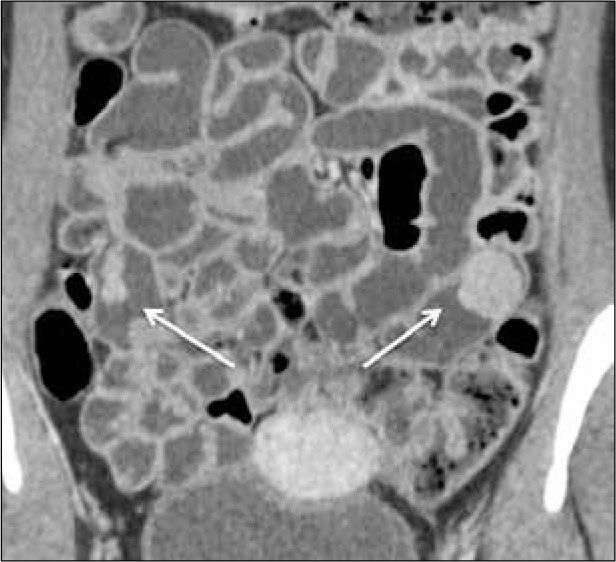
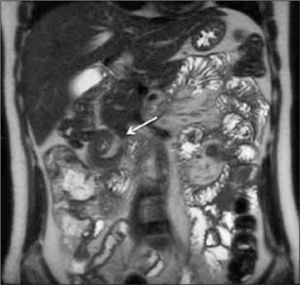
b) Proliferación de la vasa recta o “signo de la peineta”. Consiste en aumento de la vascularización del mesenterio adyacente al asa inflamada (Figura 4).
c) Proliferación del tejido adiposo mesentérico adyacente al segmento inflamado(creeping fat) (Figura 5). Este tejido jugaría un rol en la perpetuación de la inflamación (11, 12).
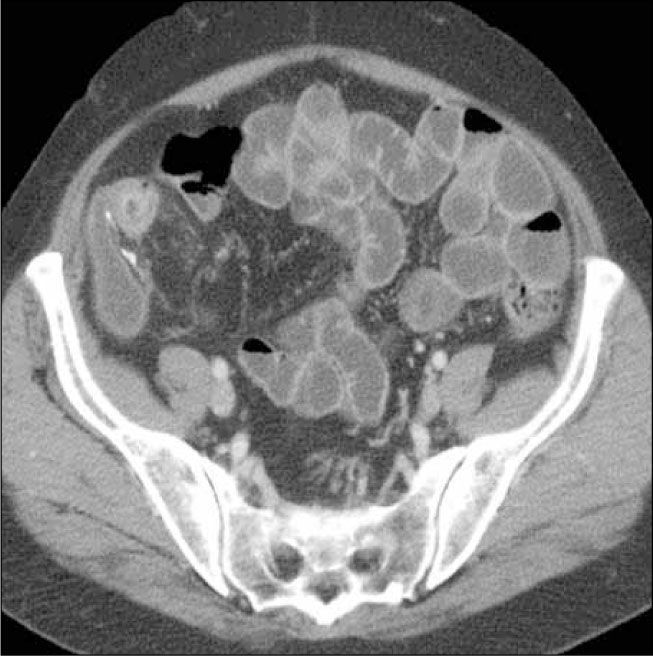
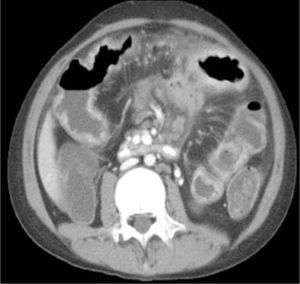
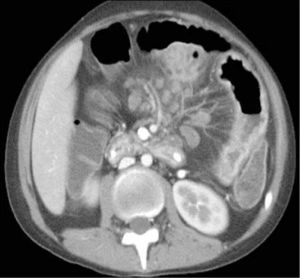
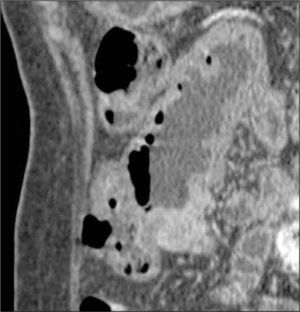
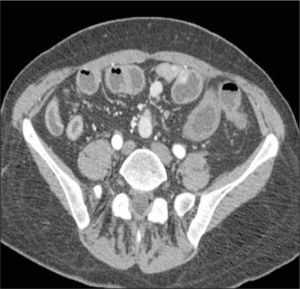
d) Obstrucción parcial de intestino delgado, que puede ser secundaria a un área de compromiso fibroestenótico, en que la inflamación da paso a la fibrosis y estenosis con dilatación del asa proximal (Figura 6). Se pierde el engrosamiento trilaminar hiperintenso en T2 dando paso a uno unilaminar hipointenso en T2.
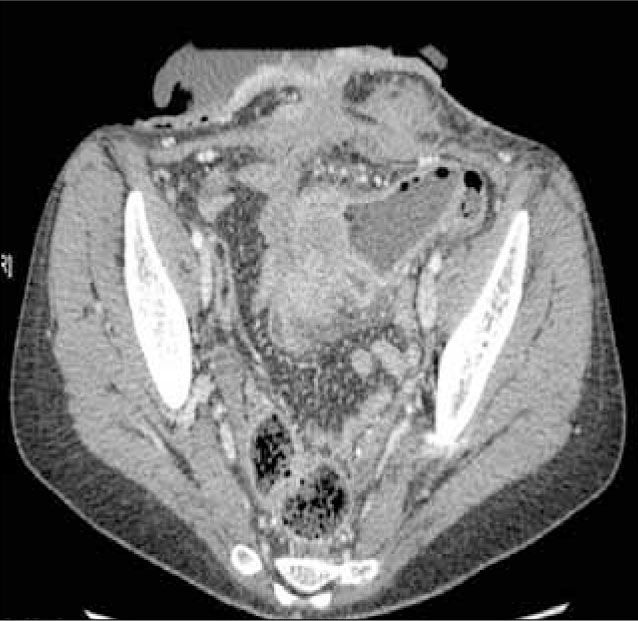
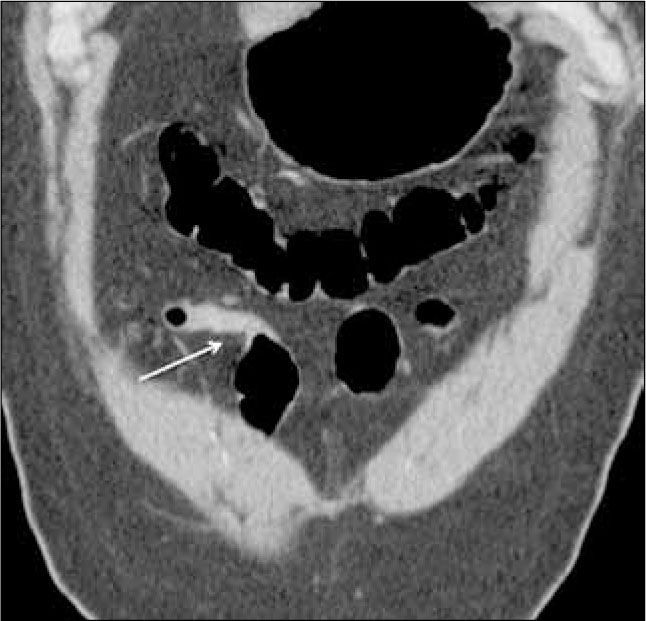
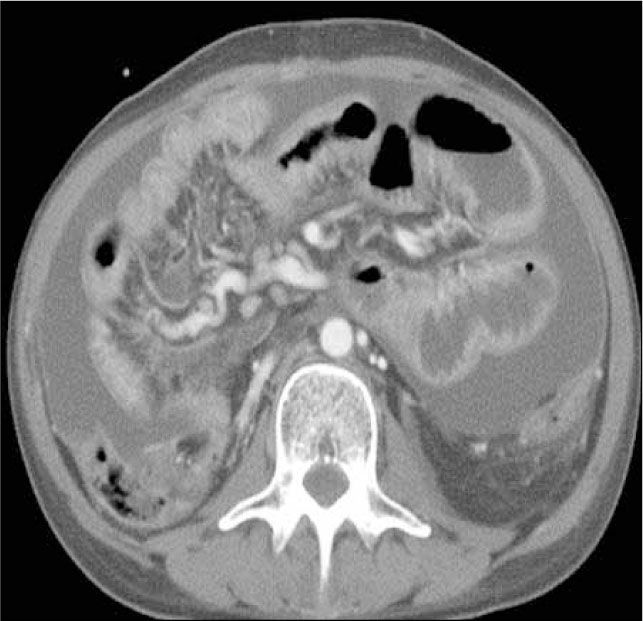
e) Presencia de fístulas, que pueden ser entero-entéricas, enterocólicas (Figura 7), entero-vesicales, entero-vaginales, entero-cutáneas (Figura 8), colo-cólicas y perianales, características del subtipo fistulizante-perforante. Por lo general se tratan con drogas anti TNF-á como el infliximab, en ausencia de abscesos, o bien con cirugía.
f) Formación de flegmones o abscesos, por lo general a nivel mesentérico, en relación a algún trayecto fistuloso. Los flegmones se visualizan como áreas de mayor densidad o señal sin presencia de una colección central (Figura 9). Los abscesos corresponden a colecciones de líquido y/o gas (Figura 10), hipodensas a la ETC, con hiposeñal en T1 e hiperseñal en T2, que presentan una cápsula que refuerza postcontraste.
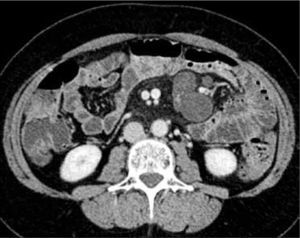
g) Presencia de adenopatías mesentéricas, que son habituales adyacentes a las áreas de inflamación (Figura 11). Sus ejes menores por lo general son inferiores a 10 mm. En caso de ser mayores, se sugiere realizar un control estricto o biopsia dado que la enfermedad de Crohn puede complicarse con linfoma o adenocarcinoma.
Tumores de intestino delgadoEl intestino delgado representa el 90% de la superficie del sistema gastrointestinal; sin embargo, sólo el 2% de las neoplasias del tubo digestivo ocurren en esta localización.
La mayoría de los tumores a este nivel son malignos, siendo los más frecuentes el adenocarcinoma, el tumor carcinoide, linfoma y el tumor estromal gastrointestinal (GIST) (13). Los tumores benignos corresponden a los lipomas, pólipos hiperplásticos y hamartomatosos, hemangiomas, entre otros.
Los síntomas asociados a estos tumores son inespecíficos. Los pacientes pueden no presentar síntomas, o bien referir dolor abdominal, náuseas, vómitos, anorexia, baja de peso, distensión abdominal y hemorragia.
La ETC tiene un rol muy importante, con detección de lesiones menores a 5 mm, en especial si son hipervasculares. Es fundamental distender en forma adecuada las asas, y las imágenes deben ser obtenidas en fases arterial y portovenosa para ver el comportamiento de las lesiones. Además, este examen sirve para etapificar el tumor a nivel abdomino-pélvico.
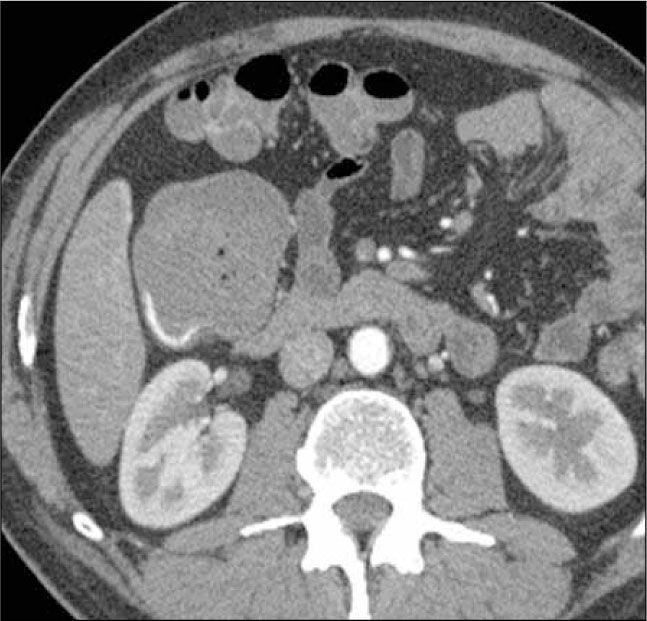
El adenocarcinoma es la neoplasia más frecuente en intestino delgado, más común en duodeno y yeyuno, y en menor grado en íleon. Por lo general es una lesión estenosante anular que refuerza heterogéneamente con el contraste y puede asociarse a adenopatías mesentéricas adyacentes (Figura 12). Puede determinar obstrucción con dilatación del asa proximal. En algunos casos puede fistulizar a otras asas intestinales.
Factores de riesgo para esta enfermedad son la enfermedad de Crohn, enfermedad celíaca, Sindrome de Peutz Jeghers, Sindrome de Lynch y la presencia de ileostomía.
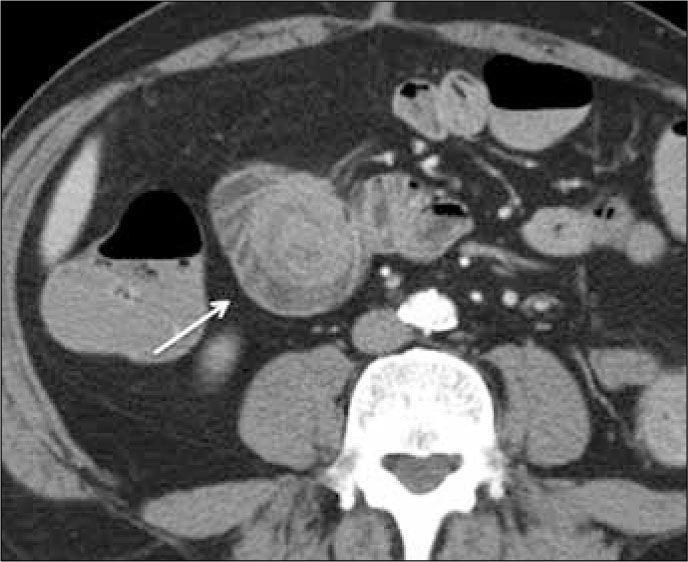
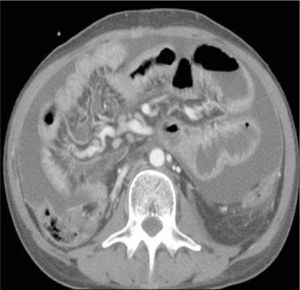
El tumor carcinoide es una neoplasia neuroendocrina que afecta principalmente íleon y apéndice, y menos frecuentemente yeyuno y duodeno. La lesión primaria puede ser multifocal en un 30-50%, y es de carácter hipervascular, por lo que se visualiza mejor en fase arterial. Puede determinar retracción del mesenterio adyacente y usualmente se asocia a adenopatías mesentéricas hipervascularizadas que son espiculadas o lobuladas secundario a la reacción desmoplástica (Figura 13). Estas adenopatías pueden comprimir o infiltrar los vasos mesentéricos superiores, determinando isquemia crónica.
El compromiso de intestino delgado por linfoma puede ser primario o secundario, más frecuentemente No Hodgkin. El íleon es el segmento más frecuentemente comprometido. Se visualiza como un engrosamiento masiforme del asa intestinal con una transición gradual entre el asa normal y el asa comprometida, habitualmente asociado a adenopatías mesentéricas (Figura 14). Una característica habitual es la llamada “dilatación aneurismática”, que consiste en dilatación en vez de estenosis del asa comprometida, por compromiso del plexo mientérico.
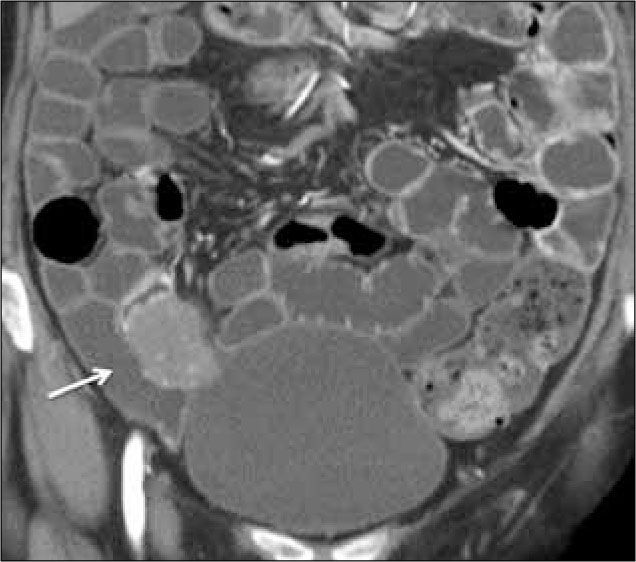
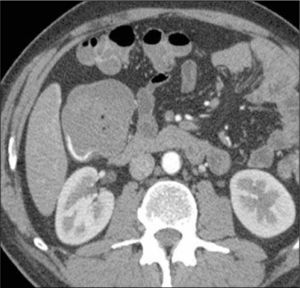
El GIST es el tumor mesenquimático más común (80%), pero representa el 0,1-3% de los tumores del sistema gastrointestinal. Se originan de la capa muscular propia de la pared intestinal a nivel de las células intersticiales de Cajal. La mayoría se localiza en el estómago, y en segundo lugar en intestino delgado (20-30%). Al estudio inmunohistoquímico, casi el 100% expresa el receptor de factor de crecimiento de tirosina kinasa como CD117. Un 70% coexpresa CD34, antígeno de célula progenitora hematopoyética. En un 50% pueden ulcerarse, lo que explica que el síntoma más frecuente sea el sangrado gastrointestinal. A la ETC se manifiestan como una masa exofítica excéntrica que se origina de la pared intestinal y protruye hacia el mesenterio (Figura 15). Presentan tamaños variables que fluctúan entre 2,2 y 21 cm con un promedio de 8,6 cm (14). Pueden presentar necrosis o abscedación central. No se asocian a adenopatías mesentéricas, pero si a metástasis hepáticas, que pueden ser quísticas.
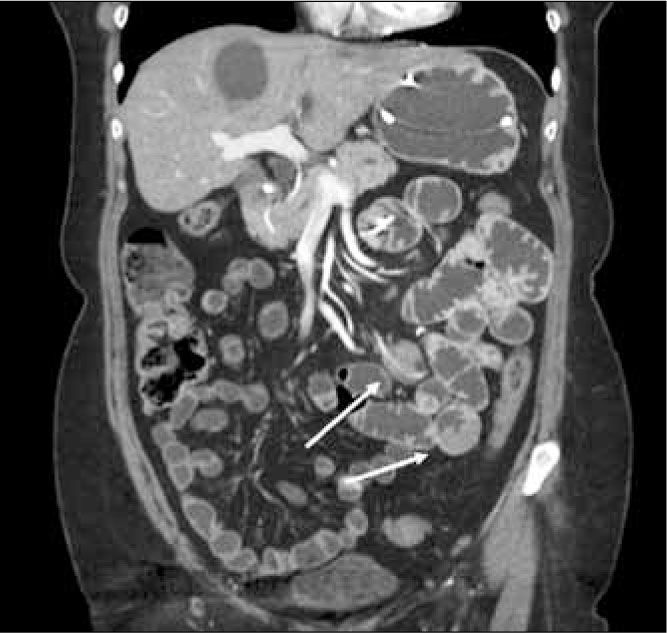
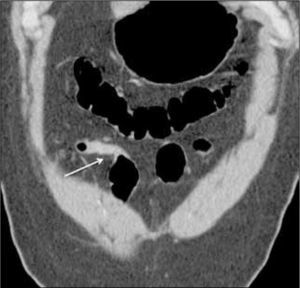
Las metástasis a intestino delgado son raras, siendo las más frecuentes las de tumores de mama, pulmón y melanoma. Por lo general se visualizan como un nódulo sólido que tiende a producir invaginación intestinal (Figura 16).
El síndrome de Peutz Jeghers es autosómico dominante, consiste en pigmentación mucocutánea, en especial en labios y dedos de las manos, asociado a la presencia de múltiples pólipos hamartomatosos en intestino delgado (Figura 17). Estos pólipos tienden a formar conglomerados que determinan focos de invaginación intestinal. Usualmente se tratan mediante resecciones seriadas a través de enteroscopía. En este síndrome hay mayor riesgo de contraer neoplasias gastrointestinales y extradigestivas (15).
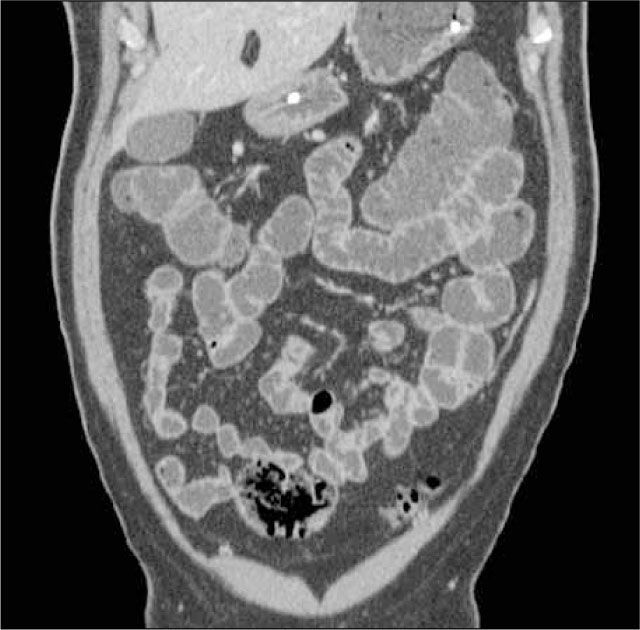
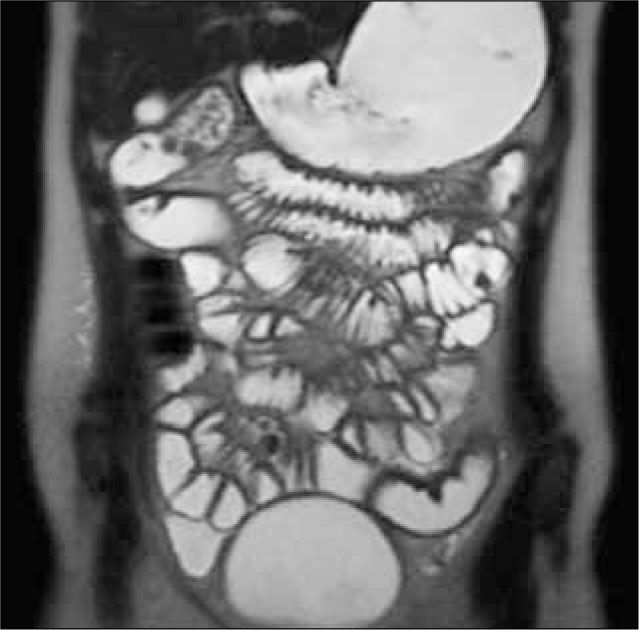
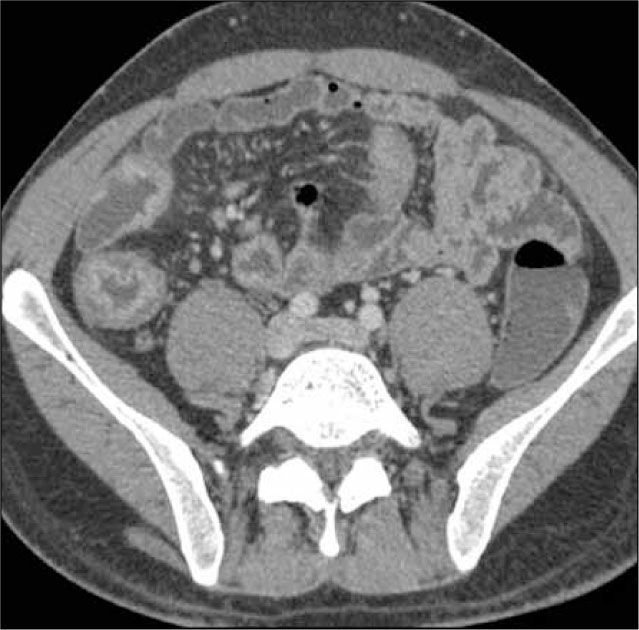
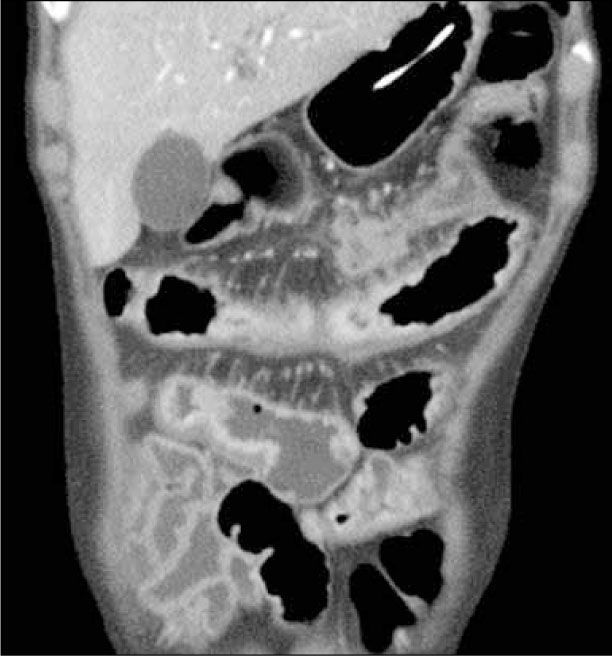
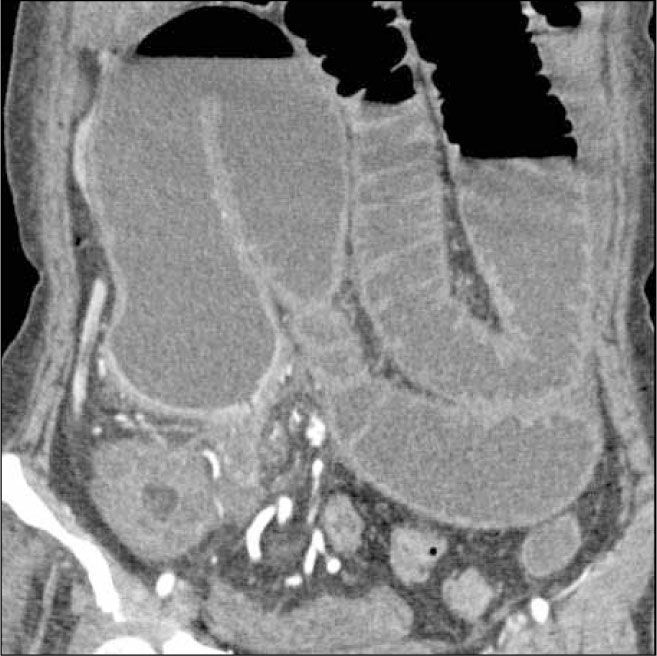
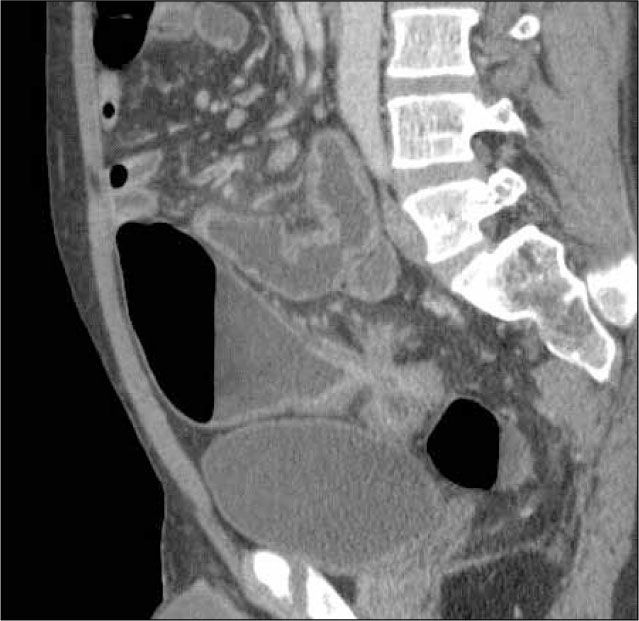
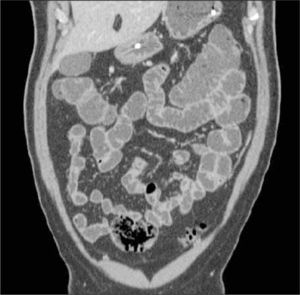
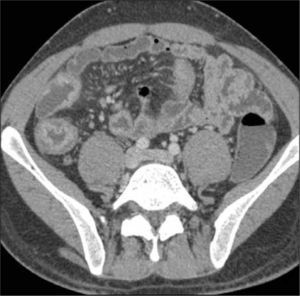
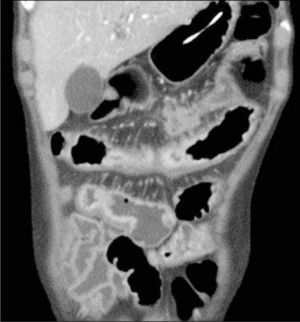
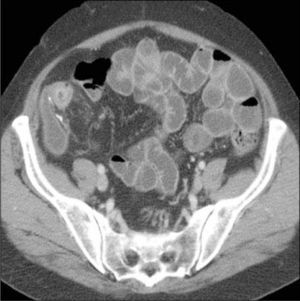
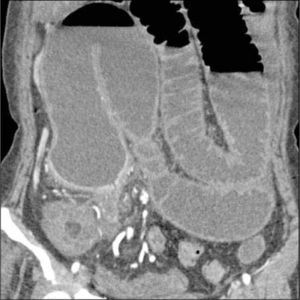
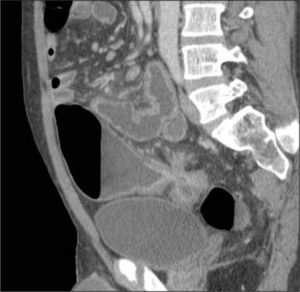
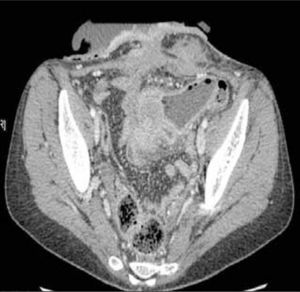
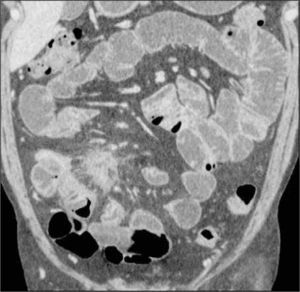
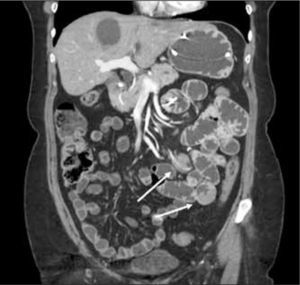
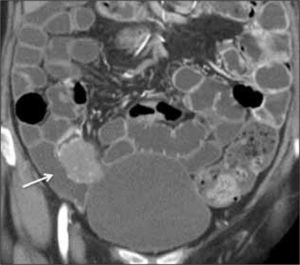
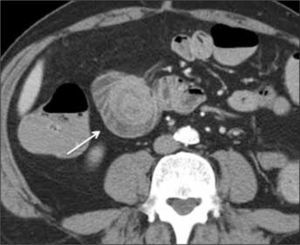
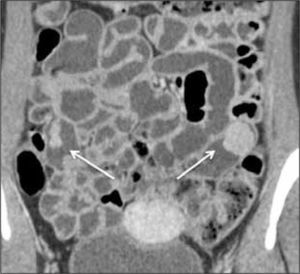
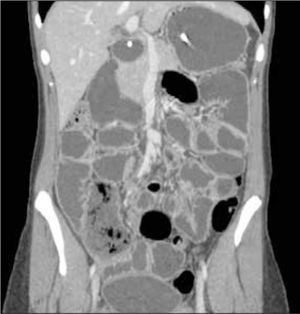
La obstrucción mecánica parcial de intestino delgado, a diferencia de la completa, es de difícil diagnóstico. Usualmente es secundario a bridas adquiridas o congénitas, y menos frecuentemente a tumores y hernias internas o externas. La sensibilidad de la TC convencional es de 48%. La ETC, gracias a la distensión de asas intestinales, actúa como un “test de esfuerzo” intestinal, aumentando la sensibilidad a 89% (Figuras 18 y 19). De esta manera no sólo se determina la presencia de una obstrucción, sino que también la localización y la causa (16).
Hemorragia digestiva con estudios endoscópicos alto y bajo negativos: Este es un problema frecuente en gastroenterología, con cifras no despreciables de morbimortalidad. Se divide en sangrado oscuro (estudios endoscópicos negativos) oculto, como la anemia ferropriva, o evidente, cuando el paciente refiere melena o hematoquezia. Las causas más importantes son tumores y angiodisplasia o malformaciones vasculares. La Cápsula Endoscópica (CE) juega un rol importante en estos pacientes, con sensibilidades reportadas de 42-80% (17); sin embargo, ésta presenta limitaciones técnicas, tiene un alto costo y puede quedar retenida.
La ETC también juega un rol muy importante en este contexto. Es crucial realizar las fases arterial y portovenosa, lo que sumado a la distensión de las asas y a la alta resolución de este examen aumentan su sensibilidad siendo competitiva con la CE.
La angiodisplasia se visualiza como una imagen nodular vascular en forma de penacho asociada a una vena mural dilatada y drenaje venoso precoz en fase arterial.
La extravasación activa se visualiza como un área de alta densidad en fase arterial en el lumen intestinal (Figura 20), que aumenta de tamaño en fase portovenosa.
Enfermedad celíacaEsta enfermedad es una enteropatía autoinmune causada por una respuesta inmune inapropiada a la ingesta de gluten, lo que genera una respuesta inflamatoria crónica a nivel de duodeno y yeyuno.
A la ETC se visualizan los siguientes hallazgos: leve dilatación de asas intestinales, más de lo esperado tras la administración de agua; inversión del patrón de pliegues intestinales, con aumento de éstos a nivel de íleon y disminución a nivel de yeyuno (Figura 21); invaginaciones transitorias (Figura 22); prominencia de los vasos mesentéricos superiores, que presentan un mayor diámetro; disminución de tamaño del bazo y presencia de adenopatías mesentéricas con centro hipodenso (Figura 23) (18).
En ocasiones puede observarse un engrosamiento parietal de yeyuno e íleon, que es compatible yeyunoileítis ulcerativa. En esta enfermedad hay un mayor riesgo de linfoma, de células T, y de adenocarcinoma.
SíntesisLa ECT es un examen de alto rendimiento y resolución espacial, que se recomienda como estudio de primera línea en la evaluación del intestino delgado.
La ERM puede ser considerada de segunda línea o como alternativa en caso de pacientes jóvenes, con alergia al medio de contraste yodado o con nefropatía.
El autor declara no tener conflictos de interés, con relación a este artículo.