Analizar la frecuencia de cefalea pospunción de la duramadre (CPPD) y el tratamiento más utilizado para esta complicación anestésica en los quirófanos centrales del Hospital General de México.
MétodoEstudio retrospectivo, transversal, observacional y descriptivo. Se revisaron las hojas de anestesia de mujeres y hombres, con técnica anestésica de bloqueo epidural y punción accidental de la duramadre. Se analizó la presentación de cefalea pospunción dural y el tratamiento más frecuente. Se estudiaron las variables: Sexo, edad, peso, talla, índice de masa corporal, localización e intensidad de cefalea y tratamiento. El análisis estadístico se llevó a cabo con medias, desviación estándar y rangos para variables cuantitativas, frecuencias y porcentajes para variables cualitativas, y prueba de t de Student pareada.
ResultadosSe revisaron 2,114 registros anestésicos, hubo punción accidental de la duramadre en 58 sujetos, y en 14 (0.66%) se presentó CPPD, 10 (71.4%) en el sexo femenino y 4 (28.6%) en el masculino. La cefalea se localizó con mayor frecuencia en la región frontal (85.7%). Se administró tratamiento conservador en 58 sujetos. Se administraron líquidos en el 100%, reposo en decúbito dorsal en 57 (9.2%) y analgésicos en 55 (94.8%). Se aplicó parche hemático epidural profiláctico en 12 pacientes, y fue efectivo en 9 (15.5%) casos, con una media de sangre autóloga de 16.5±4.8. La relación entre CPPD y escala visual análoga antes y después del tratamiento con medidas conservadoras e invasivas obtuvo una media de 4.1±3.06, con un IC al 95% (2.37-5.91) y una p=0.0001.
ConclusionesLa CPPD es una complicación frecuente, de predominio en el sexo femenino, en la quinta década de la vida. El tratamiento conservador y el parche hemático epidural profiláctico previenen la aparición de cefalea.
Frequency of post-dural puncture headache (PDPH) and most common treatment for this complication were analyzed in the central operating rooms of the Hospital General de México.
MethodsA retrospective, transversal, observational and descriptive study. Anesthesia records of men and women with epidural anesthetic technique and accidental dural puncture were reviewed. Presentation of post-dural puncture headache and most common treatment were analyzed. Age, sex, weight, height, body mass index, location, intensity, and treatment of headache, were studied. Statistical analysis was performed using means, standard deviations and ranges for quantitative variables, frequencies and percentages to qualitative variables and Student t test paired.
Results2,114 anesthetic records were reviewed, in 58 subjects occurred accidental dural puncture, PDPH in 14 (0.66%), 10 (71.4%) in female and 4 (28.6%) in male. Headache was located more frequently in the frontal region (85.7%). Conservative treatment was administered to 58 subjects, fluids were administered at 100%, rest in the supine position in 57 (9.2%) and analgesics in 55 (94.8%). Prophylactic epidural blood patch was performed in 12 patients and was effective in 9 (15.5%) cases, with a mean of 16.5±4.8 autologous blood. Relationship between PDPH and analogue visual scale before and after conservative and invasive treatment scored a mean of 4.1±3.06 with a 95% CI (2.37-5.91) and P=.0001.
ConclusionsPDPH is a common complication, predominantly in women in the fifth decade of life. Conservative treatment and prophylactic epidural blood patch prevent the onset of headache.
La cefalea pospunción de la duramadre (CPPD) se define de acuerdo con el Comité de Clasificación de Cefalea de la Sociedad Internacional de Cefalea como «la cefalea que se desarrolla dentro de los 5 días después de la punción dural [o poslumbar] y se resuelve espontáneamente en una semana o dentro de las 48h después de un tratamiento efectivo de la salida del líquido espinal (usualmente mediante parche hemático epidural [PHE]). La cefalea empeora dentro de los 15min después de asumir la posición vertical, y desaparece o mejora en los 15min posteriores a retomar la posición de decúbito»1.
La CPPD es una complicación que puede ocurrir cuando se hace una punción accidental de la duramadre (PAD) durante el bloqueo epidural, así como después de una punción lumbar diagnóstica o un bloqueo subaracnoideo2. Causa morbilidad importante en el postoperatorio, particularmente en la paciente obstétrica, desarrollándose en más de un 50%, y prolonga la estancia hospitalaria3. Depende de diversos factores que se relacionan con la PAD, como la edad, el sexo, el tipo y diámetro de la aguja epidural4, la orientación del bisel, el método para la identificación del espacio epidural y la experiencia del anestesiólogo.
La CPPD es un cuadro clínico que se inicia en los primeros 5 días siguientes a la punción dural, con un 90% de incidencia a los 3 días. El dolor tiene una localización frontal y occipital principalmente, y una severidad que varía de moderada a severa. La característica principal de la CPPD es su aparición en posición de pie o sentado, y disminución en decúbito dorsal1.
Se asocia a náuseas, vómito, rigidez de cuello, alteraciones visuales (visión borrosa, fotofobia, diplopía), y auditivas (acufenos, vértigo e hipoacusia)2. Generalmente, en un porcentaje mayor al 85% se resuelve espontáneamente en una semana sin tratamiento y en 48h después de un tratamiento efectivo, usualmente con la aplicación de PHE1,5,6.
Cuando se punciona la duramadre en forma accidental o inadvertida con una aguja epidural (Tuohy) de calibre 16G a 18G, la incidencia de cefalea es del 70-80%7, y con la de calibre 17G se reporta dentro del rango del 76-85%8. El orificio que se ocasiona con una aguja de calibre 17G o 16G es lo suficientemente amplio para permitir una fuga de líquido cefalorraquídeo, y tarda en cerrarse al menos entre 10 y 14 días, e incluso más tiempo. La cefalea aguda e intolerable aparece en un 20% de las punciones con orificio extenso. Las medidas para prevenir o tratar la CPPD se dirigen a restablecer la presión del líquido cefalorraquídeo, que desciende por la fuga a través del orificio de la punción. Existen medidas terapéuticas para la CPPD tanto conservadoras o no invasivas como invasivas9.
Las medidas conservadoras se aplican regularmente, sin embargo, no son tan efectivas. En cambio, para los métodos invasivos, hay algunas controversias, a pesar de ser más eficaces10.
La indicación del tratamiento conservador dentro de las primeras horas posteriores a la punción lumbar es una medida que previene la aparición de sintomatología. El tratamiento conservador incluye reposo en decúbito dorsal sin almohada11, hidratación con abundantes líquidos por vía oral (vo) y/o intravenosa (iv), analgésicos antiinflamatorios no esteroideos (AINE), vendaje abdominal, benzoato de cafeína12, sumatriptán13 y cortisona14.
El tratamiento invasivo comprende la administración de solución salina intratecal15, dextrán epidural16, morfina epidural17, catéter subaracnoideo18, PHE19,20, y parche hemático epidural profiláctico (PHEP)21. Con relación al volumen óptimo recomendado de sangre autóloga que se inyecta durante el PHE, todavía está en controversia. Inicialmente, se obtuvieron excelentes resultados con 2 o 3ml de sangre22,23. Estudios pasados reportan fallas o recaída de los síntomas con un volumen menor de 10ml24. Con el uso de 20ml de volumen de sangre, Crawford observó un 96% de éxito7. La tendencia actual es la administración de 20ml aproximadamente de sangre autóloga25.
El objetivo del presente estudio consistió en analizar la frecuencia de presentación de cefalea posterior a punción accidental o inadvertida de duramadre durante el bloqueo epidural y el tratamiento más usual para esta complicación anestésica en los quirófanos centrales del Hospital General de México.
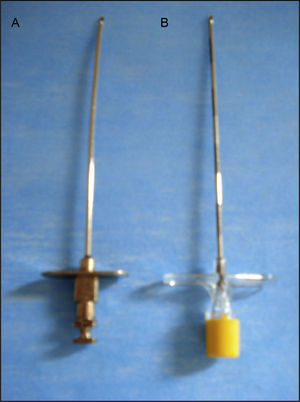
MétodoEstudio retrospectivo, transversal, observacional y descriptivo realizado en un periodo de 11meses. Con aprobación del Comité de Investigación y Ética, se revisaron 2,114 registros de anestesia de mujeres y hombres, mayores de 18 años, con clasificación del estado físico de la American Society of Anaesthesiologists I-III, para cirugía electiva y de urgencia, a quienes se les aplicó técnica anestésica de bloqueo epidural con aguja de Tuohy no desechable calibre 16G o desechable calibre 17G (fig. 1), y que presentaron PAD. Se analizó la presentación de CPPD y el tratamiento más utilizado. Se estudiaron las variables: Sexo, edad, peso, talla, índice de masa corporal, tipo y calibre de aguja epidural (Tuohy), dirección y orientación del bisel de la aguja de Tuohy, prueba para identificar el espacio epidural, rotación de la aguja, localización e intensidad de la cefalea, tratamiento conservador y/o invasivo más frecuente. La intensidad de la CPPD se valoró con la escala visual análoga (EVA) de 0-10, antes y después de la administración del tratamiento conservador e invasivo.
Análisis estadísticoLos datos se expresaron con medias y desviación estándar para variables cuantitativas, y frecuencias y porcentajes para variables cualitativas. Para la relación entre la EVA pre y postratamiento de la CPPD, se aplicó la prueba de la t de Student pareada e intervalo de confianza (95%), y significación estadística con un valor de p<0.05. Se utilizó el paquete SPSS versión 17 para el análisis estadístico.
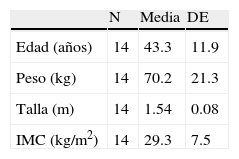
ResultadosDe 2,114 registros anestésicos de bloqueo epidural analizados, 58 sujetos tuvieron PAD. En 44 (2%) no ocurrió CPPD. Sin embargo, 14 (0.66%) presentaron cefalea, de los cuales, correspondieron al sexo femenino 10 (71.4%) y 4 (28.6%) al masculino. Las variables demográficas se muestran en la tabla 1. El mayor porcentaje de cefalea se presentó en mujeres en la quinta década de la vida (40%).
Se utilizó aguja de Tuohy calibre 16G (no desechable) en 6 (42.9%) y calibre 17G (desechable) en 8 (57.1%) sujetos. La aguja epidural se introdujo con una dirección transversal o perpendicular en 4 (28.6%) y longitudinal o paralela en 10 (71.4%) pacientes. El bisel se orientó cefálicamente en 5 (35.7%) sujetos, caudal en uno (7.1%), e indiferente en 8 (57.1%). Se utilizó la prueba de Pitkin (pérdida de la resistencia con aire) para identificar el espacio epidural en 11 (78.6%) procedimientos, y gota colgante de Gutiérrez en 3 (21.4%). La aguja de Tuohy se rotó únicamente en 2 (14.3%), una cefálica y una caudal. La localización de la cefalea correspondió a la región frontal en 12 (85.7%), occipital en 9 (64.2%) y temporal en 7 (50%) sujetos. Los síntomas asociados más comunes fueron náuseas en 6 (42.8%), mareo en 4 (28.5%), vómito en 2 (14.2%), acufenos en 3 (21.4%) y fosfenos en 2 (14.2%).
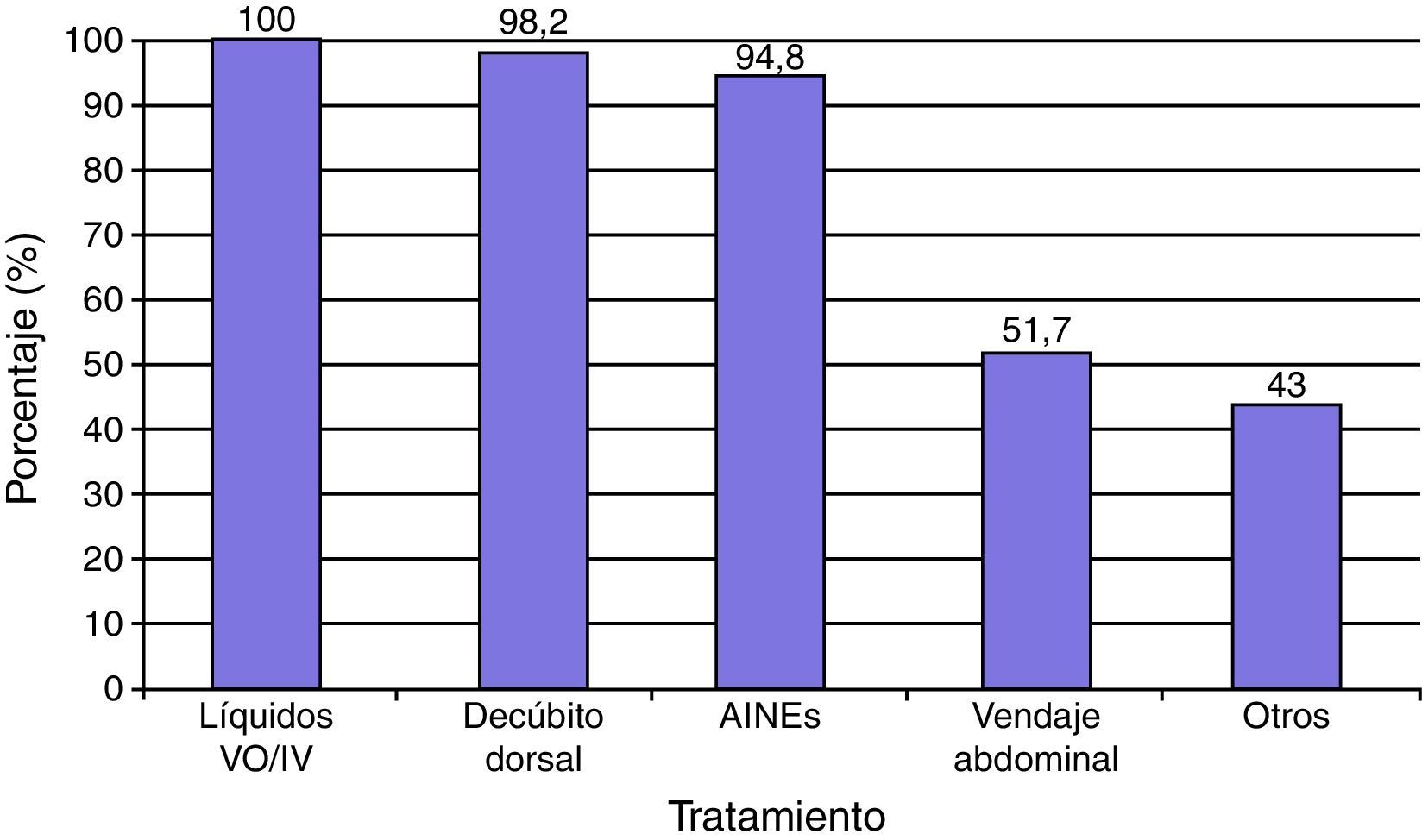
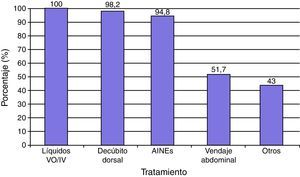
El tratamiento con medidas conservadoras para la PAD incluyó la administración de abundantes líquidos por vo y/o iv en el 100% de los casos, reposo en decúbito dorsal sin almohada en 57 (98.2%) y AINE (ketorolaco, metamizol, clonixinato de lisina) en 55 (94.8%) principalmente. Además se complementó el manejo conservador de la cefalea con vendaje abdominal en 30 (51.7%), y otras medidas como tartrato de ergotamina más cafeína (34.4%) y/o dexametasona iv (8.6%) en 25 (43%) casos (fig. 2). Se administró tratamiento conservador en los 58 sujetos con PAD y en 12 (20.6%) se aplicó PHEP. En este estudio las medidas conservadoras fueron efectivas en 34 (58.6%) casos. Las medidas conservadoras más PHEP en 9 (15.5%), el tratamiento conservador más parche hídrico en uno (1.7%), previnieron la aparición de sintomatología, y en 14 (0.66%) el tratamiento no fue efectivo en las primeras 24h.
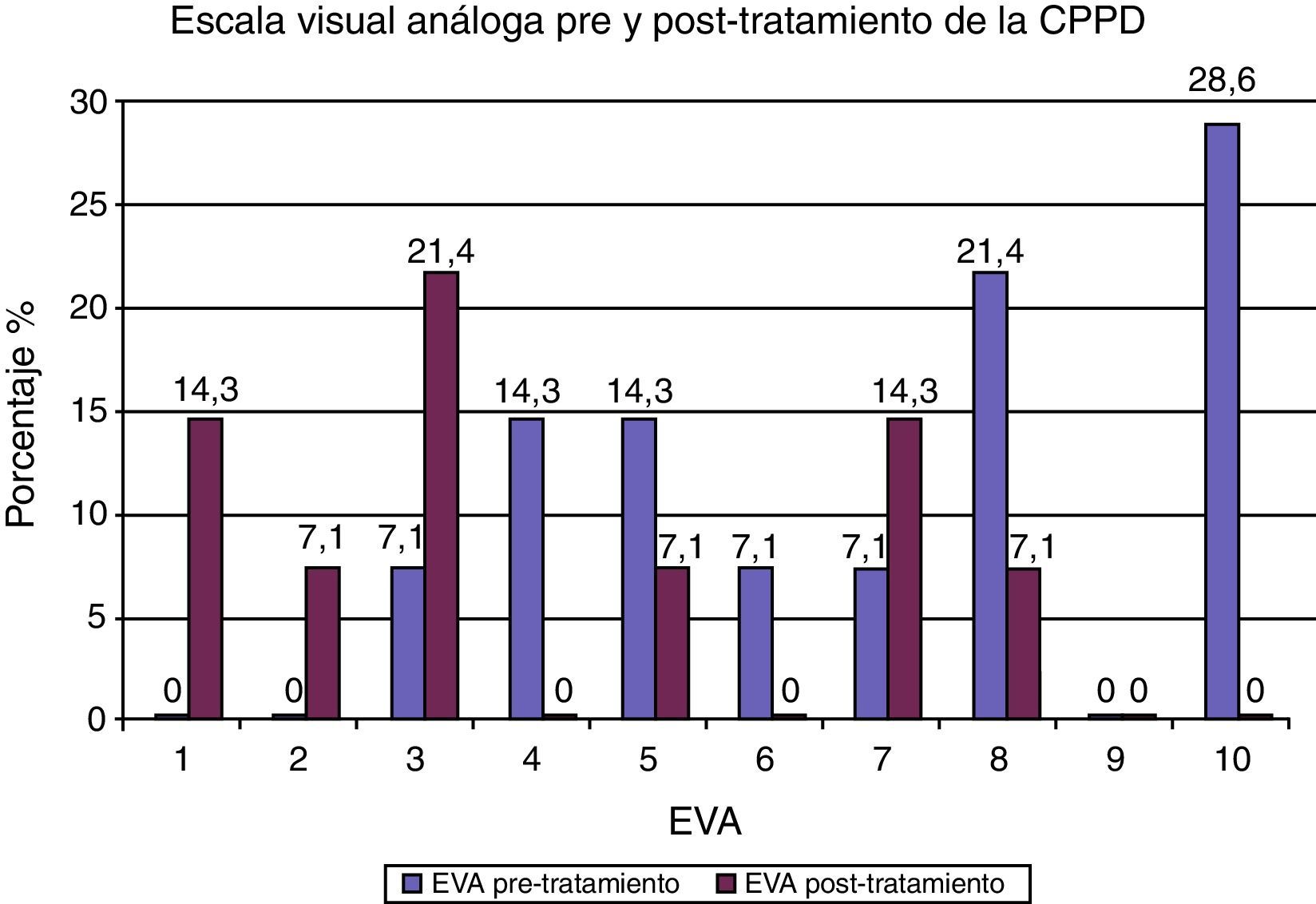
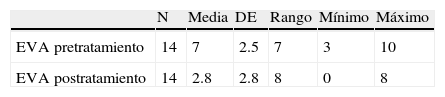
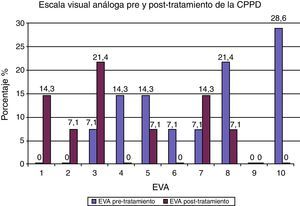
De los 14 casos con CPPD, 13 pacientes continuaron el tratamiento conservador, con disminución o desaparición de la cefalea. Solamente en uno (7.1%) se utilizó tratamiento invasivo por presentar cefalea con una EVA de 10, y consistió en la administración de PHE con 8ml de sangre autóloga, sin resolución de la cefalea (EVA de 7). La media de la cantidad de sangre autóloga utilizada en los PHEP fue de 16.5±4.8, con un rango de 15 (5-20). De los 12 PHEP, en 9 (75%) no se presentó cefalea. Sin embargo, en 2 (16.6%), utilizando cantidades de 15 y 20ml de sangre autóloga se originó cefalea, y un caso (8.3%) de PHEP, en el que se administró 5ml, requirió la aplicación de un segundo parche con una cantidad de 10ml. Para la medición de la cefalea se utilizó la EVA. En el tabla 2 se muestran los resultados pre y postratamiento, observando una media de 7±2.5 de intensidad de cefalea antes del tratamiento y una media de 2.8±2.8 después del tratamiento conservador e invasivo. En la figura 3 se muestra que el mayor porcentaje correspondió a un valor de 10 (28.6%) de EVA antes del tratamiento, y después de administrar las medidas conservadoras e invasiva (parche hemático), la cefalea se resolvió en 4 (28.6%) sujetos con EVA de 0, permaneciendo con una cefalea leve (EVA de 1 a 3) 6 (42.8%) sujetos, moderada (EVA de 5) uno (7.1%), y severa (EVA de 7 y 8) 3 casos (21.4%).
Al relacionar la CPPD con la EVA antes y después del tratamiento se obtuvo una media de 4.1±3.06, con un intervalo de confianza al 95% de 2.37-5.91) y una p=0.0001.
DiscusiónLa perforación accidental o inadvertida de la duramadre durante la colocación del bloqueo epidural origina CPPD, complicación que se presenta en un 70-80% de los sujetos7,8, porcentaje muy superior al que se observó en el presente trabajo que fue de 0.66%. Este porcentaje probablemente fue bajo debido a que se administraron medidas conservadoras a todos los pacientes que presentaron PAD, y en algunos de ellos además se colocó PHEP, tratamiento que evitó la aparición de cefalea. Se reporta una frecuencia elevada de CPPD en mujeres principalmente obstétricas. Sin embargo, si se excluye a estas pacientes, la frecuencia permanece alta comparada con los hombres26, particularmente en el grupo de edad entre los 18-30 años27. En este estudio no se incluyeron pacientes obstétricas y la frecuencia de CPPD fue mayor en mujeres en la quinta década de la vida.
En un ensayo aleatorizado y prospectivo se determinó la incidencia de CPPD, comparando la aguja de Tuohy 17G y 18G (Sprotte), y se observó que esta complicación es menor con la aguja de calibre 18G4. En esta investigación se utilizaron 2 tipos de aguja de Tuohy, y se notó que con el incremento del diámetro o calibre de la aguja epidural había mayor frecuencia de cefalea. Norris et al. reportaron el desarrollo de CPPD en un 70% con dirección perpendicular de la aguja para identificar el espacio epidural y en un 24% con dirección longitudinal o paralela28, y los resultados de un metaanálisis indican que la inserción de la aguja en sentido longitudinal reduce la CPPD29, a diferencia de lo encontrado en este trabajo en el que se encontraron más sujetos con cefalea al introducir la aguja en sentido longitudinal (71.4%), y al utilizar la prueba de pérdida de la resistencia de Pitkin para localizar el espacio epidural. Sin embargo, de acuerdo al tamaño de la muestra (14 registros), no son concluyentes estos resultados con la presentación de cefalea. En modelos de punción lumbar, no se encuentran diferencias significativas al comparar la orientación del bisel de la aguja epidural30.
La localización más común de CPPD fue en la región frontal, seguida de la occipital, asociadas frecuentemente con náuseas y mareo, resultados similares a los reportados por Turnbull y Shepherd5. Sin embargo, un estudio en 88 pacientes reporta un predominio occipital y/o suboccipital31.
La administración de líquidos vo y/o iv, el reposo absoluto en posición de decúbito dorsal y los AINE fueron los tratamientos conservadores más utilizados. Existe controversia con la posición de decúbito dorsal sin almohada, no obstante, en este estudio al adoptar esta postura disminuyó la cefalea en todos los sujetos. Con las medidas conservadoras empleadas como abundantes líquidos, decúbito dorsal sin almohada y AINE se resolvió la cefalea en la mayoría de los casos, a diferencia de otras series en donde no se demuestra una eficacia con el decúbito dorsal y la fluidoterapia32. Si el tratamiento conservador no resuelve la sintomatología, se utiliza tratamiento invasivo. El estándar de oro para la CPPD es el PHE debido a que restablece la dinámica del líquido cefalorraquídeo con datos de éxito del 70-98%33. En este trabajo se administró PHEP en 12 sujetos, obteniéndose resultados satisfactorios en 9, a diferencia de lo reportado en datos recientes, en un ensayo controlado aleatorizado donde los efectos con el PHEP no fueron significativos21,34. El volumen de sangre autóloga efectivo para la administración epidural es controversial y muy variado; se han propuesto cantidades que oscilan entre 10 y 30ml7,35. Un estudio comparó la eficacia del PHE con 7.5 y 15ml de sangre por el catéter epidural, y concluyeron que con 7.5ml la analgesia es comparable con 15ml, sin embargo, la irritación de la raíz nerviosa fue menor en el momento de la inyección con 7.5ml36. La cantidad utilizada en este estudio varió de 5 a 20ml, obteniéndose mayor efectividad con 15 y 20ml empleados en los PHEP, cantidad similar a la utilizada en estudios controlados21. En los que se usó 8 y 5ml de sangre, la efectividad fue menor, uno de ellos requirió un segundo PHE con 10ml y hubo desaparición posterior de la sintomatología. El tratamiento conservador e invasivo disminuyó significativamente la CPPD. Un estudio realizado por Sandesc et al. demostró disminución significativa de la intensidad de la CPPD mediante la EVA a las 2 y 24h posteriores a la colocación del PHE en comparación con el tratamiento convencional (p<0.0001)33,37. Un estudio prospectivo y observacional analizó 504 casos con PHE, reportando mejoría completa en un 75%, alivio incompleto en un 18% y falla después del parche hemático en un 7%20.
En el presente análisis, después del PHEP, se obtuvo un alivio completo de la sintomatología en el 75% de los casos. Un estudio aleatorizado doble ciego concluyó que el PHEP acorta la duración de los síntomas de la CPPD21. Se reporta la aplicación de un segundo PHE en un 5-50%38.
Nuevas líneas de investigación se introducen como otras alternativas de tratamiento para la CPPD. Estudios no aleatorizados sugieren la eficacia del frovatriptán oral para la prevención de la cefalea39. Otros fármacos como el maleato de metilergonovina40, teofilina41, mitazapina42 y gabapentina43, tienen poca evidencia clínica. En situaciones patológicas que contraindiquen parcial o absolutamente el PHE, se publica la utilización del parche de gelatina epidural en plasma autólogo para sellar la fuga de líquido cefalorraquídeo y como puente en defectos de la duramadre44, y el adhesivo de fibrina epidural, que consiste en la inyección epidural de trombina-fibrinógeno, con la ventaja de que se utiliza menos volumen, y la coagulación es más rápida45. El cierre quirúrgico del orificio dural es el último recurso si los otros tratamientos fracasan.
ConclusionesLa CPPD es un evento adverso del bloqueo neuroaxial que se presentó en un porcentaje bajo de pacientes, con predominio en el sexo femenino en la quinta década de la vida. La utilización de agujas epidurales de menor tamaño, la forma y la dirección del bisel en relación con las fibras de la duramadre deben considerarse para disminuir la incidencia de CPPD. La localización más común de la cefalea fue en la región frontal y occipital, acompañada con sintomatología como náuseas y mareo. El tratamiento conservador previene la aparición de la cefalea. No obstante, la diversidad de las combinaciones utilizadas en el tratamiento de la CPPD en este estudio, las medidas conservadoras como la administración de líquidos, el decúbito dorsal y los AINE, además de métodos invasivos como el PHEP, integran un tratamiento eficaz para la CPPD.
Conflicto de interesesLa autora declara no tener ningún conflicto de intereses.