¿ Introducción
La placenta humana (PH) representa la unión entre la madre y el producto de la fecundación. Su integridad durante el embarazo, es de vital importancia para la salud fetal y se conecta al feto a través del cordón umbilical (CU), estructura anatómica con ausencia de capilares y vasos linfáticos, pero que contiene una vena y dos arterias umbilicales imprescindibles para el intercambio gaseoso y paso de nutrientes de la madre al producto intrauterino.1 El CU en un embarazo de término, pesa en promedio 40 g, tiene una longitud de 60 a 65 centímetros y un diámetro de 1.5 cm.2,3
En el CU se encuentra la gelatina de Wharton o tejido conectivo embriónico que también participa en la circulación sanguínea y es abundante en células inmaduras con capacidad de diferenciación multipotente.4,5
Tanto a la PH como al CU se les consideró por muchos años un material de desecho posparto; sin embargo, a partir de las investigaciones realizadas en los años sesenta han adquirido importancia en la medicina regenerativa principalmente en trasplantes y actualmente en la terapia celular, debido a que se descubrió su potencial celular para regenerar la médula ósea dañada y otros tejidos.6-8
¿ Antecedentes históricos
Los primeros informes sobre el uso de células de CU en trasplante de médula ósea, datan de 1972 cuando Ende y Ende infundieron en un paciente de 16 años con leucemia aguda linfoide, sangre de CU obtenida de ocho donadores, y aunque no reportan que se haya presentado una reconstitución inmunológica prolongada, si refieren que hubo cambios en los antígenos de los eritrocitos probablemente debido a quimerismo celular. Sin embargo, dicho concepto no se conocía entonces.9 Secundario a este reporte se inician trabajos de investigación para determinar las cualidades biológicas de la SCU. En 1974 Knudtzon publicó en la revista Blood la existencia de "colonias celulares hematopoyéticas" aisladas de cordón umbilical con comportamiento en cultivos celulares diferente a lo conocido en esa época y predice se trate de células progenitoras.10 Siguieron algunas investigaciones en el campo pero fue hasta 1982 cuando Nakahata y colaboradores corroboraron esta hipótesis al aislar células progenitoras capaces de originar las tres líneas celulares hematológicas.11
Koike y Besalduch-Vidal demostraron que las células aisladas de SCU son capaces de mantener su viabilidad y capacidad hematopoyética después de ser mantenidas a muy bajas temperaturas, por lo que podrían ser utilizadas en trasplantes de médula ósea.12,13 Boyse y colaboradores realizaron los primeros estudios en modelos animales y consideraban que una cantidad pequeña de SCU, sería suficiente para trasplante.14 Hasta esa fecha no se conocía cuanto tiempo podrían permanecer las células congeladas, ni tampoco un método de congelamiento confiable. Broxmeyer y su equipo establecieron a finales de los años ochenta el procedimiento para recolectar y almacenar SCU para uso en humanos.15
En octubre de 1988 Matthew Farrow, un hombre con anemia de Fanconi, fue trasplantado con SCU por el equipo de la Dra. Eliane Gluckman en el Hospital St. Louis en París. Las células trasplantadas fueron capaces de reconstituir la función hematopoyética de la médula ósea que previamente fue sometida a quimio-ablación con ciclofosfamida e irradiación.16
Posterior a estos resultados, se originaron los Bancos de Sangre de Cordón Umbilical. En 1990 iniciaron operaciones los primeros bancos de SCU en Milán, Italia; Dusseldorf, Alemania; y Nueva York, EUA, en este último se instituyeron los primeros lineamientos para su función, tales como la recolección, procesamiento y congelamiento de unidades de SCU, además se establecieron los aspectos éticos relacionados al procedimiento. 17-19
¿ Propiedades biológicas de las células progenitoras de CU
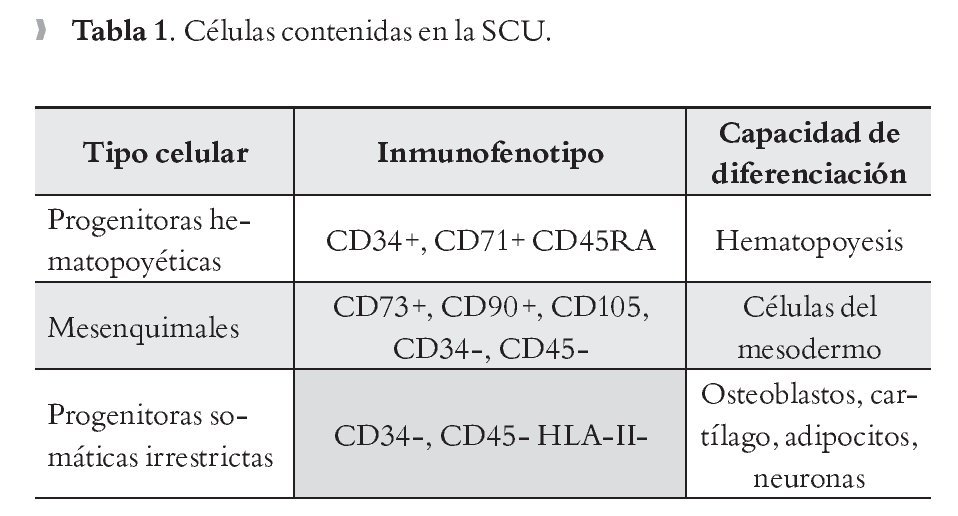
En la sangre de cordón umbilical, además de encontrarse una cantidad considerable de CPH, pueden detectarse otras células con potencial para su uso terapéutico, como son las células endoteliales20 y mesenquimales21,22 que juegan un papel importante en la reconstitución hematopoyética23,24 y las células progenitoras somáticas irrestrictas,25 que tienen capacidad de diferenciarse en células de las tres capas embrionarias.26,27 En la Tabla 1 se muestran las características específicas de cada tipo celular.
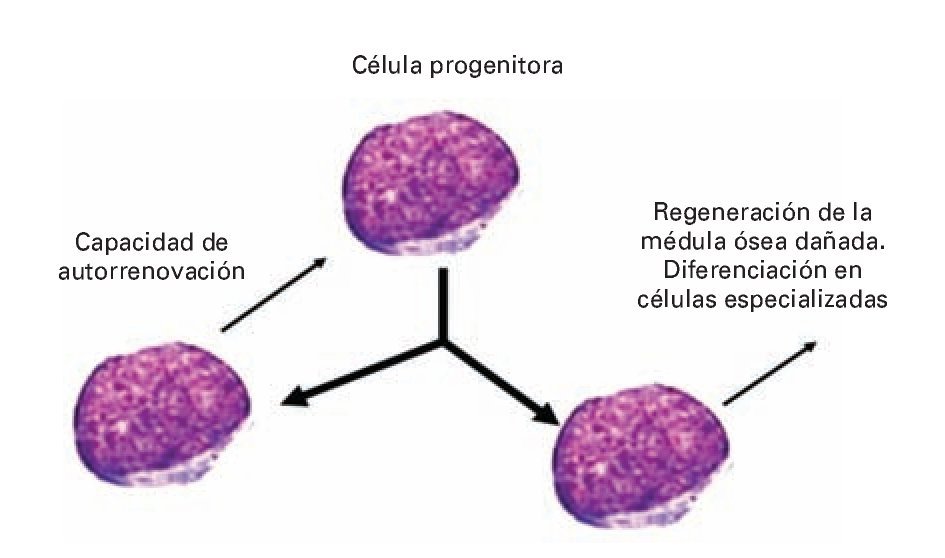
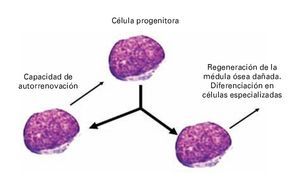
La célula tallo o progenitora, es de tipo indiferenciado y en el proceso de división, da origen a dos células: una célula hija progenitora capaz de diferenciarse en células especializadas para formar tejidos del organismo humano, y una célula progenitora que se auto-renueva manteniendo así el número adecuado de células troncales de reserva. Esto es la denominada división asimétrica de la célula progenitora (Figura 1).28,29
¿ Figura 1. División asimétrica de la CPH.
La célula progenitora mejor estudiada es la hematopoyética (CPH), ésta produce hasta un trillón de células sanguíneas diferenciadas (leucocitos, eritrocitos, plaquetas) por día, durante la vida de un organismo.30 El antígeno CD34+ es una glucoproteína que se expresa normalmente en la membrana de 1% a 2% de las células mononucleares de la médula ósea. Este antígeno es específico para reconocer a las CPH y disminuye su expresión conforme la célula madura y va perdiendo su capacidad de autorrenovación y proliferación.31
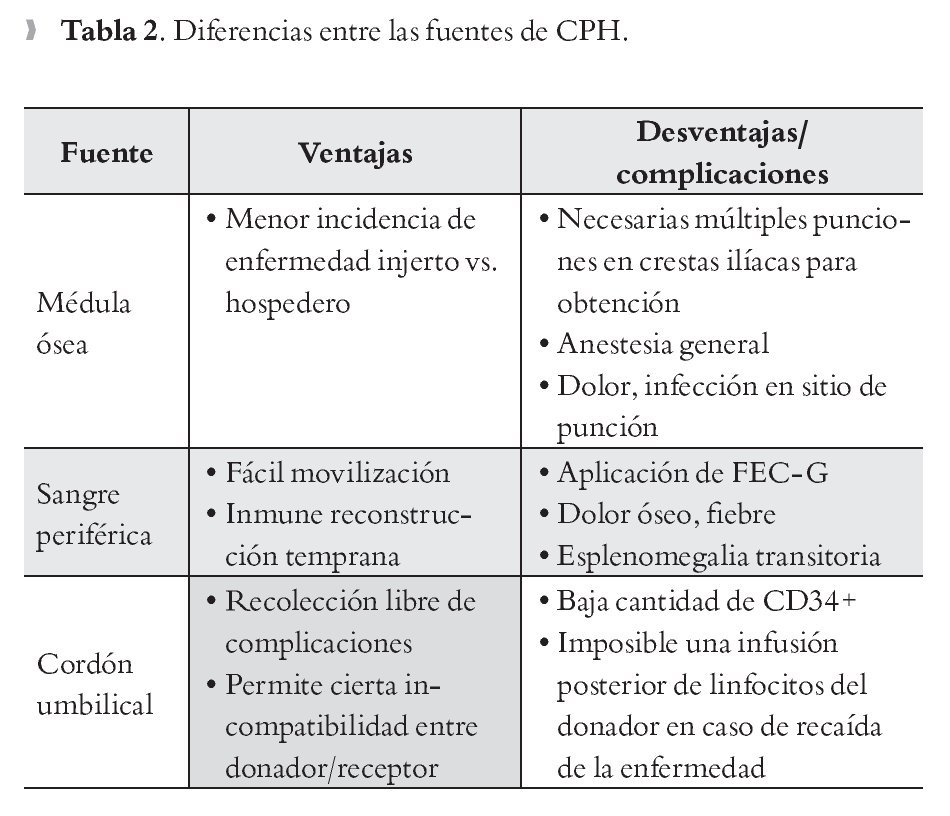
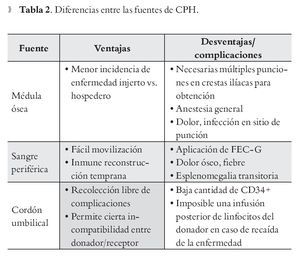
Además de la SCU, las células progenitoras hematopoyéticas pueden obtenerse de la médula ósea y de la sangre periférica,32 en el último caso es necesario aplicarle al donador factor estimulante de colonias de granulocitos (FEC-G), para estimular la producción de elastasas y catepsinas por parte de los neutrófilos y de esta forma movilizar; es decir, romper el sitio de unión, o sea la molécula CXCR433 de la célula madre, con el estroma de la medula ósea liberando así las células CD34+ a la circulación sanguínea para posteriormente, por medio de un procedimiento de aféresis, estas células son seleccionadas o cosechadas para ser infundidas al paciente.34 El FEC-G no sólo provoca la movilización de las células progenitoras a la circulación, sino que además induce su proliferación con un efecto máximo a las 48 horas de aplicado en el donador.35 La diferencia principal entre las tres fuentes de células progenitoras hematopoyéticas, es la cantidad de células CD34+ que recibe el paciente. El promedio es de 5 x 106 por kilo de peso corporal cuando se obtienen de sangre periférica, esta cantidad se reduce a 3 y 0.3 x 106 en el caso de médula ósea y de SCU respectivamente. Esto influye en el retraso de la recuperación inmunológica posterior al trasplante.32
Otras diferencias se resumen en la Tabla 2.36,37
¿ SCU en la regeneración de la médula ósea
Muchas enfermedades son potencialmente tratadas con trasplante de SCU, entre éstas se encuentran principalmente las leucemias agudas, aunque su uso abarca inmunodeficiencias, tumores sólidos, enfermedades metabólicas congénitas y hemoglobinopatias.38 Además de las diferencias ya mencionadas, la SCU tiene características propias que la hacen una atractiva materia prima en los trasplantes de médula ósea. El tiempo de espera para encontrar unidades de CPH de SCU compatibles es corto (una a dos semanas) ya que éstas se encuentran congeladas y validadas para el trasplante.39 Los linfocitos contenidos en la SCU presentan inmadurez inmunológica, es decir aún no han estado en contacto con antígenos, por lo que son menos reactivos, con lo cual la incidencia de enfermedad injerto contra hospedero es menor;40 esta cualidad permite además incompatibilidad hasta en dos antígenos del complejo principal de histocompatibilidad.41 La posibilidad de infección por Citomegalovirus y el virus de Epstein Barr es mínima o ausente en la mayoría de los casos. Todos estos factores contribuyen de forma positiva en los resultados del trasplante de médula ósea con SCU.42 Sin embargo, hay una limitante: la baja cantidad de células CD34+, lo que restringe su uso casi exclusivamente para pacientes pediátricos o aquellos con peso corporal máximo de 35 kilogramos. Aunque se han ideado técnicas para superar esta limitante, tales como el uso de dos unidades de CPH de SCU (doble cordón),43,44 la expansión celular ex vivo45, 46 y el trasplante haploidéntico.
Los resultados óptimos dependen también de factores inherentes al paciente como son el estado físico, tipo y estado de la enfermedad.47 Pero sin duda, la cantidad de células trasplantadas, tanto de células nucleadas totales (CNT) como de CD34+, es el punto crítico para la elección de la unidad de CPH de sangre de CU adecuada para cada paciente.48 Aún hay controversia en cuanto al número idóneo de células a infundir, mientras que algunos autores consideran que el número total de CD34+ es el de mayor peso para elegir una unidad de CPH otros consideran que la cantidad de CNT es la que debe tomarse en cuenta.
¿Células nucleadas totales
Las recomendaciones para la criopreservación de SCU están regidas principalmente por NETCORD, una asociación internacional que agrupa a los bancos de sangre de cordón umbilical que cumplen con los estándares de calidad adecuados. Entre otras, NETCORD tiene la función de actualizar el inventario de unidades de CPH disponibles a nivel mundial para uso en trasplante. Dicha asociación establece en su reglamentación criopreservar unidades con una cantidad mínima de células nucleadas totales de 3 x 107. Para la infusión, la dosis recomendada es de 2.5 x 107 por kilo de peso corporal (KPC) del paciente (rango de 1.7 x 107 a 3.7 x 107).49 Dosis menores a 1.7 x 107 se relacionan con falla del injerto con una probabilidad de 75% de muerte, mientras que cuentas mayores de 3.7 x 107, se asocian a grados severos de EICH.50
¿ Células CD34+
La dosis promedio a infundir es de 3.7 x 106 KPC con cantidades mínimas y máximas de 2.0 x 106 y 5.0 x 106 respectivamente.51 De igual manera que para las CNT, las dosis menores están relacionadas con una recuperación de la cuenta de neutrófilos muy prolongada (más de 35 días), con alta posibilidad de complicaciones infecciosas, por el contrario los pacientes que reciben dosis mayores a las recomendadas presentan una alta incidencia de EICH severa (III - IV) con una elevada mortalidad.52
¿ Trasplante de doble cordón umbilical
El primer trasplante de este tipo fue realizado en adultos en el Hospital Universitario de Minnesota EUA. El trasplante de dos unidades de CPH logra injertos en más de 57% de los casos.53 Como regla, la suma de la celularidad de ambas unidades de CPH debe ser estar en los rangos establecidos en los lineamientos de NETCORD previamente mencionados. Al infundir al menos una unidad con "buena celularidad" (lo mínimo en CNT o CD34+) junto con una con "celularidad deficiente", esta última permite el injerto de la primera.54 Finalmente la hematopoyesis, en la mayoría de los casos, sólo provendrá de la unidad de CPH con mayor celularidad aunque hay reportes médicos en los cuales la unidad de CPH con menor celularidad es la que injerta, esto ocurre entre la cuarta y sexta semana posterior al trasplante corroborado por las pruebas de quimerismo. En la mayoría de los casos no es predecible cuál de las dos unidades trasplantadas, injertará.55
En pacientes con leucemia aguda se recomienda actualmente, independientemente de la celularidad, el trasplante de doble unidad de CPH dado que se produce un efecto injerto contra tumor mayor (los linfocitos del donador destruyen células tumorales residuales en el paciente), disminuyendo así la posibilidad de recaída.56 En pacientes con enfermedades hematológicas benignas, no hay beneficio del trasplante de doble unidad de CPH, en éstos la recomendación es el trasplante de una sola unidad con la celularidad adecuada e histocompatibilidad de 100%.57
¿ Expansión celular ex-vivo y aplicación intraósea directa de CPH
Las CPH de SCU muestran proliferación acelerada cuando son incubadas con determinadas citocinas in-vitro.58 En el año 2002 Shpall y colaboradores demostraron la factibilidad de esta técnica y aunque inicialmente no hubo diferencias notables en la reconstitución inmunológica entre pacientes transplantados con y sin expansión celular, esto produjo mayor investigación en el campo.59 Posteriormente se demostró que el trasplante de dos unidades de CPH, una expandida ex-vivo y otra sin manipulación, sí provocaba una recuperación en la cuenta de neutrófilos de forma temprana. Actualmente se estudia cual es la mejor combinación, cantidad y tiempo de exposición de citocinas para mejorar la expansión.60,61
Con la idea de evitar el desperdicio de células CD34+ en su recorrido por la circulación sanguínea hasta llegar a la médula ósea, algunos grupos de trasplantes las están inyectando directamente en el hueso de los pacientes.62 No obstante, se reporta una disminución en la incidencia de EICH, no hubo diferencias significativas en el injerto de neutrófilos comparado con pacientes que recibieron la infusión intravenosa.63
Aún se requiere perfeccionamiento en la técnica, o quizás combinarla con infusión intravenosas paralela o expansión celular.
¿ Reconstitución inmunológica
Una de las principales desventajas del TCPH de SCU es el retardo en la reconstitución inmunológica; es decir, la recuperación del sistema inmunológico en el paciente.64 Mientras que el injerto mieloide (neutrófilos) ocurre alrededor del día 14 en pacientes trasplantados con médula ósea (MO), éste se retrasa hasta el día 22 en pacientes que reciben SCU. Respecto al injerto de plaquetas este se presenta al día 30 y 52 en pacientes trasplantados de MO y SCU respectivamente.65,66 Es por ello la importancia de una estricta terapia antimicrobiana, antimicótico y antiviral, así como apoyo transfusional intensivo en pacientes trasplantados de SCU.
¿ La histocompatibilidad
Al grado de similitud entre los antígenos de leucocitos humanos (HLA) expresados en las superficies celulares entre receptor y donador se le llama histocompatibilidad. El sistema HLA se encarga de reconocer lo propio de lo ajeno en el organismo. Los genes que codifican para HLA se localizan en el brazo corto del cromosoma 6. Existen, referido a histocompatibilidad, dos clases de HLA: I y II. Los HLA clase I se expresan en casi todas las células nucleadas del cuerpo humano, mientras que los HLA clase II se encuentran casi exclusivamente en células que participan en la presentación de antígenos a los linfocitos T; es decir, células dendríticas, monocitos y linfocitos B.67
Cuando hay discordancia de las moléculas de HLA entre receptor y donador, se produce rechazo del injerto y EICH severa, ya que los linfocitos del donador reconocen las moléculas HLA extrañas en el receptor.68
La posibilidad de incompatibilidad en el HLA entre donador y paciente es una de las ventajas que ofrece el uso de CPH de CU. En comparación con CPH de médula ósea y sangre periférica movilizada, en las cuales la compatibilidad debe ser de 100% para garantizar el injerto y evitar EICH severa, la disparidad hasta en dos alelos, es decir una compatibilidad en cuatro de seis alelos entre donador y paciente no influye de manera significativa en la incidencia de EICH.41,69 Se recomienda por lo menos, la tipificación de antígenos HLA Clase-I A y B y Clase-II DR para búsqueda de unidades compatibles. Una compatibilidad de 100% o 6/6 (los seis alelos del donador corresponden a los seis alelos del paciente) permite que se infundan unidades de CPH con mínima celularidad, mientras que en una compatibilidad 4/6 la cantidad de células a infundir debe ser la máxima recomendada.70
¿ Conclusiones
A veinte años de iniciado el trasplante de médula ósea de SCU, mucho se ha descubierto: la biología de la CPH, existencia de otros tipos celulares, el uso de doble cordón y la expansión celular. Todavía quedan sin embargo, problemas por resolver, sobretodo en el trasplante de adultos, para quienes superar la baja celularidad es un punto crítico. Se están llevando a cabo nuevos procedimientos tales como el trasplante de tres unidades de CPH en conjunto con inmunoterapia con células NK,71 el uso conjunto de células mesenquimales,72 y la utilización de una unidad de CPH de SCU y CPH de sangre movilizada de otro donador.73,74
Correspondencia: Efreen Horacio Montaño Figueroa.
Centro Nacional de la Transfusión Sanguínea. Avenida Othón de Mendizábal 195, Col. Zacatenco, Del Gustavo A. Madero. México, D. F.
Teléfono: 5119 4620, Extensión: 1313.
Correo electrónico:herrefreen@hotmail.com