Introducción: México ocupa el primer lugar mundial en obesidad infantil, en parte debido a la vida sedentaria y al tipo de alimentos que ingieren los niños.
Objetivo: En este estudio se determinan las alteraciones metabólicas en ratas Wistar.
Métodos: Estudio experimental en ratas Wistar, desde el destete se les alimentó con comida balanceada más botanas o comida "chatarra". El grupo control se alimentó con una dieta normal (Chow y agua) y el grupo experimental con una dieta control más botanas (aros de harina y refresco) durante 26 semanas. Los alimentos sólidos, la ingesta de líquidos y el peso corporal se cuantificaron semanalmente. Los triglicéridos y el colesterol plasmáticos se midieron y se realizó una prueba de tolerancia a la glucosa por grupo. El diámetro abdominal y la cantidad de grasa intraperitoneal fueron comparados entre grupos.
Resultados: Las ratas prefirieron una dieta alta en calorías, lo que resultó en aumento de peso corporal, diámetro abdominal, grasa intraperitoneal y originó intolerancia a la glucosa.
Conclusiones: Este estudio indica que la comida chatarra genera un estado prediabético en la rata Wistar. Aún cuando se trata de un modelo animal, este podría dar una idea de los efectos que en los niños mexicanos pudiera tener la ingesta de comida chatarra.
Introduction: Mexico ranks first worldwide in childhood obesity, in part because of the sedentary lifestyle of children and type of snacks they eat.
Objective: The aim of this study was to determine the metabolic alterations in Wistar rats.
Methods: experimental study with Wistar rats, from weaning who were fed with balanced meal and snaks or junk food. The control group was fed with a normal diet (Chow and water), while the experimental group was fed with a high-calorie diet that consisted of the control diet plus snacks (flour rings and soda) for 26 weeks. Solid food, fluid intake and body weight were measured weekly. The plasma cholesterol and triglycerides were measured and a test of tolerance to glucose was carried out per group. Also, the diameter and the amount of intraperitoneal fat were compared between groups.
Results: The results show that rats prefer a high-calorie diet, resulting in an increase in body weight, abdominal diameter, intraperitoneal fat and a glucose intolerance.
Conclusions: This study indicates that junk food promotes a prediabetic state in Wistar rats. Although this is an animal model that could provide awareness into the effects that might result from the intake of junk food in Mexican children.
• Introducción
La obesidad se ha incrementado en todo el mundo, a tal punto que se ha convertido en una epidemia con consecuencias adversas para la salud de la población. En México, este problema se observa, particularmente, en los niños de primaria y secundaria. El Instituto Mexicano de Salud reporta que los niños en edad escolar que tienen sobrepeso o son obesos pueden desarrollar cambios metabólicos, que pueden resultar tanto en problemas cardiovasculares como en diabetes mellitus tipo 2.1 En México, el aumento de peso en los niños es alarmante. Así, el Instituto Nacional de Salud Pública ha reportado un 77% de aumento de peso en los niños y el 47% en las niñas, en los últimos años.1-3 Esta epidemia incluye también a los adultos. Se ha informado que en la población mexicana el 62% de los hombres entre 20-59 años de edad y el 70% de las mujeres de la misma edad, tiene algún grado de sobrepeso u obesidad.4 Así, México ocupa mundialmente, el primer lugar en obesidad infantil y el segundo lugar en obesidad en adultos.5 El incremento de peso y la obesidad, no necesariamente están asociados a cambios metabólicos que resulten en patologías. Sin embargo, en México, un porcentaje alto de jóvenes obesos desarrollan síndrome metabólico (SM),6 de acuerdo a los criterios establecidos por The National Cholesterol Education Program's Adult Treatment Panel III (ATP III).7
En el desarrollo del SM pueden contribuir factores genéticos y ambientales, como el estilo de vida sedentario y la dieta desequilibrada (baja en proteínas y vitaminas y alta en carbohidratos y/ o grasas saturadas). El aumento de peso en los niños se debe principalmente a sus hábitos alimentarios, la mayoría de los niños prefieren ingerir refrescos que agua, y los alimentos fritos y de harina refinada sobre las verduras y frutas. En este sentido, durante los últimos 20 años en México, el consumo de refrescos ha aumentado en un 37%, lo que sin duda ha favorecido el aumento de peso de los mexicanos.8 El refresco de cola tiene 10.6% de azúcar y una lata de 350 mL contiene aproximadamente 37.1 g de azúcar, equivalentes a 137 kcal. Cada l00 g de frituras (aros de harina) son equivalentes a 354 kcal, la ingesta de ambos productos, representan casi 500 kcal, si se ingieren en una única porción. Por lo tanto, la obesidad en el mexicano puede estar asociada con un alto consumo de comida chatarra rica en carbohidratos (harina, refrescos), grasa y sal. Con base a estos antecedentes, el objetivo de este trabajo es establecer los cambios en el metabolismo de ratas Wistar quienes desde recién destetadas son sometidas a una dieta normal más comida chatarra (refresco de cola y aros de harina), similar a la que la mayoría de los niños mexicanos comen en el descanso durante el día escolar.
• Métodos
Se utilizaron 20 ratas macho Wistar, recién destetadas de 21-25 días de edad. Los animales fueron separados al azar en dos grupos y mantenidos a temperatura controlada (25 ± 2°C) y ciclos de luz/oscuridad (12:12). Los animales del grupo control tuvieron libre acceso a agua y alimento (Purina Rat Chow 5001). El grupo experimental tuvo libre acceso a Purina Rat Chow 5001, aros de harina, agua y refresco de cola diluido al 20%. A este tipo de dieta se sometieron durante 26 semanas. Semanalmente, en ambos grupos se determinó: el peso corporal, cantidad de alimento sólido ingerido, purina y/o aros de harina (g/rata/día) y la ingesta de agua y/o refresco ingerido (mL/rata/día). Transcurridas las 26 semanas, los animales de ambos grupos, en ayuno de 12 horas, fueron anestesiados y se les midieron los niveles de colesterol y de triglicéridos en plasma y se realizó una curva de tolerancia a la glucosa. Todos estos parámetros fueron medidos con un instrumento Accutrend® GCT (Roche).9 Finalmente, los animales se sacrificaron con anestesia profunda (pentobarbital sódico), se midió el diámetro abdominal, se retiró toda la grasa intraperitoneal (grasa epidídimal, retroperitoneal y visceral) y fue pesada. 10 La prueba estadística utilizada para determinar las diferencias en los parámetros analizados fue la t-Student (p<0.05).
Prueba de tolerancia a la glucosa
La prueba de tolerancia a la glucosa se realizó en ratas con ayuno por 12 horas, a estas se les inyectó vía intraperitoneal, glucosa (3 g/Kg); después de la inyección, se midió la glucosa en sangre de la vena de la cola a los 0, 60 120 y 180 minutos con un glucómetro Accutrend® GCT y tiras reactivas. 9
La prueba estadística utilizada fue una t-Student (p<0.05)
El manejo y el cuidado de animales se basaron en las normas de National Research Council que dictan el cuidado y uso de animales de experimentación, y bajo los protocolos, locales, aprobados por el comité de Investigación y Ética de los derechos de los animales de la Universidad Nacional Autónoma de México.
• Resultados
Ingesta de líquidos y sólidos
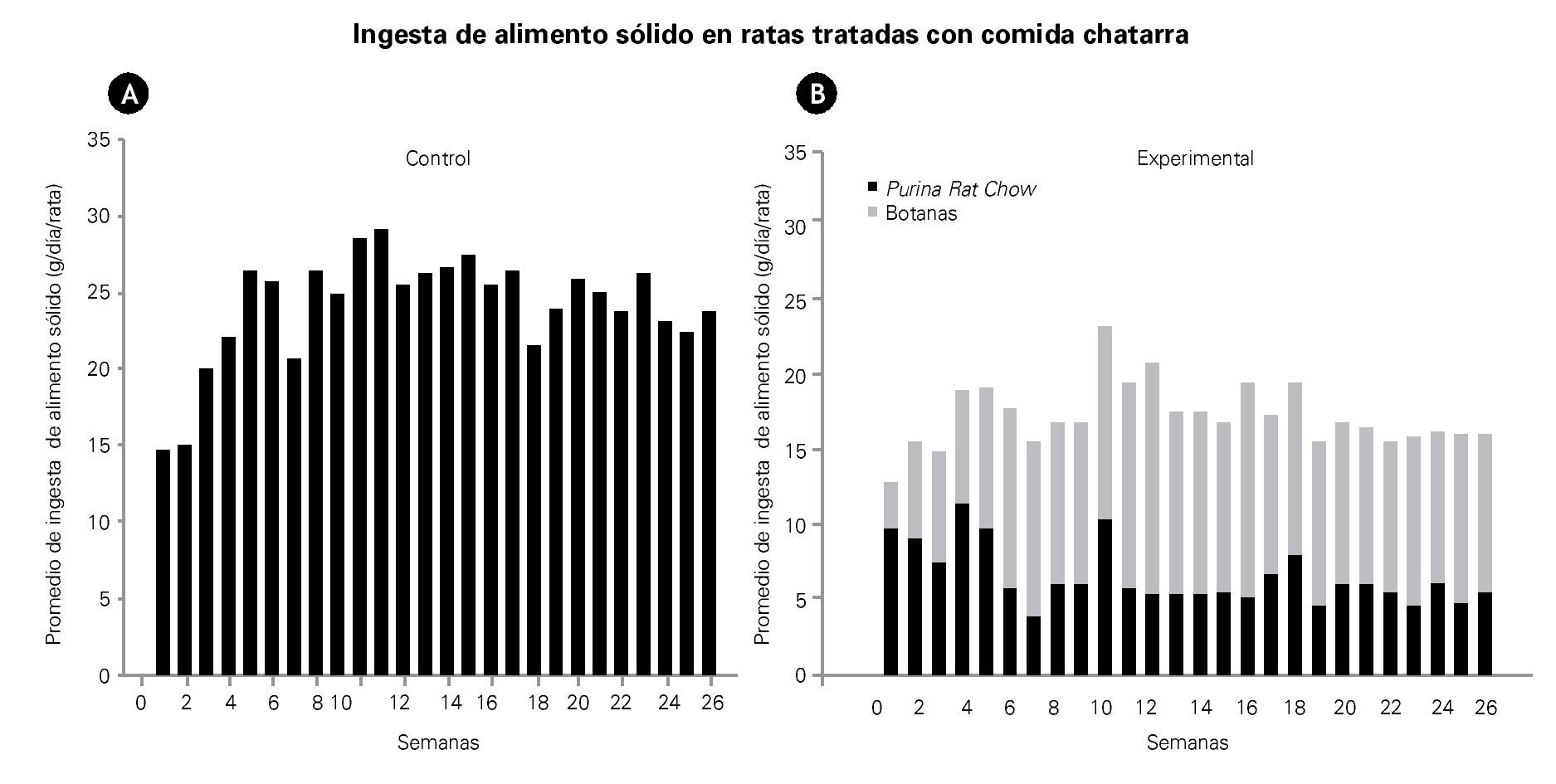
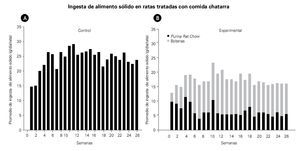
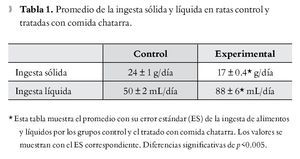
El consumo promedio de alimento sólido, en el grupo control, fue de 24 ± 1 g/rata/día, mientras que en las ratas experimentales, fue de 17 ± 0.4 g/rata/día con una diferencia significativa de p<0.005. La Figura 1 ilustra la ingesta de alimentos sólidos. El grupo experimental consume un mayor porcentaje de aros de harina que alimento purina. Es notable que el consumo de alimento sólido fue menor que el del grupo control.
Figura 1. Las gráficas muestran el promedio por día de la ingesta de alimentos sólidos en el grupo control A) y en el grupo experimental B), durante las 26 semanas de tratamiento. Las barras oscuras representan alimento Purina Rat Chow, mientras que las barras claras representan las botanas ingeridas (comida chatarra).
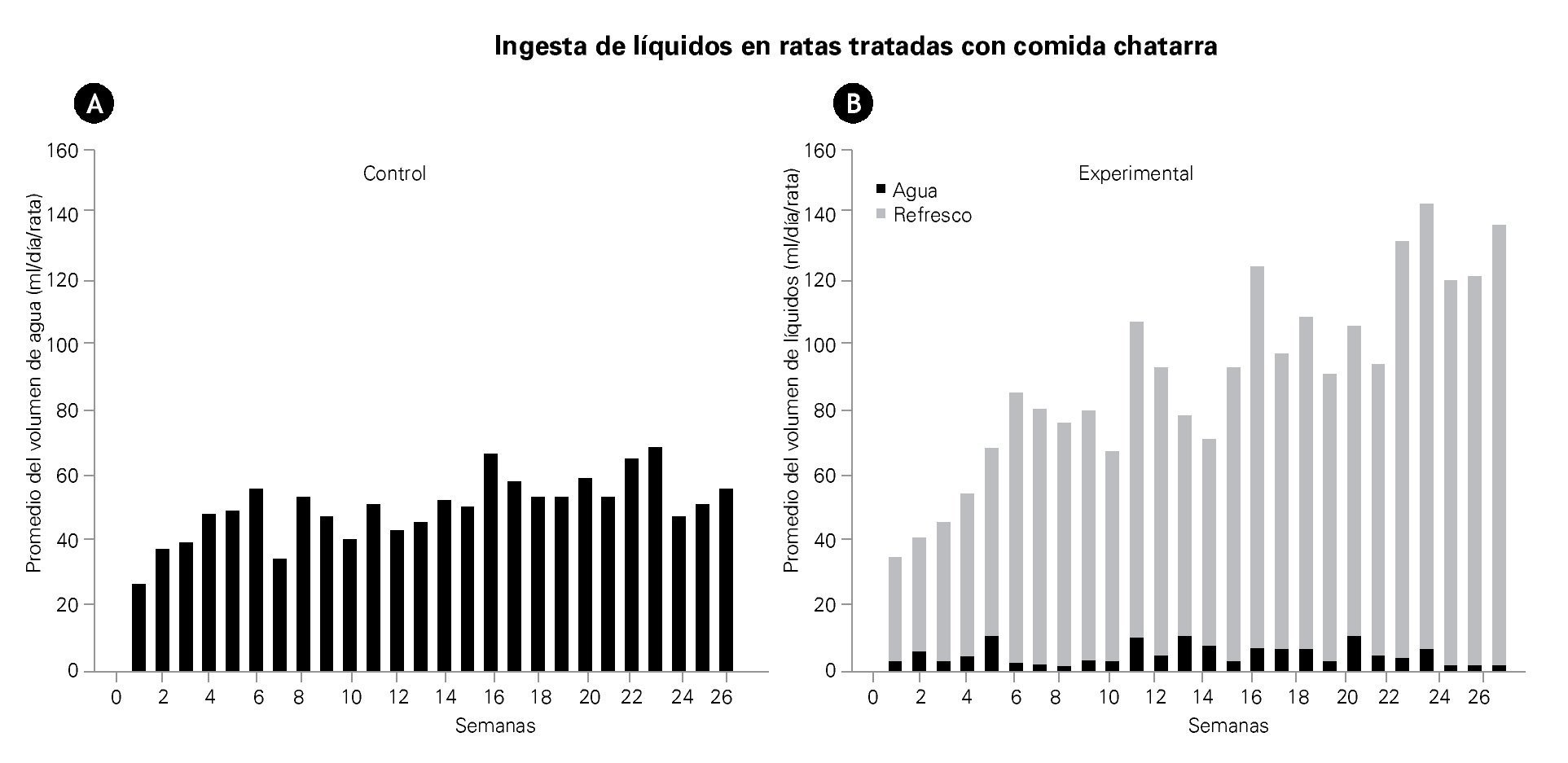
En la Tabla 1 se muestra que la ingesta de líquidos (agua) en las ratas control fue de 50 ± 2 mL/rata/ día, mientras que en las ratas experimentales el volumen total (agua y refresco de cola) fue de 88 ± 6 mL/ rata/día (Tabla 1). En la Figura 2 se muestra que en las ratas experimentales, el refresco de cola desplazó casi en un 90% la ingesta de agua, desde las primeras semanas. En las semanas finales, el consumo de refresco de cola fue casi el doble que el de agua consumida por los animales control (Figura 2).
Figura 2. Las gráficas muestran el promedio de la ingesta de líquidos por día, en el grupo control A) y en el grupo experimental B), durante las 26 semanas de tratamiento. Las barras negras representan el promedio diario del volumen de agua (mL) tomada por rata. El área de color gris claro en el gráfico B), muestra el promedio del volumen de refresco consumido (mL) por rata.
Peso corporal, diámetro abdominal y grasa intraperitoneal
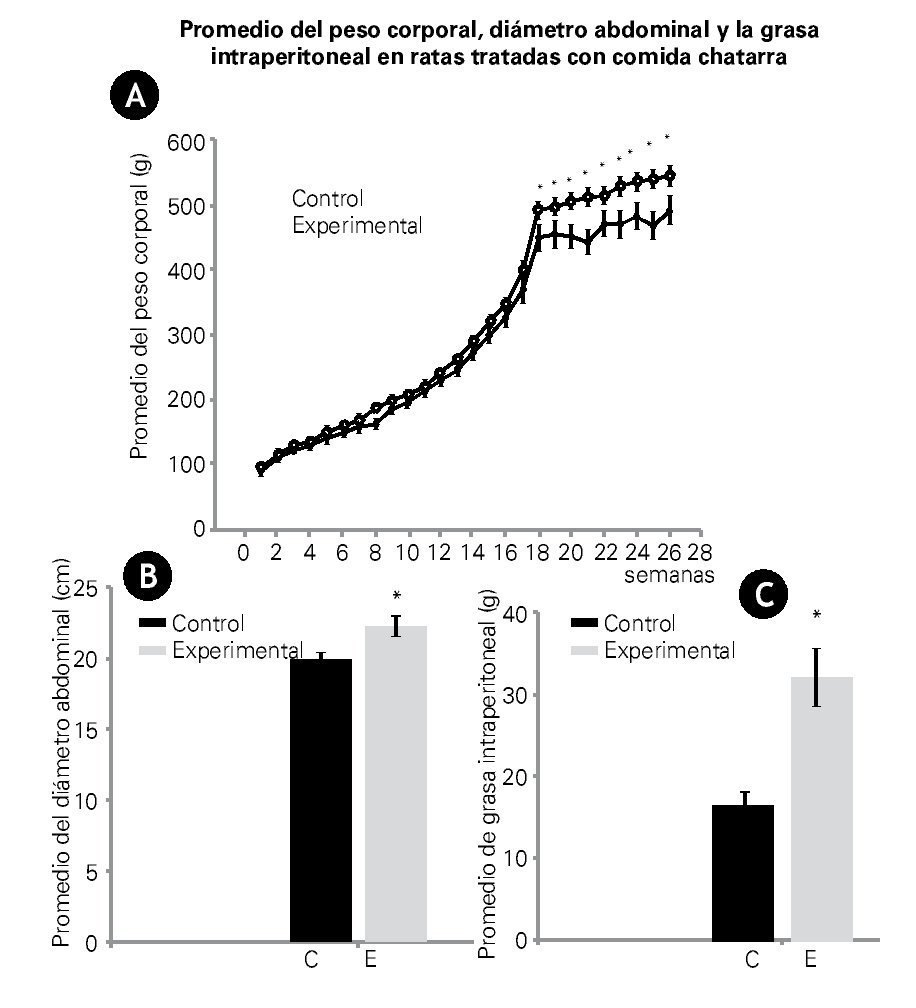
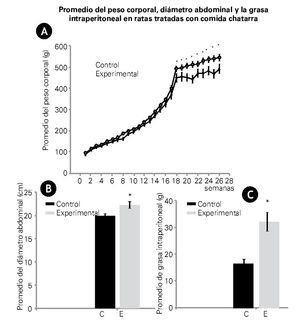
El peso corporal medido semanalmente, mostró un aumento gradual en ambos grupos durante las primeras 18 semanas, sin embargo, a partir de esta semana, el peso corporal de las ratas experimentales se mantuvo por arriba de los controles, aproximadamente en un 17% con una diferencia significativa de p<0.05 (Figura 3A).
Figura 3. A), B) y C) Muestran valores promedio ± ES. A) Se observa el peso corporal de los grupos analizados. Se observa un incremento del peso de 20 ± 5 g por semana. Alrededor de la semana 18, el peso corporal del grupo experimental se separó del control. A partir de esta semana, en el peso corporal para ambos grupos, la diferencia fue estadísticamente significativa p<0.05. B) Muestra el diámetro abdominal y C) el peso de la grasa intraperitoneal de ambos grupos a las 26 semanas de tratamiento. Grupo control (barra oscura), experimental (barra clara). Tanto en el diámetro abdominal como en el peso de la grasa intraperitoneal existen diferencias significativas (p<0.005).
El diámetro abdominal en las ratas control, fue en promedio de 20 ± 0.4 cm, mientras que en las ratas experimentales este diámetro fue de 22 ± 0.1 cm, con una significancia estadística de p<0.05. Datos que se correlacionan con el peso promedio de la grasa intraperitoneal. En el grupo control el peso de grasa fue de 16 ± 2 g, mientras en las ratas experimentales fue de 32 ± 3 g, obteniéndose una diferencia significativa de p<0.005 entre ambos grupos (Figuras 3B y 3C).
Prueba de tolerancia a la glucosa, niveles plasmáticos de triglicéridos y colesterol
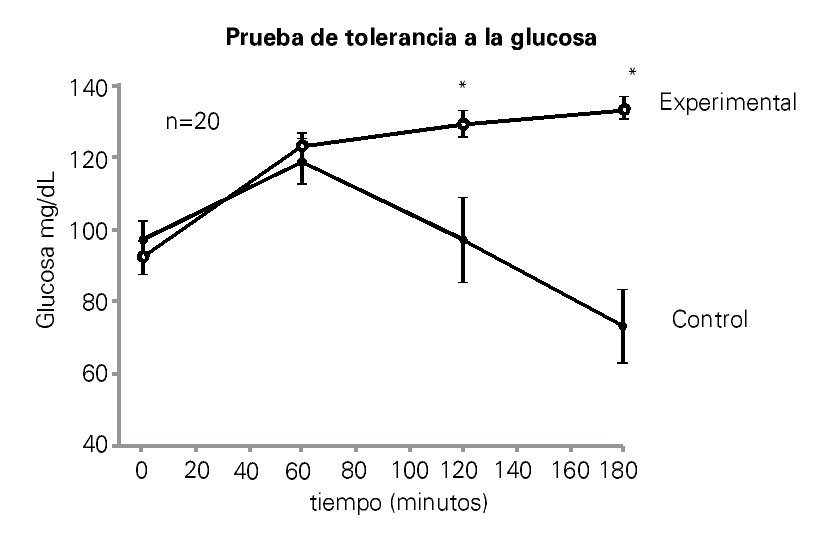
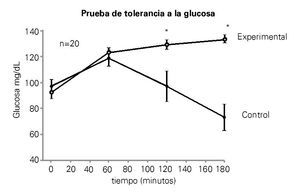
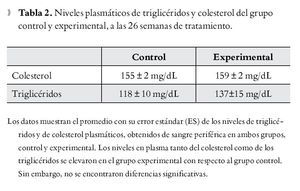
En la Figura 4 se muestran los resultados de la prueba de tolerancia a la glucosa. Cada punto es la media de los valores plasmáticos de glucosa obtenidos en ambos grupos de ratas. La prueba de tolerancia a la glucosa mostró en ambos grupos un aumento de la glucosa plasmática a los 60 minutos después de la inyección. En el grupo control, los niveles de glucosa en plasma fueron disminuyendo gradualmente hasta alcanzar niveles similares a los de la etapa cero en aproximadamente 120 minutos. A los 180 minutos, la glucosa cayó por debajo de los niveles basales en el grupo mencionado. En el grupo experimental los niveles de glucosa se mantuvieron elevados a los 120 y 180 minutos con respecto al control. Se encontraron diferencias significativas entre ambos grupos con una p<0.05. En la Tabla 2 se muestran los niveles plasmáticos de colesterol y triglicéridos de ambos grupos, aunque los dos parámetros se elevaron en el grupo experimental no se encontraron diferencias significativas.
Figura 4. El gráfico muestra la prueba de tolerancia a la glucosa. Los puntos representan los valores promedios de glucosa plasmática obtenidos a partir de las 10 ratas de cada grupo. Glucosa en ayuno del grupo control, fue de 97 mg/dL y del grupo experimental fue de 93 mg/dL. Existen diferencias significativas entre el grupo control y el experimental a los 120 y 180 minutos (p<0.05).
• Discusión
En este estudio los resultados muestran que la ingesta total de alimentos en los animales control fue mayor que en el grupo experimental. El grupo experimental reduce la ingesta total de alimento sólido (purina y aros de harina). La ingesta de alimento sólido se basa principalmente en el consumo de aros de harina, como se observa en la Figura 1B, está claro que el alimento balanceado fue sustituido por más del 50% por los aros de harina. Este patrón de alimentación se mantuvo durante todo el experimento.
La cantidad de alimento sólido total consumido fue significativamente menor en los animales experimentales que en el control, lo que probablemente resulte de una mayor ingesta de refresco de cola. La Figura 2B muestra en este grupo experimental que la ingestión de agua fue eliminada casi 100% al final del experimento.
Estos datos sugieren que la comida chatarra (aros de harina y refresco de cola) son preferidos en lugar del alimento balanceado. La tendencia a consumir los alimentos "palatables" en cantidades que exceden los requerimientos de energía, se ha vinculado a un proceso similar a la adicción.11 Hay evidencias que sugieren que el alto contenido en grasas y sal de los alimentos de preparación rápida puede incrementar el potencial adictivo,12,13 lo que podría estar sucediendo en el grupo experimental en este estudio. En México, por ejemplo, PROFECO indica que 100 g de "chips" ("papitas") contienen, entre un 23%-40% de grasa, entre 50%-60% de hidratos de carbono y entre 0.2% y 1.9% (dependiendo de la marca) de sal, lo que puede resultar en lo apetecible de las papitas.14
También en el grupo experimental, el volumen refresco de cola ingerido se duplicó con respecto al volumen de agua ingerido por el grupo control, es probable que este mayor ingreso de líquidos se deba indirectamente al consumo de aros de harina, los cuales tienen alto contenido de sal, lo que aumentaría la osmolaridad plasmática, estimulando a los osmorreceptores hipotalámicos y resultando en un aumento de la sed que podría explicar en parte este mayor consumo de líquidos. Sin embargo, el consumo de agua se limita y se sustituye por la ingestión de refresco de cola que muestra que tal vez más que el aumento de la osmolaridad del plasma, es lo apetecible del refresco de cola lo que induce este alto consumo. En la población mexicana, el consumo de refresco de cola ha ido en aumento y es elegido, aparentemente, por su sabor.15
En los roedores también se ha demostrado la existencia de una adicción al consumo de azúcar, mostrando signos de tolerancia y abstinencia.13 El refresco que se utilizó en este trabajo tiene 45.6 mg de cafeína16 y azúcar (10%), ambas sustancias pueden conducir a un comportamiento adictivo, promoviendo su ingesta en grandes cantidades, lo que al paso del tiempo puede inducir sobrepeso y el desarrollo de obesidad.17
Mercer y colaboradores concluyen que existen dos factores que afectan los requerimientos para la utilización de los nutrientes y la energía en un organismo, estos son la necesidad fisiológica y el balance de nutrientes.18 Ellos mencionan que la necesidad se satisface cuando el organismo está en condiciones "óptimas", es decir, cuando es capaz de funcionar. El balance de nutrientes implica la interacción del organismo con el ambiente o el efecto de la proporción de un nutriente a otro. La necesidad fisiológica y el balance de nutrientes puede regular mecanismos del control de la ingesta de alimentos.18 Reportes clínicos han sugerido que algunas personas pueden desarrollar conductas adictivas con el consumo de alimentos palatables, lo que los conduce a ingerirlos de manera compulsiva y promover alteraciones en el metabolismo, que finalmente puede llevarlos a un estado de obesidad y desarrollar SM.13 En este estudio, las ratas sí prefieren consumir alimentos "sabrosos", lo que podría explicar la ganancia de peso en estos animales, debido a una posible conducta adictiva a los alimentos chatarra.
Aún cuando el peso de los animales experimentales se mantuvo ligeramente superior a la de los controles fue estadísticamente significativo hasta la semana 18. Es probable que a esta edad los animales experimentales hayan controlado su peso debido a que los mecanismos de regulación están activos, por ejemplo, una posibilidad es que no han desarrollado resistencia a la leptina como se ha sugerido que sucede en los animales obesos.19
En ratas de la cepa Fischer, se observó que el peso corporal aumentó ligeramente después de la edad de cuatro meses, este incremento en el peso se asoció con una elevación de la concentración de leptina en plasma.20 Este aumento de la leptina plasmática podría ser el resultado de la disminución de la sensibilidad a esta hormona.
Es un hecho que tanto los humanos como los animales tienen un aumento de la adiposidad asociada con el envejecimiento,20 lo que puede resultar de la disminución de la sensibilidad a la leptina;21 esto sugiere que no hay inhibición de la centros orexigénicos y por lo tanto, el animal continúa el consumo de alimentos aumentando su peso y la adiposidad.18
En ratas se ha demostrado que, independientemente de la dieta, la leptina se regula de acuerdo con la edad del animal,21 en este estudio se muestra que hay un punto que inicia la separación de la ganancia de peso de manera significativa entre ambos grupos, ¿es posible que sea en este punto el inicio de la insensibilidad a la leptina?
En este trabajo, las ratas experimentales, además de tener una ganancia de peso corporal con respecto al grupo control, mostraron un aumento del diámetro abdominal (Figura 3B) que coincide con un incremento de grasa intraperitoneal, ambos valores fueron significativamente diferentes con respecto al control. Se ha reportado que los niños que tienen SM o diabetes tipo 2, presentan un aumento de la circunferencia de la cintura. Este tejido adiposo blanco intraabdominal que reviste el abdomen, segrega un mayor número de adipocinas (por ejemplo, TNF, interleucinas 8 y 10 [IL-8, IL-10] y la resistina), comparado con el tejido adiposo blanco subcutáneo.22 En este estudio, los animales experimentales presentaron un aumento significativo en la cantidad de grasa intraperitoneal como se muestra en la Figura 3C, es posible que en estos animales existan alteraciones en la secreción de adipocinas, aunque en este estudio no fue posible medirlas, en otros modelos experimentales se ha demostrado, por ejemplo en el ratón obeso, que el aumento de grasa intraperitoneal promueve alteraciones en adipocinas y esta alteración está asociada con la adiposidad,22 la presencia de estas adipocinas, puede en su momento, inducir resistencia a la insulina e iniciar el desarrollo del SM.
La resistina, una de las adipocinas secretadas por el tejido adiposo; promueve la resistencia a la insulina en los tejidos periféricos (hígado, músculo y tejido adiposo), induciendo hiperglucemia crónica.22 En este estudio, en la Figura 4 se muestra la prueba de tolerancia a la glucosa, ambos grupos al inicio tenían un nivel de ayuno de glucosa en suero muy similar (c=97 mg/dL), (e=93 mg/dL), su valor máximo se alcanzó a los 60 minutos tras la inyección de glucosa. En el grupo control el nivel de glucosa plasmática empezó a disminuir a los 60 minutos, continuando la disminución hasta llegar a 117 mg/dL después de dos horas de la administración de la glucosa. Sin embargo, los animales de experimentación después de 120 minutos muestran claramente una respuesta hiperglucémica, que continúa por más de 180 minutos (133 mg/dL).
Los datos mostrados indican que ya hay una resistencia a la acción de la insulina, lo que puede sugerir un estado prediabético en estos animales.23
La respuesta hiperglucémica de las ratas experimentales puede estar asociada con cantidades de grasa abdominal que es diferente significativamente a la de los controles (Figuras 3B y 3C). Este dato se ha asociado con la resistencia a la insulina y al SM.9
Por otro lado, los niveles de triglicéridos y colesterol se incrementaron en ratas experimentales, aún cuando estos no son significativamente diferentes de los controles (Tabla 2), es probable que si el experimento se hubiera prolongado, estos datos podrían llegar a ser significativos. Este hecho se ha observado también en los animales a los que se indujo diabetes mellitus. 24
• Conclusión
Las ratas recién destetadas prefieren la dieta hipercalórica, que eventualmente promueve en estos animales un aumento de peso y acumulación de grasa intraperitoneal, como se ha demostrado en otros modelos de ratas obesas. La grasa intraabdominal promueve la intolerancia a la glucosa, una condición que induce a un estado prediabético y al SM. Este estudio demuestra que una dieta de comida chatarra suscita alteraciones como aumento de peso, aumento del diámetro abdominal y de la grasa intraperitoneal e intolerancia a la glucosa. Este modelo de rata, nos permite dar una idea de lo que podría estar sucediendo con los hábitos alimenticios "no sanos" de los niños en edad preescolar de México. Los niños pueden obtener los productos mencionados a bajo costo en la escuela, es así, que las porciones ingeridas durante el día pueden ser de dos o más. Como esta dieta alta en calorías es muy común, el aumento de peso es inminente. Se sabe que un niño obeso será un adulto obeso y es probable que tenga una calidad de vida deteriorada por el número de enfermedades asociadas con la obesidad. Es indiscutible que se requiere un número mayor de estudios dirigidos a la prevención de la obesidad, y que es urgente tomar medidas para modificar los hábitos alimenticios en los niños mexicanos para mejorar las condiciones de vida en estas personas.
• Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
• Financiamiento
No se recibió ningún patrocinio para llevar a cabo este artículo.
Correspondencia:
Bertha Gómez Prieto.
Departamento de Fisiología, Laboratorio de Neurofisiología Integrativa,
Facultad de Medicina, Universidad Nacional Autónoma de México,
C.P. 04510, México D.F., México.
Teléfono: 52 (55) 5623 2346. Fax: 52 (55) 5623 2391.
Correo electrónico: prieto@unam.mx