¿ Introducción
La leucemia aguda mieloide (LAM) se diagnostica en cada 4/100 000 habitantes, con una media de edad de 60 años. En el grupo de edad mayor a 65 años, o denominado paciente viejo, la incidencia se incrementa hasta en 15/100 000 habitantes.1-3 En una proporción importante de los pacientes viejos que se diagnostican con LAM la celularidad en médula ósea se acompaña de cambios displásicos.4 Hasta 10% tienen antecedentes de haber sido tratados por otros cánceres.5 Aunado a esto, otros factores intervienen de forma significativa en los resultados negativos en el tratamiento de estos pacientes: en primer lugar los cambios biológicos del envejecimiento como son la disminución de la capacidad del hígado para la depuración de toxinas,6 disminución del filtrado glomerular,7 disminución de la capacidad vital pulmonar,8 decremento de la respuesta de vasos sanguíneos a cambios de tensión,9,10 baja producción de precursores hematopoyéticos,11 por mencionar algunos. Estos cambios interfieren de forma definitiva en el metabolismo de los quimioterápicos aplicados, por lo cual los efectos secundarios serán más intensos y prolongados.
¿ Pronóstico y edad
En los últimos años, mucho se ha avanzado en el tratamiento de la LAM; actualmente hasta 70% de los pacientes con LAM, menores de 60 años, alcanzan remisión completa (RC); sin embargo, para pacientes viejos los resultados continúan siendo malos a pesar de nuevos medicamentos y nuevos esquemas de quimioterapia la RC se observa en menos de 30% de los casos.12 En pacientes jóvenes se observan remisiones completas y prolongadas (mayores de cinco años) hasta en 40% sólo con quimioterapia, y de 40% a 80% en pacientes sometidos a trasplante de médula ósea, mientras que en pacientes viejos la sobrevida alcanza sólo unos meses (promedio, seis) y 10% sobrevive más allá de 10 años,13
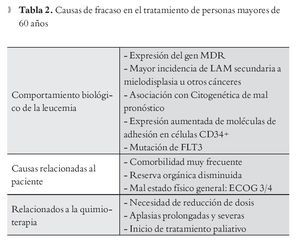
El comportamiento biológico de la LAM en pacientes viejos es diferente al de los jóvenes. La expresión de proteína de multi-resistencia a drogas (MDR) tiene una alta frecuencia en pacientes mayores de sesenta años con reportes entre 60% y 71%, con mayor resistencia a los quimioterápicos, motivo por el cual los casos de refractariedad son más comunes en este grupo.14 En caso de conocerse por medio de estudios moleculares, que un paciente mayor de sesenta años tiene expresión de MDR, debe ofrecérsele solo tratamiento paliativo,15 el uso de inhibidores de la expresión de este gen como ciclosporina A no ha mostrado hasta el momento una mejoría significativa en los resultados.16 La diferencia en la sobrevida media entre pacientes que reciben tratamiento quimioterápico intensivo y no intensivo no es significativa. Con el tratamiento intensivo sin embargo, se presentan mayor frecuencia de complicaciones asociadas al mismo tratamiento, hospitalizaciones prolongadas y mala calidad de vida. Estos resultados muestran que en casos de pacientes con alta comorbilidad asociada es mejor optar por tratamiento no intensivo y/o paliativo que exponer al paciente al tratamiento agresivo.17
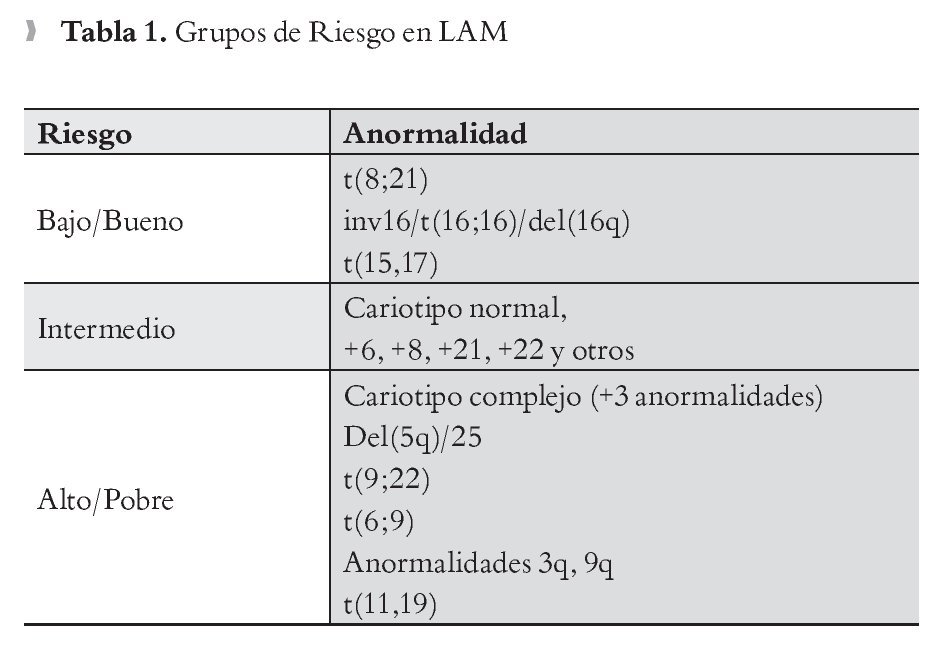
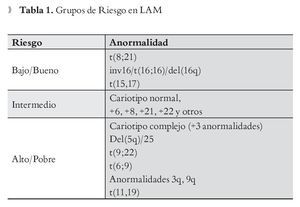
Los resultados en citogenética, también difieren de manera evidente entre pacientes con LAM viejos, respecto a los jóvenes. La sobrevida a cinco años está directamente relacionada con los resultados del cariotipo. De pacientes menores de sesenta años, 10% a 15%, tienen cariotipo de buen pronóstico inicial.18 En el grupo de genética de mal pronóstico se encuentran principalmente los pacientes mayores de 60 años, en los que se informa hasta en 35% a 40% alteraciones en los cromosomas cinco y siete.19 De los pacientes, tanto jóvenes como mayores, 50% a 60% se estadifican de pronóstico intermedio, de acuerdo a estos resultados.20,21 Los grupos de riesgo de acuerdo a la citogenética se muestran en la Tabla 1.
¿ Evaluación geriátrica
Dentro de la valoración del paciente viejo con LAM, la evaluación geriátrica ofrece una visión completa, logrando discernir que paciente "es apto" para recibir un tratamiento quimioterápico intensivo. La valoración del paciente viejo debe incluir factores físicos, psicológicos y socioeconómicos, aunados a las enfermedades crónico-degenerativas acompañantes que modifican directamente la función general del paciente. Cualquier anomalía en alguno de esos puntos influirá sin duda en los resultados del tratamiento. El valorar al paciente como "un todo" y no solo como una "persona enferma de leucemia" es vital para obtener resultados óptimos. La capacidad de preservar íntegras las actividades de la vida diaria (básicas e instrumentadas) es un punto importante en estos pacientes, ya que no se pretenderá aplicar una quimioterapia intensiva a un paciente postrado en cama por inmovilidad y perdida de la función, que requiere atención por parte de un cuidador para realizar la mayor parte de las actividades de la vida diaria.22,23 La depresión en las personas mayores se sesenta años es frecuente, por lo que se debe reconocer esta antes de iniciar tratamiento para no confundir con "efectos secundarios" de la quimioterapia o de la propia enfermedad hematológica, estos síntomas incluyen fatiga, debilidad, dolor no localizado, anorexia o abatimiento funcional.24,25 La depresión en el viejo exacerba los síntomas de las enfermedades físicas. De ser posible, de debe aplicar alguna Escala de Depresión Geriátrica (GDS, ADL).26,27
¿ Evaluación oncológica
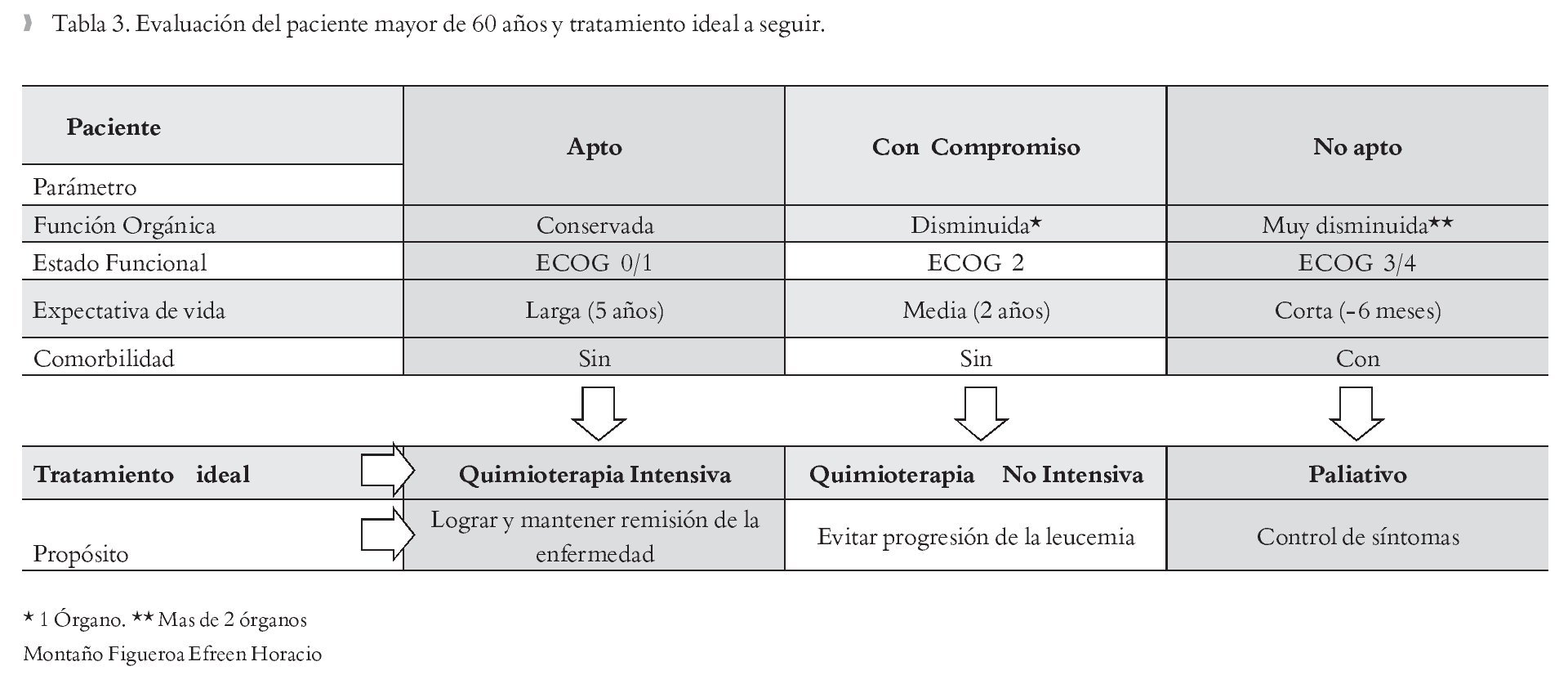
Una adecuada asignación del estado físico actual proporcionará mas herramientas médicas para decidir cual tratamiento iniciar. Las dos escalas actualmente usadas son la Eastern-Cooperative-Oncology-Group (ECOG ) y el índice de Karnofsky. Ambas brindan un panorama objetivo de la capacidad física y de la necesidad de cuidados de terceros de los pacientes. Generalmente, los pacientes con un estado funcional ECOG 3/4 se asocian con alto riesgo de mortalidad en la fase de inducción a la remisión.28 El índice de Karnofsky describe además la actividad física del paciente en la vida diaria y como la enfermedad la afecta; se recomienda iniciar tratamiento quimioterápico intensivo en pacientes con un índice mayor del 60%.29
¿ Co-morbilidades
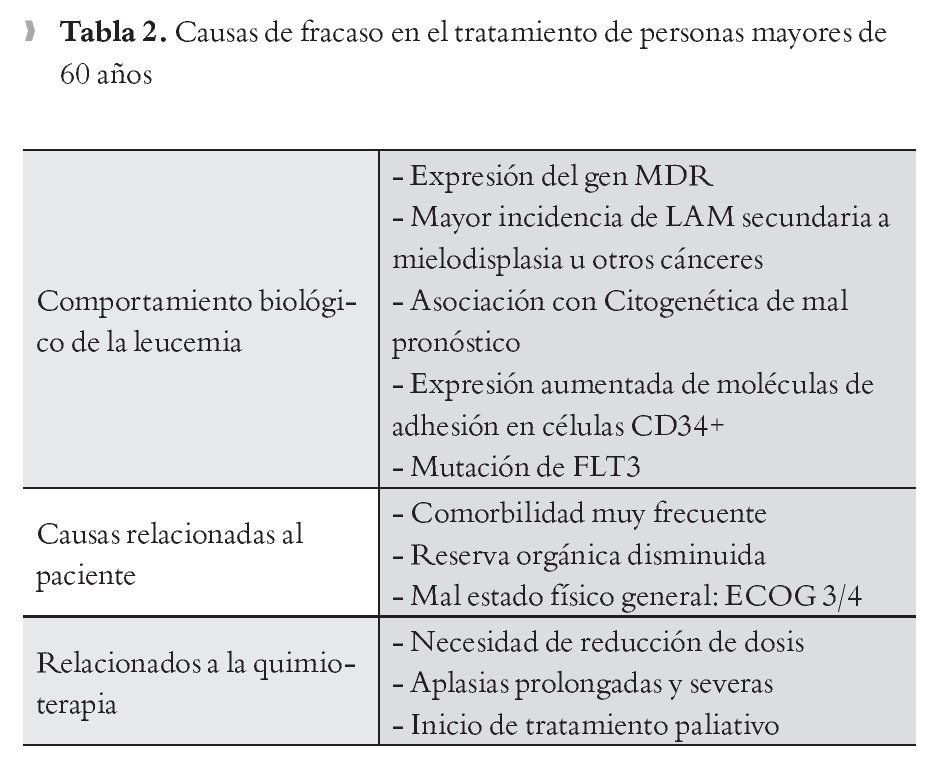
Los pacientes mayores de 65 años presentan frecuentemente enfermedades cardiopulmonares asociadas como insuficiencia cardiaca o enfermedad pulmonar obstructiva crónica; también la incidencia de falla renal y enfermedades endócrinas, como diabetes mellitus, aumenta; todos estos factores juegan un papel principal en los resultados del tratamiento. Muchos pacientes con estas características, sólo deben recibir tratamiento quimioterápico no intensivo.30 Idealmente, a estos pacientes debe aplicárseles escalas de evaluación geriátrica como la Cumulative Illness Rating Scale for Geriatrics (CIRS-G), (Figuras 1 y 2).31
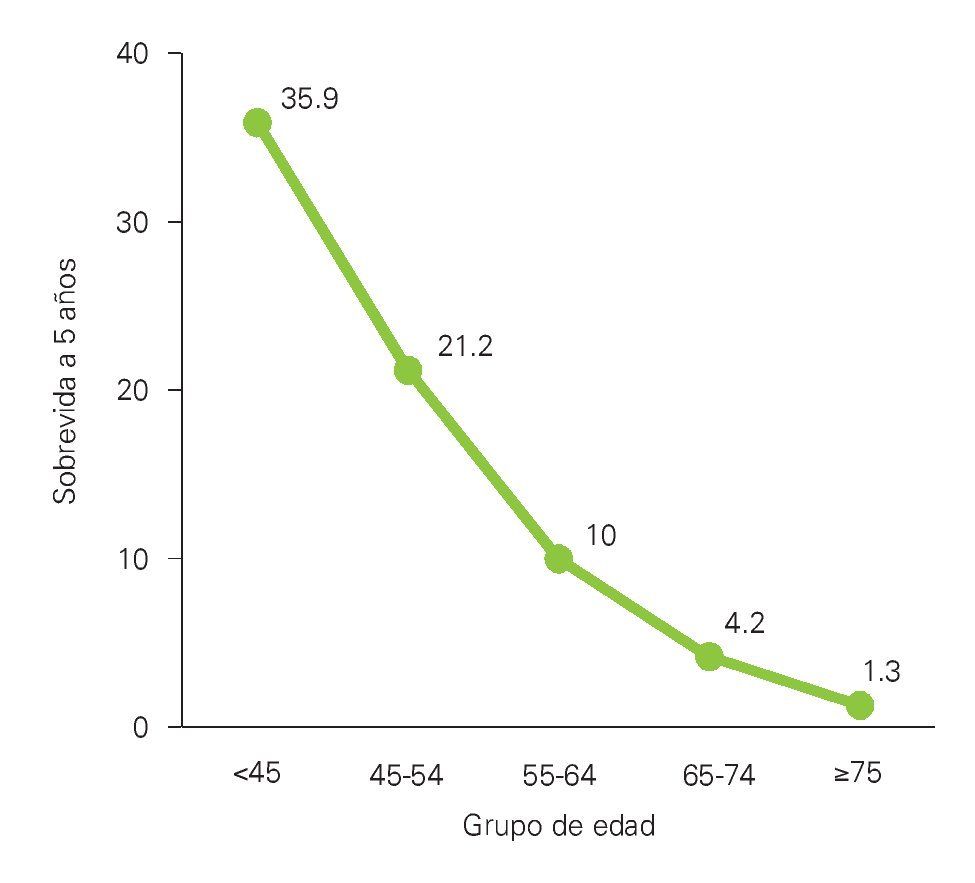
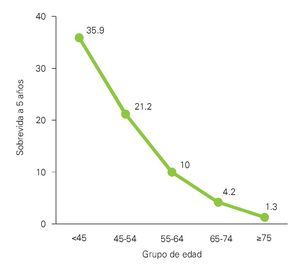
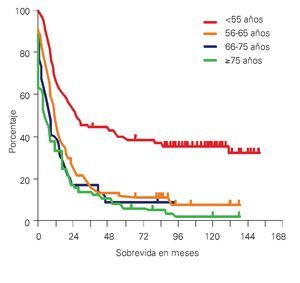
¿ Figura 1. Sobrevida en pacientes con LAM y grupos de edades. 19
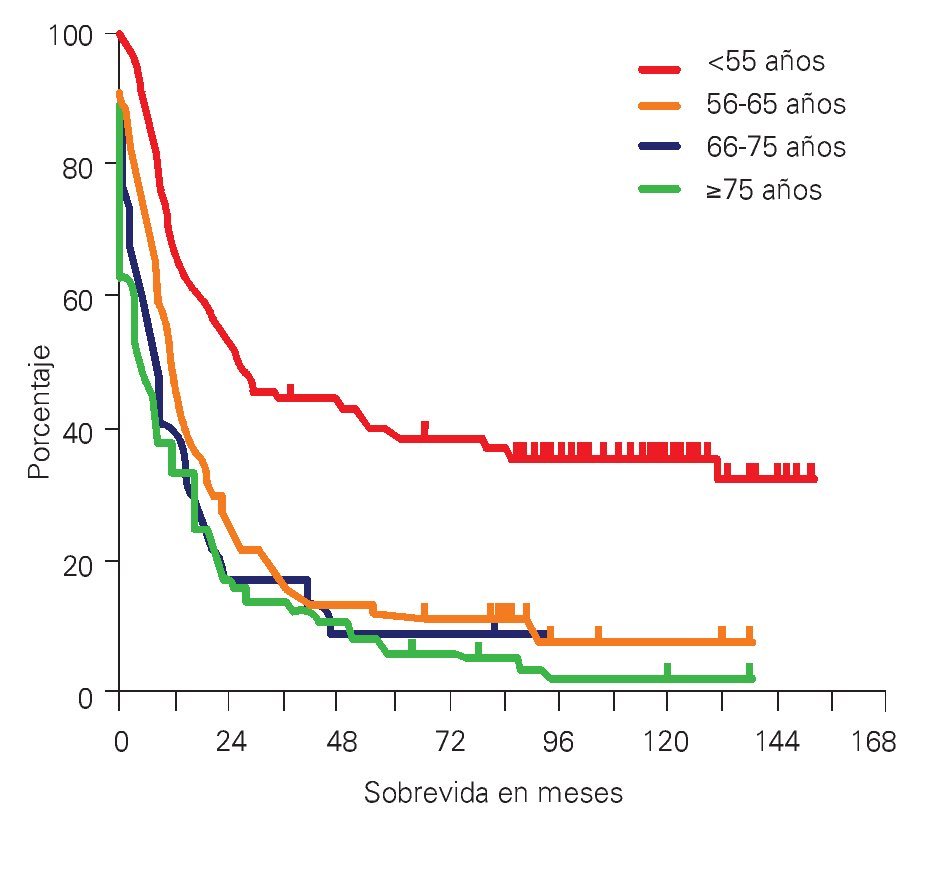
¿ Figura 2. Sobrevida en pacientes con LAM riesgo intermedio e influencia de edades. 19
¿ Decisión final: ¿qué tipo de quimioterapia debe recibir el paciente?
Antes de iniciar tratamiento para pacientes mayores de sesenta años con LAM, es importante estadificarlo e identificar factores que influenciarán los resultados del tratamiento. Esto implica no tan sólo tener en cuenta los factores ligados a la neoplasia en sí, sino también los inherentes al paciente y al estado de salud en general. Los parámetros a tomar en cuenta, como ya se habían descrito previamente son: función orgánica (pruebas hepáticas, renal, pulmonar, cardiaca), estado funcional (ECOG/Karnofsky), expectativa de vida (¿cuánto tiempo se espera podría vivir el paciente con la enfermedad?), comorbilidad (diabetes mellitus, hipertensión arterial sistémica, reumatológicas).32 Conocido esto, se estará en condiciones de catalogar al paciente como "apto" o "no apto" para recibir tratamiento quimioterápico. En el paciente que recibe quimioterapia intensiva el fin de ésta es inducir la remisión de la enfermedad y mantenerla el mayor tiempo posible, en cambio para los pacientes "no aptos" el tratamiento ideal es paliativo/de soporte sólo para control de sintomatología y mejoría en la calidad de vida.33,34 Estos datos se muestran en la Tabla 3.
¿ Quimioterapia intensiva
La sobrevida de los pacientes mayores de 70 años es en promedio de tres a seis meses a pesar de que reciban tratamiento intensivo, esto es porque las complicaciones asociadas al tratamiento se presentan con mayor frecuencia.35,36 Pacientes que logran la remisión, en promedio recaen en los siguientes seis meses.37 Cuando se comparan el uso de esquemas intensivos tradicionales (3 + 7) y no intensivo (dosis bajas de citarabina), se observan diferencias notables en RC con 52% vs. 32% respectivamente, aunque con presencia significativamente mayor de complicaciones relacionadas con el tratamiento en el brazo de quimioterapia intensiva; finalmente, en la sobrevida no se observan diferencias muy significativas con una media de 12 vs. ocho meses en ambos brazos.38,39 En pacientes "aptos", es conveniente el uso de esquema a base de citarabina/daunorrubicina (3 + 7) para IR, después una consolidación con esquema 2 + 5 con los mismos agentes quimioterápicos; en el caso de lograr remisión, el paciente puede continuar con tratamiento no intensivo. El uso de altas dosis de citarabina no es recomendado, ya que las complicaciones asociadas conducen en un alto porcentaje a la muerte del paciente.30,40,41 Otros esquemas utilizados postremisión son: Daunorrubicina ó Idarrubicina mensual combinada con citarabina subcutánea.42,43
¿ Quimioterapia no intensiva
La quimioterapia no intensiva representa una opción para pacientes con compromiso orgánico no severo, ECOG 2 y sin morbilidad asociada. La utilización de citarabina subcutánea 20 mg por día por siete a 10 días, es actualmente esquema más usado, con mejores resultados y relativamente pocos efectos secundarios.44 Los ciclos pueden repetirse cada tres a cuatro semanas, dependiendo de la evolución clínica. Otros quimioterápicos usados para este fin, son la hidroxiurea, 6-mercaptopurina y tioguanina.45 En todos los casos se recomienda el uso de factores estimuladores de colonias hematopoyéticas (granulocitos) durante la aplicación de la quimioterapia y hasta la recuperación de la cuenta absoluta de neutròfilos (> 0.5 x 109); esto disminuye de forma importante las complicaciones infecciosas y la estancia hospitalaria.46,47
¿ Tratamiento paliativo
Incluye el uso de quimioterápicos citoreductores en conjunto con medidas generales, con objeto de disminuir la sintomatología: apoyos transfusional, anti-microbiano y psicológico.48
¿ Nuevas estrategias de tratamiento
Actualmente, una docena de nuevos medicamentos se están utilizando en protocolos de tratamiento de pacientes mayores de sesenta años; estos incluyen gemtuzumab ozogamicina, un anticuerpo monoclonal dirigido contra el antígeno CD33 presente en más de 90% de los blastos de la LAM,49,50 tratamiento epigenético (drogas hipometilantes e inhibidores de la acetilación de histonas), inhibidores de la farnesil transferasa e inmunomoduladores. Estos medicamentos se utilizan en combinación con los agentes quimioterápicos convencionales (citarabina, antraciclinas).48 En pacientes con ECOG 0/1 y adecuada reserva orgánica, pueden ser sometidos a trasplante de médula ósea con esquema de acondicionamiento no ablativo, es decir con dosis menores de quimioterápicos para evitar mayor daño orgánico aunque en nuestro medio la mayoría de los pacientes mayores de 65 años y LAM no son candidatos a trasplante.51
Correspondencia: Dr. Efreen Horacio Montaño Figueroa.
Dr. Balmis N°148. Colonia Doctores, México D. F.
Teléfono: (55) 2789 2000, extensión 1009.
Correo electrónico: herrefreen@hotmail.com