¿ Introducción
La parálisis hipocalémica tirotóxica (PHT), es una rara, pero grave complicación de la tirotoxicosis. La mayor frecuencia de casos se ha reportado en varones jóvenes asiáticos y latinoamericanos, donde se estima que hasta 10% de quienes sufren tirotoxicosis desarrollan PHT.1 El incremento de la incidencia en otras poblaciones, tales como afroamericanos y caucásicos, se ha atribuido al mestizaje producto de la migración.2 La mayor susceptibilidad de algunas poblaciones a cursar con PHT se encuentra asociada a factores genéticos, sobresaliendo algunos alelos del complejo mayor de histocompatibilidad (HLA).
La causa más común de tirotoxicosis es la enfermedad de Graves; sin embargo, se han documentado casos de parálisis hipocalémica en pacientes con bocio tóxico nodular, tirotoxicosis inducida por yodo, tiroiditis linfocítica, tiroiditis secundaria a medicamentos (amiodarona) y adenomas secretores de tirotropina.3
Existen factores desencadenantes de PHT, tales como: estrés, ingestión abundante de carbohidratos, consumo excesivo de alcohol, deshidratación, uso de diuréticos, terapia con glucocorticoides a altas dosis, y uso de antirretrovirales o interferón gamma.
La fisiopatología de la PHT está relacionada con el ingreso acelerado de potasio al interior de las células, favorecido por la activación que las hormonas tiroideas ejercen sobre la enzima Na+/K+- ATPasa, sin que exista una depleción real de los niveles de potasio corporal.3
¿ Presentación del caso
Hombre de 35 años de edad, originario de Villahermosa, Tabasco y residente del Distrito Federal: médico, con los siguientes antecedentes de importancia: consumo de tabaco desde los 17 años de edad a razón de uno a dos cigarros al mes, consumo de alcohol desde los 17 años de edad aproximadamente una vez al mes a base de cerveza. Sin antecedentes crónico degenerativos. El paciente se conocía como sano previamente. Inició su padecimiento el día de su ingreso aproximadamente a las doce de la noche, tras regresar de un viaje a Villahermosa, Tabasco, mientras se encontraba sentado en el autobús, caracterizado por dificultad para incorporarse por parestesias y debilidad en extremidades inferiores. En el transcurso de las siguientes cuatro horas la debilidad progresó en sentido cefálico, hasta comprometer extremidades torácicas, llegando finalmente a la cuadriplejia e incapacidad para la marcha. Al mismo tiempo cursó con alteraciones de la tonalidad de la voz, volviéndose bitonal, así como parestesias diseminadas. Fue recibido en el servicio de urgencias del Hospital General de México con los siguientes hallazgos: hombre de edad biológica similar a la cronológica, sin facie característica, despierto, orientado, con funciones mentales superiores normales. Los signos vitales mostraron tensión arterial 130/80 mmHg, frecuencia cardiaca de 114 latidos por minuto, frecuencia respiratoria de 24 respiraciones por minuto, temperatura de 36°C. Por segmentos, la exploración física reveló nervios craneales sin alteraciones, cuadriplejia, con tono muscular disminuido, ausencia de reflejos miotáticos, sensibilidad conservada, sin signos de irritación meníngea. Por la instalación brusca del cuadro clínico y su rápida evolución se consideró como diagnóstico un probable síndrome de Guillian-Barré. Tras valorar al enfermo, el servicio de Neurología Clínica, coincidió con dicho diagnóstico. Sin embargo, los exámenes de laboratorio tomados al ingreso mostraron las siguientes alteraciones: glucemia 163 mg/dL, potasio sérico 1.6 mmol/L, fósforo sérico 0.7 mg/dL y aumento de enzimas musculares CPK de 600 UI/L, mioglobina de 45 mg/dL. Electrocardiograma con taquicardia sinusal. Se administró cloruro de potasio por vía parenteral 60 mEq en infusión lenta, administrando 10 mEq/h con recuperación progresiva de la fuerza muscular, se realiza control de potasio a las cuatro horas encontrándose este en 3.2 mEq/L, a las doce horas en 3.9 mEq/L, y finalmente a las veinticuatro horas 4.4 mEq/L con recuperación ad integrum de la fuerza y tono musculares, así como de los reflejos miotáticos. Una vez trasladado al servicio de Medicina Interna, se realizó nuevo interrogatorio dirigido, encontrando como posible factor desencadenante un cuadro de deshidratación secundario a sudoración excesiva por las condiciones climáticas durante su viaje. El interrogatorio también reveló que el paciente cursaba con temblor fino distal de dos meses de evolución y leve ansiedad, sin ningún otro síntoma de hipertiroidismo. Se emitieron como posibilidades diagnósticas: una parálisis hipocalémica tirotóxica o secundaria a hipocalemia por hiperaldosteronismo, además de probable diabetes mellitus tipo 2. El protocolo de estudio incluyó toma de perfil tiroideo, electrolitos urinarios, electromiografía y realización de tomografía computada de glándulas suprarrenales. Estos dos últimos estudios no se realizaron pues antes se recibió el resultado del perfil hormonal tiroideo, el cual mostró T3 libre 16.47 pg/mL, T4 libre 3.4 ng/mL y TSH 0.01 mUI/mL, compatible con hipertiroidismo primario; corroborándose el diagnóstico de parálisis hipocalémica tirotóxica. Se inició tratamiento con metimazol 5 mg vía oral cada ocho horas y propranolol 40 mg vía oral cada ocho horas, además de continuar reposición de potasio por vía oral al tercer día de su internamiento dos tabletas de cloruro de potasio (20 mEq) cada ocho horas, se tomó potasio de control previo a su alta del servicio reportándose 4.4 mEq/L, así como electrocardiograma de control el cual se encontró normal, fue egresado clínicamente sin sintomatología, el paciente fue enviado al servicio de Endocrinología continuar manejo ambulatorio tanto del hipertiroidismo como de la probable diabetes mellitus tipo 2.
¿ Discusión
La parálisis hipocalémica tirotóxica (PHT) es una complicación infrecuente del hipertiroidismo en el hemisferio occidental. El diagnóstico no ofrece dificultades cuando existe el antecedente de hipertiroidismo, pero constituye un reto cuando es la manifestación inicial,4 como en el caso que presentamos.
La PHT afecta principalmente a varones entre la segunda y cuarta décadas de la vida. Se caracteriza por ser generalmente simétrica (con algunas excepciones), de inicio en las extremidades inferiores, con progresión en sentido cefálico hasta los músculos de la cadera y finalmente involucra a las extremidades superiores (simulando clínicamente a la parálisis ascendente del síndrome de Guillán-Barre). La sensibilidad se encuentra conservada, pero los reflejos miotáticos se encuentran disminuidos o abolidos. Estos episodios son recurrentes y transitorios, duran hasta 72 horas y con tratamiento oportuno y adecuado, la recuperación es completa. No involucra a los músculos oculares y, aunque no compromete al centro respiratorio bulbar y rara vez afecta a los músculos respiratorios, se han reportado casos asociados a insuficiencia respiratoria aguda que requirieron apoyo ventilatorio mecánico.5 Las funciones mentales superiores se conservan, aunque en casos graves de tirotoxicosis la PHT puede asociarse a cuadros psicóticos.6 En algunos casos puede haber síntomas prodrómicos como dolor, parestesias o rigidez de los músculos afectados.
La PHT ocurre con más frecuencia durante el verano y otoño. Este patrón estacional de aparición podría explicarse por el consumo de bebidas dulces, ejercicio y actividades al aire libre, así como el incremento en la pérdida de potasio en el sudor.
El diagnóstico se basa en los hallazgos clínicos y bioquímicos (hipertiroidismo e hipocalemia).7 Los ataques de parálisis periódica pueden preceder a los signos y síntomas de hipertiroidismo, por ello es útil tomar unas pruebas de funcionamiento tiroideo para el diagnóstico temprano y diferencial. En la PHT es frecuente no encontrar ningún dato clínico de hipertiroidismo. En el caso que nos ocupa, el temblor fino distal y la taquicardia sinusal fueron los datos que permitieron sospechar el diagnóstico. La existencia de hipertensión arterial sistólica en pacientes jóvenes con parálisis hipocalémica también debe orientar hacia el diagnóstico de hipertiroidismo.8
En la determinación de electrolitos séricos se observa hipocalemia en donde los niveles de potasio son menores de 3 mEq/L y pueden ser tan bajos como 1.1 mEq/L. La hipocalemia ocurre por una entrada masiva potasio al interior de la célula y no por una pérdida real; el grado de hipocalemia refleja la gravedad de la parálisis, pero no de la tirotoxicosis. En la excreción urinaria, electrolitos, el índice potasio, creatinina urinaria y el gradiente transtubular de potasio calculado es menor a 2 mEq/L y tres, respectivamente.9 En cuanto a la excreción de fosfatos y calcio, el hueso es sensible a la acción de las hormonas tiroideas por lo tanto en los pacientes con PHT, en contraste con la hiperfosfaturia a menudo encontrada en pacientes con hipertiroidismo, la excreción de fosfato se encuentra reducida como resultado de la entrada de fosfato a la célula. El índice calcio/fósforo (urinario) mayor de 1.7 mg/mL es un dato bioquímico con alto valor predictivo de parálisis tirotóxica con una sensibilidad de 100% y una especificidad de 97%.10
Los datos electrocardiográficos pueden incluir taquicardia sinusal, prolongación del intervalo QT (a causa de la hipocalemia), prolongación del intervalo PR,11 aumento del voltaje QRS y bloqueo auriculoventricular Mobitz 1. En casos graves se ha reportado fibrilación ventricular.12
En la electromiografía se encuentra una reducción de la amplitud del potencial de acción, que sólo se encuentran durante los ataques agudos y activos de la parálisis.
Histopatológicamente, la microscopía electrónica de músculo estriado muestra anormalidades mitocondriales y vacuolización de miofibrillas.6
La fisiopatología de la PHT está asociada a los siguientes fenómenos: el secuestro intracelular por activación de la bomba Na+/ K+- ATPasa, alcalosis, estimulación beta-adrenérgica e hiperinsulinemia.
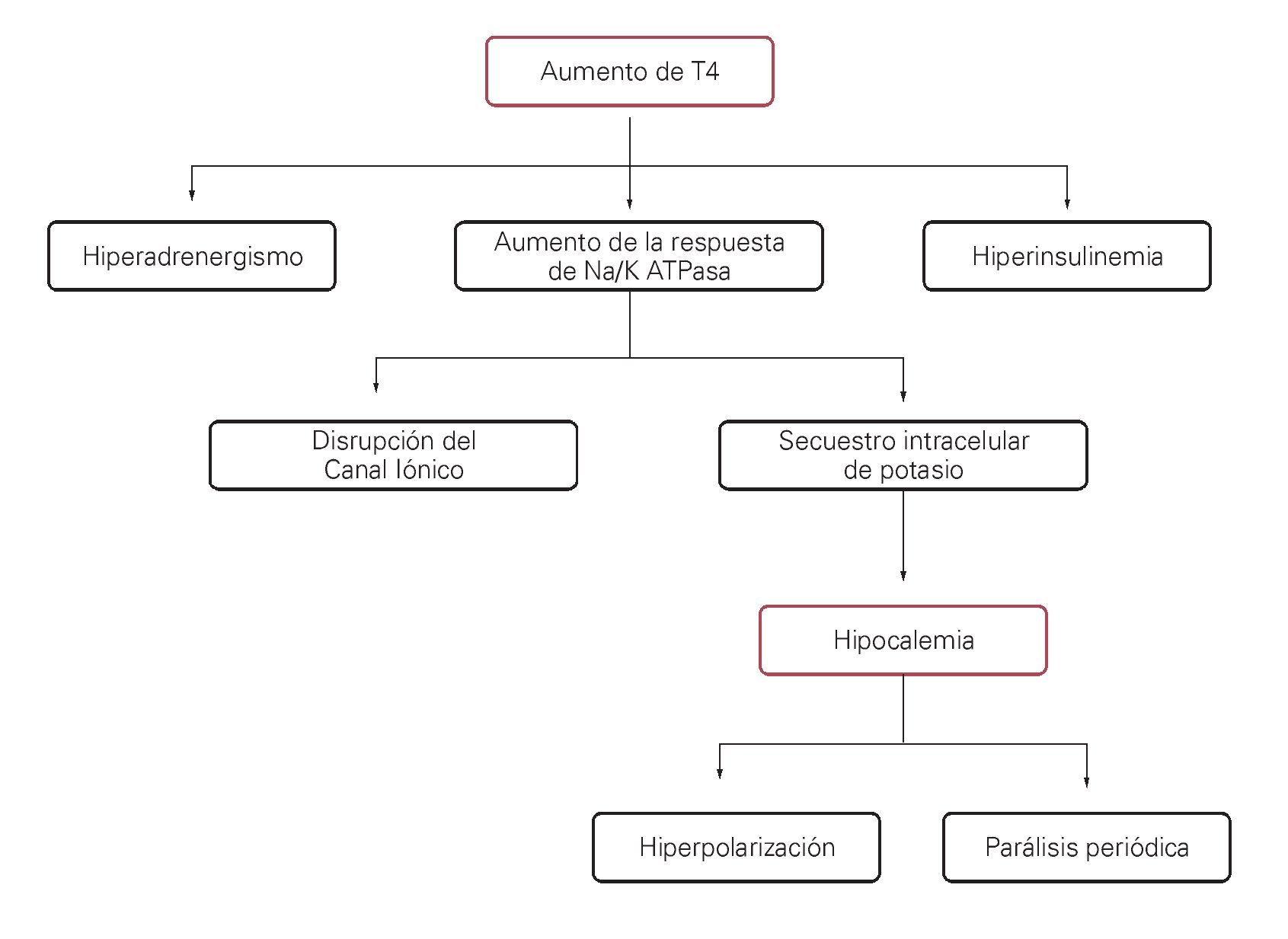
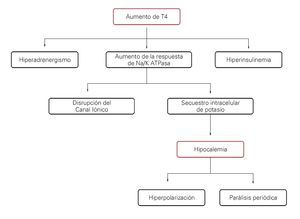
La hipocalemia, causada por secuestro intracelular de potasio, altera la polarización de la membrana plasmática de los miocitos lo que a su vez hace que se modifique el potencial de acción (hiperpolarización), con posterior parálisis de la musculatura estriada (Figura 1).7
¿ Figura 1. Posible mecanismo fisiopatológico que explica la parálisis por secuestro de potasio.
Otro factor involucrado es la acción de los andrógenos sobre la actividad de la Na+/K+-ATPasa. Esto justificaría porque, aunque el hipertiroidismo es más frecuente en mujeres, la PHT predomina en personas del sexo masculino, con una relación hombre:mujer de 20:1.2.
Las hormonas tiroideas ayudan a la regulación genética de los canales de sodio. La resistencia en las membranas musculares se relaciona con el secuestro intracelular de potasio; las hormonas tiroideas incrementan la actividad de la ATPasa Na-K no solo en músculo esquelético sino en hígado y riñón.8 La hipofosfatemia e hipomagnesemia han sido señalados y contribuyen a la debilidad.
La predisposición en poblaciones asiáticas y latinoamericanas se ha justificado con la presencia de antígenos HLA, como el HLA-DRw8 (en Japón), HLA-A2, Bw22, Aw19, y B17 (en Singapur), B5 y Bw46 (en Hong Kong).9 Investigaciones recientes han demostrado la existencia de mutaciones en el gene Kir2.6, que modifica la permeabilidad de las membranas celulares al potasio y se ha encontrado en otros padecimientos que cursan con parálisis hipocalémica, englobados en el término de canalopatías. Dicha mutación parece incrementar la susceptibilidad de sufrir parálisis hipocalémica en los pacientes con tirotoxicosis.10
Un panorama general de la fisiopatología de la PHT se presenta en la Figura 1.
La inmediata corrección de potasio es fundamental para prevenir complicaciones cardiacas. Los requerimientos son entre 40 - 200 mEq de KCl, reemplazando de manera lenta, pues se ha reportado el desarrollo de hipercalemia mayor de 5.5 mEq/L en 40% de los pacientes que reciben más de 40% de KCl, aunque Lin y colaboradoes señalan que hasta 70%.10,11 Los bloqueadores beta-adrenérgicos no selectivos previenen la hipocalemia al producir un efecto antihiperadrenérgico, además de controlar la taquicardia y otros síntomas hipertiroideos. Propanolol a altas dosis es efectivo para prevenir hipocalemia (3 a 4 mg/kg).12 El control del hipertiroidismo hasta llevar a un estado eutiroideo es el tratamiento definitivo, utilizando fármacos anti-tiroideos, cirugía o yodo radioactivo, éstos dos últimos indicados en enfermedad de Graves, adenoma multinodular y adenoma tóxico.11
Ante una parálisis asociada a hipocalemia, el diagnóstico diferencial debe incluir a la parálisis periódica hipocalémica familiar.11,12 Aunque cursan con la misma presentación clínica, los pacientes con parálisis periódica hipocalémica familiar tienen el antecedente importante de historia familiar, una edad de presentación menor a los 20 años y se encuentran mutaciones en los canales de calcio voltaje dependientes subunidad Cav1.1 (CACNA1S), en los canales de sodio voltaje dependiente subunidad Nav1.1 (SCN4A) y al gen Kv3.4 (KCN3E) ensamblado al péptido 2 MinK del canal de voltaje dependiente de potasio del músculo esquelético, que no se encuentran en la PHT.9 Otros diagnósticos diferenciales incluyen al síndrome de Anderson Tawil, en el cual además de parálisis muscular existen arritmias ventriculares y alteraciones dismórficas, al síndrome de Batter, el síndrome de Gitelman, la acidosis tubular renal, el hiperaldosteronismo primario y secundario.12
¿ Conclusión
La parálisis hipocalémica tirotóxica es una entidad patológica que precisa de un rápido diagnóstico, pues aunque es reversible, amerita tratamiento urgente por el riesgo de mortalidad asociada a complicaciones cardiacas. Aunque es poco común que la parálisis se manifieste como síntoma inicial del hipertiroidismo, debe sospecharse PHT en todo paciente varón joven que se presente con un cuadro de parálisis asociada a niveles bajos de potasio sérico, aun cuando no exista sintomatología o signología de hipertiroidismo. La experiencia del médico para detectar signos sutiles de hipertiroidismo, tales como ansiedad, temblor o taquicardia, será fundamental para orientar el diagnóstico.
Correspondencia: Servicios de Medicina Interna U-110 Hospital General de México.
Correo electrónico:ayurabid_2605@hotmail.com