La lesión por isquemia-reperfusión hepática (IRH), se caracteriza por la interrupción del aporte de oxígeno y del flujo sanguíneo al hígado, esta fase se conoce como isquemia, y la fase de reperfusión se lleva a cabo al restablecerse el aporte sanguíneo a este órgano;1 con lo que se produce una fase inflamatoria a nivel local y sistémica que puede llegar a producir daño celular como necrosis o apoptosis,2 falla orgánica o muerte, que dependerá del tiempo de isquemia fría o caliente al que haya sido sometido el órgano y por lo tanto estos pueden ser los efectos directos a la reoxigenación del hígado.3
El fenómeno de IRH está involucrado en una serie de eventos como son la procuración de órganos para trasplante, en cirugía y resecciones hepáticas, en el trasplante hepático (TH)4 y en las lesiones asociadas al trauma, como las heridas ocasionadas por armas de fuego, lesiones penetrantes de abdomen o contusas.5 Las especies reactivas del oxígeno (ERO) se producen en la fase de reperfusión, siendo el radical superóxido e hidroxilo, especies altamente reactivas, que son en parte responsables del inicio de la lesión por IRH.6 Posteriormente se activan las células endoteliales y las de Kupffer, con migración de neutrófilos polimorfonucleares (PMN), por lo que se produce lesión sobre los hepatocitos asociada a una respuesta inmunológica mediada entre otros grupos celulares por los leucocitos CD4 y el sistema de complemento, por lo que la respuesta inflamatoria altera la señalización intracelular.7,8
En relación con la respuesta celular, se ha tratado de modular para evitar los efectos deletéreos de la IRH, nuestro grupo previamente ha trabajado con los antiinflamatorios no esteroideos (AINE). El piroxicam pertenece a ésta familia de fármacos; es un inhibidor primariamente de la enzima COX-1, es ampliamente empleado en la práctica clínica,9 tiene además funciones inmunoreguladoras del proceso inflamatorio, se le ha atribuido un efecto antioxidante y modulador de la migración y adhesión de PMN.10
Estudios realizados con naloxona en modelos experimentales similares, han proporcionado datos alentadores en base a los resultados obtenidos en el fenómeno de isquemia reperfusión.11 La naloxona se conoce como un antagonista de los receptores opiáceos, que modula la producción del anión superóxido de los PMN y se ha estudiado en el tratamiento de las lesiones isquémicas de corazón, riñón, intestino delgado, cerebro, hígado y en estudios de choque hemorrágico.12-14 En trabajos previamente publicados por nuestro grupo, se demostró la acción benéfica del piroxicam al ser administrado de manera aislada durante el fenómeno de isquemia-reperfusión hepática,15 y del mismo modo, se observó efecto protector con naloxona durante la isquemia-reperfusión en el intestino delgado,11 por lo que decidimos probar la administración conjunta de ambos fármacos esperando observar un efecto sinérgico.
En los estudios mencionados anteriormente, se aplicaron los fármacos en la fase previa al evento isquémico, pero desconocemos si éste efecto se modifica al aplicarlo en la fase de reperfusión, por lo que nos será de utilidad en eventos programados en los que conocemos que el tejido será sometido a un evento de isquemia-reperfusión.
¿ Objetivo
Determinar la utilidad de piroxicam y naloxona aplicados conjuntamente en un modelo experimental en rata de isquemia reperfusión hepática, así como identificar el tiempo de administración de los fármacos mencionados, ya sea previo al evento isquemico o posterior a la reperfusión.
¿ Métodos
Previa aprobación por el comité de ética e investigación del protocolo de estudio y la autorización para el manejo de los animales de laboratorio del Hospital General de México, se utilizaron ratas Wistar de características microbiológicas convencionales de 250 a 300 g de peso, machos, del servicio de Bioterio y Cirugía Experimental de la misma institución. Fueron 50 ratas asignadas aleatoriamente en cinco grupos de estudio, con 10 ratas por cada grupo, siendo el grupo I el sham o simulado y los grupos II, II, IV y V los experimentales.
Las características y distribución de los grupos de estudio, fueron las siguientes:
Grupo I: Sham o Simulado. Se realizó laparotomia exploradora, con incisión por la línea media abdominal, previa anestesia intramuscular con ketamina y xilacina, no se realizó isquemia-reperfusión del hígado y no se aplicaron los fármacos en estudio.
Grupos II: Con el mismo abordaje quirúrgico, pero se realizó isquemia caliente parcial por 60 minutos y reperfusión hepática, sin aplicación de fármacos.
Grupo III: A diferencia del grupo anterior, con la aplicación de piroxicam y naloxona, una hora previo al evento isquémico.
Grupo IV: A diferencia del grupo anterior la aplicación de piroxicam y paloxona fue a los 30 minutos posteriores, al inicio de la fase de reperfusión.
Grupo V: Y en este grupo se inyectó naloxona y piroxicam una hora antes de la isquemia y 30 minutos después de la reperfusión.
Las dosis empleadas fueron: piroxicam: 0.3 mg/ Kg IV por dosis y de naloxona: 20 nanogramos/Kg IV por dosis.
Después de 12 horas de ayuno, manteniendo a los animales únicamente con ingesta de agua ad libitum, bajo anestesia general con xilacina 100 mg/Kg IM y ketamina 10 mg/kg IM. Se colocó a las ratas en tabla quirúrgica en posición decúbito dorsal, fijando y separando las cuatro extremidades con tela adhesiva, con técnica aséptica se realizó incisión media longitudinal, con electrocauterio y tijera de Metzembaum, hasta abordar la cavidad peritoneal, procediendo a la disección e identificación de la rama izquierda de la vena porta y la rama izquierda de la arteria hepática, realizando una isquemia hepática parcial, con micropinzas vasculares, interrumpiendo el flujo de los vasos que irrigan el lóbulo mediano y lateral izquierdo, manteniendo la circulación de los lóbulos caudado y lateral derecho, para evitar la estasis esplácnica.
Se mantuvo la isquemia por 60 minutos, al término de ella, se retiraron las pinzas vasculares, para reperfundir los lóbulos isquémicos y se resecaron los lóbulos caudado y lateral derecho, para dejar al animal de investigación únicamente con el tejido sometido a isquemia-reperfusión, durante el procedimiento quirúrgico, se mantuvo la hidratación del animal con solución salina isotónica tibia a 15 mL/kg/hora por vía intraperitoneal.
Los fármacos se administraron: la primera dosis, una hora antes de la fase isquemica, por vía intravenosa a través de la vena cava inferior, en los grupos en los que se aplicó los fármacos en la reperfusión, se realizó a los 30 minutos por la vena porta y las subsecuentes dosis por vía intramuscular, cada 12 horas, por los siguientes tres días. Se mantuvieron las ratas en observación por ocho días, registrándose sobrevida acumulada, se sacrificaron los animales con una sobredosis anestésica. Se les realizó estudio postmortem inmediato, enviando los lóbulos hepáticos a estudio histopatológico, con conservación/fijación con (formol al 10%). Cuando falleció algún animal antes del término del período de observación, de la misma manera se le realizó estudio postmortem inmediato.
Además, se realizó determinaciones de laboratorio para deshidrogenasa láctica (DL), ácido láctico (AL), bilirrubinas totales (BT), transaminasa glutámico oxaloacética (TGO), transaminasa glutámico pirúvica (TGP), con muestras de sangre obtenidas de la vena cava inferior, en las 10 ratas por grupo de estudio. Se llevó a cabo con una jeringa de insulina de un mililitro a los 60 minutos de iniciada la reperfusión en los grupos II, III, IV y V y el grupo I a los 60 minutos posteriores a realizar la exploración de la cavidad abdominal.
Estadística: Para todas, se empleó la prueba estadística de Ji cuadrada, en función de valorar si existen diferencias entre los grupos de estudio en las muestras de laboratorio y se aplicó la prueba Exacta de Fisher para la sobrevida acumulada y para identificar diferencias estadísticas, con un valor de p <0.05 y T pareada para los grupos y sus variables respectivas.
¿ Resultados
A todos los grupos se les realizo el análisis estadístico Ji cuadrada, resultando diferencias entre los grupos por lo que se aplicó, la prueba estadística de T pareada en las determinaciones de TGO, TGP, DHL, AL y BT.
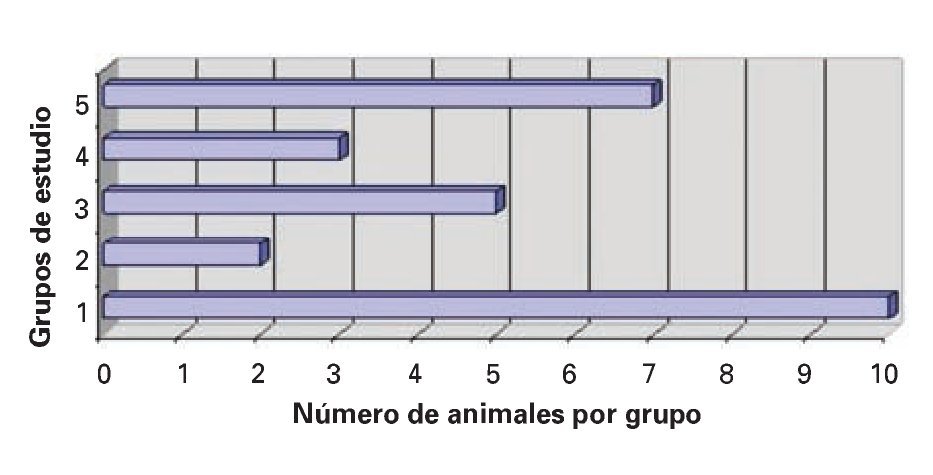
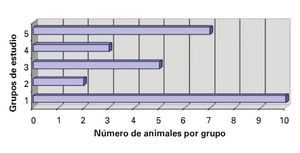
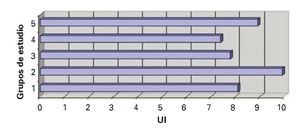
1. Sobrevida acumulada: En relación a la sobrevida acumulada, en el grupo I o SHAM, las 10 ratas sobrevivieron los siete días, que comprendió el tiempo estimado para el estudio de esta variable, que inició posterior al evento quirúrgico. Por el contrario, en el grupo II sobrevivió una de las 10 ratas, mientras que en el grupo III fueron cinco de 10 ratas, en el IV fueron tres y en el grupo V, ocho de 10 animales de experimentación, encontrándose diferencias estadísticas significativas (DES), a favor del grupo V, al compararse con los grupos II y IV, con un valor p <0.003; no se encontró DES con el grupo III (Figura 1).
¿ Figura 1. La sobrevida acumulada fue realizada a los siete días, posteriores al procedimiento quirúrgico, y en los grupos experimentales fue registrado el seguimiento después del evento isquémico y de la fase de reperfusión.
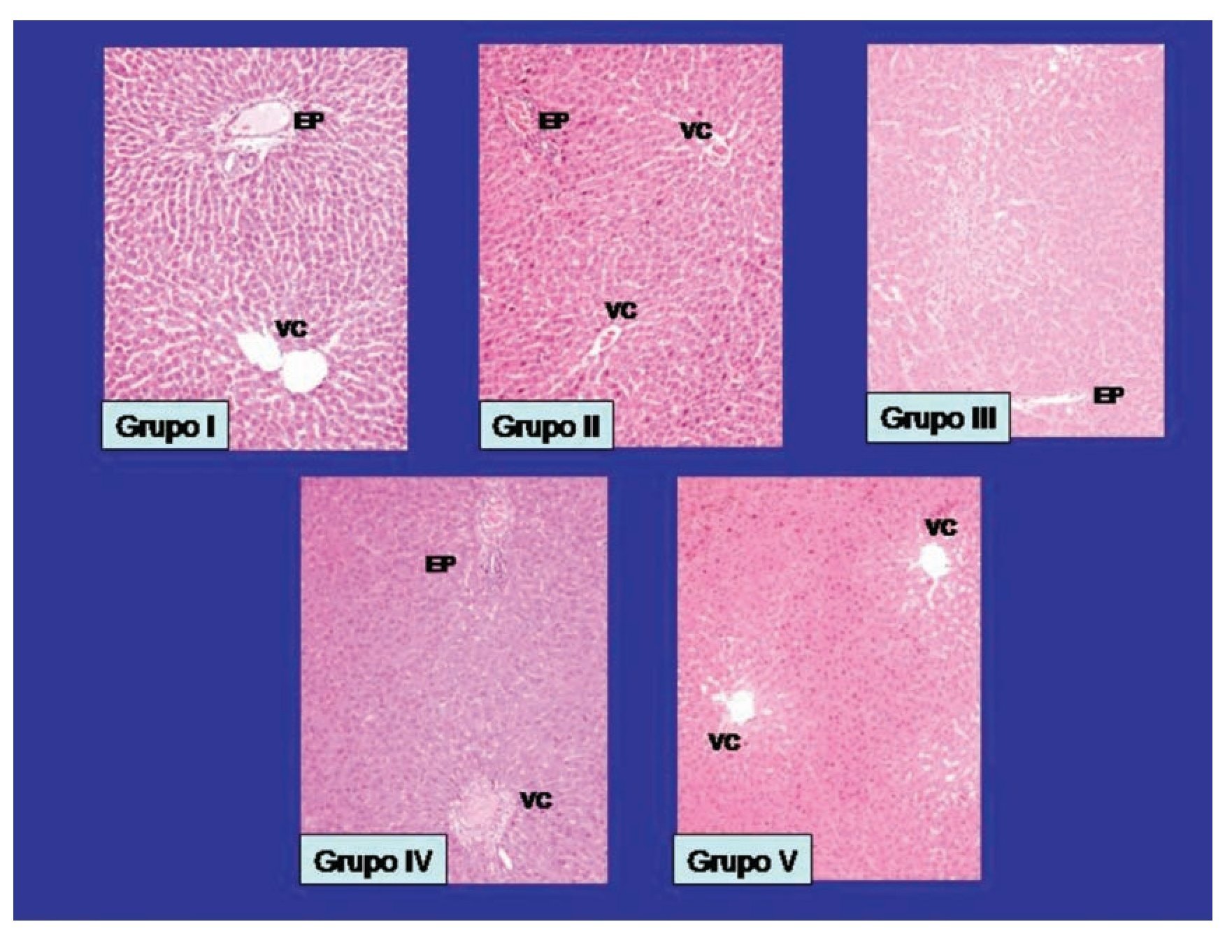
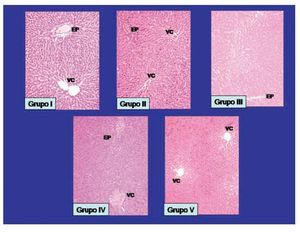
2. Biopsias hepáticas con tincion de hematoxilina y eosina: Se presentan en la Figura 2, una muestra representativa de las biopsias hepáticas de los grupos de estudio, las fotomicrografías se realizaron con la tinción de hematoxilina y eosina.
¿ Figura 2. Se presentan las fotomicrografías representativas de las biopsias de hígado, con una tinción de hematoxilina y eosina. Los hallazgos encontrados se presentan en el área de resultados en base a los datos de necrosis, infiltrado inflamatorio y congestión del parenquima hepático. Se muestran señalados los Espacio Porta (EP), y la Vena Central (VC). Ampliación 10 aumentos.
Necrosis: En relación al grupo I, no se observó datos de necrosis, mientras que en el grupo II, se presentó necrosis en ocho de 10 biopsias hepáticas estudiadas, en el grupo III en cuatro, en el grupo IV se observó datos de necrosis en siete y en el grupo V fueron dos muestras de hígado, existiendo DES entre el grupo V al compararse con los grupos II y IV, con una p <0.0004, no encontrándose DES al compararse con el grupo III.
Infiltrado inflamatorio: En relación al grupo I, no se observó infiltrado inflamatorio, mientras que en el grupo II, se presentó en nueve biopsias hepáticas analizadas, en el grupo III en tres, en el grupo IV en seis muestras, y relación al grupo V en tres ratas observó infiltrado inflamatorio en las 10 muestras revisadas. Existiendo DES, en los grupos II y IV, al compararse con los restantes grupos de estudio, con un valor de p <0.008.
Congestión: No se observó congestión en los sinusoides hepáticos en el grupo I, mientras que en el grupo II presentó una congestión severa en las 10 biopsias de hígado revisadas, en el grupo III se observó en cinco muestras hepáticas, en el IV fueron en siete biopsias evaluadas y en el grupo V se observó congestión en cuatro de las muestras revisadas, se demostró DES a favor del grupo V al compararse con el grupo II, no hubo DES con los grupos III y IV, con un valor de p <0.003.
3. Enzimas hepáticas séricas, ácido láctico y bilirrubinas: A todos los grupos se les realizo el análisis estadístico Ji cuadrada, resultando diferencias entre los grupos para las determinaciones de TGO, TGP, DHL, AL y BT. Los valores se midieron en unidades internacionales.
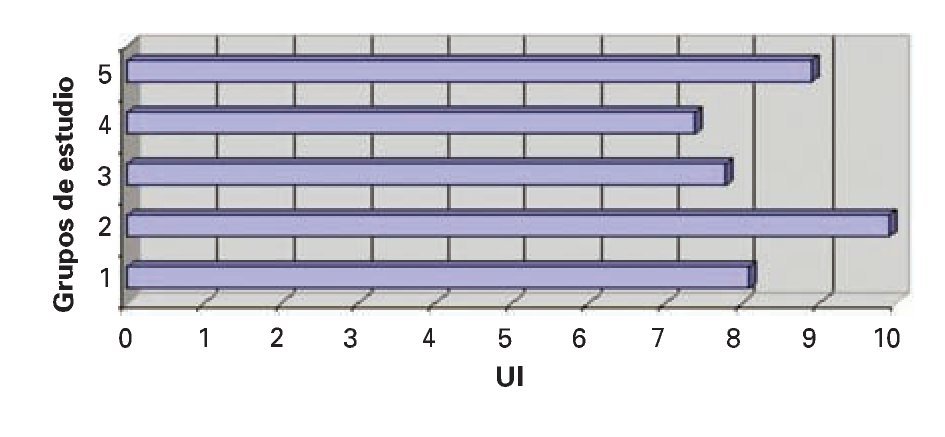
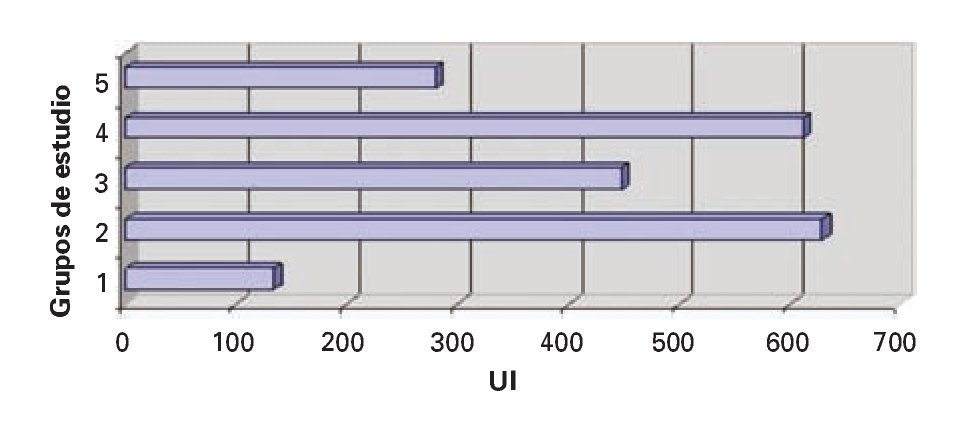
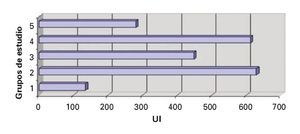
Bilirrubina total (BT): Se observó una mayor elevación en los valores de bilirrubina total en el grupo IV al compararse con datos de los grupos I, II, III y IV, aunque no se encontró diferencias estadísticamente significativas (DES) (Figura 3).
¿ Figura 3. Bilirrubina total.
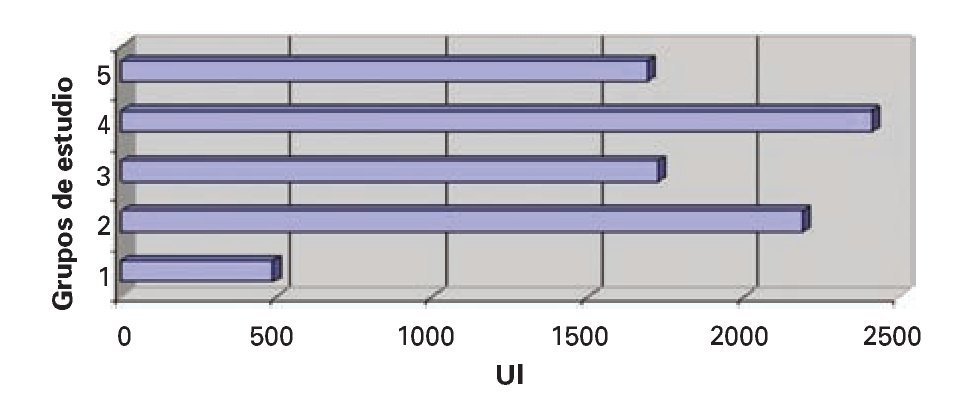
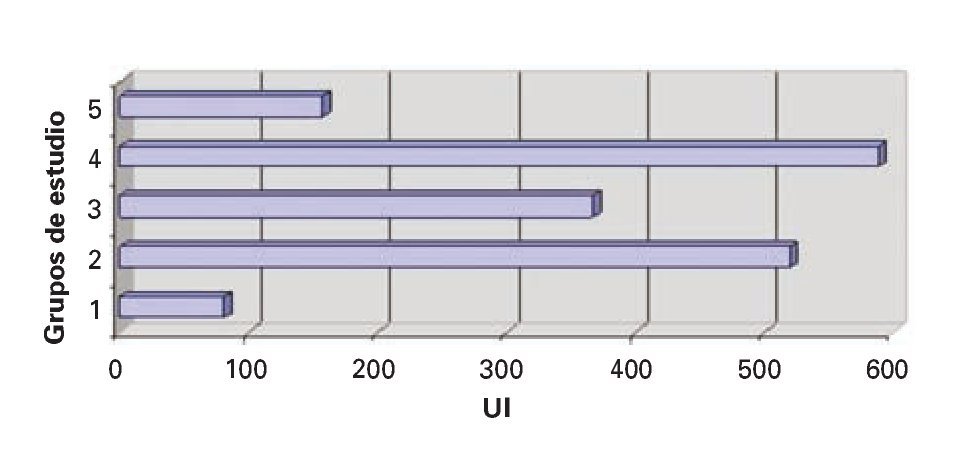
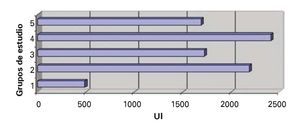
Deshidrogenasa láctica (DHL): Se evidenció DES en los valores de deshidrogenasa láctica en los grupos II, III y IV, en comparación con en el grupo IV (Figura 4).
¿ Figura 4. Deshidrogenasa láctica.
Ácido láctico (AL): En las determinaciones de AL, no se encontró DES, en ninguno de los grupos de estudio. No se muestra en figuras las variaciones de los grupos.
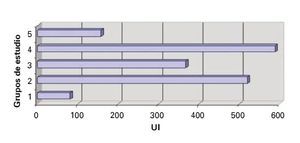
Transaminasa glutámico oxaloacética (TGO): En las muestras séricas de la transaminasa glutámico oxaloacética, se observó una mayor elevación en el grupo II y IV al compararse con los grupos III y IV. Entre estos dos grupos no se encontraron DES (Figura 5).
¿ Figura 5. Transaminasa glutámico oxalacética.
Transaminasa glutámico pirúvica (TGP): Asimismo, en los valores séricos de la transaminasa glutámico pirúvica, se observó una mayor elevación en el grupo II y IV al compararse con los grupos III y IV. Entre estos dos grupos no se encontraron DES (Figura 6).
¿ Figura 6. Transaminasa glutámico pirúvica.
Los resultados de laboratorio de las determinaciones por grupo, corresponden al rango de parámetros normales para el grupo de animales de estudio.
¿ Discusión
Se observó efecto protector de naloxona y piroxicam, durante el fenómeno de IRH, cuando fueron administrados conjuntamente, previo al evento isquémico y posterior a la fase de reperfusión en el modelo de isquemia caliente en rata. Se observó una mayor sobrevida de los animales en los grupos III, IV y V, que fueron tratados con estos fármacos comparados con el grupo experimental sometido únicamente a IRH sin aplicación de los fármacos como lo observado en el grupo II (Figura 1); así como una menor lesión histológica, conn base en las variables estudiadas, como fueron el infiltrado inflamatorio, congestión y necrosis (Figura 2) y con los resultados obtenidos en las determinaciones séricas de deshidrogenasa láctica, y transaminasas, no se observó efecto en los valores de bilirrubinas y ácido láctico (Figuras 3 - 6).
El emplear piroxicam y naloxona en el presente trabajo, brindó un efecto protector al hígado; de estos fármacos, piroxicam pertenece a la familiar de los AINE y su mecanismo de acción es primordialmente mediado por la regulación de las prostaglandinas, sintetizadas a partir del ácido araquidónico por la enzima prostaglandina H sintetasa o también denominada ciclooxigenasa (COX).16 Se han identificado dos enzimas: COX-1 y la COX-2; este AINE tiene un efecto mayor sobre la COX-1, enzima que se caracteriza por la regulación del tracto gastrointestinal, especialmente en estómago, así como a nivel renal y plaquetas,17 mientras que la actividad de la COX-2 se manifiesta en la respuesta inflamatoria,18 se ha aislado en el hipocampo, en órganos genitales femeninos y se han empleado en el tratamiento de varios tipos de cáncer como de piel, tiroides, páncreas, colon, mama y pulmón,19-23 así como su efecto en la carcinogenesis;20,24,25 por otro lado participa en la expresión genética como factor transcripcional.26,27
Como parte fundamental en la línea de estudios de nuestro grupo, es identificar sustancias que se puedan emplear en soluciones de preservación de órganos, o idealmente aplicarlos en la práctica clínica previo al evento isquemico.28 Como son las soluciones de preservación EuroCollins, de la Universidad de Winsconsin, HTK (histidine-tryptophan-ketoglutarate) y Celsior.29-32
En base en trabajos previos, el tiempo de isquemia de 60 minutos es adecuado para el presente modelo experimental, sin embargo 90 minutos parece ser el límite tolerable para recuperar la viabilidad del tejido hepático hipóxico, aunque se han planteado la posibilidad del pre-acondicionamiento hepático, con la finalidad de disminuir el grado de lesión y proporcionar un mayor tiempo total de isquemia, y menor daño histológico.33,34
Previamente comentamos que durante la lesión por IRH se liberan especies reactivas de oxígeno por la activación de las CK en el hígado pos-isquémico, estas ERO´s pueden dañar el ADN, las proteínas o los lípidos celulares, mediante la carbonilación de las proteínas o lipoeroxidación lípidica.35
Cuando el fenómeno de IRH total, se prolonga por más tiempo, el daño histológico puede ser irreversible, este efecto se disminuye al plantearse el modelo experimental de IRH parcial o segmentario, como el que empleamos en este trabajo, evitando la éxtasis esplácnica y translocación bacteriana intestinal.36
¿ Conclusión
De acuerdo con los resultados obtenidos en el presente estudio experimental, el grupo V fue en el que se observó mejores resultados en sobrevida y las variables histopatológicas; se evidencia que los fármacos administrados, naloxona y piroxicam, proporcionan un efecto protector adicional durante la lesión por IRH, cuando se aplica antes de la isquemia y después de la reperfusión de manera simultánea. Es necesario, continuar trabajando en la realización de protocolos de investigación, para evaluar su posible aplicación clínica.
¿ Agradecimientos
Al todo el personal médico y equipo técnico de la Unidad de Cirugía Experimental del Hospital General de México, en especial al Dr. Javier Rojero y Vallejo, a la Dra. Guadalupe Rojas Vargas, al Dr. Cuahtemoc Campos García Rojas y a la Enfermera Alicia Perez Jiménez por su valiosa ayuda a la realización de la fase quirúrgica del presente trabajo.
Correspondencia: Eduardo E. Montalvo Javé.
Circuito Universitario 3000. C.P. 04510. Delegación Coyoacán. México D.F. México.
Telefono y fax: 56 2321 6061.
Correo electrónico:montalvoeduardo@hotmail.com