El hígado es el principal responsable del metabolismo de nutrientes, fármacos y sustancias no farmacológicas. La hepatotoxicidad inducida por drogas (HTID) es la causa más frecuente de muerte asociada a insuficiencia hepática aguda (IHA); representa a nivel mundial cerca del 10% de los casos. La HTID puede ser intrínseca o idiosincrática, siendo más común esta última. Clínicamente, la HTID puede manifestarse por lesión hepatocelular, colestasis o ambas. El diagnóstico de HTID requiere siempre excluir otras causas de hepatopatía. La HTID es un problema clínico complejo de predecir, diagnosticar y tratar.
The liver is the principal responsible for nutrients, drugs and non-pharmacological substances metabolism. Drug-induced liver injury (DILI) is the most common cause associated with death by acute liver failure (ALF) and worldwide represents near of 10% of cases. DILI can be intrinsic or idiosyncratic, being most common the last one. Clinically, DILI can be manifest by hepatocellular injury, cholestasis or both. Diagnosis of DILI always requires excluding other causes of liver injury. DILI is a clinical problem complex to predict, to diagnostic and to treat.
¿ Introducción
El hígado es el principal responsable del metabolismo tanto de nutrientes, como de fármacos y sustancias no farmacológicas, esto lo hace susceptible de daño. La hepatotoxicidad inducida por drogas (HTID) es la causa más frecuente de muerte asociada a insuficiencia hepática aguda (IHA); representa a nivel mundial cerca del 10% de los casos. La HTID es la principal reacción adversa implicada en el abandono del desarrollo de futuros medicamentos en las fases preclínica o clínica, de negación de registros por parte de las agencias reguladoras, y de retiro del mercado o restricciones de uso después del registro del fármaco.1
La HTID puede ser intrínseca o idiosincrática. La intrínseca es aquella que depende de la dosis, es predecible y reproducible. Los fármacos que ocasionan lesión hepática de forma intrínseca pueden actuar directamente sobre el hepatocito, o a través de un compuesto tóxico generado durante su metabolismo.2 El fármaco que característicamente se relaciona con lesión hepática intrínseca es el acetaminofén (paracetamol).3 Otros ejemplos de hepatotoxicidad intrínseca son los producidos por el ácido acetilsalicílico, la intoxicación por setas (amanita phaloides) y las alteraciones hepáticas producidas por productos industriales, como el tetracloruro de carbono.1
La HTID idiosincrática es aquella que ocurre de forma impredecible y no depende de la dosis, ésta es la forma más común de HTID y se estima que ocurre entre 1/10 000 a 1/100 000 exposiciones.4
¿ Hepatotoxicidad por acetaminofén
El acetaminofén es una toxina dosis-dependiente. Cuando se ingiere, una pequeña fracción es metabolizada en el hígado formando un metabolito reactivo llamado N-acetil-p-benzoquinona imina (NAPQI), que normalmente es detoxificado (reducido) por el glutatión y la unión a grupos sulfhidrilo. En general, el cuadro de insuficiencia hepática aguda se presenta en pacientes con ingestión de dosis elevadas (> 10 g/día); en estas condiciones, el exceso de NAPQI agota rápidamente las reservas hepáticas de glutatión y el NAPQI libre es capaz de unirse a proteínas intracelulares ocasionando daño y muerte celular.5 Sin embargo, puede ocurrir daño hepático severo incluso a dosis de entre 3 a 4 g/día, sobre todo en pacientes susceptibles, con daño hepático crónico previo o alcohólicos.6,7
La elevación de aminotransferasas mayor a 3 500 UI/L se correlaciona altamente con toxicidad por acetaminofén. Niveles séricos bajos o ausentes de acetaminofén no lo descartan como causa de HTID, debido a que el tiempo de la ingestión puede ser remoto (varios días) o no conocido, especialmente en aquellos en quienes la sobredosis no fue intencional. Cuando la ingestión ocurrió pocas horas previas, puede administrarse carbón activado por vía oral, la dosis estándar es de 1 g/Kg de peso que ayuda a la descontaminación gástrica, esta medida es más efectiva si se aplica dentro de la primera hora de la sobredosis de acetaminofén, y puede tener algún beneficio entre las tres a cuatro horas. La administración previa de carbón activado no reduce la eficacia de la N-acetilcisteína (NAC), esta última es el antídoto específico del acetaminofén.8-10
La administración de NAC debe iniciarse lo antes posible, idealmente en las primeras 48 horas posteriores a la ingestión de acetaminofén. La dosis recomendada es 140 mg/Kg por vía oral o sonda nasogástrica (SNG) diluida en solución glucosada al 5% (SG5%), seguido de 70 mg/Kg por vía oral o SNG cada cuatro horas hasta completar 17 dosis. Si por algún motivo no es posible utilizar la vía oral, puede indicarse por vía intravenosa a dosis de carga de 150 mg/Kg diluida en SG5% para 15 minutos, seguido de 50 mg/Kg para cuatro horas y finalmente 100 mg/Kg para las siguientes 16 horas. Los efectos adversos son náusea y vómito, raramente urticaria o broncoespasmo; estas reacciones alérgicas habitualmente ceden al descontinuar la NAC, con antihistamínicos y epinefrina en casos de broncoespasmo.3
¿ Hepatotoxicidad idiosincrática
La mayoría de las reacciones idiosincráticas ocurren de cinco a 90 días después de la ingesta del fármaco. Sin embargo, puede ocurrir hasta 12 meses después.11 En la Tabla 1 se muestran algunos fármacos que pueden producir HTID idiosincrática.
Comparado con el daño hepático por acetaminofén, se conoce menos sobre la patogénesis de la HTID de tipo idiosincrático, en gran parte debido a la dificultad para reproducir las reacciones en modelos animales.12
Una hipótesis que explica la HTID idiosincrática es la generación de metabolitos reactivos durante las reacciones de biotransformación hepática de fase I, controladas por el citocromo P450 (CYP). La ausencia de un determinado CYP o la presencia de polimorfismo en uno o varios CYP, determinaría bien la inactivación del compuesto original (tóxico) o bien, la formación de metabolitos aberrantes (idiosincrasia metabólica). El resultado de este proceso es la presencia intracelular de radicales libres o compuestos electrofílicos que agotan el glutatión de los hepatocitos, se unen covalentemente a proteínas, lípidos o ácidos nucleicos o inducen lipoperoxidación. La lesión citotóxica culmina en la muerte celular por necrosis o apoptosis.1
El efecto citotóxico también puede ser secundario al estrés oxidativo que se genera durante el metabolismo de las toxinas. En situación de estrés oxidativo se produce una depleción de adenosin trifosfato (ATP), la oxidación de grupos sulfhidrilo de las proteínas, trastornos en la hemostasis iónica y un aumento sostenido en la concentración intracelular de calcio. Todo ello conduce a la pérdida de la integridad celular. En una minoría de casos el metabolito reactivo presumiblemente forma aductos con proteínas o con el propio CYP que lo ha generado, comportándose como un neoantíageno. Estos neoantígenos, formados a nivel del citosol, migran hacia la membrana celular bien vía vesicular o uniéndose a receptores de membrana de antígeno leucocitario humano (HLA), desde donde estimulan la respuesta inmune celular y humoral dirigida contra las células hepáticas, originando así las reacciones idiosincráticas inmunoalérgicas o por hipersensibilidad. En raras ocasiones, la HTID idiosincrática sobreviene por un fallo genéticamente condicionado en los sistemas enzimáticos de detoxificación (reacciones de fase II), encargados de neutralizar los metabolitos reactivos, los cuales pueden dar lugar a determinados síndromes como la colestasis, al inhibir transportadores específicos de la bilis, o a la esteatosis microvesicular y esteatohepatitis al alterar la β-oxidación mitocondrial.1,2,13,14
La colestasis inducida por fármacos ocurre debido a disrupción de los filamentos de actina cercanos a los canalículos o a la inhibición de bombas transportadoras. Los defectos en la proteína tres de multi-drogo resistencia (MDR3) conducen a excreción biliar defectuosa de fosfatidilcolina, y en consecuencia, originan la expresión de síndromes colestásicos de tipo familiar. Recientemente, mutaciones en el MDR3 se han implicado en predisposición a colestasis inducida por fármacos.2
¿ Clasificación clínica del daño hepático
Clínicamente el daño hepático puede manifestarse por lesión hepatocelular, colestasis o ambas. Tomando en cuenta las alteraciones en las pruebas de funcionamiento hepático, particularmente alanino aminotransferasa (ALT) y fosfatasa alcalina (FA), podemos clasificar el tipo de lesión de acuerdo con la siguiente fórmula:
(ALT paciente/ALT límite superior normal)/(FA paciente/FA límite superior normal)
Así, una relación menor a dos indica colestasis, mientras que una relación mayor a cinco es indicativa de lesión hepatocelular, y entre dos y cinco se considera daño mixto.2
Las manifestaciones clínicas son inespecíficas e incluyen malestar general, anorexia, náusea, vómito, dolor en hipocondrio derecho, hepatomegalia dolorosa. Cuando existe colestasis es común la ictericia, y puede haber acolia, coluria y prurito. La presencia de fiebre y rash son sugestivos de hipersensibilidad (ej.: fenitoína).14
En el paciente con HTID que desarrolla alteración en la coagulación (INR ≥ 1.5) y cualquier grado de encefalopatía, debe considerarse la progresión a IHA.3
¿ Diagnóstico: determinación de causalidad
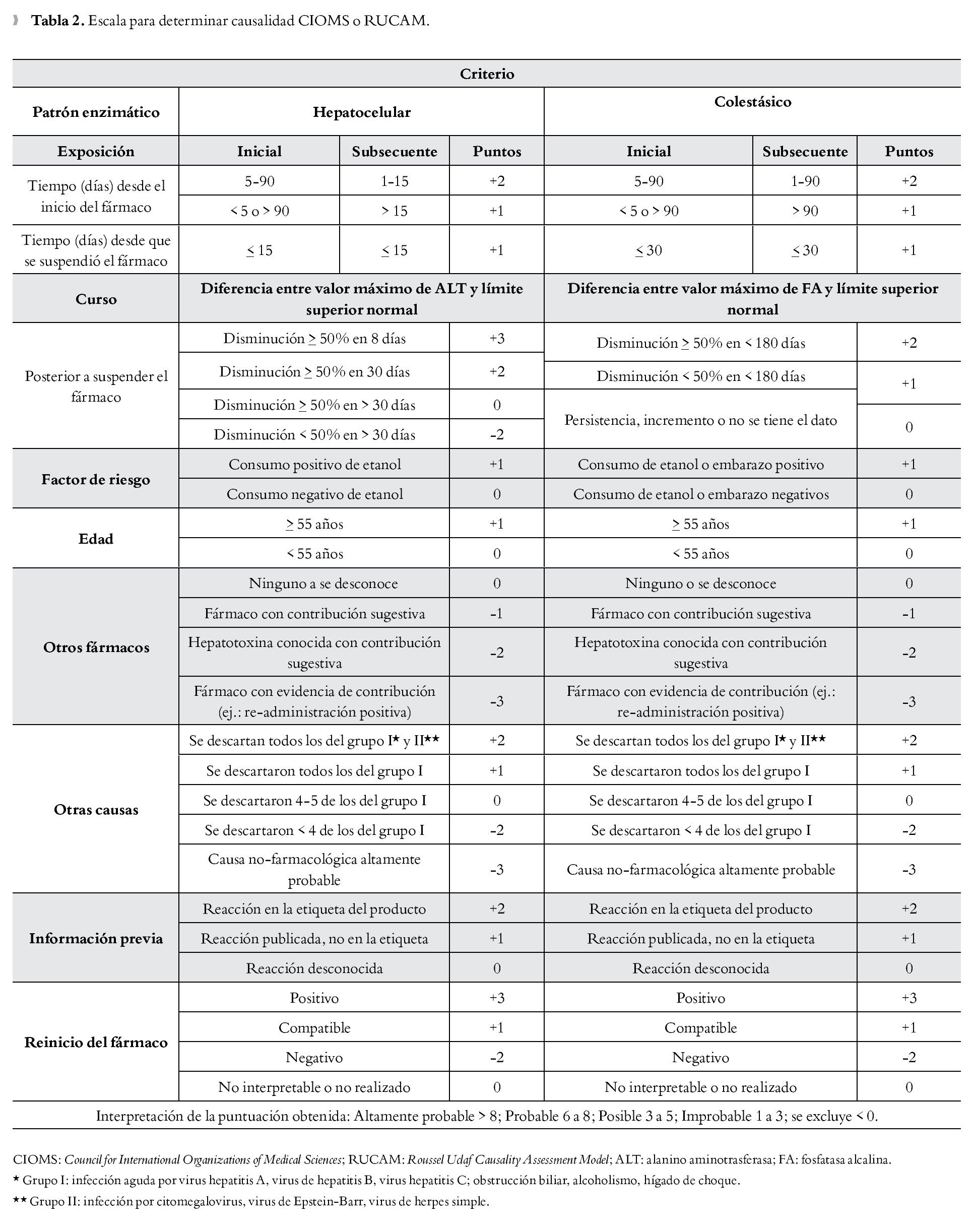
Llegar al diagnóstico de HTID amerita exclusión de otras causas de daño hepático. Existen además modelos de apoyo para el diagnóstico de HTID. El primero de estos modelos fue el Roussel Uclaf Causality Assessment Model (RUCAM), también conocido como CIOMS (por sus siglas en Inglés, Council for International Organizations of Medical Sciences). Este modelo incluye cuatro dominios principales: relación cronológica entre la administración del fármaco y la lesión, factores de riesgo, exclusión de otras causas y la existencia de lesión reportada con anterioridad (Tabla 2).15
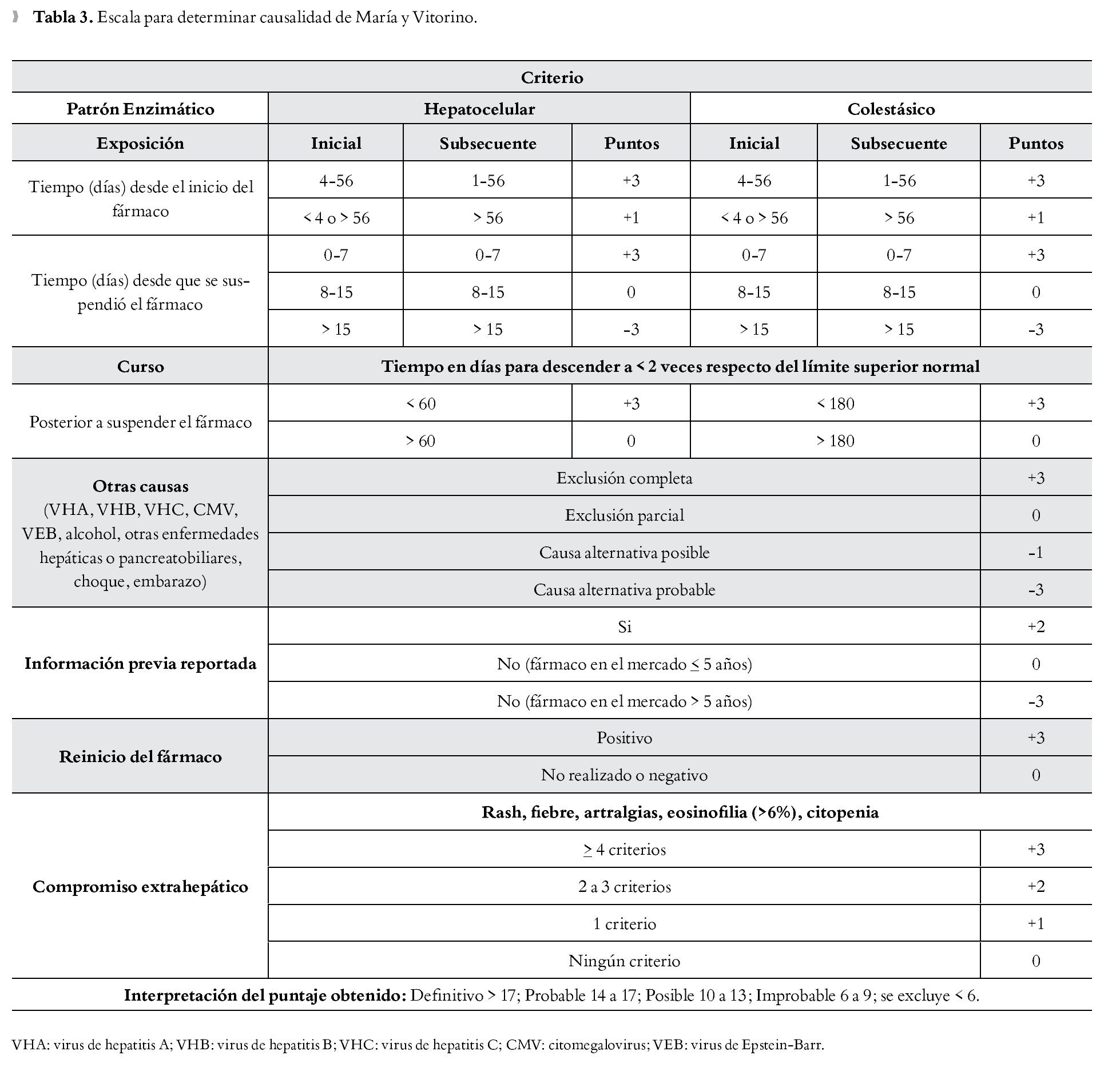
Otro modelo para determinar causalidad es el de María y Vitorino (MyV), desarrollado en Portugal. Esta escala toma en cuenta cinco componentes: 1) relación temporal entre el consumo de la droga y la aparición del cuadro clínico, 2) la exclusión de otras causas, 3) manifestaciones extrahepáticas, 4) re-exposición y, 5) el informe previo de la literatura médica. En el grupo de estudio original que desarrolló y validó la escala se obtuvo un acuerdo de 86% de los casos, que corresponde a una kappa ponderada de 0.93; así, la escala clínica demostró tener un nivel alto de validez y fiabilidad entre los evaluadores, así como una buena capacidad discriminatoria entre los diferentes niveles de probabilidad (Tabla 3).15,16
¿ Daño hepático por herbolaria
Frecuentemente el consumo de productos herbolarios o comúnmente denominados "naturistas", no cuenta con una regulación sanitaria apropiada y se pueden comprar libremente. Diversas hierbas y preparados herbales han sido implicados como causa de daño hepático tanto en forma aguda como crónica. Algunas hierbas con toxicidad demostrada son Teucrium chamaedrys (camedrio o germander), Celedonium majus (celandina mayor), Piper methysticum rhizoma (kava-kava), Larrea tridentata (chaparral o gobernadora), Cassia angustifollia (senna), Camellia sinensis (té verde), Cimifuga racemosa (cohosh negro).17- 20
• Teucrium chamaedrys (camedrio o germander)
Los usos más comunes de esta planta son como diurético, colerético, antiséptico, antipirético y adelgazante. En Francia, en 1992 fue retirado del mercado tras la comunicación de 30 casos de hepatotoxicidad. El tipo de daño que produce es intrínseco, el mecanismo patogénico radica en el metabolismo a través del CYP de los componentes furano-diterpenoides, cuyos metabolitos electrofílicos agotan las reservas de glutatión y proteínas tiólicas. El tipo de lesión más común es la hepatitis citolítica aguda con un periodo de latencia medio de dos meses. El tiempo de recuperación es variable, desde mes y medio hasta seis meses, aunque se han descrito tres casos de cronificación y algunos casos de hepatitis fulminante.21-25
• Celedonium majus (celandina mayor)
Sus principales usos son como colerético y antiespasmódico. La planta está compuesta por más de 20 alcaloides. El mecanismo de hepatotoxicidad es idiosincrático, probablemente de tipo inmunoalérgico.26-28
• Piper methysticum rhizoma (kava-kava)
Es una planta nativa de las islas del Pacífico Sur, se emplea como ansiolítico, antidepresivo, somnífero y analgésico, debido al efecto agonista sobre receptores del ácido gama amino butírico (GABA) de las sustancias conocidas como kavapironas. El mecanismo de hepatotoxicidad parece ser idiosincrático asociado a tres diferentes mecanismos: inhibición del CYP, reducción del glutatión intracelular, e inhibición de la ciclooxigenasa.19
• Larrea tridentata (chaparral o gobernadora)
Esta planta crece en los desiertos de Norteamérica y en las zonas desérticas del Norte de la República Mexicana. Se le conoce como gobernadora debido a su habilidad para inhibir el desarrollo de otras plantas a su alrededor, y obtener de ese modo más agua. Su principal ingrediente activo es el ácido nordihidroguaiarético (NDGA), inhibidor de las ciclo y lipooxigenasas, se emplea como antioxidante, antimicrobiano, antiinflamatorio y analgésico. Contiene además lignanos que poseen actividad estrogénica. La hepatitis colestásica es la forma clínica más común de daño hepático. El mecanismo patogénico sugerido es la inhibición del CYP por el NDGA.29-32
• Cassia angustifollia (senna)
Ampliamente utilizado como laxante, debido a su contenido de senósidos A y B. Estas antraquinonas pueden ser convertidas en antrón por las bacterias intestinales, este puede ser el responsable de los efectos hepatotóxicos debido a su similitud con en dantrón o crisazina, un compuesto orgánico con potencial hepatotóxico y carcinogénico demostrado.33
• Camellia sinensis (té verde)
Ampliamente utilizado para tratamiento de la obesidad y como antioxidante. Se ha demostrado que produce daño hepático mixto en humanos, el mecanismo exacto que genera hepatotoxicidad es desconocido; en ratas se ha demostrado toxicidad hepática por el componente galato de epigalocaterol.34-36
• Cimifuga racemosa (cohosh negro)
Los preparados herbales a base de esta planta se utilizan para tratar los síntomas de la posmenopausia y las alteraciones menstruales. El mecanismo exacto por el cual esta planta se asocia con toxicidad hepática se desconoce, pero se ha reportado la inhibición del CYP 3A4 y del CYP 2D6. La presentación clínica es diversa, se han reportado casos de hepatitis aguda similar a hepatitis de tipo autoinmune, hepatitis subaguda y hepatitis crónica.37-43
¿ Consideraciones terapéuticas
En el caso de la HTID de tipo idiosincrático no existen antídotos específicos.3 Siempre deberá suspenderse el fármaco o agente causal. Los corticoesteroides no están indicados a menos que se sospeche reacción de hipersensibilidad, sobre todo en aquellos pacientes que además cursan con fiebre, rash, eosinofilia. En pacientes con colestasis puede ser de utilidad la administración de ácido ursodesoxicólico o colestiramina, sobre todo para mejorar el prurito.14
En pacientes con daño hepatocelular severo puede presentarse IHA, en estos casos es importante considerar y dar manejo de soporte oportuno a alteraciones que afectan sistema nervioso cerebral, infecciones, coagulopatía, hemorragia de tubo digestivo, alteraciones hemodinámicas, metabólicas y en el funcionamiento renal. En ocasiones, el tratamiento definitivo será el trasplante hepático.3
¿ Conclusiones
La HTID es un problema clínico complejo de predecir, diagnosticar y tratar. Cuando se han descartado otras causas de hepatopatía y/o colestasis intrahepática debe sospecharse e investigarse. Cabe recordar que muchos productos de origen herbolario o comúnmente denominados "productosnaturistas", son también potencialmente hepatotóxicos y debe interrogarse acerca de su consumo cuando existe la posibilidad de HTID.
¿ Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
¿ Financiamiento
Los autores no recibieron ningún patrocinio para llevar a cabo este artículo.
Correspondencia:
María de Fátima Higuera de la Tijera,
Hospital General de México, Gastroenterología Unidad 107 (Clínica de Hígado),
Dr. Balmis 148, Colonia Doctores, Delegación Cuauhtémoc, C.P. 06720, México D.F., México.
Teléfono: 27 89 2000, ext 1523.
Correo electrónico: fatima-higuera@hotmail.com