¿ Introducción
Las enfermedades trombóticas son responsables de más de la mitad de las muertes en las sociedades desarrolladas.1 La incidencia anual de la trombosis venosa se incrementa de uno en 100 000 durante la infancia, hasta uno por 100 en los adultos mayores.2
En la actualidad, la trombofilia ha tenido un notable incremento como causa de morbi-mortalidad; esto al adquirir factores de riesgo propios de la vida moderna y por el importante desarrollo de algunas sociedades. En función de las características geográficas, raciales y socioculturales, se puede decir que se trata de un problema universal.3
Salwa Khan y colaboradores definen trombofilia como la predisposición a formar coágulos de manera inapropiada, donde puede originarse por factores genéticos, cambios adquiridos en el mecanismo de la coagulación o más comúnmente, por interacción entre factores genéticos y adquiridos.2,4,5
Uno de los defectos familiares descritos en 1965, fue realizada por Egeberg; los miembros de la familia sufrían trombosis venosas recurrentes y el trastorno tenía un patrón hereditario autosómico dominante. Se evidenció la deficiencia de la antitrombina (AT).6,7 Desde este descubrimiento, muchos estudios han demostrado más de 250 diferentes mutaciones para la deficiencia de antitrombina y los riesgos asociados con este desorden. En 1983, Broekman y colaboradores estudiaron tres familias danesas; descubrieron la deficiencia de proteína C, confirmando que se trataba de una enfermedad autosómica dominante y de un desorden poligénico, con expresión variable. Años más tarde se descubrió la deficiencia hereditaria del cofactor de la proteína C y S.3,8 En 1993 múltiples factores genéticos aumentaron el riesgo de trombosis, describiendo la resistencia de la proteína C activada (RPCa), lo que ocasiona cambios dramáticos en el diagnóstico y tratamiento de los eventos trombóticos venosos. Dahlback y colaboradores describieron una familia del sur de Suiza en la que se sucedían trombosis recurrentes, demostrando que el tiempo de la activación parcial de tromboplastina no se prolongaba al adicionar PCa (PCA inactiva Factor Va y FVIIIa, disminuyendo la disponibilidad de la trombina), es decir, su plasma era "resistente" a la acción de la PCa. Se introdujo entonces el concepto de resistencia a la proteína C activada (RPCa).2,9 En 1994, Bertina y colaboradores en la Universidad de Leiden, identificaron que el fenotipo de la RPCa está asociado a la homocigocidad o heterocigocidad de la mutación en el punto del exón 10 del gen del factor V, en el que la sustitución de un nucleótido G por A en la posición 1691 produce la síntesis de una molécula anómala del factor V, denominándolo Mutación del Factor V de Leiden.10,11
La incidencia real de la trombofilia primaria no se conoce bien, puesto que aún no se establecen todas las alteraciones genéticas que ocasionan una tendencia mayor a la trombosis, que existen diferencias raciales sustanciales; y que aun en un mismo país existen resultados diferentes, sin embargo, se ha estimado una incidencia aproximada en la población general de 1:2,500 a 1:5000. Ejemplo, la prevalencia más alta del Factor V de Leiden se encuentra en Suecia con 15%, mientras que en Alemania es de 10%; Holanda, Reino Unido y USA de 3% a 5%. España e Italia de 2%, Venezuela de 1.6%, Argentina de 5.1%, Costa Rica de 2%, Brasil 2% y Chile 3.8%.12 Un estudio realizado en 2007 por Middeldorp y colaboradores, informaron que en población general que donó sangre, la prevalencia de deficiencia de antitrombina es de 1:300 y la deficiencia de proteína C entre 1:200 y 1:500. La mutación del Factor V de Leiden y la mutación del gen de la Protrombina 20210 varían en Europa entre 2% a 7% y 1% a 3%, respectivamente.13
El riesgo de trombosis es muy bajo antes de los 15 años; a partir de ese momento, se incrementa en 2% a 4% por año. A los 50 años de edad, de 50% a 70% de los enfermos con trombofilia primaria, han desarrollado algún tipo de trombosis.14,15 Aproximadamente la mitad de ellos tiene trombosis espontánea, sin relación con otro factor de riesgo. El resto de los enfermos presentan algún evento trombótico asociado a cirugía, traumatismos, embarazo, inmovilización o ingesta de anticonceptivos orales.16 De las trombofilias primarias las deficiencias de AT, PC y PS se estima en menos de 15%; de estas deficiencias, es más frecuente la de PC, con una estimación de 1:500, en comparación a la deficiencia de AT de 1:5000.17,18 Por otra parte la causa más frecuente de trombofilia primaria, la RPCa se estima en una incidencia de 3% a 7% en población caucásica y se presenta en aproximadamente en el 50% de los casos de trombosis.19,20
¿ Métodos
De una cohorte de 200 casos con trombosis arterial y venosa (cerebral, pulmonar, mesentérica o de miembros pélvicos), de diferentes instituciones de salud (Instituto Nacional de Neurología, Hospital siglo XXI, Gabriel Mancera y Hospital General de México), se seleccionó a 72 pacientes para determinar los siguientes estudios: Leiden (FV R506Q), protrombina 20210A y metil-tetrahidrofolato reductasa al igual que la cuantificación de la proteína C, proteína S, antitrombina, plasminógeno y resistencia a la proteína C activada, con objeto de determinar la prevalencia alteraciones hemostáticas relacionadas con el evento trombótico.
Diseño del estudio: Transversal analítico, en una cohorte de pacientes con trombosis. Criterios de selección: pacientes mayores de 16 años, menores de 45 años, de cualquier sexo, con diagnóstico de trombofilia con uno o más eventos trombóticos arterial o venoso.
Estadística: Descriptiva. Se llevó a cabo con las variables correspondientes a medidas de tendencia central y de dispersión: media, desviación estándar, mediana y percentiles 25 y 75. El análisis estadístico se realizó con el programa SPSS versión 17.0.
Procedimiento de laboratorio:
Toma de muestra: Las muestras de sangre periférica se obtuvieron con el sistema Vacutainer®, en tubos con anticoagulante EDTA se separaron las células mononucleares para la técnica de reacción en cadena de la polimerasa.
Obtención de las células mononucleares por gradiente de densidad:
1. Las muestras se obtuvieron en tubos con EDTA (dos tubos de 5 mL); se les adicionaron 10 mL de solución amortiguadora de fosfatos (PBS) y posteriormente se mezclaron suavemente por inversión.
2. En un tubo cónico para centrífuga de 15 mL, se le adicionó Ficoll-Hypaque con una densidad 1.077.
3. Al tubo que contenía el Ficoll, se le adicionó la mezcla de sangre con EDTA y PBS cuidadosamente sin romper el gradiente de densidad.
4. Se centrifugó durante 30 minutos a 1500 rpm a 4°C.
5. Con una pipeta Pasteur, se retiró la interfase donde se encuentran las células mononucleares y se colocaron en otro tubo de centrífuga de 15 mL y se llenó con PBS hasta 10 mL.
6. Se centrifugó por 10 minutos a 2500 rpm a 4°C.
7. Se decantó completamente el sobrenadante y se re-suspendió el botón celular.
8. Se adicionaron nuevamente 10 mL de PBS y se re-centrifugó durante 10 minutos a 2500 rpm a 4°C.
9. Se decantó completamente el sobrenadante y se adicionaron 100 μL de solución amortiguadora B.
10. Se congelaron a -70°C hasta la extracción del DNA.
Extracción de DNA: Se realizó por el método de DNAzol:
1. Se descongeló la muestra de células mononucleares del tubo eppendorf de 1.8 mL y se conservó en solución amortiguadora B a -70°C.
2. Se agregó a este tubo 1 mL de DNAzol. Se mezcló por inversión y se centrifugó por 10 minutos a 10 000 rpm a 4°C.
3. Después de la centrifugación, se transfirió el sobrenadante viscoso a un tubo limpio de vidrio.
4. El DNA se precipitó al adicionarle 0.5 mL de etanol al 100%. Se mezcló por inversión de los tubos de cinco a ocho veces y se almacenó a temperatura ambiente por uno a tres minutos. Se aseguró que el DNAzol y el alcohol absoluto se mezclaran para formar una solución homogénea.
5. Se removió el DNA con una punta de pipeta. Se mezcló dando vueltas sobre la punta y se sujetó sobre la pared del tubo cerca de la parte superior por deslizamiento suave. Se transfirió el DNA a un tubo limpio. Se almacenaron los tubos verticalmente por un minuto dejando que el DNA se fuera al fondo del tubo y removiendo del fondo de los tubos el resto del lisado homogéneo.
6. El DNA precipitado se lavó dos veces con 1 mL de etanol al 75%. En cada lavado se resuspendió el DNA en etanol por inversión del tubo de tres a seis veces. Se almacenaron los tubos verticalmente por un minuto para permitir que el DNA se fuera al fondo de los tubos y se removió el etanol por pipeteo o decantándolo.
7. El DNA precipitado se suspendió en 100 μL de TE 0.1X
Determinación de la Concentración y pureza del DNA obtenido:
1. A 7 μL de la suspensión se le adicionaron 663 μL de TE 0.1X.
2. Se preparó otro tubo con solución TE 0.1X que se ocupa como blanco de lectura.
3. En un espectofotómetro se leyó a una longitud de onda de 260 y 280 nm.
4. Con base en los resultados se obtuvo la concentración, multiplicando la lectura de 260 nm de longitud de onda por 100 por 0.05.
5. Una vez obtenida la concentración y pureza el DNA se almacenó a 4°C hasta su uso.
¿ Resultados
Características Generales: De una cohorte de 200 casos con el diagnóstico de trombofilia primaria, de acuerdo a los criterios establecidos por la Sociedad Internacional de Hemostasia y Trombosis (ISTH), se seleccionó a 72 pacientes para este estudio.
Las características de los pacientes estudiados fueron: 53 mujeres (73.6%) y 19 hombres (26.4%) con rango de edad de 16 a 45 años y promedio de 34.8 años. Todos los pacientes tenían al menos un evento trombótico antes de los 45 años.
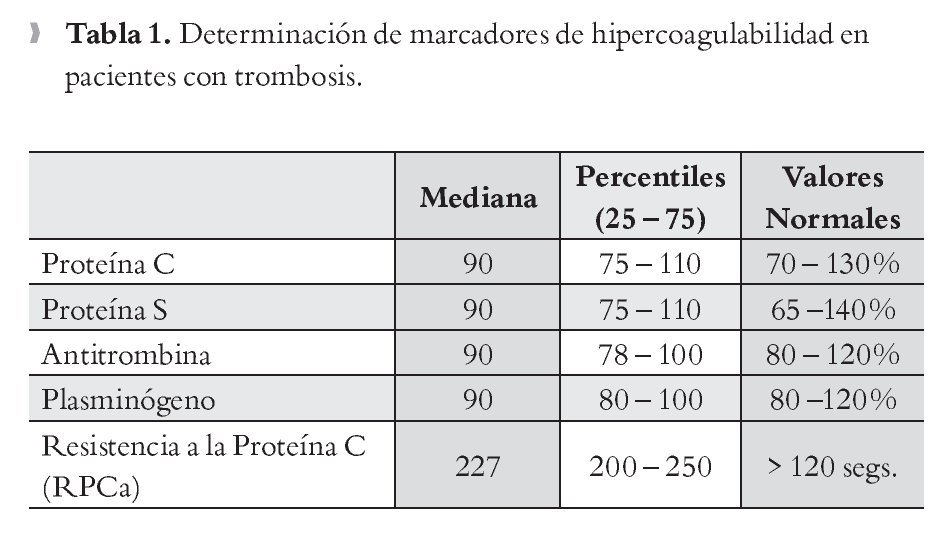
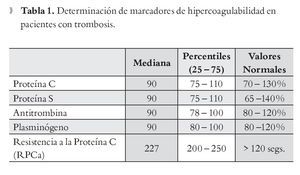
Pruebas Básicas de Hemostasia: A todos los pacientes incluidos en el estudio se les efectuaron las pruebas de valoración en hemostasia, con objeto de determinar variaciones que pudieran modificar las concentraciones de las pruebas para determinar un estado de trombofilia. Los resultados muestran los valores de la mediana y percentiles de las pruebas de hemostasia que incluyeron: cuenta de plaquetas, tiempos de coagulación, cuantificación de factores de la coagulación y dímeros-D. Estos valores no mostraron variaciones clínicamente significativas con respecto a los valores normales de referencia.
Valoración de Hipercoagulabilidad: Se realizaron pruebas hemostáticas a través de la determinación de marcadores de hipercoagulabilidad como la proteína C, proteína S, antitrombina, plasminógeno y RPCa obteniendo la mayoría de los resultados dentro de los parámetros normales, solo algunos pacientes presentaron valores alterados (Tabla 1).
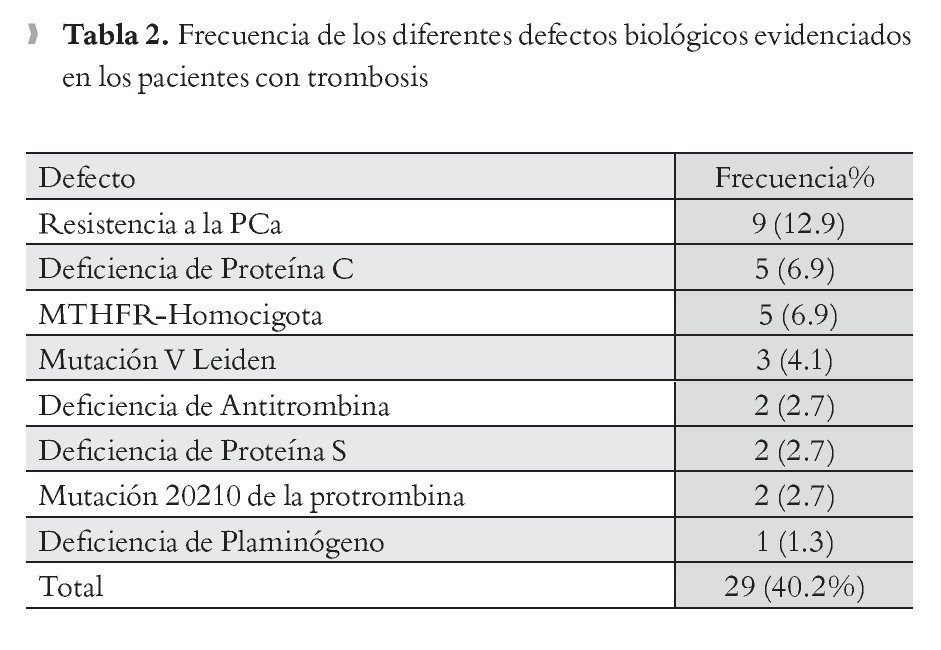
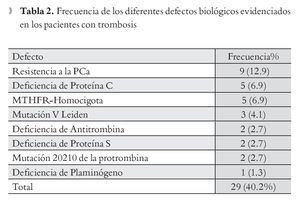
Frecuencia de Trombofilias Primarias: En el análisis global de las pruebas de trombofilia se encontraron los resultados que se muestran en la Tabla 2 para los pacientes con trombosis, de los 72 estudiados, 29 pacientes (29.1%) presentaron las siguientes alteraciones: RPCa nueve casos (12.9%); deficiencia de proteína C en cinco casos (6.9%); MTHFR homocigota cinco casos (6.9%); deficiencia de proteína S, dos casos (2.7%); deficiencia de antitrombina, dos casos (2.7%); Mutación 20210 de la protrombina dos casos (2.7%); deficiencia de plasminógeno un caso (1.6%) y Mutación de FVL tres casos (4.1%).
Sitios de trombosis: En relación con la localización de los eventos trombóticos, se encontraron las siguientes: Trombosis venosa profunda (TVP) de miembro pélvico izquierdo 44.4%, seguido de la TVP de miembro pélvico derecho con 15.3%, trombosis cerebral 13.9% y 8.3% tuvieron el diagnóstico de tromboembolia pulmonar. En 9.7% las localizaciones fueron subclavias y axilares. Se presentaron en seis casos (8.3%) de trombosis bilateral.
¿ Discusión
La trombosis se define como un estado clínico alterado, en el que existe una predisposición a la formación de un trombo, el cual puede presentarse tanto en territorio venoso como arterial y puede ser localizado o embolizar. La trombosis usualmente se presenta en venas profundas de miembros inferiores, aunque también puede presentarse en el cerebro, en la retina o en el mesenterio. Algunos individuos experimentan solamente un episodio trombótico único, y otros pueden presentar múltiples eventos, los cuales se deben a diferentes factores que pueden ser adquiridos dando lugar a la trombofilia secundaria ocasionada por factores conocidos que generalmente son de corta duración como por ejemplo el embarazo, infecciones, obesidad, inmovilización y la ingesta de anticonceptivos orales, o también se debe a factores hereditarios que dan lugar a la trombofilia primaria. Los factores hereditarios, incrementan la tendencia.
Se analizaron las pruebas de hemostasia de 72 pacientes en quienes todos los valores se encontraban prácticamente en rangos normales. En cuanto a las pruebas de hipercoagulabilidad se encontraron alteraciones en 29 casos, lo que estadísticamente se traduce en una prevalencia de 40.2%.
Está bien determinado que estas deficiencias son responsables de trombosis en edad temprana, de hecho la prevalencia más frecuentemente informada es la RPCa que constituye la expresión fenotípica de un defecto molecular localizado en el factor V de la coagulación como originalmente lo describió Dahlback, y a la cual se le atribuye la principal causa de trombosis venosas;1 sin embargo, en este estudio se demostró una baja prevalencia, tres casos con la mutación del factor V Leiden. En nuestro estudio en población mexicana, se evidenció la mutación G20210 del gen de la protrombina en dos pacientes, con una prevalencia de 1.7%, lo que también implica una baja penetrancia de este defecto y probablemente en general en la población mexicana.
El encontrar prevalencia baja de mutaciones atribuibles al Factor V Leiden y a la G20210 de la protrombina, con valores similares a lo previamente publicado en Brasil, hace pensar que estos dos defectos son importados de la población Europea y que sí juegan un papel muy importante las diferencias raciales.2
Se han descrito nueve mutaciones termoestables en el gen de MTHF, el cual se localiza en el cromosoma 1p36.3. La mutación termolábil más común de la MTHFR es la C677T, una mutación autosómica recesiva, en la que se sustituye una alanina por una valina en la proteína, creando un sitio de restricción para la enzima Hinf I. La mutación homocigota se caracteriza por una disminución en la actividad en cerca de 50% en la capacidad de donar grupos metilo a la enzima metionina sintetasa, con lo que disminuye la velocidad de conversión de homocisteína hacia metionina, elevándose los niveles de homocisteína. La prevalencia de este polimorfismo varía con la población norte de Italia (26%), Sur de Italia (8%); oeste de África (33%).4 La incidencia de mutación heterocigota es más frecuente que la homocigota, mismo resultado que en este estudio, demostrándose 48 pacientes heterocigotos y cinco homocigotos.
En nuestro estudio con 72 pacientes, 29 pacientes (40.2%) presentaron algún defecto primaria para trombofilia, en 60% no se identificó alguna causa de trombofilia primaria, y no existió algún factor de riesgo que desencadenara la patología, por lo que se abre una puerta a la investigación, ya que pueden existir algunos otros factores que hasta el momento no se han descubierto y en los que efectivamente, las diferencias raciales podrían contribuir a esta causa.
¿ Conclusiones
La prevalencia de RPCa sin relación con la mutación del FV Leiden y/o mutación del G20210, nos hace sospechar que ésta sea atribuida a otras causas que hasta el momento no se han detectado. La presencia de homocigotos de la MTHFR es de 7% en población mexicana, lo cual constituyó el defecto primario más frecuente. Con el aporte adecuado de Ácido fólico o B12, se puede prevenir esta patología. Existe todavía un grupo importante de pacientes con trombosis donde no se pudo identificar la causa por pruebas de laboratorio, por lo que deben efectuarse estudios con los que se identifiquen otras razones no conocidas, como polimorfismos del PAI-1, de la Glucoproteína IIb/IIIa o por incremento en los factores de la coagulación
No debe subestimarse el diagnóstico de TVP; éste debe sospecharse y estudiarse a profundidad en todos aquellos pacientes que desencadenan un cuadro de trombosis, venoso o arterial, en edades tempranas y sin algún factor de riesgo o causas secundarias con la finalidad de prevenir eventos trombocitos recurrentes.
Correspondencia: Dr. Carlos Martínez-Murillo.
Dr. Balmis N°148, Col. Doctores, México D. F.
Correo electrónico:carlmarz@prodigy.net.mx