¿ Introducción
El gen MDR-1 se localiza en el brazo largo del cromosoma 7, codifica para una proteína de 170 kDa, también conocida como glicoproteína P (gP).1,2 Este gen forma parte de una familia que tiene dos miembros en los humanos (MDR1, MDR2/3).2,3 La glucoproteína pertenece a la superfamilia de proteínas ABC (casete de unión de ATP) especializadas en el transporte celular dependiente de energía, que participa en un amplio rango de eventos como la expulsión de sustancias nocivas, secreción de toxinas y movilización de iones y péptidos.1-4 La gP está compuesta por una cadena de aproximadamente 1280 residuos de aminoácidos con dos mitades homólogas y 12 dominios transmembranales.1-3 Presenta dos zonas de unión al ATP ubicadas en la parte citoplasmática, un sitio de glucosilación entre el primero y el segundo dominio transmembranal y varios sitios de fosforilación. Se especula que las drogas pasan a través de un poro hidrofóbico formado por un dominio transmembranal y que la salida de sustancias requieren un cambio conformacional de la proteína dependiente de energía.5,6 La gP constituye un sistema de desintoxicación natural que se expresa en varios tejidos normales, como hígado, intestino delgado, riñón, placenta, células endoteliales del sistema nervioso central y testículo.7 La mayoría de los sustratos antitumorales de la gP son los alcaloides de la Vinca como lo son la vincristina y la vinblasina, atraciclinas como daunorrubicina y doxorrubicina, las epipodófilotoxinas como el etopósido y tenopósido y más recientemente los Inhibidores de cinasa de tirosina.2,3 La expresión de este gen se ha observado en diferentes neoplasias como el sarcoma indiferenciado,8 carcinoma hepatocelular,9-11 linfoma nasal de células T,12 cáncer mamario,13,14 neoplasias hipofisiarias,15 cáncer de células germinales16 y leucemias,17,18 siendo en gran medida, la responsable de la respuesta al tratamiento. En las leucemias agudas, diversos factores se han relacionado con la supervivencia y éxito del tratamiento; los principales son: la edad al diagnóstico, la cifra inicial de leucocitos,19 el inmunofenotipo, las diversas alteraciones citogenéticas y moleculares,20 el género y, en especial, la respuesta al esquema de inducción a la remisión. Este último factor depende en gran medida de la presencia o ausencia de la expresión de los genes de resistencia a multidrogas.21-23 En las leucemias agudas tanto mieloides (LAM) como linfoides (LLA), la expresión del gen MDR-1 se ha asociado a una falla al tratamiento de inducción y por ende a una menor tasa de supervivencia.1,5,17,24 La frecuencia de expresión en LAM al diagnóstico es cercana a 33%, sin embargo en la recaída, se ha informado hasta de 40%. En el caso de LAL al diagnóstico, no se ha informado la presencia de este gen, sin embargo ante la recaída, la frecuencia es en promedio de 35%.25 Actualmente se desconocen los factores que propician el aumento en la expresión de este gen, sin embargo su sobre-expresión en pacientes en recaída, es un indicativo para un pronóstico desfavorable. La frecuencia de expresión de este gen en la población mexicana se desconoce y no existe algún estudio molecular que relacione su expresión, con la respuesta al tratamiento. Es por eso que nuestro grupo de trabajo analizó la expresión del gen MDR-1 por medio de técnicas de biología molecular al diagnóstico en pacientes con leucemia aguda mieloblástica del Hospital General de México.
¿ Métodos
Se realizó un estudio de tipo experimental, prospectivo y longitudinal en el periodo comprendido de enero de 2008 a enero de 2009 en el Servicio de Hematología del departamento de Biología molecular U-103 y U-204. La realización de esta investigación fue aprobada por los Comités de Investigación y de Ética de la Institución. Se incluyeron en el estudio pacientes con diagnóstico de LAM de novo, de independientemente del sexo, a los que se les realizó la toma de muestra de sangre periférica previa firma del consentimiento informado. El diagnóstico de LAM se realizó mediante los criterios de la Asociación Franco-Américo-Británica y con apoyo mediante inmunofenotipo y citoquímica. El seguimiento de los pacientes se realizó por medio de las consultas subsecuentes y los datos clínicos se recabaron del archivo clínico.
Protocolo de tratamiento: Todos los pacientes iniciaron tratamiento con base en el protocolo institucional 3 + 7, que consiste en la administración de citarabina (Ara C) a dosis de 100 mg/m2 en infusión continua de 24 horas durante siete días y daunorrubicina a dosis de 60mg/m2 en bolo durante los primeros tres días de quimioterapia; en caso de no contar con daunorrubicina, se consideró la administración de doxorrubicina o epirrubicina. En caso de presentarse una leucemia refractaria se consideró el inicio de un esquema de rescate.
Metodología: Entre las principales variables consideradas, se incluyeron la edad, género, cifra inicial de leucocitos, respuesta al tratamiento de inducción (protocolo institucional 3 + 7), buscando una correlación con la expresión del gen MDR-1 y parámetros clínicos.
Líneas celulares: Se utilizaron las líneas celulares K562 (leucemia mieloide crónica), U937 (linfoma histiocítico), HL-60 (leucemia aguda promielocítica), Jurkat (leucemia aguda linfoblástica de células T) y Raji (linfoma de Burkitt). Se cultivaron en medio RPMI-1640 suplementado con 10% de suero fetal bovino (Gibco BRL, Grand Island,NY), L-glutamina 2mM, piruvato de sodio 1mM (Hyclone Laboratorios, Logan, UT), penicilina/estreptomicina 1% y 2mercaptoetanol 50uM (Gibco BRL, Grand Island, NY).
Células leucémicas de pacientes: Se colectaron muestras de médula ósea de pacientes con LAM, previa firma del consentimiento informado. Las muestras fueron obtenidas con un tubo heparinizadas y centrifugadas utilizando Lymphoprep (Nycomed Pharma AS, Oslo, Norway), obteniendose células mononucleares.
RT-PCR: La extracción del RNA celular total por medio del reactivo de Trizol (Life Thechnologies, Paisley, UK ) y 1ug de RNA fue utilizado para la síntesis de cDNA por medio de la MMLV (Life Thechnologies, Paisley, UK).
La amplificación de PCR fue realizada con los primers MDR-1F 5'- AAA GCG ACT GAA TGT TCA GT - 3' y MDR-1 R 5'- TCT GCA TTC TGG ATG GTG G - 3. El RNA de la línea celular K562 y HL-60 fue usado como control positivo y negativo respectivamente. Cada cDNA fue probado por PCR usando primers específicos para el gen GADPH (Gliceraldheido 3- fosfato deshidrogenasa). La reacción de PCR fue realizada por 35 ciclos: un minuto a 94˚C, un minuto a 55˚C, un minuto a 72˚C. Lo productos de PCR fueron visualizados en un gel de agarosa a 1.5% teñido con bromuro de etidio
Análisis Estadístico: El método estadístico utilizado fue el de Ji cuadrada, prueba exacta de Fisher y la prueba de Mann-Whitney; considerándose significativo un nivel de p de 0.05
¿ Resultados
Características de los pacientes: Se analizaron 22 pacientes, la media de edad fue de 40 años (rango 18-84), en cuanto al género, el 36% correspondieron al sexo femenino (n=8) y 64% al sexo masculino (n= 14).
Resultados de la inducción: Acorde con la clasificación morfológica, la mayoría de de los casos (n=14, 63%) presentaron leucemia aguda mielo-monoblástica (LAM-M4), seguido de leucemia aguda mieloide con diferenciación (n=7, 31%); por último, leucemia aguda mieloide sin diferenciación (LAM-M1), 4.5%. En cuanto a los resultados de inducción, se registró remisión completa en 45% de los casos.
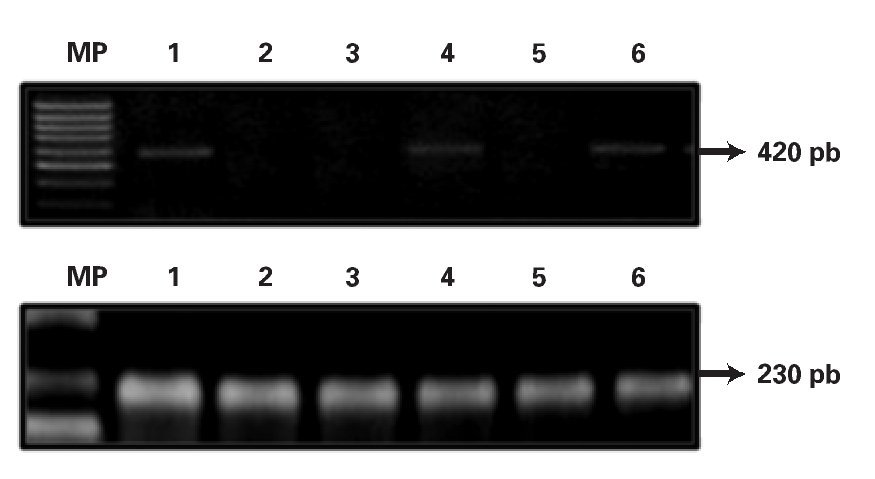
Expresión del gen MDR-1 en líneas celulares leucémicas: Se analizó la expresión del gen MDR-1 en seis líneas celulares leucémicas por medio de RT-PCR, (Jurkat, Molt-4, Reh, HL-60, U-937, K562). Se observó expresión en la línea celular K-562 amplificando un fragmento de 400pb, el resto de las líneas celulares leucémicas fueron negativas (Figura 1). Los productos amplificados de la línea celular K562 fueron secuenciados en el ABI Prism Dye Terminator Cycle. La secuencia obtenida fue alineada en el programa BLASTN del Gene-Bank, con resultado de 95% de homología con el gen MDR-1 de la familia ABC-B1.
¿ Figura 1. Análisis de la expresión del gen MDR-.1 en líneas hematopoyéticas leucémicas. Panel Superior: Expresión del gen MDR-1 amplificando un fragmento de 420 pb en líneas celulares leucémicas, Carril 1 Jurkat, Carril 2 Molt 4, Carril 3 Reh, Carril 4 HL-60, Carril 5 U-937 y Carril 6 K-562; Panel Inferior: Expresión del gen constitutivo GAPDH amplificando un fragmento de 230 pb en líneas celulares leucémicas (Carril 1-6).
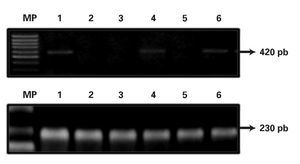
Expresión del gen MDR-1 en pacientes con Leucemia Aguda Mieloblástica: Se analizó la expresión del gen MDR-1 por RT-PCR en 22 pacientes con diagnóstico de LAM, vírgenes de tratamiento. La calidad del RNA fue evaluada por medio de la amplificación del gen de expresión constitutiva GADPH que amplifica un fragmento esperado de 230pb. Los resultados mostraron una frecuencia de expresión del gen MDR-1 de 27.3% (6/22). Se utilizó como control positivo la línea celular K562 y control negativo la línea celular leucémica HL-60 (Figura 2).
¿ Figura 2. Análisis de la expresión del gen MDR-.1 en los pacientes con LAM. Panel Superior: Carril 1 control positivo línea celular K562, Carril 2 control negativo línea celular HL-60, Carriles 3-6 muestras de los pacientes con LAM. Panel Inferior: Amplificación del gen constitutivo GAPDH de 230 pb.
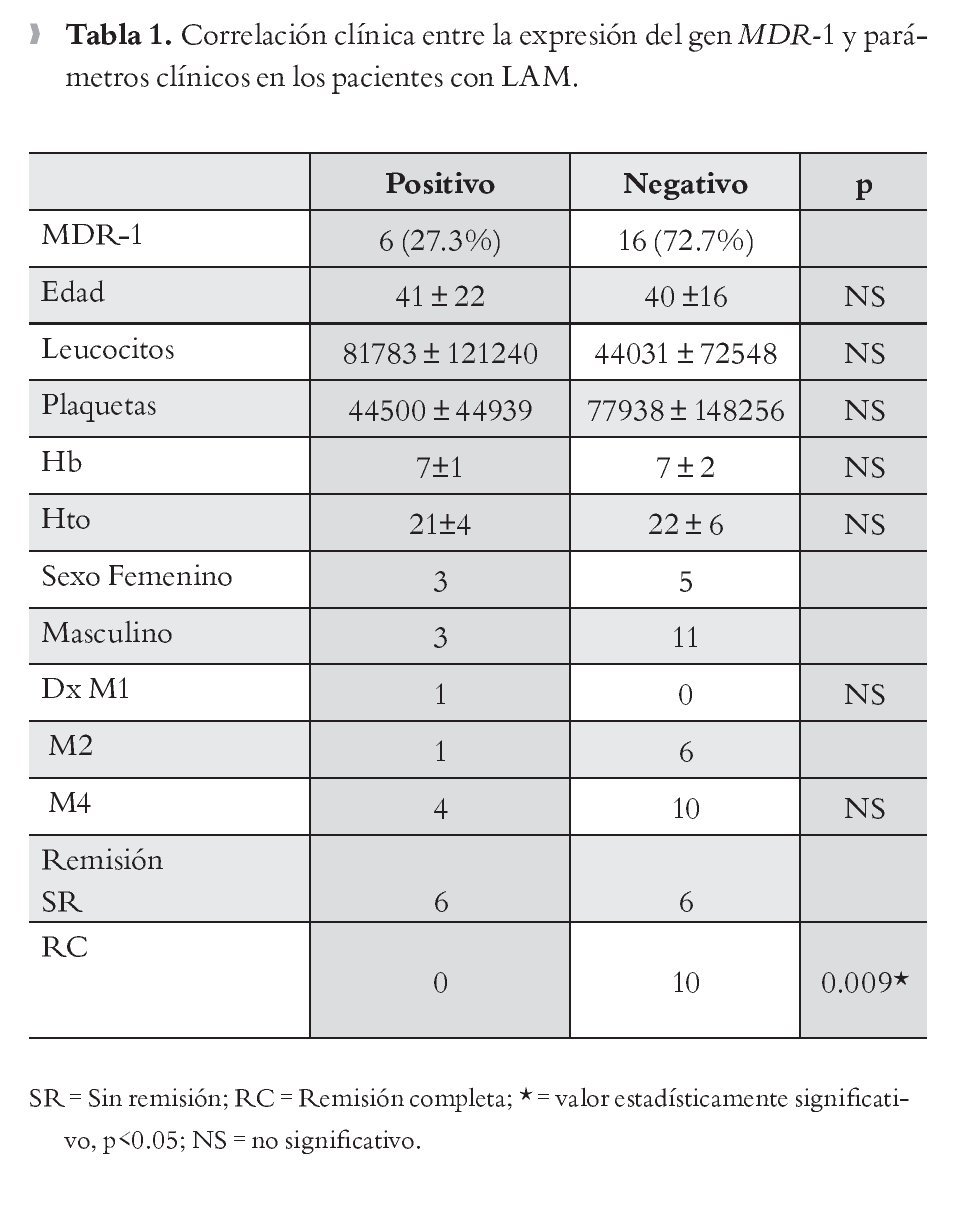
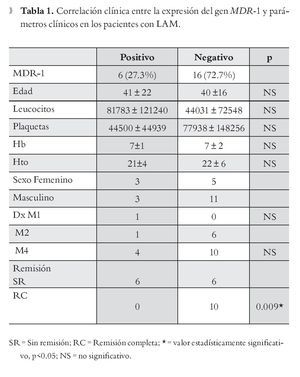
Correlación de factores clínicos con la expresión del gen MDR-1: Se correlacionaron la expresión del gen MDR-1 y los factores clínicos como: edad, sexo, número de leucocitos hemoglobina, hematocrito, número de plaquetas, tipo de leucemia, y remisión clínica. De acuerdo con los resultados obtenidos, se evidenció correlación estadísticamente significativa (p = 0.009) entre la expresión del MDR-1, con la actividad del padecimiento de base posterior al tratamiento de Inducción (leucemia refractaria). No se observó correlación con ningún otro parámetro clínico (Tabla 1).
¿ Discusión
En la actualidad, las tasas de éxito en el tratamiento de las LAL, es de alrededor de 80% a 95% en población pediátrica y entre 20% a 30% en la población adulta. En cuanto a la LAM, su pronóstico continua siendo desfavorable, tanto en población pediátrica (25%) y población adulta (15%).26-29 En la actualidad, la resistencia celular a la quimioterapia representa la principal causa de falla en el tratamiento de las neoplasias onco-hematológicas; esto se traduce en elevadas tasas de mortalidad. Uno de los mecanismos más estudiados en la resistencia a las diversos agentes quimioterápicos y quizás el más importante, es la presencia de la glucoproteína P (gp-P170), resultante de la expresión del gen MDR-1 sobre las células leucémicas. La actividad de bomba dependiente de energía de la gp-P170 permite la eliminación rápida del fármaco localizado en el interior de la célula expulsándolo a través de una bomba de cationes hacia el espacio extracelular y por lo tanto la falla al tratamiento. Los resultados que informamos en este trabajo, están encaminados a evaluar la importancia del estudio del gen MDR-1 en los pacientes con LAM en la población mexicana y su correlación clínica. Se analizó la expresión del gen MDR-1 en diversas líneas celulares, detectando expresión únicamente en la línea celular K562. La frecuencia de la expresión del gen MDR-1 en pacientes con LAM es de 39%30-32 y en recaída alcanza 71%.33-35 En nuestros pacientes se obtuvo una frecuencia de expresión de 27.3%. Las diferencias obtenidas de expresión podrían deberse al número de muestras incluido en el estudio. En cuanto a la correlación con factores clínicos se encontró significancia estadística entre la expresión del gen MDR-1 y la presencia de refractariedad al tratamiento inicial (inducción a la remisión), lo que condiciona leucemia refractaria, lo que coincide con lo informado por diversos autores en pacientes con recaída de su enfermedad.30-35 En cuanto al resto de las variables (edad, género, subtipo morfológico, cuenta inicial de blastos) no se evidenció correlación estadística.
En conclusión, la detección del gen MDR-1 es de gran importancia como un marcador molecular que podría tener relevancia en la falla al tratamiento en LAM.
¿ Agradecimientos
Proyecto apoyado por CONACyT 80085, P48015-M y por la Dirección de Investigación del Hospital General de México: número de registro DIC/08/103/03/0007.
Correspondencia: Dr. Adolfo Martínez Tovar.
Dr. Balmis N°148 Col.
Doctores. 06426, México, D. F.
Teléfono: 2789 2000 Ext. 1609.
Correo electrónico: mtadolfo@starmedia.com