Introducción
El cáncer de cuello uterino es una forma frecuente de cáncer entre las mujeres a nivel mundial.
En el origen de su desarrollo están las lesiones precancerosas debidas a los virus de la familia del papiloma (VPH) presentes en el 99% de los cánceres cervicales.
Los virus del papiloma humano (VPH) pertenecen a una amplia familia de pequeños virus ADN con tropismo epitelial, cuya característica esencial es favorecer la proliferación, benigna o maligna, de células que infectan.
En la actualidad se conocen más de 200 genotipos de VPH, 120 han sido identificados y secuenciados, las patologías asociadas que afectan al hombre varían en función del genotipo encontrado1.
El VPH se clasifica en tres grandes grupos:
De tipo mucosa y genital, de elevado potencial cancerígeno: VPH16, 18, 31, 33, 35, 45, 51, 52, 58, 73. El VPH16 prevalece en el cáncer anal, la displasia vulvar de alto grado y el cáncer del orofaringe; los VPH16 y 8, por sí solos, son responsables del 70% de las lesiones precancerosas de cuello uterino y de más del 60% de las neoplasias intraepiteliales cervicales de grado 3 (CIN III)2.
De tipo mucosa y genital, de bajo potencial cancerígeno: los VPH6 y 11 representan más del 85% de los VPH implicados en las verrugas anogenitales.
De tipo cutáneo: VPH1, 2, 3, 4, 5, 7, 8, 10, 27, 57, 60.
La transmisión del VPH por contacto directo, piel a piel, o mucosa a mucosa, hace de la infección por VPH del tipo mucogenital la más frecuente de las infecciones sexuales transmitidas. Según los Centers for Disease Control and Prevention (CDC), del 50 al 75% de los adultos sexualmente activos albergarán el virus en algún momento de su vida. La prevalencia de la infección es del 40% en mujeres jóvenes, disminuye progresivamente con la edad, a veces con un segundo pico alrededor de los 45-49 años, en el caso de mujeres menopáusicas. En 2009, los CDC indican que la prevalencia de los VPH de alto riesgo en la población de los 20-24 años es del 28%, y la de bajo riesgo, del 30%3; las coinfecciones son frecuentes (del 20 al 30%) y pueden asociar virus del papiloma de alto riesgo y de bajo riesgo4.
En la mayoría de los casos, la infección por VPH es asintomática; el sistema inmunitario combate el virus con éxito y la gran mayoría de los virus del papiloma son eliminados espontáneamente en 1 o 2 años, sobre todo en las mujeres jóvenes. Si la infección por el papilomavirus se vuelve crónica, sin dejar de ser asintomática, provoca en plazos variables (a veces varios años) displasias, que pueden evolucionar hacia un cáncer.
El riesgo de progresión de las lesiones inducidas por VPH hacia un cáncer, es mayor entre las mujeres de 30 años que entre las mujeres más jóvenes5.
¿Qué hace que el VPH no sea eliminado sistemáticamente por nuestro sistema inmunitario y pueda conducir a un estado neoplásico?
La evolución hacia un cáncer está relacionada con el propio virus (infección por VPH de alto riesgo oncogénico) y la existencia de cofactores relacionados con el terreno6.
De una manera general, la respuesta inmune contra el VPH en los epitelios es poco eficaz, los queratocitos son malas células presentadoras de antígeno y las células dendríticas no son muy numerosas. El desarrollo intraepitelial del ciclo viral hace que el virus esté poco expuesto al sistema inmunitario, especialmente a las células de Langerhans y a las células dendríticas; por otra parte, las proteínas virales E6 y E7 disminuyen la expresión de los receptores de superficie que reconocen los ADN virales, lo que permite que el virus se multiplique en un estado de tolerancia inmune7.
En el aspecto molecular, las proteínas virales E6 y E7 aumentan la expresión de NFkB, un factor de transcripción nuclear capaz de aumentar la expresión de los genes antiapoptósicos.
Además, E6 y E7 estimulan la síntesis de grandes cantidades de IL-1, citocina por si misma proinflamatoria y que aumenta la síntesis, vía el NFkB, de otras citocinas proinflamatorias (TNFα, IL-6), lo que favorece la inflamación y la oncogénesis.
Esta importante producción de IL-1 induce, por otro lado, un aumento de la producción de IL2 que favorece la supervivencia y la proliferación de los Treg, y conduce a una situación de inmunotolerancia8.
¿Qué acción terapéutica utilizar?
No hay un tratamiento alopático que permita erradicar el VPH. Las recomendaciones establecidas por las autoridades sanitarias son: en los casos de displasia leve, ASCUS o CINI, se recomienda un seguimiento cada 6 meses por medio de un frotis de control y, a partir de un CIN II, se recomienda una conización.
Siempre respetando estas recomendaciones, otro enfoque terapéutico permite dar a los pacientes la oportunidad de erradicar el virus de manera más rápida y segura: un tratamiento con microinmunoterapia. Este tratamiento puede proponerse en este intervalo de 6 meses; permite mantener el sistema inmunitario y ayudar al organismo en su acción de eliminación del virus.
La microinmunoterapia es un enfoque terapéutico que se basa en la modulación homeopática (principio de Arndt Schultz) de las funciones inmunes utilizando citocinas altamente diluidas y SNA preparados según la farmacopea homeopática.
A continuación presento un seguimiento llevado a cabo en mi consulta en 34 pacientes; la identificación y determinación del VPH han sido sistemáticas y realizadas al mismo tiempo que el frotis.
Las pacientes fueron tratados con 2L®PAPI a razón de 1 cápsula/día; la duración del tratamiento no se ha estandardizado.
Descripción de la población
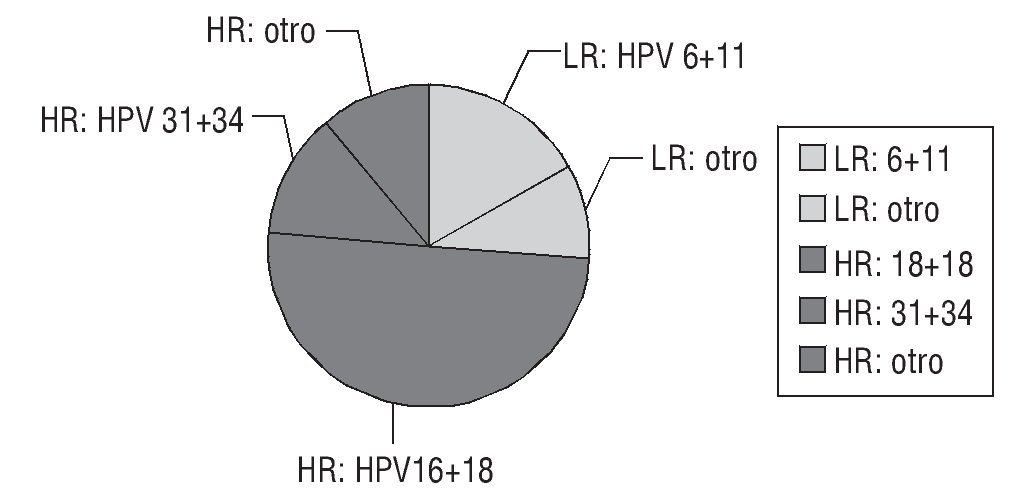
De las 34 pacientes (fig. 1):
Figura 1 Repartición de los serotipos HPV antes del tratamiento (34 pacientes).
9 (26%) estaban infectadas por un VPH de bajo riesgo oncogénico: los VPH6 y 11 representaron el 56% de los VPH de bajo riesgo.
25 (74%) estaban infectadas por un VPH de alto riesgo oncogénico: los VPH16 + VPH18 representaban por sí solos el 68% de los VPH de alto riesgo oncogénico.
Resultados
La tolerancia del medicamento ha sido excelente, no se observaron efectos secundarios.
En las 9 pacientes infectadas con un VPH de bajo riesgo oncogénico (LR), la duración media del tratamiento fue de 3,33 meses (± 0,71).
La tasa de erradicación de los VPH de bajo riesgo fue del 89%; un sólo fracaso: un VPH53 que desapareció después de 4 meses de tratamiento pero con la aparición de un VPH31 (fig. 2).
Figura 2 Repartición de los serotipos HPV después del tratamiento (34 pacientes).
En el caso de las 25 pacientes infectadas por un VPH de alto riesgo oncogénico, la duración media del tratamiento fue de 5,7 meses (± 3,4).
La tasa de erradicación de los VPH de alto riesgo fue del 80% (20 curaciones/25) (fig. 2).
La acción beneficiosa del tratamiento de microinmunoterapia en la citología aparece claramente reflejada en las figuras 3 y 4. Los CINI y CINII han desaparecido.
Figura 3 Citologías antes del tratamiento (34 pacientes).
Figura 4 Citologías después del tratamiento (34 pacientes).
Algunas pacientes que tenían inicialmente un frotis normal con infección VPH, no han hecho frotis de control debido a que el VPH había sido erradicado. Estos frotis han sido contabilizados junto con los normales.
Discusión y conclusión
Si tenemos en cuenta los fracasos del tratamiento (6/34), nos encontramos que, en 5 casos, la duración del tratamiento ha sido ≤ 4 meses, y en un solo caso, de 6 meses.
Se recomienda un período de tratamiento de 6 meses como mínimo; puede resultar necesario aumentarlo en función del terreno de la paciente (especialmente en el caso de fumadoras).
Estoy firmemente convencido que este tratamiento es muy beneficioso y seguro para las pacientes infectadas por el VPH, ya que les da la oportunidad, no despreciable, de erradicar de forma más segura y más rápida este virus causante de muchas angustias para las mujeres.
Actualmente, otros seguimientos prospectivos en curso serán ocasión de futuras comunicaciones.
Correo electrónico:djacques@wanadoo.es
Recibido el 30 de mayo de 2010;
aceptado el 10 de septiembre de 2011