Introducción: Las nanopartículas de oro (AuNP) radiomarcadas y funcionalizadas, pueden funcionar como sistemas para radioterapia y ablación térmica1. El receptor del péptido liberador de gastrina (GRP-r) está sobreexpresado en las células de cáncer de próstata; la Lys3-bombesina es un péptido con alta afinidad específica al GRP-r1,2. El péptido Tat(49-57) es un péptido de penetración celular capaz de alcanzar el ADN. El 177Lu ha sido utilizado para el tratamiento en células de cáncer mostrando un eficiente efecto de fuego cruzado, mientras que el uso del 99mTc, se ha limitado al diagnóstico, sin embargo la internalización de éste en el núcleo de las células de cáncer hace que actúe como un sistema efectivo de radioterapia de blancos moleculares debido al efecto biológico producido por los electrones Auger. El objetivo de este trabajo fue evaluar el potencial in vitro de nanopartículas de oro radiomarcadas con 99mTc y 177Lu y conjugadas a los péptidos Lys3-Bombesina (99mTc/177Lu-AuNP-Tat-BN) como un sistema de radioterapia y terapia fototérmica plasmónica en células PC3 (células de cáncer de próstata).
Materiales y métodos: Las AuNp (5nm) fueron funcionalizadas con los péptidos a través de la reacción espontánea con el grupo tiol de la cisteína (C). Después del calentamiento con luz láser la viabilidad de las células PC3 fue cuantificada. El calentamiento de las células PC3 incubadas con AuNPTat-BN fue realizado mediante el uso de un láser pulsado de Nd:YAG con duración de pulso 5 ns a 532nm (0.65 W/cm2). Para la obtención del 99mTc/177Lu-AuNP-Tat-BN, se prepararon primero los radiopéptidos 177LuDOTA-Gly-Gly-Cys y 99mTcHYNIC-octreótido y simultáneamente fueron adicionados a AuNPTat-BN. Las células PC3 fueron incubadas con 99mTc/177Lu-AuNP-Tat-BN (20 Bq/célula) y el efecto en la proliferación celular fue evaluado después de 3 días.
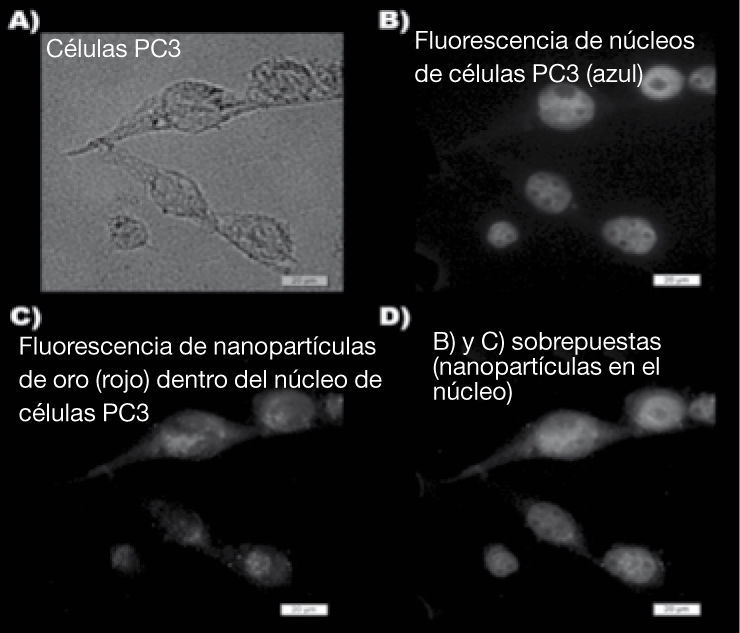
Resultados: La figura 1 muestra las imágenes fluorescentes de la internalización nuclear del sistema 99mTc/177Lu-AuNPTat-BN. Después de la irradiación con láser, la presencia de AuNP-Tat-BN causo un incremento significativo en la temperatura del medio (46.4°C vs. 39.5°C obtenida sin AuNP) resultando una disminución significativa en la viabilidad de las células PC3 por debajo del 1.3%. Después del tratamiento con 99mTc/177Lu-AuNP-Tat-BN, se inhibió proliferación de las células PC3.
Representación del campo (40X) de células PC3 tratadas con AuNP-Tat-BN. A) En contraste de fase, B) núcleo de las células teñido con Hoechst, C) detección la autoflorescencia emitida por las AuNP´s después de ser excitadas a 530nm, y D) fusión de imagen nuclear y de fluorescencia.
Conclusiones: El nanosistema presenta propiedades adecuadas para el tratamiento de cáncer de próstata debidas a la terapia fototérmica plasmónica y a la radioterapia de blancos moleculares específicos.
Consejo Nacional de Ciencia y Tecnologia (CONACYT-SEPCB-2010-01-150942).