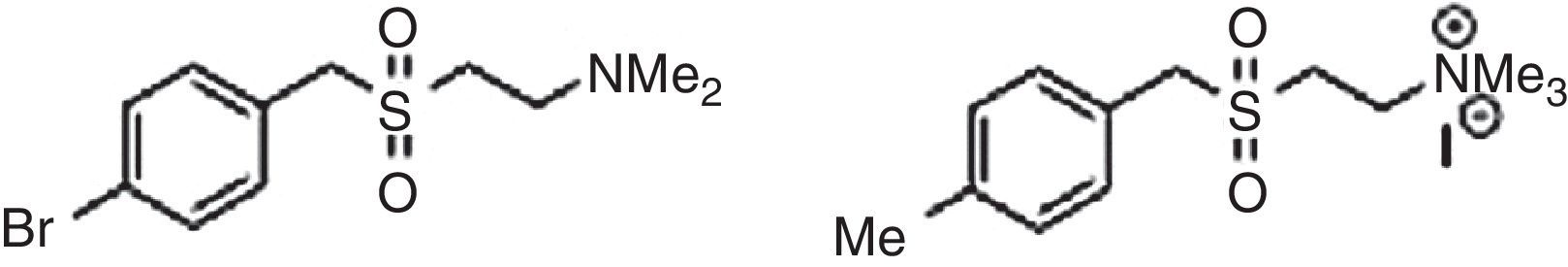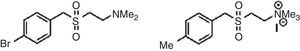El proceso de coevolución que se da entre parásito y hospedador ha traído consigo la selección genética en el parásito de numerosos y efectivos mecanismos de evasión del sistema inmunológico del hospedador. Estos mecanismos tienen un enorme potencial como compuestos líderes para el desarrollo de fármacos. Entre los objetivos de la presente publicación está dar a conocer algunos de estos mecanismos, los más interesantes desde el punto de vista científico y farmacológico para, de este modo, ayudar a potenciar la investigación para su aprovechamiento en el diseño de fármacos.
Así, se destacan los últimos hallazgos en cuanto a mecanismos de evasión del sistema inmunitario de un gran número de parásitos, abarcando desde los protozoos hasta los helmintos. Ya se puede entender que entre las aplicaciones de los sustratos moleculares de estos mecanismos destaca tanto el tratamiento de enfermedades autoinmunes y alérgicas, como el desarrollo de vacunas.
The co-evolution process existing between parasite and host has brought about genetic selection of several effective mechanisms to evade the immune response of the host. These mechanisms are useful as leading compounds aimed at drug development. Among the objectives of this publication is to present those that are the most interesting from a scientific and pharmacological point of view and, thereby, help promote research for use in drug design.
Thus, the latest findings in relation to immune response evasion mechanisms are reviewed, considering a wide spectrum of parasites ranging from protozoans to helminths. Now it can be understood the applications of the molecular substrates of these mechanisms include the treatment of autoimmune and allergic diseases and vaccine development.
La coevolución parásito-hospedador, especialmente en el caso de los parásitos inmunorreguladores, ha hecho suya la máxima de Sun Tzu: «El supremo arte de la guerra es doblegar al enemigo sin luchar».
En muchos parásitos, esto se instrumentaliza a través de estrategias evolutivas de evasión del sistema inmunitario de su hospedador. Y no solo con el objetivo de evitar el daño que pudiera producir el sistema inmunológico del hospedador en el parásito, que puede acabar con él, sino también para reducir el daño en el hospedador para que, de este modo, este pueda albergar mejor y por más tiempo al parásito: el sistema inmunológico, vía respuesta inflamatoria, puede causar daños en el hospedador que le hagan perder valor como hospedador y, además, hacerle acudir en busca de ayuda química para acabar con el parásito. En definitiva, el parásito que cuide mejor su hogar-hospedador estará en mejor situación de satisfacer la directiva genética de supervivencia y reproducción, ya que podrá realizar más ciclos reproductivos en el mismo hospedador, reduciendo el riesgo de fracaso en la búsqueda de otros; además, se tratará de un hospedador con más recursos, más sano.
Es por ello que la lucha evolutiva ha seleccionado numerosos parásitos inmunomoduladores, especializados en eludir las respuestas del sistema inmunológico del hospedador. En este artículo se revisarán algunos de los que me han parecido más interesantes, centrándome en sus mecanismos de evasión inmunológica, muchos de los cuales aún no vienen en los libros por ser resultado de investigaciones recientes, que se han revisado para elaborar esta publicación. Además, estas características inmunorreguladoras de muchos parásitos serán clave en el desarrollo de fármacos destinados al tratamiento de procesos inflamatorios de diferente índole, como los de origen autoinmune1.
Material y métodosPara la elaboración del presente trabajo, se ha revisado diversa documentación, constituida principalmente por las publicaciones internacionales más recientes y relevantes sobre los mecanismos de evasión del sistema inmunológico más interesantes presentes en diferentes parásitos, con especial hincapié en aquellos con más relevancia desde el punto de vista de desarrollo de nuevos fármacos. La tipología de la documentación revisada está constituida principalmente por artículos de revistas científicas y libros, tanto en español como en inglés. Las bases de datos consultadas para localizar artículos han sido, principalmente y entre otras: el catálogo CISNE, UCM-AECID, SciELO, PubMed, el catálogo de revistas extranjeras Bucea, y Google Scholar.
Resultados y discusiónGiardia spp.El caso de Giardia es muy interesante, ya que muchos de sus mecanismos patológicos y de evasión inmunitaria aún no están bien documentados, quedando mucho aún por investigar. El mecanismo de evasión central es similar a un cambio de disfraz: una variación antigénica2. Todo el parásito, incluidos flagelos y disco suctorio, se encuentra recubierto de unas proteínas transmembrana ricas en cisteína, que se denominan proteínas variables de superficie (variant surface proteines [VSP]). Estas son muy inmunogénicas y se cambian cada 6-16 generaciones3, dependiendo de la especie; el cambio afecta a todo el parásito2-4, no ocurriendo mosaicismo (concurrencia de diferentes proteínas de superficie en un mismo momento, lo que sería un «derroche antigénico»). Aún no está bien documentado el mecanismo epigenético4 que induce al cambio de las mismas; lo que sí se sabe es que es un mecanismo seleccionado por la evolución, que cumple la función de evasión del sistema inmunitario. Además se sabe que estas proteínas transmembrana, las VSP, también tienen funciones de transducción de señales y de adhesión al enterocito.
La potencialidad de la variación antigénica reside en la posibilidad de expresión de proteínas VSP provenientes de la combinación de entre 150 y 303 genes3,5, dependiendo de la especie. El mecanismo de selección de los genes a expresar consiste en un interesante proceso de silenciamiento postranscripcional basado en ARN de interferencia3.
Otro mecanismo evasivo es la secreción de proteinasas que rompen las inmunoglobulinas A, defensa clave del sistema inmunológico contra Giardia6.
También tiene especial interés la arginina deiminasa, enzima que neutraliza la arginina producida por las células de la mucosa del hospedador para la obtención de óxido nítrico, necesario en el ataque al parásito vía especies reactivas de nitrógeno6.
Entamoeba histolyticaEn este caso, el mecanismo de evasión está ligado al mecanismo de adherencia a las células intestinales del hospedador. Este mecanismo está conformado por la formación de un trímero denominado proteína de adherencia inhibible por galactosa (galactose-inihibitable adherence protein [GIAP]), que contiene lectinas, que unen a restos de galactosa (Gal) y a N-acetil-galactosamina (NAcGal) presentes en las cadenas de hidratos de carbono del glicocálix de las células del hospedador. Una vez unida, la ameba puede moverse fácilmente gracias a sus lobopodios y penetrar en tejidos gracias a la secreción de fosfatasas y cisteín proteasas, de carácter lítico, y a la formación de ameboporos en las células hospedadoras.
Para que ocurra la activación de las GIAP como adhesinas, es necesario que se forme el trímero. Los componentes de ese trímero son, por un lado, un heterodímero formado por una cadena pesada (H) y otra ligera (L) y, por otro, una cadena intermedia (I) que reside en «balsas de colesterol» de la membrana (denominadas rafts). Un aumento de la concentración de colesterol en la membrana de la ameba facilita que estas balsas viajen a través del mosaico fluido que es la membrana, aumentando las posibilidades de interacción no covalente con el dímero H-L. Esta interacción activa el comportamiento adhesina del trímero.
Una de las características relevantes de H es que es homóloga a CD59 presente en las células de los mamíferos, cuya presencia impide su lisis por el propio sistema de complemento. Ello se logra mediante la unión de CD59 a los componentes C8 y C9 del complemento, impidiendo la polimerización del complejo de ataque a membrana. De este modo, Entamoeba histolytica (E. histolytica) elude un mecanismo defensivo del sistema inmunológico, como es la lisis por el sistema de complemento7.
Plasmodium spp.Este género posee numerosos mecanismos evasivos, entre los que se van a destacar varios en este epígrafe. En primer lugar, una proteína con interesantes funciones evasivas es circumsporozoite protein (CSP), expresada en las fases infectivas de Plasmodium: los esporozoítos8. Tanto es así que ha sido empleada en el diseño de vacunas antimaláricas, como la RTS/S: vacuna recombinante con coadyuvante, actualmente en fase de diseño, debida a Pedro Alonso (de GSK). Esta vacuna contiene un fragmento de CSP9. Entre las funciones de evasión de la respuesta inmunitaria de CSP, cabe destacar su interferencia con el factor de transcripción NF-κB10, lo que afecta a la respuesta inmunitaria del hepatocito, por ejemplo inhibiendo la generación de especies reactivas de oxígeno (ROS) en respuesta a microorganismos intracelulares como Plasmodium. El mecanismo de esta interferencia es la competencia entre CSP y NF-κB en el acceso al núcleo, inhibiéndose la transcripción de genes dependientes de NF-κB11. Además, este hecho también afecta a la producción de citocinas proinflamatorias. En la célula de Kupffer, leucocito que el parásito tiene que atravesar para invadir el hepatocito, también se inhibe la producción de ROS, aunque de un modo algo diferente12. Además, hay que destacar otras funciones de esta proteína que son clave para el progreso de la infección y de la invasión, como por ejemplo: el desarrollo del esporozoíto en ooquistes y su salida de los mismos, la adhesión a ligandos de las glándulas salivares del vector (Anopheles) para posibilitar la invasión de las mismas13, la adhesión a restos de heparán-sulfato presentes en el hepatocito para instrumentalizar su invasión, la inducción de apoptosis hepatocito, etc.
Dada la importancia de la proteína CSP para el ciclo biológico del parásito, su carácter altamente antigénico y el hecho de que, hoy por hoy, y a pesar de haber fracasado, la vacuna más perfecta que se ha diseñado contra la malaria es la RTS/S, que incluye un segmento de CSP9, actualmente está en estudio la variación genética que puede afectar a esta proteína clave en el ciclo de vida de Plasmodium14. Es posible que estos estudios arrojen algo de luz sobre el hecho de por qué la vacuna RTS/S no es totalmente efectiva.
En segundo lugar, destaca el mecanismo de acceso de los merozoítos a los capilares pulmonares, escondidos en la membrana del hepatocito que acaban de destruir tras una esquizogonia15, que exhibe una de las mayores tasas de reproducción que se conoce en células eucariotas, y que es clave para amplificar la carga parasitaria y, consecuentemente, aumentar las posibilidades de éxito de la infección. La cobertura por la membrana del hepatocito destruido es fundamental para evadirse del sistema inmunitario, posibilitando la salida de Plasmodium de la fase hepática y facilitando su acceso a la sangre, con la consiguiente invasión del eritrocito. Estos restos de membrana del hepatocito, cada uno de los cuales esconde cientos o miles de parásitos provenientes de la esquizogonia extraeritrocítica, se denominan en la literatura científica merosomas o extrusomas15.
En tercer lugar, también son de destacar en este caso los fenómenos de aglutinación de eritrocitos, basados en proteínas de adherencia que se expresan en los denominados knobs (zonas electrodensas) o abultamientos que se constituyen en la superficie de los eritrocitos infectados. Entre estas destaca la proteína transmembrana P. falciparum erythrocyte membrane protein 1 (PfEMP1). Es notable el recorrido que tiene hacer esta proteína para alcanzar la membrana eritrocítica, teniendo que atravesar la vacuola parasitófora (VP), el citoplasma y la membrana del eritrocito. Esta proteína es responsable de fenómenos de adherencia tanto al endotelio capilar, como a otros eritrocitos, trombocitos y monocitos16; de este modo, se forman rosetas y aglutinaciones celulares en el flujo sanguíneo, que facilitan a los eritrocitos infectados17:
- –
Infectar a otros cercanos, más accesibles en la proximidad de la aglutinación.
- –
Evadir la respuesta del sistema inmunológico, al quedar rodeados por otros elementos celulares sanos que los ocultan del mismo.
- –
Retrasar su llegada al bazo, donde sufrirían los correspondientes procesos de aclaramiento que ocurren en él.
Lógicamente, PfEMP1 también es un factor de virulencia de la malaria que causa Plasmodium falciparum (P. falciparum), ya que estos mecanismos enlentecen el flujo sanguíneo, con las conocidas consecuencias clínicas de la malaria.
Un resultado extremadamente interesante es el hallazgo de que las variantes de la hemoglobina que reducen la virulencia de la enfermedad lo hacen porque distorsionan la expresión de PfEMP1 en los eritrocitos infectados16.
Hay que decir que en la formación de knobs están implicadas otras proteínas, como PfEMP2 y knob associated histidine rich proteins17, ambas actuando en el lado interno de la membrana; a través de interacciones con el citoesqueleto del eritrocito, confieren esa morfología característica a los knobs y anclan la parte interna de PfEMP1.
P. falciparum también presenta mecanismos de variación antigénica basados en genes de contingencia18,19, análogos a los que se describirán más adelante al hablar de Trypanosoma brucei (T. brucei). Así, PfEMP1 es una proteína de alta variedad antigénica, asegurada por el hecho de estar implicados 60 genes var en su codificación; estos genes se encuentran situados principalmente en regiones subteloméricas. A través de procesos de exclusión alélica, solo se expone una versión de PfEMP1 cada vez. De este modo, se mantiene oculto del sistema inmunológico del hospedador el arsenal antigénico existente, listo para ser utilizado en cada momento a través de cambios en la expresión de las PfEMP1. La expresión de las diferentes «versiones» de PfEMP1 es gobernada por procesos epigenéticos relacionados con alteraciones de la estructura de la cromatina17. Además, a través de procesos de recombinación homóloga de estos genes en las meiosis, se mantiene una enorme variedad de PfEMP1 entre los distintos parásitos. A pesar de esta variedad en la estructura primaria de estas proteínas PfEMP1, no se alteran sus funciones.
Toxoplasma gondiiA igual que otros Apicomplexa, este parásito está dotado de un interesante mecanismo de penetración celular, que le permite desarrollar su ciclo biológico como parásito intracelular. Además es uno de los parásitos con mayor éxito evolutivo. Esto es gracias a la gran variedad de hospedadores intermedios a los que es capaz de parasitar debido, tanto a un amplísimo proteoma que le permite desenvolverse en todos y cada uno de ellos, como a la disposición de una ruta de infección alternativa a la reproducción sexual con ooquistes; esta vía alternativa consiste en la posibilidad de infectar a través de la ingestión de quistes al consumir carne.
Su principal relevancia patológica es en inmunodeprimidos y neonatos. Especial interés tiene su relación con patologías psiquiátricas20-22.
Toxoplasma gondii (T. gondii) dispone de determinadas estructuras, encargadas de la secreción proteínas cuyas funciones son, entre otras:
Instrumentalizar la invasión a través de la formación del anillo de ensamblaje en la superficie de la célula a invadir y del ensamblaje móvil en el propio parásito, que deslizará sobre el anillo en el proceso de penetración. Este es el caso de las proteínas MIC, secretadas desde los micronemas y de las RON, secretadas desde las roptrias del parásito.
Crear un ambiente apropiado para el desarrollo y reproducción del parásito en la VP mediante: limitación de las posibilidades de unión de lisosomas a la misma, posibilitar la asociación a la VP de estructuras como el retículo endoplásmico y la micocondria de la célula invadida, permitir el tráfico de nutrientes y desechos a través de la membrana de la VP, formación de la estructura en roseta host organelle secreted túbulo structures (H.O.S.T), etc. Entre las proteínas de T. gondii, involucradas en estas funciones, destacan las proteínas GRA23, secretadas desde los gránulos densos presentes en el parásito, que son clave en el mantenimiento de la VP.
En este apartado, también es importante destacar a ROP-5, secretada por las roptrias durante la invasión y presente en la VP, debido a su función como proteína adaptadora de otras; esta función consiste en mediar el acoplamiento de otras proteínas a la VP.
Modular el sistema inmunológico del hospedador para atenuar la respuesta Th1, que es necesaria para hacer frente a este tipo de infección. Este apartado es el que nos interesa en la presente publicación, por sus posibles aplicaciones en el desarrollo de nuevos fármacos.
A continuación, se indican algunas de las macromoléculas clave en la regulación de la respuesta inmunológica. Como se ve, no todas ellas son inmunosupresoras, como ROP-16 y ROP-18, sino que algunas son proinflamatorias, como GRA-15. Lo relevante es destacar cómo el parásito regula el sistema inmunológico del hospedador a su antojo, mediante la secreción en cada momento de las proteínas adecuadas a la fase de la infección de que se trate (tabla 1).
Proteínas en Toxoplasma gondii relevantes para el tema que se trata
| Proteína | Origen | Acción | Vía |
|---|---|---|---|
| ROP-16, cinasa de tirosina24 | Roptrias de cepas i y ii de T. gondii | Atenuación de la respuesta inflamatoria Th124,25 | La vía de señalización es JAK/STAT en determinadas CPA y (MFφ). ROP-16 activa, independientemente de la vía JAK3a, STAT3 (inhibidor de la activación de NF- kB) y STAT624,25. Estas acciones inhiben la cascada de proinflamatoria Th1 de IL-12, bloqueando la secreción de IFN-g por los linfocitos T y células NK. Además inhiben el proceso apoptótico |
| ROP-18, cinasa de treonina26 | Roptrias de T. gondii | Inhibe algunos de los mecanismos de citotoxicidad para parásitos intracelulares IFN-g26 | Fosforilación de los IRG, que tapizan la VP e instrumentalizan la citotoxicidad mediada por IFN-g para microbios intracelulares26 |
| GRA-1523,25 | Gránulos densos de la cepa II de T. gondii23,25 | Activa la respuesta Th1 y es responsable de la virulencia de la toxoplasmosis23,25 | Activación del factor de transcripción NF-kB23,25 independientemente de la vía fisiológica MyD88. Este factor de transcripción es clave en la producción de la citocina proinflamatoria Th1, IL-12 |
| ROP-38 cinasa27 | Roptrias de T gondii. Mayor expresión en cepas II y III, pero presente en todas27 | Inmunomodulación a través de la inhibición de la transcripción de citocinas27 | Parece que actúa inhibiendo la vía MAPK, responsable de la transcripción de ARNm para la biosíntesis de numerosas citocinas27 |
CPA: células presentadoras de antígenos;IFN-g: interferón gamma; IL: interleucina; MF: macrófagos.
Las proteínas STAT son factores de transcripción que se encuentran en el citoplasma desactivadas y, al unir una citocina al receptor, este dimeriza y, las tirosina-cinasa JAK (de Janus) asociadas a él, al estar próximas, se fosforilan cruzadamente, activándose, y luego fosforilan al propio receptor. Los residuos tirosina fosforilados en el receptor son sitios de unión para los dominios SH2 de las proteínas STAT que, al unirse, son fosforiladas por JAK y, de este modo, dimerizan y se activan, traslocándose al núcleo para activar la transcripción de determinados genes. ROP cortocircuita esta vía, fosforilando directamente los residuos de STAT3/STAT5, aun en ausencia de citocina señalizadora. El resultado es la síntesis de proteínas de función inmunoreguladora.
Ya puede entenderse el interés que presentan estas proteínas, por ejemplo ROP-16, como compuestos líderes para el desarrollo de futuros fármacos destinados al tratamiento de enfermedades inflamatorias y autoinmunes, como la enfermedad de Crohn. Otras proteínas, como ROP38, ampliamente secretadas durante la invasión por T. gondii, y presentes en mayor o menor medida en todas las cepas del mismo, pueden presentar utilidad en el desarrollo de vacunas contra la toxoplasmosis crónica27.
Trypanosoma bruceiOtro proceso de variación antigénica similar al de Giardia, ocurre con las glucoproteínas variables de superficie (VSG) de T. brucei. Igual que en el caso de Giardia, en cada momento, solo una de estas proteínas transmembrana con anclaje glicosilfosfatidilinositol tapiza la superficie del parásito, sin mosaicismos28. La secuencia de aminoácidos de estas glucoproteínas es muy diferente entre ellas; a pesar de ello, la estructura secundaria y terciaria no difiere tanto, para asegurar un tapizado adecuado de la superficie del parasito. Existen unos 1.600 genes que dan soporte a las VSG, aunque no todos ellos son funcionales29; todos ellos están situados en zonas que no se transcriben, situadas en regiones silentes subteloméricas, salvo el que se está expresando en cada momento. Sin embargo, en este caso, el mecanismo de expresión de unos u otros, más que un mecanismo postranscripcional, como es el caso de Giardia, consiste en una recombinación homóloga28,29, que sitúa una copia de un gen VSG en el sitio activo de transcripción, junto a la región telomérica de determinados cromosomas29. Como puede deducirse del tipo de mecanismo30, en algunos casos puede producirse la combinación de genes o fragmentos de genes VSG diferentes, en el sitio activo de transcripción, expresándose en superficie ese nuevo constructo VSG29. Esto enriquece todavía más la variedad de proteínas VSG que estos parásitos pueden expresar.
Este tipo de genes, normalmente responsables de procesos de variación antigénica, se denominan genes de contingencia18.
Trypanosoma cruziEn Trypanosoma cruzi hay que destacar las funciones de la enzima transialidasa, también denominada factor neurotrófico derivado del parásito (PDNF) por su importancia en el establecimiento y virulencia de la patología nerviosa en la enfermedad de Chagas.
Existen numerosos genes que codifican diversas formas de PDNF, unas son proteínas transmembrana y otras son secretadas.
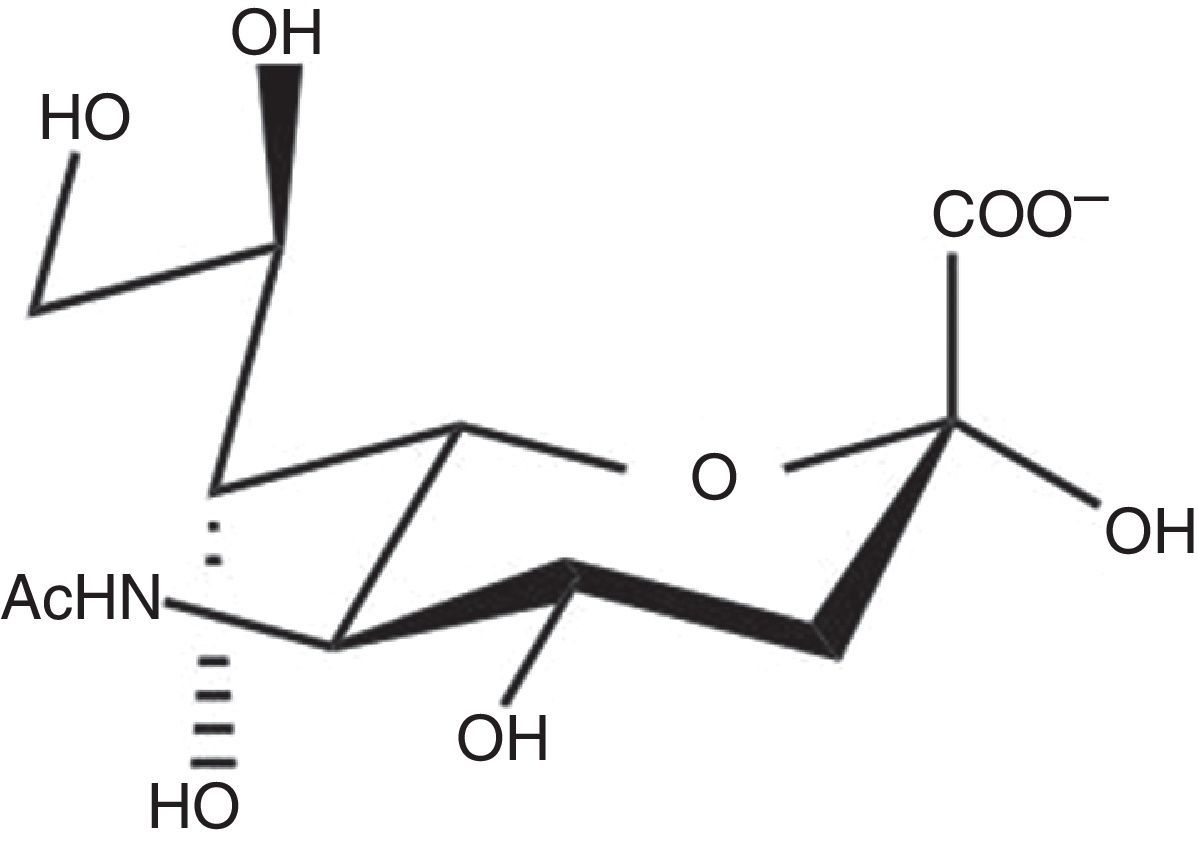
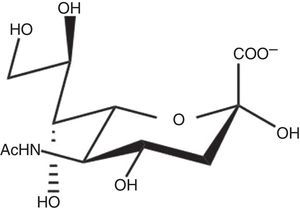
Esta enzima es una glicosil hidrolasa31, cuya función es la transferencia de restos de ácido siálico (fig. 1) de las células hospedadoras a determinadas macromoléculas del parásito32 (p. ej., tipo mucinas), o al espacio intercelular. Entre las consecuencias de esta transferencia de ácido siálico al parásito que, de este modo emula los tejidos del hospedador, está la evasión del sistema inmunológico del siguiente modo31:
- –
Inhibición de la vía alternativa de activación del sistema de complemento de la inmunidad innata.
- –
Protección contra la opsonización por anticuerpos del hospedador.
- –
Interacción de los restos de ácido siálico del parásito con proteínas de superficie de las células dendríticas, iniciando cascadas de señalización celular que inhiben la secreción de citocinas proinflamatorias interleucina-12, necesarias para orquestar la respuesta inmunológica frente al parásito.
Asimismo es destacable como estrategia evasiva la interacción de la enzima transialidasa, tanto desde la superficie del parásito como secretada, con receptores de actividad intrínseca tirosina cinasa de las células hospedadoras invadidas. Este hecho activa las vías Erk1/2 y Akt, tanto para evitar la apoptosis de la célula hospedadora invadida, como para inhibir la respuesta de estrés oxidativo y la liberación de citocinas proinflamatorias33.
Pero esta enzima también desempeña otras importantes funciones invasivas, como es la adherencia a células hospedadoras, tanto en vector como en hospedador humano. Esa adherencia puede producirse bien por la propia morfología de la enzima transialidasa en sí misma, bien a través de los restos de ácido siálico que la enzima transfiere a macromoléculas del parásito.
Trichuris suisEn este caso, son los glucanos presentes en los productos solubles de Trichuris suis (T. suis) son los que producen el efecto inmunorregulador1. Actualmente son objeto de desarrollo de nuevos medicamentos para el tratamiento de enfermedades en las que esté involucrado el sistema inmunológico, como son: colitis ulcerativa, enfermedad de Crohn, esclerosis múltiple, autismo y otras.
Además de T. suis, existen multitud de otros helmintos poseedores de mecanismos inmunorreguladores que les confieren interesantes aplicaciones farmacoterapéuticas en el campo de las enfermedades autoinmunes, muchos de los cuales están actualmente en estudio1: Trichuris trichiura, Necator americanus, Hymenolepis diminuta, Schistosoma mansoni, Heligmosomoides polygyrus bakeri, Trichinella spiralis, Strongyloides stercoralis, Ascaris lumbricoides, Fasciola hepatica, Nippostrongylus brasiliensis y Schistosoma japonicum. Entre las enfermedades de origen autoinmune cuyo tratamiento se está investigando en relación con los mencionados parásitos están: encefalomielitis autoinmune, diabetes mellitus tipo 1, artritis reumatoide y celiaquía. Además, se está investigando el tratamiento de otras patologías, como la obesidad.
Acanthocheilonema viteaeEste helminto contiene una glucoproteína, ES-62, que presenta propiedades atenuadoras de la respuesta inmunológica Th2 en pacientes alérgicos. Los restos de fosforil-colina de esta macromolécula están sirviendo de líderes en el desarrollo de nuevos fármacos antialérgicos1,34 (fig. 2).
Compuestos análogos sintéticos de los restos de fosforil-colina presentes en ES-62, que actualmente están en estudio.
Tomado de Rzepecka et al.34.
Ausente.
Conflicto de interesesAusente.
El presente manuscrito no ha sido presentado en ningún evento ni revista ni similar.