Este método pionero involucra el uso de luz en longitudes de onda de 280-570nm, para controlar la actividad de los canales iónicos de rodopsina y halorodopsina en neuronas de hipocampo, giro dentado y cerebelo. De esta forma se emula un interruptor molecular en el intrincado circuito neuronal, que activando o inhibiendo una neurona individual e incluso varios conglomerados de redes neuronales permiten un control de la actividad eléctrica neuronal.
Los sustratos clave usados en la optogenética son proteínas sensibles a la luz denominados «actuadores optogenéticos» los cuales son una subfamilia de proteínas retinilidenas (rodopsinas) que funcionan como canales iónicos sensibles a la luz.
La optogenética se ha aplicado con éxito en la investigación en neuromodulación, mostrándose como una prometedora herramienta para el tratamiento de varias enfermedades motoras neurodegenerativas al inhibir circuitos hiperactivos de forma selectiva y precisa, ello sin los efectos lesivos secundarios de la quimioterapia común y con la garantía posible de que el procedimiento tenga un efecto a largo plazo sobre la base funcional.
This pioneering method involves the use of light in wavelengths of 280nm to 570nm, to control the activity of ionic channels of rodopsin and halorodopsin in neurons present in the hippocampus, dentate gyrus and cerebellum. In this form emulating a molecular switch in the intrincate neuronal circuit, that activating or inhibiting an individual neuron and even various conglomerates of neuronal networks allow a control of the electric neuronal activity.
Key substrates used in optogenetic, are light sensitive proteins called ‘optogenetic actuators’ which are a subfamily of retinilidenas proteins (rhodopsin) which function as light gated ion channels.
Optogenetics has been successfully applied in research in the field of neuromodulation, appearing as a promising tool for the treatment of various motor neurodegenerative diseases by inhibiting hyperactive circuits selectively and precisely, this without the harmful side effects of common chemotherapy and with a possible guarantee that the procedure will have a long lasting effect over the functional basis.
Los sustratos clave usados en la optogenética son proteínas sensibles a la luz. El control neuronal preciso es logrado usando los denominados «actuadores optogenéticos»1 los cuales son una subfamilia de proteínas retinilidenas (rodopsinas) que funcionan como canales iónicos sensibles a la luz2 sirviendo como fotorreceptores sensoriales en las algas verdes unicelulares, controlando el fenómeno de la fototaxis3. Estos canales que se denominan «canalrodopsinas (ChR)» son expresados en las células de otros organismos como las medusas y algunas archeobacterias, permitiendo controlar la excitabilidad eléctrica por medio del influjo de calcio4.
El potencial de la optogenética se evidenció de forma paralela al de la terapia genética con Friedmann y Roblin en 1972, cuando iniciaba como ciencia emergente en el campo de la medicina para el tratamiento de enfermedades genéticas en sistemas enzimaticos5. Este hecho fue y es de gran importancia actualmente, ya que gracias a la ingeniería genética fue posible disponer de herramientas que permitieran modificar de manera precisa los sistemas moleculares de las células e influir en ellos de tal forma que se lograra un control total de sus funciones.
Francis Crick, en 1999, realizó las primeras hipótesis sobre el uso de luz para activar neuronas, junto con Richard Fork revelaron la amplía relación entre la función neuronal y la manifestación de diferentes patrones de comportamiento; estas se convirtieron en premisas que permitieron fundamentar la teoría en la que, de lograrse controlar esos patrones de activación neuronal, sería posible modificar aquellos estados disfuncionales presentes en enfermedades neurodegenerativas e incluso restaurar la función neuronal normal.
Zemelman y Miesenböck en 2002, comprobaron el potencial del láser en la estimulación de neuronas genéticamente modificadas, empleando los fotorreceptores rodopsina de la Drosophila para controlar la actividad neuronal en neuronas mamíferas6.
Posteriormente, en 2003 Zemelman y Miesenböck desarrollaron un segundo método para la activación neuronal dependiente de luz en donde canales individuales inotrópicos como TRPV1, TRPM8 y P2X2 (todos receptores transicionales) fueron sensibilizados por ligando en respuesta a la luz7.
A principios del 2005, Lima y Miesenböck reportaron el primer uso de fotoestimulación en neuronas modificadas genéticamente para el control del comportamiento en un animal8; demostraron que la fotoestimulación de grupos neuronales circunscritos como aquellos del sistema dopaminérgico presentaban cambios característicos en el comportamiento de moscas de la fruta. Los grupos de Gottschalk y Nagel fueron los primeros en extender el uso de canalrodopsina-2 para el control de la actividad neuronal en rata intacta.
La optogenética es un campo científico emergente que explora nuevos métodos para tratar ciertos padecimientos neurológicos como el Parkinson, determinadas coreas como la de Tourette e incluso enfermedades de pérdida integral en la función como la enfermedad de Huntington.
Algunos estudios proponen su uso como probables tratamientos revolucionarios en el control de desórdenes del sueño, la epilepsia, enfermedades psiquiátricas como el Alzheimer, la depresión, los trastornos de bipolaridad o la esquizofrenia9.
En la optogenética, el objetivo principal es imprimir moléculas fotosensibles o fotosintéticas que se acoplen a aquellas eléctricamente sensibles encontradas en las neuronas de forma natural, logrando que estas últimas desarrollen sensibilidad por la luz.
De esta forma se emula un interruptor molecular en el intrincado circuito neuronal, que activando o inhibiendo una neurona individual e incluso varios conglomerados de redes neuronales permiten un control de la actividad eléctrica neuronal.
Métodos y materialesLa técnica inicialmente desarrollada por Tsien y perfeccionada por LaLumiere11 involucra la implementación de inserciones genéticas en grupos específicos de células cerebrales, o neuronas, dentro de una región cerebral de determinado interés, usualmente infectándolas con un virus que ha sido modificado para contener secuencias específicas de ADN, siendo uno de los vectores más satisfactorios en la terapia genética. Estos genes, que usualmente son extraídos de halobacterias como es el caso de la halorodopsina (NpHR) o medusas (ChR), producen proteínas sensibles a la luz que pueden ser estimuladas para activarse o inhibirse en respuesta a cambios de luz. Ello permite a los investigadores escrudiñar la forma en que diferentes células contribuyen a la función de los circuitos neuronales.
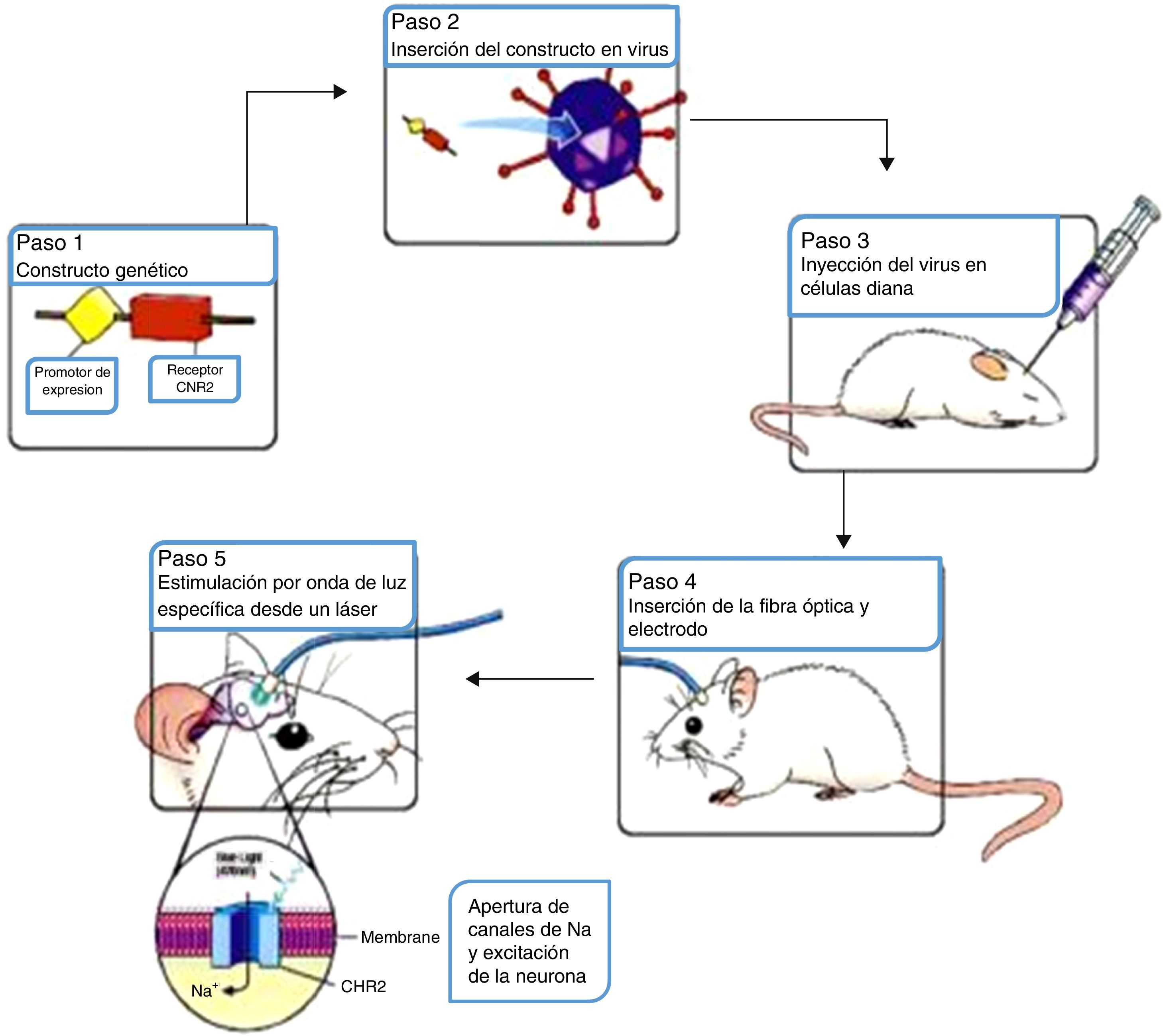
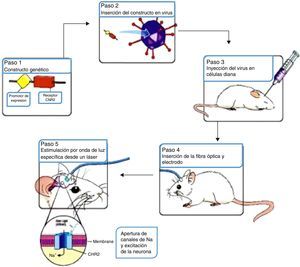
La técnica de la optogenética utiliza los principios de la terapia genética para compensar la pérdida de una función al actuar en el ADN; este proceso puede describirse en 5 pasos como se explica a continuación (fig. 1).
Resumen del procedimiento optogenético. Fuente: G, N, et al.10
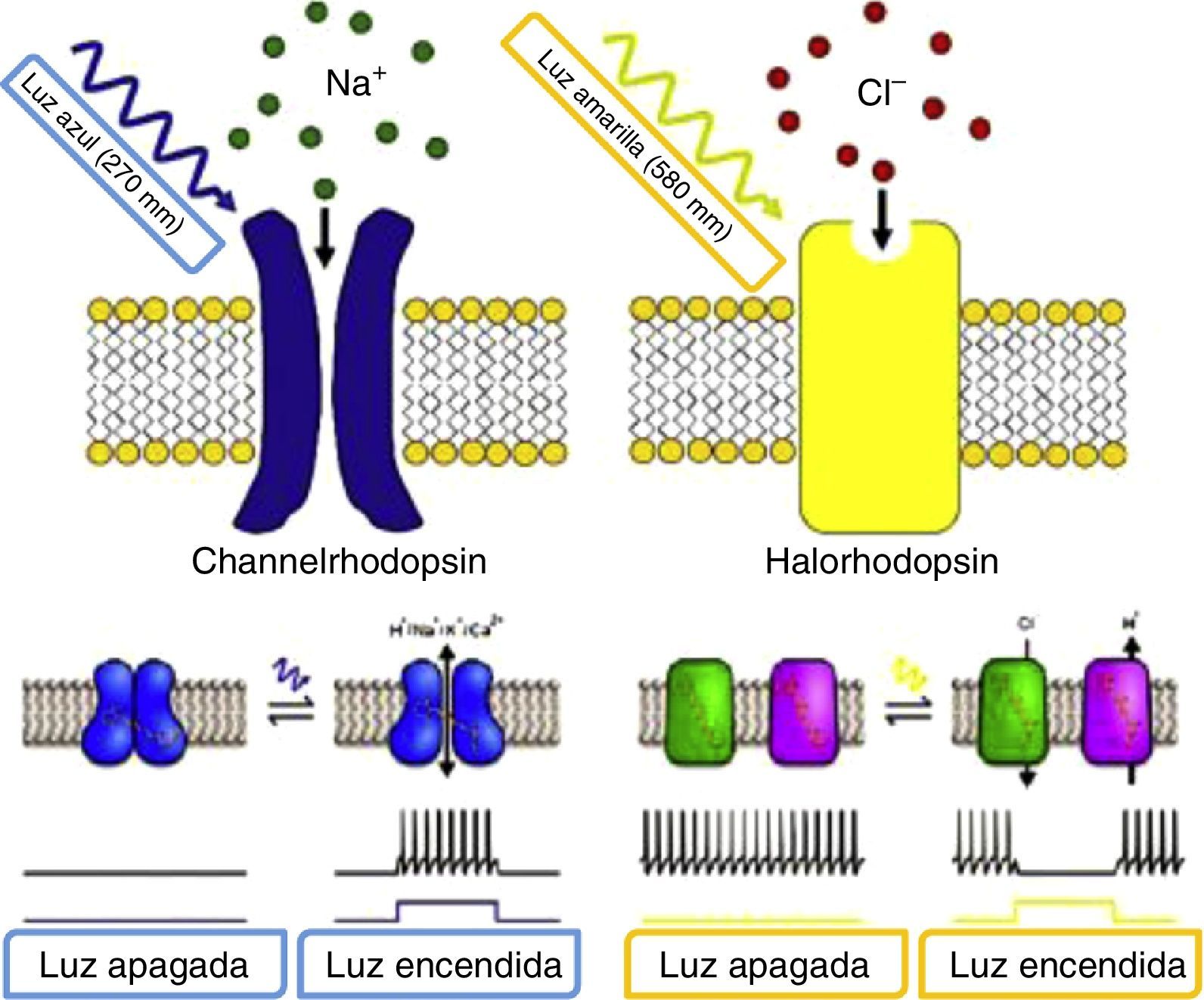
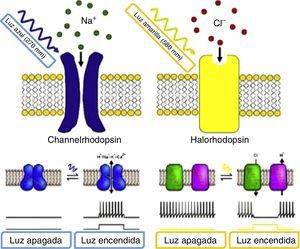
El proceso de la técnica comienza por perforar de forma conjunta constructos genéticos que se componen de una secuencia promotora y un gen. Los genes de la ChR o de la NpHR son los más usados para codificar las proteínas sensibles a la luz en células diana. En la presencia de luz azul (con una onda en el espectro de 470mm) el ChR es llevado a un cambio conformacional que permite el influjo de iones de sodio para despolarizar la célula, activándola de manera efectiva; mientras que en el caso de NpHR la célula es apagada de forma efectiva por la presencia de luz amarilla (con una onda en el espectro de 580mm) al permitir que iones de cloro logren la hiperpolarización de la célula (fig. 2)12.
Proteínas sensibles a la luz ChR (izquierda) y NpHR (derecha). Fuente: Natasha et al.12.
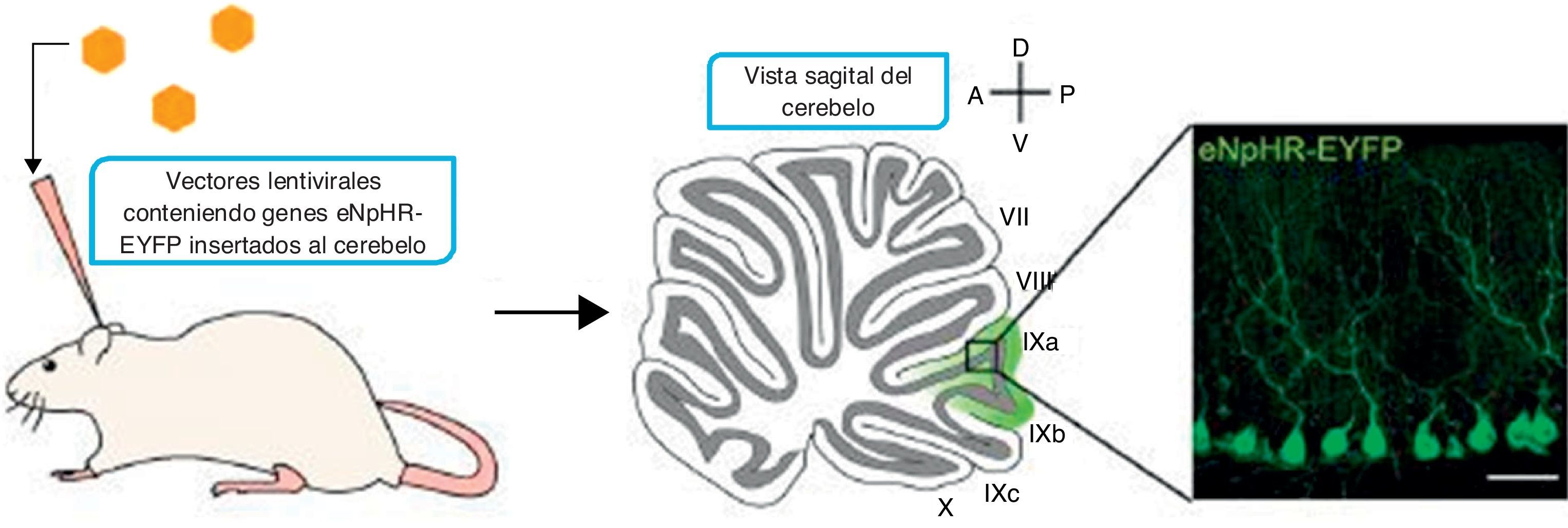
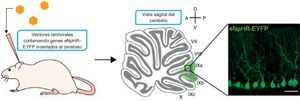
Existen 3 métodos principales para entregar los genes codificantes para proteínas sensibles a la luz hacia las células diana. Estos consisten en la transfección, el uso de líneas animales transgénicas, y el método más popular, la transducción viral. Con el uso de vectores virales células precisas pueden ser seleccionadas para el uso de un promotor específico que sea transportado al interior de estas por la localización de una inyección específica, siendo el sitio más común el cerebelo cuyo papel fundamental en las vías motoras es apreciable al ser una de las principales zonas responsables del relevo de dicha información13 (fig. 3).
Transporte del gen a la célula diana. Fuente: Tonnesen13.
Esta transmisión de luz in vivo para estimular a la célula diana es comúnmente realizada al transmitir una fuente de luz focal desde un láser acoplado a fibras ópticas guiadas a través de una cánula al tejido transducido14 (fig. 4).
Transmisión de luz a una célula diana. Fuente: Bernstein et al.14.
La epilepsia es un trastorno neurológico crónico que se describe como la aparición de convulsiones recurrentes e impredecibles que se activan por el aumento de la actividad eléctrica en las neuronas del cerebro. En la mayoría de los casos, la causa de la epilepsia no ha sido identificada, pero se ha asociado a factores como trauma cerebral, apoplejía, cáncer, el abuso de drogas y alcohol, y la fiebre alta en los niños.
La epilepsia del lóbulo temporal es uno de los tipos más comunes de epilepsia que afecta a los adultos. Los tratamientos actuales para la epilepsia del lóbulo temporal han causado grandes preocupaciones debido a los efectos secundarios negativos y por ello es importante tener en cuenta otras formas de tratamiento como la optogenética. Armstrong et al. han sugerido la detención de la aparición de convulsiones espontáneas utilizando optogenética en un modelo de ratón que tiene epilepsia del lóbulo temporal.
Descubrieron que la optogenética activa las células GABAérgicas en el hipocampo lo que impide la aparición de convulsiones debido a la exposición de la luz. Señalaron que las convulsiones del lóbulo temporal pueden detectarse y prevenirse mediante el control de poblaciones específicas de células de una manera espacialmente limitada con el uso de esta técnica15. Por lo tanto, enfoques clínicos para el tratamiento de la epilepsia podrían desarrollarse aún más utilizando los conceptos de la optogenética, pero los efectos secundarios de este tratamiento serán desconocidos hasta que se haya probado en cerebros epilépticos humanos.
Adicionalmente, debido a que esta técnica puede ser usada en organismos vivos, tales como en los modelos animales de la enfermedad de Parkinson, los investigadores están ganando nuevas perspectivas e información sobre desórdenes neuronales. Ahora, un nuevo estudio realizado por el equipo de neurociencia liderado por Esther Krook-Magnuson ha denotado que algún día será posible utilizar la optogenética como un método novedoso para detener de una vez por todas las convulsiones en pacientes epilépticos.
Su trabajo anterior en modelos animales demostró que es posible utilizar la estimulación fotónica para detener las convulsiones de manera efectiva en ratones que fueron modificados para desarrollar diferentes tipos de epilepsias16 (fig. 5).
Ratón de experimentación con la interfaz optogenética de onda espectral azul (270mm, ChR) colocada. Fuente: Deisseroth20.
Sin embargo, quedó inconcluso el conocer qué regiones del cerebro o sitios de acción serían los más efectivos de estimular para detener las convulsiones en su desarrollo, lo cual la neurocientífica Krook-Magnuson y sus colegas recientemente se han propuesto explorar más detenidamente.
Actualmente se han investigado parcialmente los efectos de la estimulación de un tipo celular específico en la estructura denominada giro dentado, que forma parte del hipocampo, una región crítica para el aprendizaje y la memoria; algunas líneas de evidencia indican que estas células, llamadas células granulosas, pueden prevenir una actividad convulsiva en el hipocampo, resultado de nuevos estudios realizados actualmente en modelos animales17.
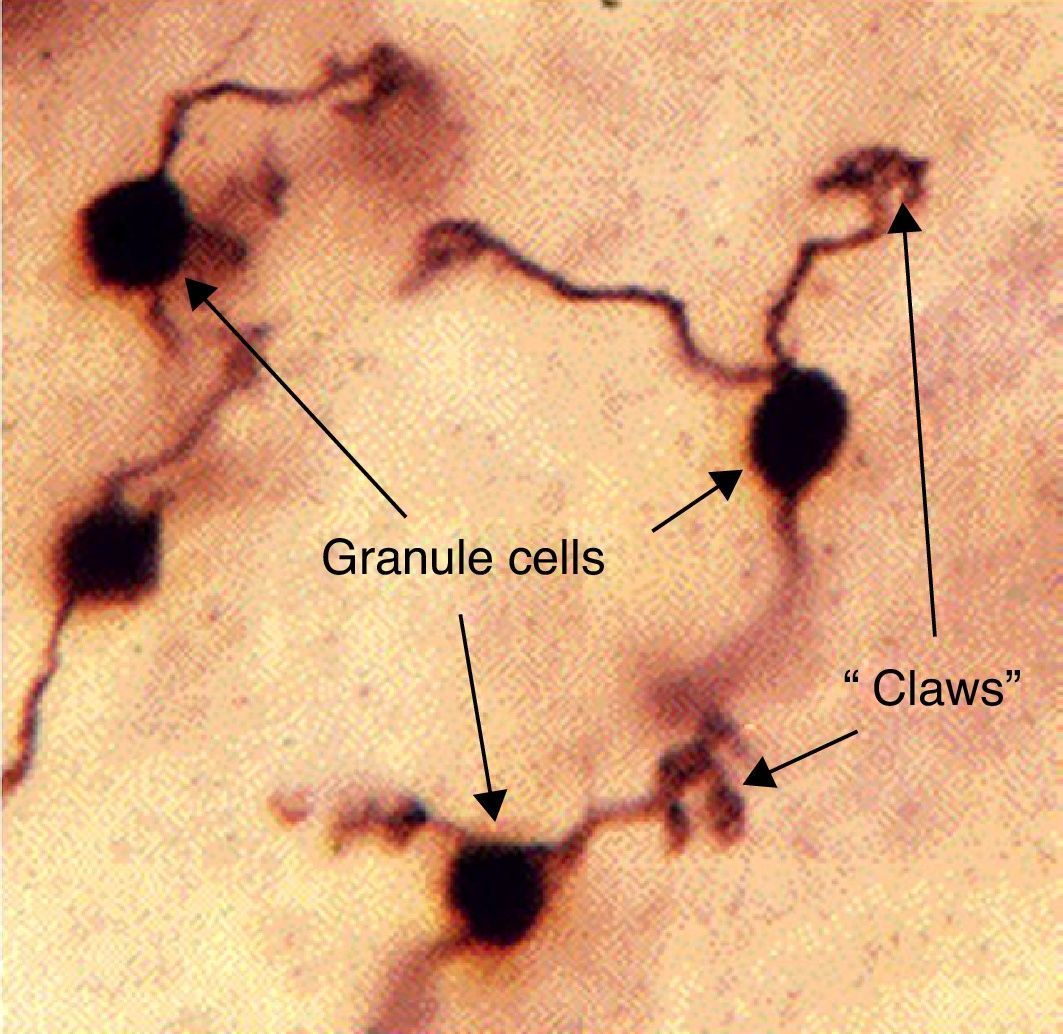
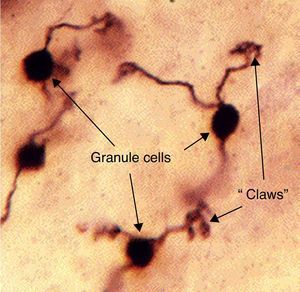
El nombre de célula granulosa ha sido utilizado por los anatómicos para un número de diferentes tipos de neurona cuya única característica común es que todas ellas tienen cuerpos celulares muy pequeños. Las células granulares se encuentran dentro de la capa granular del cerebelo, el giro dentado del hipocampo, la capa superficial del núcleo coclear dorsal, el bulbo olfatorio y la corteza cerebral18.
Las células granulares del cerebelo representan la mayoría de las neuronas en el cerebro humano. Estas células granulares reciben señales excitatorias de entrada a partir de fibras musgosas procedentes de núcleos del puente (fig. 6).
Modelo histológico de la célula granulosa y su unión a fibras musgosas. Fuente: Medicine TWUSo25.
Estas células granulares del cerebelo envían fibras paralelas a través de la capa de Purkinje en la capa molecular donde se ramifican y se propagan a través de glorietas dendríticas de células de Purkinje. Estas fibras paralelas forman miles de sinapsis-célula-célula gránulo Purkinje excitatorios en las dendritas intermedias y distales de las células de Purkinje utilizado el glutamato como neurotransmisor, el cual tiene un efecto inhibitorio en el sistema nervioso19.
Prevenir que estas células granulosas se activen durante una convulsión ha servido para detenerlas de forma efectiva, mientras que la estimulación ha logrado que se empeoren las convulsiones a diferencia de lo observado en el modelo del cerebelo, lo cual apunta a una posible razón de que el hipocampo comprometa una región mucho más sensible neuronalmente hablando.
El hipocampo es a menudo el foco de las crisis epilépticas: la esclerosis del hipocampo es el tipo más comúnmente visible de daño tisular en la epilepsia del lóbulo temporal21. Sin embargo, aún no está claro si la epilepsia es generalmente causada por anomalías del hipocampo o si el hipocampo está dañado por los efectos acumulativos de las convulsiones. En los entornos experimentales donde convulsiones repetitivas son inducidas artificialmente en animales, el daño del hipocampo es un resultado frecuente22. Ello puede ser una consecuencia del hecho de que el hipocampo es una de las partes más excitables eléctricamente del cerebro. También puede tener algo que ver con el hecho de que el hipocampo es una de las pocas regiones del cerebro donde nuevas neuronas siguen siendo creadas a lo largo de la vida23.
DiscusiónLa optogenética se ha aplicado con éxito en la investigación en neuromodulación. Por ejemplo, Witten et al.24 utilizaron herramientas de optogenética para aclarar la relación entre la dopamina (DA) y el disparo de las neuronas con retroalimentación positiva en ratas genéticamente modificadas. Observaron que la estimulación óptica de las neuronas DA en el área tegmental ventral de estas ratas llevó a la vigorosa autoestimulación intracraneal, por lo que pensamos que podría tener un papel muy importante en el tratamiento de enfermedades como la de Parkinson.
Del mismo modo, Tsai et al.26 demostraron que la actividad dopaminérgica fásica es suficiente para mediar en mamíferos el condicionamiento conductual, mediante el uso de un enfoque optogenético. Se hace hincapié en que la integración de la optogenética con otros enfoques (por ejemplo, electrofisiológicos, conductuales y métodos electroquímicos) revelará interacciones de las neuronas DA con otros circuitos neuromoduladores (por ejemplo, monoaminérgica y circuitos opioides).
El uso de la optogenética reveló además los roles opuestos de neuronas D1 y D2++ (en el núcleo accumbens) en el procesamiento de la recompensa de la cocaína (Lobo et al.27). Se encontró que la activación de las neuronas D2+ suprime la recompensa de la cocaína, mientras que la activación de las neuronas D1+ muestra el patrón opuesto. De esta forma es posible que en el futuro este conocimiento sea útil en el tratamiento de adicciones.
Otro ejemplo de la neuromodulación optogenética muestra cómo los síntomas de la enfermedad de Parkinson pueden ser agravados o mejorados al modular la actividad de descarga de neuronas individuales, o con la manipulación de las vías directas o indirectas en los ganglios basales28. Resultados como estos demuestran que el uso de la optogenética puede conducir a una mejor comprensión de las relaciones causa-efecto, por ejemplo en los trastornos neuronales basados en dopamina.
En suma, la optogenética es una herramienta prometedora para la neurociencia cognitiva y creemos que en el futuro podrá ser aplicada en seres humanos a largo plazo como un tratamiento funcional para ciertas enfermedades neuronales. Aunque esta ciencia todavía se enfrenta a obstáculos, como es su propio desarrollo, el campo de la optogenética está creciendo rápidamente y se están realizando continuamente nuevos avances para mejorar la técnica.
Los modelos experimentales en optogenética no han mostrado efectos secundarios como aquellos vistos en muchos de los actuales fármacos destinados a controlar la actividad neuronal, debido a su especificidad espacial, pudiendo sustituir potencialmente el tratamiento por estimulación cerebral profunda en el futuro26.
Tomada en conjunto, la optogenética complementa otros métodos neurocientíficos y se debería comenzar a utilizar en una escala más amplia dentro de la neurociencia cognitiva, en vista del alcance tan preciso que esta tiene como interfaz de retroalimentación de la función eléctrica neuronal. Es preciso comentar que la optogenética va a ser una gran herramienta que en un futuro cercano nos ayudará a cambiar el paradigma con el cual tratamos las enfermedades neuronales.
Hoy en día una cantidad abrumadora de fármacos son recetados a cientos de pacientes para controlar la mayoría de estas enfermedades, posiblemente el día de mañana baste decirle a estos pacientes que se verán sometidos a una cirugía rápida e indolora en la cual un circuito asegure su recuperación a largo plazo, simplemente activando unos cuantos estímulos neuronales, similar a la función de un marcapasos.
FinanciaciónNo se recibió patrocinio para llevar a cabo este artículo.
Conflicto de interesesEl autor declara no tener conflicto de intereses.