Se presenta un estudio filogenético del subgénero Phyllophaga (Triodonyx) basado en 48 taxones de Melolonthinae y 140 caracteres morfológicos externos de adultos y de genitales masculinos y femeninos. Del análisis cladístico se obtuvieron 3 árboles igualmente parsimoniosos que permitieron comprobar la monofilia del grupo y evaluar su posición taxonómica. Los resultados muestran evidencias suficientes para asegurar que las 5 especies, tradicionalmente asignadas al subgénero Triodonyx, no pertenecen al género Phyllophaga. Se propone la restitución del género Triodonyx y la formación de la subtribu nueva Triodonina. Las relaciones del nuevo grupo con otras tribus de Melolonthinae se comentan en forma preliminar.
A phylogenetic study of the subgenus Phyllophaga (Triodonyx) based on external morphology and male and female genitalia characters of adult specimens is presented. The cladistic analysis included 48 taxa of Melolonthinae and 140 morphological characters. Three equally parsimonious trees were obtained. The results allowed to conclude that the 5 species traditionally included in the subgenus Triodonyx do not belong to the genus Phyllophaga. The restitution of the genus Triodonyx and the formation of the subtribe Triodonina are proposed. The relationships of the new group with other tribes of Melolonthinae are preliminarily commented.
Dentro de la subfamilia Melolonthinae Leach, 1819 tradicionalmente se han agrupado en 17 tribus con distribución mundial (Morón, 2004; Carrillo-Ruiz y Morón, 2006). La tribu Melolonthini Leach, 1819 contiene a las subtribus Rhizotrogina, Melolonthina y Diplotaxina. Actualmente, Rhizotrogina Burmeister, 1855 incluye 76 géneros y cerca de 1 770 especies distribuidas en América, Eurasia, Asia y África (Lacroix, 2012). El género Phyllophaga Harris, 1827 incluye 9 subgéneros (Phyllophaga s. str. Harris, 1827; Phytalus Erichson, 1847; Chlaenobia Blanchard, 1850; Listrochelus Blanchard, 1851; Tostegoptera Blanchard, 1851; Eugastra LeConte, 1856; Chirodines Bates, 1888; ClemoraSaylor, 1942; CnemarachisSaylor, 1942 y TriodonyxSaylor, 1942) y 41 grupos de especies (Morón, 1986; Morón et al., 1997; Morón, 2003; Evans et al., 2009). Lacroix (2012) estimó que a nivel mundial existen 792 especies de Phyllophaga restringidas a las regiones neártica y neotropical, que en su mayoría se encuentran en Estados Unidos y México.
El género Triodonyx fue propuesto por Saylor en 1942, para incluir a Phyllophaga gigantissima Saylor, 1935, P. lalanza Saylor, 1941 y provisionalmente P. ecostata (Horn, 1887), haciendo notar que las 3 especies presentan las uñas tridentadas, la carina meso y metatibial incompleta y escaso dimorfismo sexual, además de que P. gigantissima y P. lalanza tienen un surco longitudinal en el propigidio. Arnett (1962) reubicó Triodonyx como un subgénero dentro de Phyllophaga, argumentando que tenía diferencias morfológicas insuficientes para ameritar el nivel de género y Morón (1986) confirmó dicha postura. Warner y Morón (1992) hicieron una revisión del subgénero Triodonyx. Describieron 3 especies nuevas para el grupo: Phyllophaga bellamyiWarner y Morón, 1992, P. woodruffWarner y Morón, 1992 y P. nogueiraiWarner y Morón, 1992. Tales autores incluyeron en Triodonyx a todas las especies que presentan el cuerpo muy robusto (hasta 30mm de longitud y 17mm de ancho máximo), carina meso y metatibial incompleta y reducida a 2 o 3 espinas, uñas tarsales tridentadas, propigidio con un surco mesial muy bien marcado, vestidura dorsal ausente, borde anterobasal del pronoto crenulado, élitros densamente punteados, antenas con 10 segmentos, ojos deprimidos bajo el nivel de la frente, mandíbulas con ápice doblado ventralmente, dimorfismo sexual prácticamente nulo, genitales masculinos con los parámeros amplios contiguos o casi contiguos, y edeago en forma de “u” o de tridente. Warner y Morón (1992) excluyeron a P. ecostata (Horn, 1887) de Triodonyx argumentando que, aunque presenta uñas tarsales tridentadas y carina tibial incompleta, las piezas bucales están reducidas en relación con el ancho de la cabeza, la sutura frontoclipeal es recta, las antenas tienen 9 segmentos, el pronoto presenta diferente vestidura y puntuación, los élitros muestran vestigios notables de costillas, carece de surco medio en el propigidio y las uñas tarsales están débilmente curvadas. Actualmente Triodonyx incluye 5 especies con distribución en el oeste central mexicano y el suroeste de Estados Unidos (Morón et al., 1997).
Los objetivos del presente trabajo fueron realizar un análisis para definir las relaciones filogenéticas del subgénero Triodonyx, comprobar la monofilia del grupo y evaluar su posición taxonómica dentro del género Phyllophaga, usando caracteres morfológicos externos de adultos y de genitales masculinos y femeninos de todas las especies incluidas en el subgénero.
Materiales y métodosSe revisaron 144 especímenes pertenecientes a la colección entomológica del Instituto de Ecología A. C., Xalapa, Veracruz (IEXA) y la colección M. A. Morón, Xalapa (MXAL). El grupo interno incluye las 5 especies de Triodonyx, 24 especies representantes de los otros 7 subgéneros de Phyllophaga y 12 especies tradicionalmente incluidas dentro de la subtribu Rhizotrogina. Para el grupo externo se escogieron 9 especies de melolontinos de los géneros Isonychus, Anoxia, Melolontha, Polyphylla, Serica, Diplotaxis y Macrodactylus, un género representante de la subfamilia Hopliinae (Hoplia) y un representante de Dynastinae (Cyclocephala) (Cuadro 1).
Taxones seleccionados para el análisis filogenético
| Especie | Subgénero | Distribución | Ejs. Revisados |
|---|---|---|---|
| Phyllophaga gigantissima Saylor, 1935 | Triodonyx | México (Sin.) | 1 |
| P. lalanza Saylor, 1941 | Triodonyx | México (Nay.) | 8 |
| P. woodruffiWarner y Morón, 1992 | Triodonyx | México (Jal.) | 1 |
| P. bellamyiWarner y Morón, 1992 | Triodonyx | EUA (AZ) | 2 |
| P. nogueiraiWarner y Morón, 1992 | Triodonyx | México (Jal.) | 2 |
| P. vexata Horn, 1885 | Chlaenobia | México (S.L.P.) | 2 |
| P. latipes Bates, 1888 | Chlaenobia | México (Ver.) | 4 |
| P. peccata Blackwelder, 1944 | Chlaenobia | México (Col.) | 2 |
| P. pruinosa Blanchard, 1851 | Phytalus | México (Ver.) | 2 |
| P. trichodes Bates, 1888 | Phytalus | México (N.L.) | 2 |
| P. obsoleta Blanchard, 1850 | Phytalus | México (Sin.) | 2 |
| P. cristagalli Arrow, 1933 | Listrochelus | México (Son.) | 2 |
| P. praesidii Bates, 1888 | Listrochelus | México (Col.) | 2 |
| P. nogueirana Morón, 2002 | Listrochelus | México (Son.) | 2 |
| P. setífera Burmeister, 1855 | Trichesthes | México (Sin.) | 2 |
| P. lenis Horn, 1887 | Trichesthes | México (Son.) | 4 |
| P. cribrosa LeConte, 1853 | Eugastra | EUA (TX) | 2 |
| P. lanceolata Say, 1825 | Tostegoptera | EUA (TX) | 2 |
| P. hirticula Knoch, 1801 | Phyllophaga | EUA (TN) | 4 |
| P. profunda Blanchard, 1850 | Phyllophaga | EUA (LA) | 2 |
| P. pleei Blanchard, 1850 | Cnemarachis | Puerto Rico | 2 |
| P. kenscofi Wolcott, 1928 | Cnemarachis | Rep. Dominicana | 2 |
| P. mali Wolcott, 1928 | Cnemarachis | Rep. Dominicana | 2 |
| P. opaca Moser, 1918 | Phyllophaga | México (Son.) | 9 |
| P. dasypoda Bates, 1888 | Phyllophaga | México (Ver.) | 6 |
| P. temora Saylor, 1943 | Phyllophaga | México (N.L.) | 8 |
| P. torta LeConte, 1856 | Phyllophaga | México (N.L.) | 2 |
| P. pubicollis Blanchard, 1850 | Phyllophaga | México (Ver.) | 3 |
| P. sturmi Bates, 1888 | Phyllophaga | México (Ver.) | 3 |
| Rhizotrogus aestivus Olivier, 1789 | Rep. Georgia | 2 | |
| Amphimallon solstitialis Linnaeus, 1758 | Rep. Checa | 2 | |
| Miltotrogus vernus Germar, 1824 | Hungría | 2 | |
| Heptophylla picea Motschulsky, 1857 | Japón | 3 | |
| Cryptotrogus weisei Kraatz, 1888 | Jordania | 2 | |
| Haplidia transversa Fabricius, 1801 | Macedonia | 2 | |
| H. serrata Fabricius, 1787 | India | 2 | |
| H. rufoflava Brenske, 1894 | India | 2 | |
| H. lata Brenske, 1892 | Taiwán | 2 | |
| H. nigra Redtenbacher, 1868 | China | 2 | |
| Microtrichia kawadai Nomura, 1959 | Japón | 3 | |
| Schizonycha mimocontinens Pope, 1960 | Rep. Sudafricana | 2 | |
| Isonychus piperitus Bates, 1887 | México (Ver.) | 2 | |
| Anoxia orientalis Krynicky, 1832 | Bulgaria | 2 | |
| Melolontha melolontha Linnaeus, 1758 | Italia | 2 | |
| Polyphylla petiti Guerin, 1830 | México (Hgo.) | 2 | |
| Serica porcula Casey, 1884 | EUA (AZ) | 3 | |
| Diplotaxis hirsuta Vaurie, 1958 | México (Ver.) | 2 | |
| Macrodactylus nigripes Bates, 1887 | México (Pue.) | 2 | |
| Hoplia squamifera Burmeister, 1844 | México (Ver.) | 9 | |
| Cyclocephala lunulata Burmeister, 1847 | México (Ver.) | 7 |
Todas las muestras de las especies contaron con al menos un representante de cada sexo. En algunas especies se revisaron series de hasta 9 individuos para conocer la variación de los caracteres y evitar una valoración inadecuada de los mismos. Los ejemplares seleccionados se reblandecieron en vapor de agua durante 30 minutos o dentro de una cámara húmeda durante un día. Todos los ejemplares se disecaron con ayuda de un microscopio estereoscópico Leica Zoom 2000 para exponer sus piezas bucales; mentón, maxilas, mandíbulas y labro; antenas, con las lamelas separadas; alas y genitales. Las piezas extraídas se pegaron con goma entomológica sobre pequeños soportes de papel opalina blanco y se montaron en el mismo alfiler del ejemplar de origen (Fig. 1). Las placas genitales de todas las hembras no se retiraron del ejemplar y solo se expusieron entre la placa anal y pigidial, de forma que se pudieron analizar observando al ejemplar en vista ventral.
Se seleccionaron 140 caracteres morfológicos, de los cuales 126 fueron binarios y 14 fueron multiestado, codificados con números (0, 1 y 2), donde el número 0 no es considerado necesariamente como un estado plesiomórfico. Los caracteres inaplicables se codificaron como “-” y los faltantes se señalaron como “?” (Cuadro 2). Cabe mencionar que los caracteres morfológicos de las alas y la mayor parte de los caracteres asociados con las piezas bucales nunca se habían tomado en cuenta en estudios anteriores de este grupo.
Matriz de caracteres morfológicos usada en el análisis filogenético
| 10. | 20. | 30. | 40. | 50. | ||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Phyllophaga lalanza | 0 | 0 | 1 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 |
| Phyllophaga gigantissima | ? | 0 | 1 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | 0 | 0 | 0 | 0 | ? | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 |
| Phyllophaga woodruff | 0 | 0 | 1 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | 0 | 0 | 0 | 0 | ? | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 1 | 0 | 0 |
| Phyllophaga bellamyi | 0 | 0 | 1 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 |
| Phyllophaga nogueirai | 0 | 0 | 1 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 |
| Phyllophaga hirticula | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 |
| Phyllophaga profunda | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | ? | 1 | 1 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 |
| Phyllophaga pleei | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 2 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Phyllophaga kenscoff | 0 | 0 | 0 | 1 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 |
| Phyllophaga mali | 0 | 0 | 0 | 1 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 2 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Phyllophaga vexata | 0 | 0 | 0 | 1 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Phyllophaga latipes | 0 | 0 | 0 | 1 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Phyllophaga peccata | 0 | 0 | 0 | 1 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Phyllophaga pruinosa | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 |
| Phyllophaga trichodes | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 0 |
| Phyllophaga obsoleta | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Phyllophaga cristagalli | 0 | 0 | 1 | 1 | 2 | 0 | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 |
| Phyllophaga praesidii | 0 | 0 | 1 | 1 | 2 | 0 | 1 | 0 | 1 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 |
| Phyllophaga nogueirana | 0 | 0 | 1 | 1 | 2 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 0 | 1 |
| Phyllophaga setifera | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 |
| Phyllophaga lenis | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 |
| Phyllophaga cribrosa | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 |
| Phyllophaga lanceolata | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 |
| Phyllophaga opaca | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 |
| Phyllophaga dasypoda | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 |
| Phyllophaga temora | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 |
| Phyllophaga torta | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 |
| Phyllophaga pubicollis | 0 | 0 | 0 | 1 | 2 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 |
| Phyllophaga sturmi | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Rhizotrogus aestivus | 0 | 0 | 0 | 0 | 2 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 1 | 0 |
| Amphimallon solstitialis | 0 | 0 | 0 | 0 | 2 | 0 | 1 | 0 | 0 | 0 | 1 | 1 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 2 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 1 | 0 |
| Miltotrogus vernus | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 0 | 0 |
| Heptophylla picea | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 2 | 1 | 0 | 1 | 1 | 0 | 0 | 0 |
| Cryptotrogus weisei | 0 | 0 | 0 | 0 | 2 | 0 | 1 | 1 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 1 | 2 | 2 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 1 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 |
| Haplidia transversa | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 0 | 1 |
| Holotrichia serrata | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 1 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 |
| Holotrichia rufoflava | 0 | 0 | 1 | 1 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 |
| Holotrichia lata | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 1 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Holotrichia nigra | 0 | 0 | 1 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Microtrichia kawadai | 0 | 0 | 1 | 1 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 |
| Schizonycha mimocontinens | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 2 | 1 | 1 | 1 | 1 | 0 | 0 | 1 |
| Isonychus piperitus | 0 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 0 |
| Anoxia orientalis | 0 | 0 | 0 | 1 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 2 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 1 | 1 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 0 |
| Melolontha melolontha | 1 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 |
| Polyphylla petiti | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 1 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 0 | 1 | 1 | 0 | 1 | 1 | 0 | 1 | 1 | 1 | 1 | 0 | 1 | 0 |
| Serica porcula | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 1 | 2 | 0 | 1 | 0 | 1 | 1 | - | - | - | - | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 |
| Diplotaxis hirsuta | 1 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 0 |
| Macrodactylus nigripes | 0 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 1 | 1 | 1 | 1 | 0 | 0 |
| Hoplia squamifera | 0 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 |
| Cyclocephala lunulata | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 2 | 1 | 0 | 0 | 0 | 2 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 60. | 70. | 80. | 90. | 100. | ||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Phyllophaga lalanza | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 |
| Phyllophaga gigantissima | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | ? | ? | ? | ? | ? | ? | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | ? | 1 |
| Phyllophaga woodruffi | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | ? | ? | ? | ? | ? | ? | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | ? |
| Phyllophaga bellamyi | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 |
| Phyllophaga nogueirai | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 |
| Phyllophaga hirticula | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Phyllophaga profunda | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Phyllophaga pleei | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 |
| Phyllophaga kenscoffi | 1 | 1 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 |
| Phyllophaga mali | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 |
| Phyllophaga vexata | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 |
| Phyllophaga latipes | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 0 | 0 | 0 |
| Phyllophaga peccata | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 2 |
| Phyllophaga pruinosa | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 |
| Phyllophaga trichodes | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Phyllophaga obsoleta | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Phyllophaga cristagalli | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 |
| Phyllophaga praesidii | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 |
| Phyllophaga nogueirana | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Phyllophaga setifera | 1 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Phyllophaga lenis | 1 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Phyllophaga cribrosa | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 1 | 1 | 0 | 0 | 1 | 1 | 0 | 0 | 1 | 0 | 1 | - | 0 | 1 | 1 | - | - | - | - | - | - | - | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Phyllophaga lanceolata | 0 | 1 | 1 | 0 | 1 | 1 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 |
| Phyllophaga opaca | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Phyllophaga dasypoda | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 1 |
| Phyllophaga temora | 1 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 |
| Phyllophaga torta | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Phyllophaga pubicollis | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Phyllophaga sturmi | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Rhizotrogus aestivus | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Amphimallon solstitialis | 1 | 1 | 1 | 0 | 0 | 1 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Miltotrogus vernus | 0 | 1 | 0 | 0 | 1 | 1 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Heptophylla picea | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 |
| Cryptotrogus weisei | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 |
| Haplidia transversa | 0 | 1 | 0 | 0 | 1 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 |
| Holotrichia serrata | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 |
| Holotrichia rufoflava | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 |
| Holotrichia lata | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 |
| Holotrichia nigra | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 |
| Microtrichia kawadai | 0 | 1 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 |
| Schizonycha mimocontinens | 1 | 1 | 0 | 0 | 1 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Isonychus piperitus | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Anoxia orientalis | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 |
| Melolontha melolontha | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 |
| Polyphylla petiti | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 |
| Serica porcula | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 |
| Diplotaxis hirsuta | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 |
| Macrodactylus nigripes | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Hoplia squamifera | 0 | 1 | 1 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 |
| Cyclocephala lunulata | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 |
| 110. | 120. | 130. | 140. | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Phyllophaga lalanza | 0 | 1 | 1 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 |
| Phyllophaga gigantissima | 0 | 1 | 1 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | ? | ? | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 |
| Phyllophaga woodruffi | 0 | 1 | 1 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | ? | ? | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 |
| Phyllophaga bellllamyi | 0 | 1 | 1 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 |
| Phyllophaga nogueirai | 0 | 1 | 1 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | ? | ? | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 |
| Phyllophaga hirticula | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Phyllophaga profunda | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Phyllophaga plleei | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Phyllophaga kennsscoffi | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | ? | ? | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Phyllophaga mali | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | ? | ? | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Phyllophaga vexata | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | ? | 0 | 0 | ? | ? | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 2 | 0 | 1 |
| Phyllophaga latipes | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 2 | 0 | 1 |
| Phyllophaga peccatta | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 2 | 0 | 1 |
| Phyllophaga pruinosa | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 0 |
| Phyllophaga trichodes | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 0 |
| Phyllophaga obsoleta | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | ? | - | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 0 |
| Phyllophaga cristagalli | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | - | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 3 | 0 | 1 |
| Phyllophaga praesidii | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | - | 0 | 0 | ? | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 3 | 0 | 1 |
| Phyllophaga nogueirana | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 3 | 0 | 1 |
| Phyllophaga setifera | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 |
| Phyllophaga lleniss | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 |
| Phyllophaga cribrosa | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Phyllophaga lanceolata | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | ? | ? | ? | ? | ? | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Phyllophaga opaca | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Phyllophaga dasypoda | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 |
| Phyllophaga temora | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Phyllophaga torta | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | ? | 0 | 0 | 0 | ? | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Phyllophaga pubicollis | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | ? | 0 | 0 | ? | ? | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 |
| Phyllophaga sturmi | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Rhizotrogus aestivus | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Amphimallon solstitialis | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | ? | 0 | 0 | ? | ? | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Miltotrogus vernus | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | - | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Heptophylla picea | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | ? | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 0 |
| Cryptotrogus weisei | 0 | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 1 | 1 | - | 0 | 0 | 0 | 1 | 1 | 1 | - | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Haplidia transversa | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | - | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 |
| Holotrichia serrata | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | ? | ? | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Holotrichia rufoflava | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Holotrichia lata | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | ? | ? | ? | ? | ? | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Holotrichia nigra | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Microtrichia kawadai | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | - | 0 | ? | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Schizonycha mimocontinens | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | ? | ? | - | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 0 |
| Isonychus piperitus | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | ? | ? | ? | ? | ? | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 0 |
| Anoxia orientalis | 0 | 1 | 1 | 1 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | - | 1 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Melolontha melolontthaa | 1 | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | ? | ? | ? | ? | ? | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Polyphylla petiti | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Serica porcula | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 2 | 0 | 0 | 0 | ? | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 2 | 0 | 1 |
| Diplotaxis hirsuta | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | - | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 1 |
| Macrodactylus nigripes | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | ? | 0 | 0 | 0 | 0 | 0 | 1 | 0 | - | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 2 | 0 | 1 |
| Hoplia squamifera | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | - | 0 | 0 | 1 | 1 | 0 | 0 | 1 | 0 | - | - | 0 | 0 | 0 | 1 | 1 | 2 | 0 | 0 |
| Cyclocephala lunulata | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 2 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 2 | 1 | 0 |
El análisis cladístico basado en parsimonia se hizo con los programas WinClada, versión 1.00.08 (Nixon, 2002) y NONA, versión 2.0 (Goloboff, 1999). Todos los caracteres fueron tratados como desordenados (optimización de Fitch) y con el mismo peso. Se hizo una búsqueda heurística por permutación de ramas con la estrategia TBR múltiple + TBR (mult*max*), almacenando 10 000 árboles. Se hicieron 1 000 réplicas, partiendo de 10 árboles por cada réplica y se polarizaron los estados de carácter por la comparación con el grupo externo. Este procedimiento se repitió 10 veces. Por último, se aplicó una prueba de bootstrap (1 000 réplicas) como medida de soporte y robustez de las ramas (Felsenstein, 1985). Sin embargo, debido a las grandes diferencias entre la representatividad de las muestras de cada agrupamiento, el criterio para aceptar el soporte de los valores de bootstrap fue flexible.
Lista de caracteres morfológicosCabeza
- 1.
Margen apical del prementón en vista dorsal. 0) bilobulado, 1) recto.
- 2.
Labio. 0) tan largo como ancho o más ancho que largo, 1) más largo que ancho.
- 3.
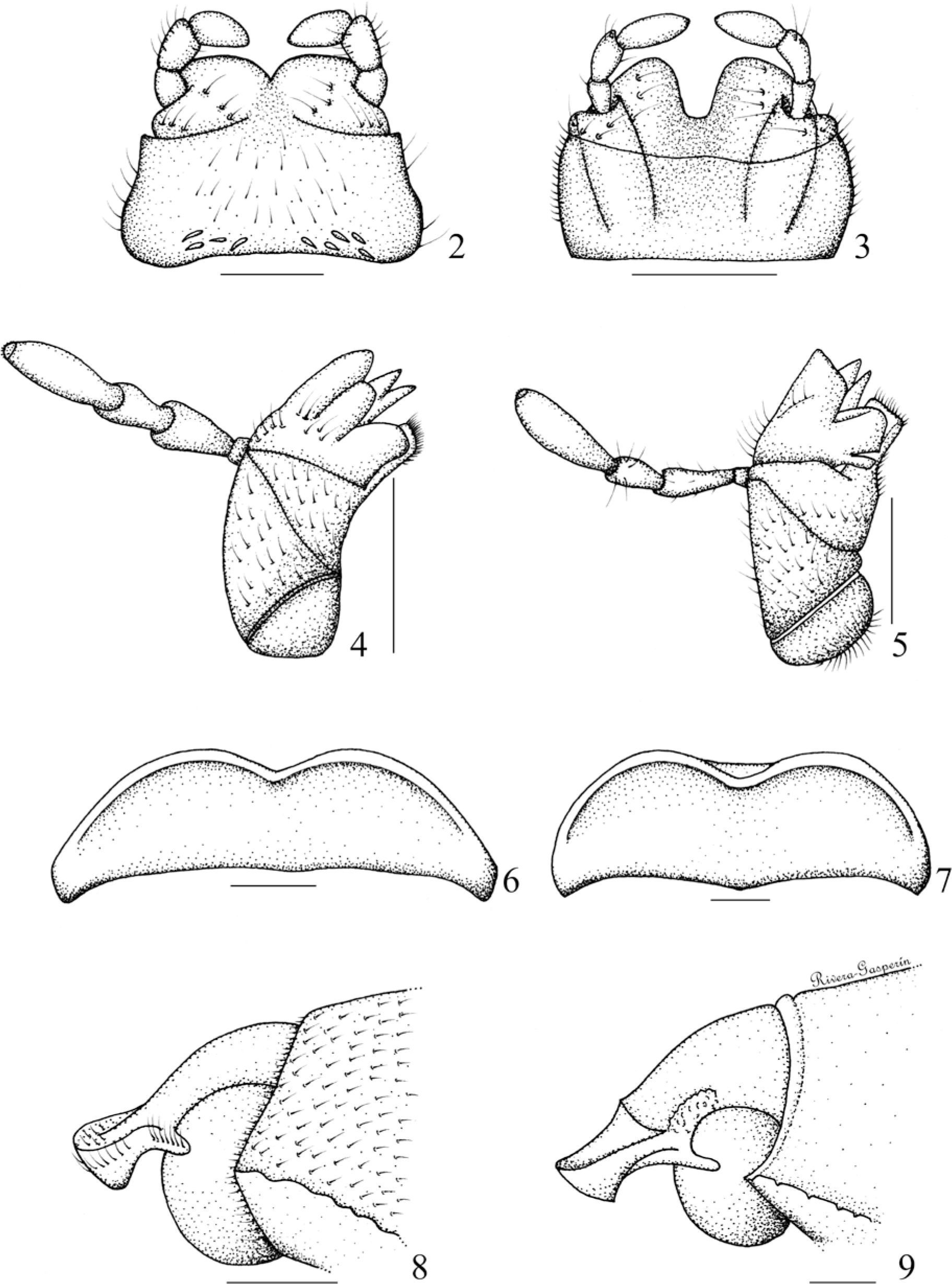
Elevaciones laterales en el mentón. 0) ausentes (Fig. 2), 1) presentes (Fig. 3).
- 4.
Dimensión de la galea maxilar. 0) reducida, 1) amplia.
- 5.
Número de dientes maxilares. 0) 4 o 5, 1) 6 o más, 2) 1.
- 6.
Diente maxilar más cercano a la lacinia, observando a la maxila en vista ventral. 0) sencillo (Fig. 4), 1) bifurcado (Fig. 5).
- 7.
Disposición de la lacinia. 0) fusionada con la galea, 1) libre y proyectada.
- 8.
Forma de los palpos maxilares. 0) delgados, 1) engrosados.
- 9.
Forma del área sensorial del 4° artejo de los palpos maxilares (“sensillum”). 0) circular, 1) alargado.
- 10.
Sensillum maxilar en hembras. 0) no expuesto y simétrico, 1) expuesto y asimétrico.
- 11.
Vestidura del 4° artejo de los palpos maxilares. 0) con sedas, 1) glabro.
- 12.
Cara exterior del 4° artejo de los palpos maxilares. 0) lisa o solo se observa un cambio ligero de textura, 1) con una depresión lateral profunda (“área sensorial diferenciada”).
- 13.
Longitud del último artejo de los palpos maxilares respecto a los 2 anteriores. 0) más largo, 1) más corto o similar.
- 14.
Posición de las mandíbulas con respecto a los bordes del clípeo en vista dorsal. 0) expuestas, 1) ocultas.
- 15.
Dimensión del lóbulo incisivo mandibular. 0) desarrollado, 1) muy reducido.
- 16.
Dientes en el lóbulo incisivo mandibular. 0) ausentes o poco conspicuos, 1) presentes y muy bien marcados.
- 17.
Margen del lóbulo incisivo mandibular. 0) sin muesca, 1) con muesca.
- 18.
Cara dorsal del lóbulo incisivo mandibular derecho. 0) nivelado, 1) cóncavo.
- 19.
Seno postincisivo. 0) ausente, 1) presente.
- 20.
Dimensión del lóbulo molar mandibular. 0) reducido 1) amplio.
- 21.
Área proximal del lóbulo molar de la mandíbula derecha. 0) con 2 a 4 quillas proyectadas, 1) con 5 o más quillas proyectadas, 2) con 0 o 1 quilla proyectada.
- 22.
Área distal del lóbulo molar de la mandíbula izquierda. 0) con 3 a 11 quillas proyectadas, 1) con 12 o más quillas proyectadas, 2) con 0 o 1 quilla proyectada.
- 23.
Textura de la región media del lóbulo molar mandibular. 0) estriada, 1) semiplana.
- 24.
Lóbulo molar de la mandíbula derecha con 8 o más estrías paralelas. 0) ausente, 1) presente.
- 25.
Forma del borde externo mandibular. 0) curvado o sinuado, 1) recto.
- 26.
Base del labro. 0) articulada con el clípeo, 1) fusionada con el clípeo.
- 27.
Forma del borde antero-basal del labro. 0) homogéneamente bilobulado, 1) heterogéneamente bilobulado, 2) semicircular.
- 28.
Vestidura del borde anterior del labro en vista ventral. 0) con sedas libres dirigidas hacia el centro, 1) con sedas mezcladas con las sedas de la epifaringe.
- 29.
Perfil del borde anterior del labro en vista lateral. 0) vertical, 1) disminuido, 2) diagonal.
- 30.
Amplitud de los lóbulos laterales del labro. 0) delgados, 1) anchos.
- 31.
Número de artejos antenales. 0) 10, 1) 9.
- 32.
Número de lamelas en el macho. 0) 3, 1) más de 3.
- 33.
Número de lamelas en la hembra. 0) 3, 1) más de 3.
- 34.
Longitud de la maza antenal respecto al funículo en machos. 0) similar o ligeramente más larga, 1) más del doble de larga.
- 35.
Dimorfismo sexual en la longitud de la maza antenal. 0) nulo o ligeramente marcado, 1) fuertemente acentuado.
- 36.
Forma del borde anterior del clípeo en vista dorsal. 0) bilobulado o circular, 1) rectangular o trapezoidal.
- 37.
Parte central del borde anterior del clípeo. 0) recto (Fig. 6), 1) inclinado, retraído (Fig. 7).
- 38.
Forma de los ángulos latero-apicales del clípeo. 0) redondeados, 1) proyectados.
- 39.
Forma del contorno del clípeo en vista dorsal. 0) subtrapezoidal, 1) subrectangular.
- 40.
Grosor del borde anterior del clípeo en vista lateral. 0) grueso, 1) adelgazado.
- 41.
Forma de la sutura frontoclipeal. 0) sinuada, 1) recta, 2) trapezoidal.
- 42.
Continuidad de la sutura frontoclipeal. 0) completa, 1) incompleta.
- 43.
Elevación de la sutura frontoclipeal. 0) nivelada (Fig. 8), 1) ligeramente elevada (solo se aprecia en vista lateral) (Fig. 9), 2) evidentemente elevada.
- 44.
Vestidura de la superficie del clípeo. 0) glabro o con sedas tan pequeñas que sólo se aprecian con aumento superior a 10x (Fig. 10), 1) setoso (Fig. 11).
- 45.
Textura de la frente. 0) punteada, 1) rugoso-punteada.
- 46.
Vestidura del centro de la frente. 0) glabro o con sedas tan pequeñas que sólo se aprecian con aumento superior a 10x (Fig. 10), 1) setosa (Fig. 11).
- 47.
Vestidura de la región paraocular. 0) glabro o con sedas tan pequeñas que sólo se aprecian con aumento superior a 10x (Fig. 10), 1) setosa (Fig. 11).
- 48.
Zona paraocular. 0) nivelada (Figs. 8, 11), 1) elevada (Figs. 9, 10).
- 49.
Superficie de la frente. 0) uniforme, 1) irregular.
- 50.
Vértice. 0) sin carina, 1) con carina.
- 51.
Vértice con banda ancha transversal. 0) punteada, 1) lisa.
- 52.
Distancia interocular (ancho de la frente entre el diámetro de los ojos). 0) angosta, caben menos de 5 diámetros oculares (ojos grandes), 1) amplia, caben más de 5 diámetros oculares (ojos chicos).
Protórax
- 53.
Textura de la superficie dorsal del pronoto. 0) punteada, 1) rugoso-punteada.
- 54.
Puntuación del pronoto. 0) ausente, 1) presente. 0) puntuación sin textura interna, 1) puntuación con textura interna.
- 55.
Parte mesial del pronoto, cercana al borde posterior. 0) con puntuación continua, 1) con una línea longitudinal sin puntación que se ve a simple vista.
- 56.
Vestidura de la superficie dorsal del pronoto. 0) glabro o con sedas tan pequeñas que sólo se aprecian con aumento superior a 10x, 1) setosa.
- 57.
Regiones pruinosas en el pronoto. 0) ausentes, 1) presentes.
- 58.
Margen anterior en el pronoto. 0) con borde membranoso, 1) sin borde membranoso.
- 59.
Forma de los ángulos anteriores del pronoto. 0) agudos, 1) redondeados.
- 60.
Forma de los ángulos posteriores del pronoto. 0) agudos y proyectados, 1) redondeados o plegados hacia el pleurón.
- 61.
Ángulos posteriores del pronoto en vista dorsal. 0) visibles, 1) no visibles.
- 62.
Formaciones en el margen lateral del pronoto. 0) onduladas o crenuladas, 1) liso.
Meso y metatórax
- 63.
Margen anterior del escutelo. 0) deprimido, pero sin formar una depresión de 90°, 1) formando una depresión de 90° muy bien marcada.
- 64.
Textura del escutelo. 0) punteada, 1) lisa.
- 65.
Región mesial del escutelo. 0) sin quilla tenue longitudinal, 1) con quilla tenue longitudinal.
- 66.
Vestidura del escutelo. 0) glabro o con sedas tan pequeñas que sólo se aprecian con aumento superior a 10x, 1) setosa.
- 67.
Textura elitral. 0) punteada, 1) estriada.
- 68.
Vestidura de la superficie elitral. 0) glabra o con sedas tan pequeñas que no se ven a simple vista, 1) con sedas conspicuas.
- 69.
Sedas escamiformes en los élitros. 0) ausentes, 1) presentes.
- 70.
Regiones pruinosas en los élitros. 0) ausentes, 1) presentes.
- 71.
Élitros. 0) no fusionados, 1) fusionados.
- 72.
Relieve de la interestría sutural. 0) elevado, 1) apenas marcado.
- 73.
Vestidura del margen elitral. 0) setoso, 1) glabro.
- 74.
Sedas en el margen elitral. 0) en todo el margen (Fig. 12), 1) sólo hasta la mitad anterior (Fig. 13), 2) cubren 3/4 del margen (a partir de la base) (Fig. 14).
- 75.
Textura de la zona media del margen elitral. 0) lisa, 1) con estrías transversales diminutas.
- 76.
Forma del perfil elitral en vista lateral. 0) aplanado, 1) convexo, 2) ligeramente deprimido al centro.
- 77.
Alas membranosas en los machos. 0) desarrolladas, 1) reducidas.
- 78.
- 79.
Relación de proporción de largo-ancho de las alas membranosas. 0) cortas (razón menor a 3), 1) largas (razón mayor a 3).
- 80.
Forma de la vena mediana. 0) sencilla, 1) ligeramente curvada en el ápice.
- 81.
Ápice de la vena yugal (J). 0) terminando antes del margen, 1) uniéndose al margen.
- 82.
Delimitación de la celda basal. 0) casi cerrada entre A1 y A2, 1) cerrada entre A1 y A2.
- 83.
Forma de la vena anal 2. 0) «Y», 1) «T».
- 84.
Región proximal de la vena anal 2. 0) curvada, 1) formando un ángulo de 90°.
- 85.
Proyección media de la vena anal 2. 0) corta, semiperpendicular a la vena anal 1, 1) prolongada, semiparalela a la vena anal 1.
- 86.
Sutura entre el propleurón y el basiesternón. 0) apenas marcada y nivelada, 1) muy visible y elevada.
- 87.
Regiones pruinosas en la propleura. 0) ausentes, 1) presentes.
- 88.
Proceso proesternal 0) ausente o muy pequeño, 1) bien desarrollado.
- 89.
Dimensión del metaesternón en machos. 0) alargado, 1) corto.
- 90.
Regiones pruinosas en los esternitos. 0) ausentes, 1) presentes.
- 91.
Esternitos. 0) sin crestas, 1) crestados.
Abdomen
- 92.
Región mesial de la base de la placa anal. 0) entero, 1) con un proceso bidentado.
- 93.
Placa anal muy expandida. 0) ausente, 1) presente.
- 94.
Base del propigidio. 0) expuesto, 1) oculto por el ápice de los élitros.
- 95.
Propigidio. 0) sin surco mesial (Fig. 15), 1) con surco mesial (Fig. 16).
- 96.
Vestidura del disco pigidial. 0) setosa, 1) glabra.
- 97.
Disco pigidial en hembras. 0) simple, 1) con prominencias.
- 98.
Textura pigidial. 0) punteada, 1) rugosa.
- 99.
Perfil lateral del pigidio masculino. 0) convexo, 1) casi plano.
- 100.
Perfil lateral del pigidio femenino. 0) convexo, 1) casi plano, 2) cóncavo.
Genitales masculinos
- 101.
Perímetro dorsal del tecto. 0) similar o más angosto que el de la pieza basal, 1) más ancho que el de la pieza basal.
- 102.
Longitud del tecto respecto a la pieza basal. 0) similar o más largo, 1) más corto.
- 103.
Falobase y parámeros fusionados dorsalmente en su extremo basal, formando una acanaladura longitudinal. 0) ausente, 1) presente.
- 104.
Falobase y parámeros formando un tubo muy alargado, estrecho y curvado hacia arriba. 0) ausente, 1) presente.
- 105.
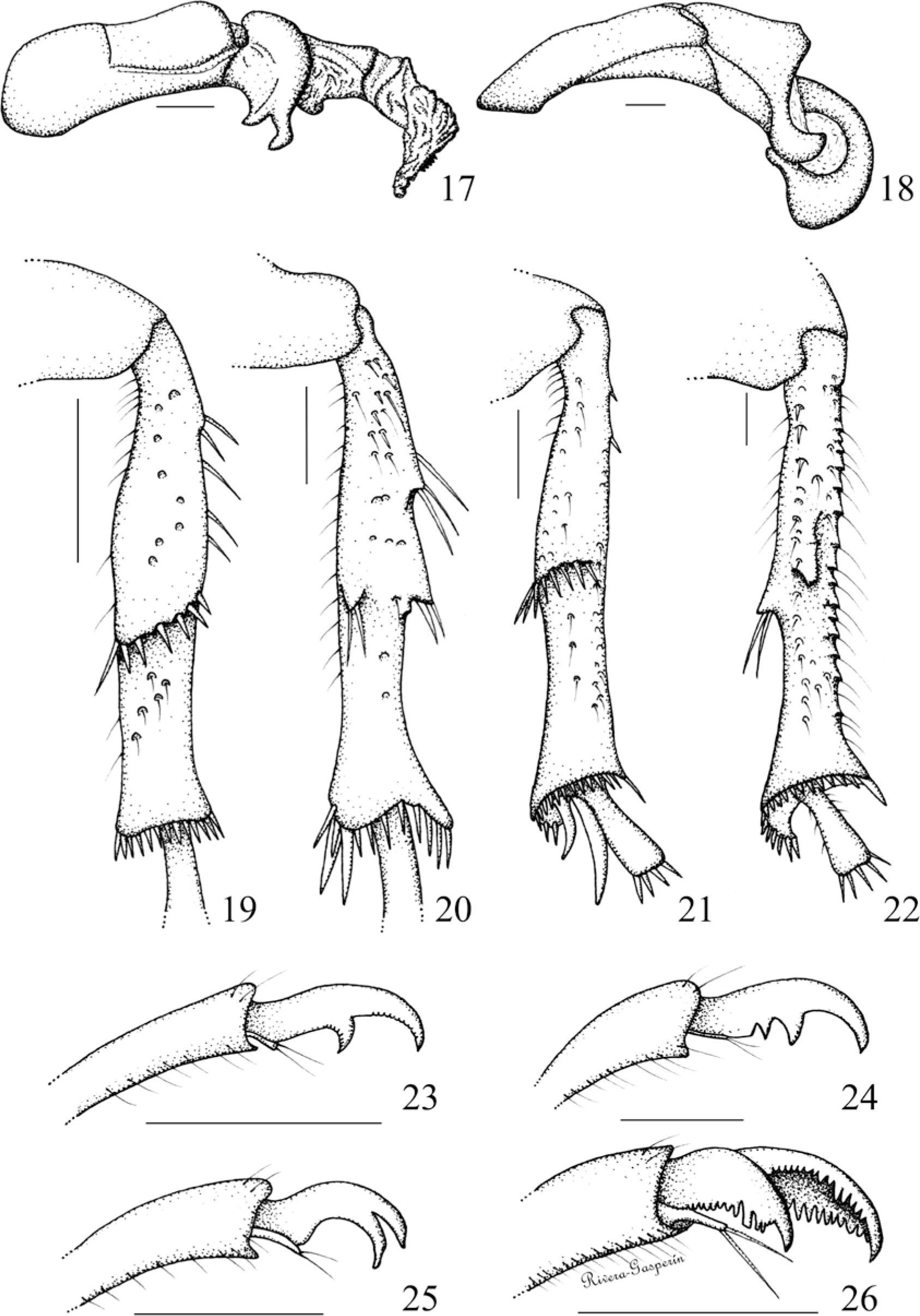
Falobase y parámeros formando un tubo engrosado y curvado hacia abajo, con el ápice ancho y comprimido. 0) ausente (Fig. 17), 1) presente (Fig. 18).
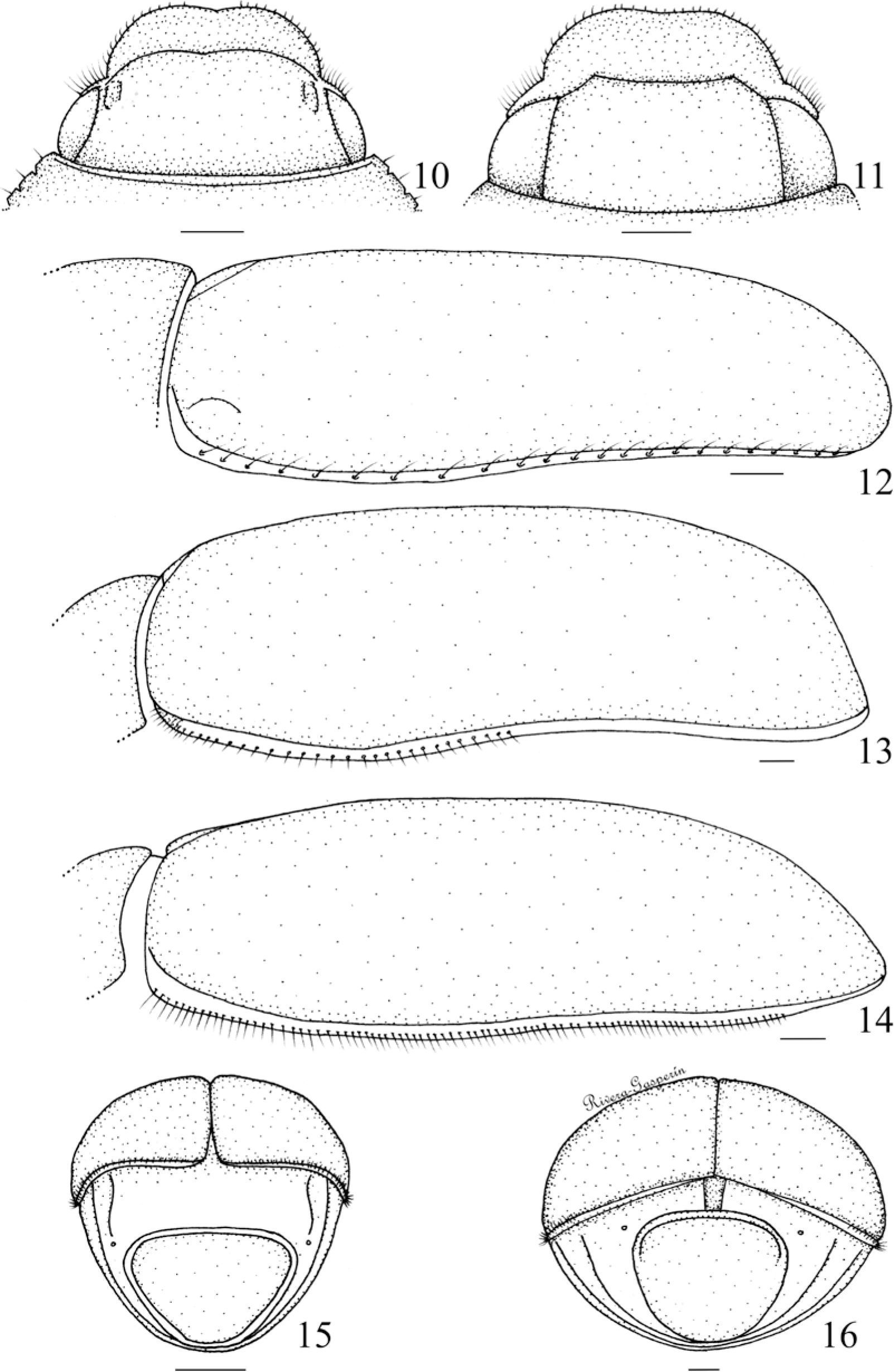
Figuras 17-26.Genitales masculinos en vista lateral: 17), P. torta; 18), P. lalanza. Mesotibias izquierdas en vista ventral: 19), R. aestivus; 20), P. lalanza. Metatibias derechas en vista lateral: 21), P. hirticula; 22), P. gigantissima. Uñas protarsales izquierdas: 23), P. lenis; 24), P. lalanza; 25), P. pruinosa; 26), P. praesidii.
(0.36MB). - 106.
Simetría de la falobase y parámeros. 0) simétricos, 1) asimétricos.
- 107.
Ápice de los parámeros como placas anchas y simétricas. 0) ausente (Fig. 17), 1) presente (Fig. 18).
- 108.
Parámeros excavados, muy extendidos y asimétricos. 0) ausente, 1) presente.
- 109.
Razón de longitud de la pieza basal-tecto respecto a la longitud de la falobase-parámeros. 0) más de 1 (parámeros cortos), 1) 1 o menos (parámeros largos).
- 110.
Cóndilos laterobasales en la pieza basal. 0) no desarrollados, 1) desarrollados.
- 111.
Cóndilos laterobasales en la pieza basal. 0) simétricos, 1) asimétricos.
- 112.
Reborde del foramen basal en la pieza basal. 0) sin reborde, 1) con reborde marcado.
- 113.
Forma del spiculum gastrale. 0) “Y”, 1) “V”, 2) “U”.
- 114.
Longitud de la porción basal del spiculum gastrale.0) larga (su longitud es mayor o igual que la longitud de los brazos), 1) corta (su longitud es menor que la longitud de los brazos), 2) ausente.
Genitales femeninos
- 115.
Placas dorsales de los genitales femeninos. 0) separadas, 1) fusionadas.
- 116.
Proceso púbico. 0) ausente, 1) desarrollado.
- 117.
Ápice lateral interno de las placas ventrales o inferiores. 0) entero, sin proyecciones, 1) con una proyección alargada y setosa.
- 118.
Vestidura de las placas ventrales o inferiores. 0) con sedas escasas, 1) glabras.
- 119.
Placas superiores e inferiores. 0) ambas presentes, 1) solo las inferiores.
Patas
- 120.
Espolón protibial en machos. 0) presente, 1) ausente.
- 121.
Espolón protibial en hembras. 0) presente, 1) ausente.
- 122.
Alcance del espolón protibial en machos. 0) rebasando el ápice interno de la protibia, 1) sin rebasar el ápice interno.
- 123.
Número de dentículos bien definidos en las protibias de los machos. 0) 2 ó 3, 1) ninguno o 1.
- 124.
Número de dentículos bien definidos en las protibias de las hembras. 0) 3, 1) 2.
- 125.
Carina mesotibial. 0) completa (Fig. 19), 1) incompleta (Fig. 20).
- 126.
Carina metatibial. 0) completa (Fig. 21), 1) incompleta (Fig. 22).
- 127.
Lado externo de las meso y metatibias (con el ejemplar en vista lateral). 0) entero (Fig. 21), 1) con dentículos (Fig. 22).
- 128.
Metafémur con doble margen dorso-apical. 0) ausente, 1) presente.
- 129.
Ápice de las metatibias. 0) con 2 espolones, 1) con 1 espolón.
- 130.
Ápice de las metatibias con una corona de sedas gruesas, largas y fuertes (como espolones). 0) ausente, 1) presente.
- 131.
Tamaño del espolón metatibial interno respecto al externo. 0) notablemente mayor, 1) más corto, similar o ligeramente mayor.
- 132.
Base del espolón metatibial externo. 0) articulado, 1) fusionado.
- 133.
Dimorfismo sexual en las protibias (diferencia en número de dientes externos, grosor de las tibias o presencia de espolón protibial). 0) discreto o nulo, 1) marcado.
- 134.
Cobertura setosa de la región ventral de los tarsos. 0) escasa, 1) abundante.
- 135.
Borde membranoso en la región ventral de los tarsos. 0) entero, 1) aserrado-pectinado.
- 136.
Número de uñas metatarsales. 0) 2, 1) 1.
- 137.
Forma de las uñas metatarsales. 0) ornamentadas, 1) sencillas.
- 138.
Forma de las uñas de los 3 pares de patas. 0) bidentadas (Fig. 23), 1) tridentadas (Fig. 24), 2) bífidas o hendidas (Fig. 25), 3) pectinadas o bipectinadas (Fig. 26).
- 139.
Forma de las uñas pro y mesotarsales en el macho. 0) similares, 1) diferentes.
- 140.
Razón corporal (determinado como la longitud total, desde el ápice del clípeo hasta el ápice de los élitros, dividido entre el ancho máximo elitral) 0) robusto (razón menor a 2), 1) esbelto (razón de 2 o más).
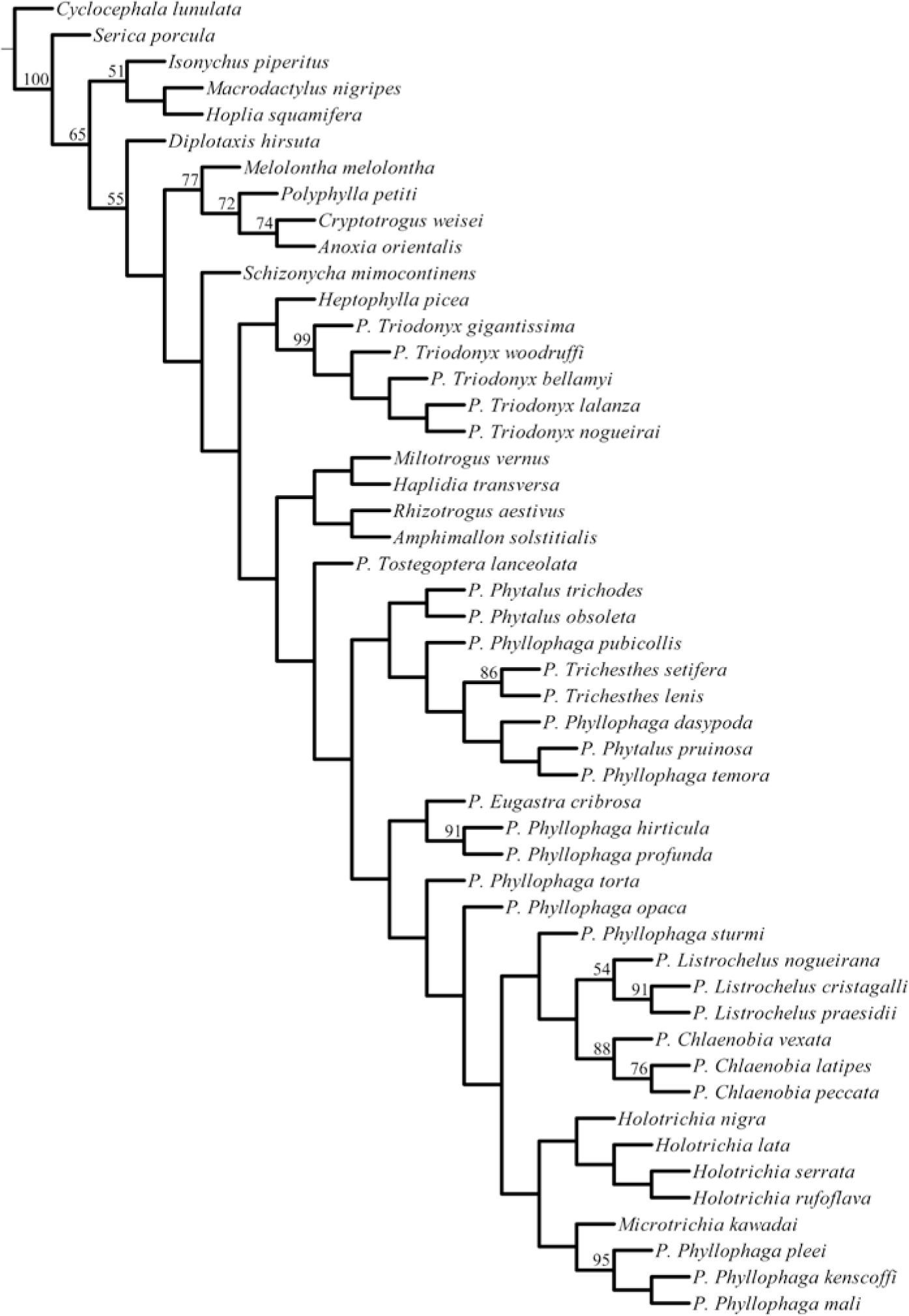
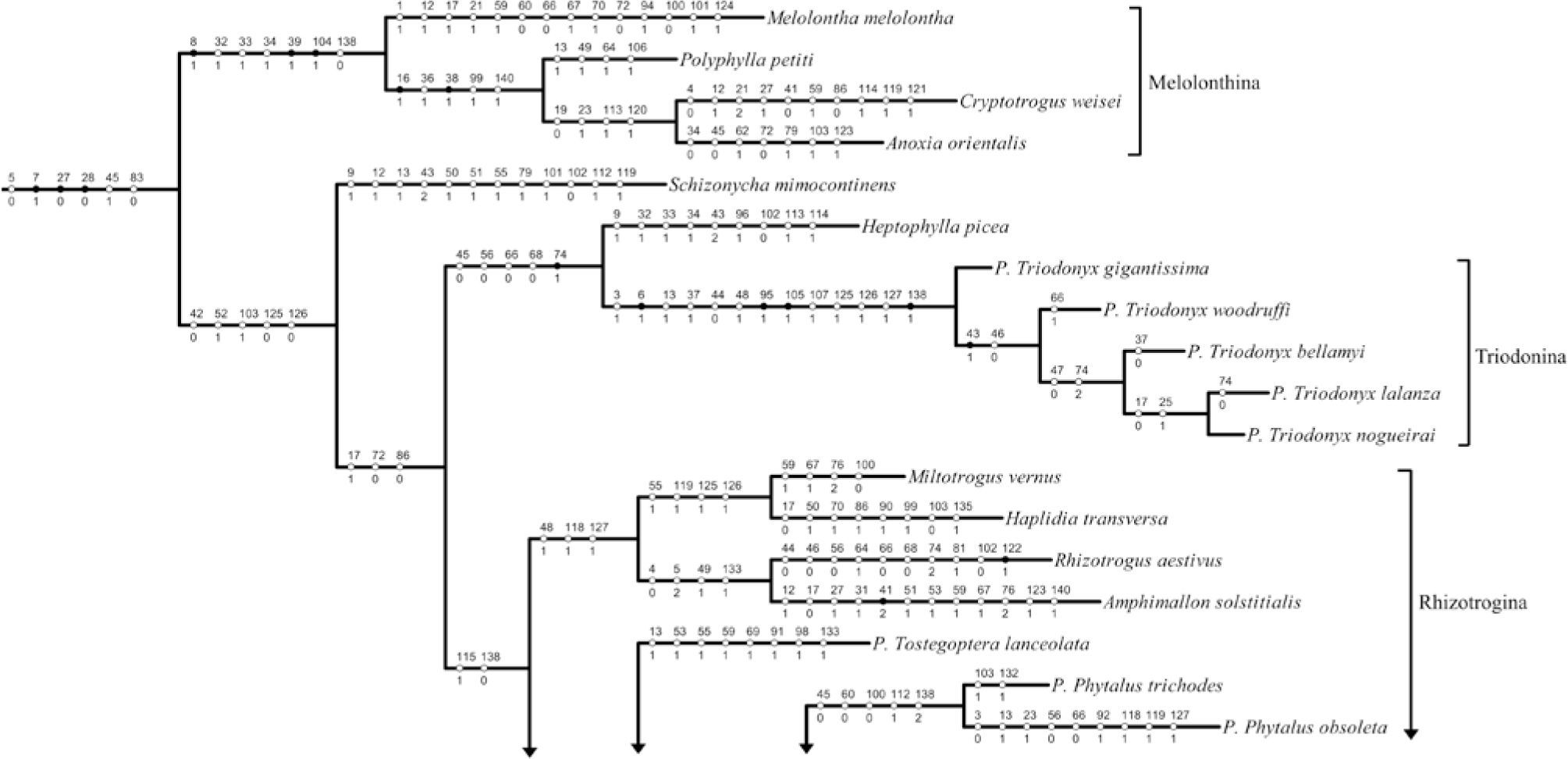
Se obtuvieron 3 árboles igualmente parsimoniosos, con una longitud de 579 pasos, un índice de consistencia de 0.26 y un índice de retención de 0.57. Repitiendo el mismo procedimiento 10 veces, se obtuvieron los mismos valores de los estadísticos y los mismos 3 cladogramas. Para analizar los resultados se seleccionó el árbol número 2 (Fig. 27), debido a que muestra con mayor claridad las posibles relaciones entre los clados. En esta hipótesis, el agrupamiento que nos interesa comparar con detalle se ubica entre las especies tradicionalmente consideradas como parte de las subtribus Melolonthina, Schizonychina, Heptophyllina y Rhizotrogina (según Dalla-Torre, 1912) (Fig. 28). Schizonycha mimocontinens Pope, 1960 se encuentra estrechamente relacionado con el clado que mantiene las relaciones entre Heptophyllina y Rhizotrogina (bootstrap= 24%), con los cuales comparte 5 caracteres: sutura frontoclipeal completa, distancia interocular amplia, falobase y parámeros fusionados dorsalmente en extremo basal, formando acanaladura longitudinal y carinas meso y metatibial completas (Fig. 28).
Parte del árbol elegido, en donde se muestran los caracteres que soportan al grupo de interés. Los círculos negros representan sinapomorfías, los números sobre las líneas indican los caracteres morfológicos y los números 0, 1 y 2 (bajo las líneas) hacen referencia al estado de carácter.
Las subtribus Heptophyllina y Rhizotrogina se relacionan estrechamente entre sí por compartir 3 caracteres: margen del lóbulo incisivo mandibular con muesca, interestría sutural de los élitros elevada, y sutura entre propleurón y basiesternón apenas marcada (Fig. 28).
Heptophylla picea Motschulsky, 1857 se relaciona con Triodonyx (bootstrap=12%) por presentar la frente punteada, pronoto, escutelo y élitros glabros, además de que solo la mitad anterior del margen elitral tiene sedas (Fig. 13). Este último carácter representa una sinapomorfía para el clado (Fig. 28).
El clado de Triodonyx, el cual incluye a las 5 especies del subgénero, se encuentra soportado por un valor de bootstrap de 99% y 4 sinapomorfías (Figs. 27, 28): diente maxilar más cercano a la lacinia, bifurcado (Fig. 5), propigidio con surco mesial (Fig. 16), falobase y parámeros formando un tubo engrosado y curvado hacia abajo, con el ápice ancho y comprimido (Fig. 18) y uñas tridentadas (Fig. 24); además, este grupo comparte otros 9 estados de carácter que no son exclusivos para el clado: mentón con elevaciones laterales (Fig. 3), último artejo de los palpos maxilares más corto o similar que los 2 anteriores (Fig. 5), parte central del borde anterior del clípeo inclinado y retraído (Fig. 7), clípeo glabro (Fig. 11), zona paraocular elevada (Figs. 9, 11), ápice de los parámeros con forma de placas anchas y simétricas (Fig. 18), carina meso y metatibial incompleta (Figs. 20, 22), y borde externo de las meso y metatibias con dentículos (Fig. 22).
La especie más basal dentro del clado es P. gigantissima, por presentar sedas en la frente y región paraocular y la sutura frontoclipeal nivelada. El clado de P. woodruffi, P. bellamyi, P. lalanza y P. nogueirai se encuentra soportado por un valor de bootstrap de 41% y 2 caracteres: frente glabra y sutura frontoclipeal ligeramente elevada (Fig. 9). Este último carácter es una sinapomorfía para el grupo. P. woodruffi se segrega del clado de P. bellamyi, P. lalanza y P. nogueirai, por presentar sedas en el escutelo.
Por otro lado, P. bellamyi, P. lalanza y P. nogueirai se agrupan con un valor de bootstrap de 43% y 2 caracteres: región paraocular glabra (Figs. 9, 11) y margen elitral con sedas en % de su extensión, a partir de la base (Fig. 14). En este punto, P. bellamyi se segrega del grupo por presentar la parte central del borde anterior del clípeo recta.
Por último, en el clado de Triodonyx se agrupan P. lalanza y P. nogueirai con un soporte de bootstrap de 22% y 2 caracteres: margen del lóbulo incisivo mandibular sin muesca y borde externo mandibular recto. Por su lado P. lalanza presenta los élitros con sedas a lo largo de todo el margen.
DiscusiónEl cladograma elegido muestra que los límites del subgénero Triodonyx son sumamente claros (bootstrap=99%), sustentados por 4 sinapomorfías exclusivas y una combinación de 9 estados de carácter que no son exclusivos para el grupo. La monofilia del grupo es evidente, así como el hecho de no pertenecer a Phyllophaga y estar fuera de los Rhizotrogina tradicionales como parte de un linaje basal, ya que Triodonyx presenta las uñas tarsales tridentadas, nunca bidentadas, bífidas, hendidas o pectinadas como otros Melolonthini, y sus placas genitales femeninas están separadas entre sí, a diferencia de muchas otras especies estudiadas que las tienen fusionadas. Con base en la hipótesis obtenida, se propone la restitución del género Triodonyx propuesto por Saylor (Evans et al., 2009), y la creación de una nueva subtribu americana, Triodonina, cuyas subtribus hermanas en el Lejano Oriente y África serían Heptophyllina y Schizonychina, respectivamente. Sin embargo, debido a la pequeña muestra revisada de las últimas subtribus y a los valores bajos de bootstrap que sostienen a estos clados, dichas relaciones han de tener un carácter necesariamente provisional, como parte de los estudios que continúan realizando los autores del presente artículo.
De acuerdo con los lineamientos establecidos en los capítulos 7 y 8 del Código Internacional de Nomenclatura Zoológica (2000), se establecen los siguientes cambios nomenclatoriales:
Triodonina Rivera-Gasperín y Morón, nueva subtribu Género tipo: TriodonyxSaylor, 1942: 158 (Especie tipo: Phyllophaga gigantissima Saylor 1935), stat. rev. Diagnosis. Melolonthini americanos con el diente maxilar más cercano a la lacinia bifurcado, mentón con elevaciones laterales, último artejo de los palpos maxilares más corto o similar que los 2 anteriores, parte central del borde anterior del clípeo inclinado y retraído, clípeo glabro, zona paraocular elevada, carina meso y metatibial incompleta y borde externo de las meso y metatibias con dentículos, uñas tridentadas, propigidio con surco mesial, falobase y parámeros formando un tubo engrosado y curvado hacia abajo, con el ápice ancho y comprimido, con forma de placas anchas y simétricas.
Esta subtribu monotípica posee 5 especies: T. gigantissima (Saylor, 1935), T. lalanza (Saylor, 1941), T. bellamyi (Warner y Morón, 1992), T. woodruffi (Warner y Morón, 1992) y T. nogueirai (Warner y Morón, 1992), distribuidas en Arizona (EUA), Sonora, Sinaloa, Nayarit y Jalisco (México) (Warner y Morón, 1992; Morón et al., 1997).
La primera autora agradece al Conacyt por la beca 58623, otorgada durante sus estudios en el INECOL, dentro del programa de Maestría en Ciencias (Biodiversidad y Sistemática). Agradecemos a Hortensia Carrillo-Ruiz de la Benemérita Universidad Autónoma de Puebla, Sergio Ibáñez-Bernal del Instituto de Ecología, A. C., Xalapa, Juan Márquez-Luna de la Universidad Autónoma del Estado de Hidalgo, así como a 2 revisores anónimos, por enriquecer este trabajo con sus observaciones y correcciones.