Se analizaron los patrones de distribución de las comunidades de megacrustáceos bentónicos en la plataforma continental del banco de Campeche mediante el empleo de métodos multivariados. Los datos utilizados provienen de 7 campañas oceanograficas realizadas en 1994 (mayo, agosto y noviembre) y 1995 (febrero, mayo, agosto y noviembre) correspondientes a las estaciones de primavera, verano, otoño e invierno. Se obtuvo un total de 11 113 megacrustáceos con un peso total de 173.28 kg, pertenecientes a 55 especies y 24 familias. Las familias Leucosiidae, Penaeidae y Portunidae fueron las de mayor riqueza específica y abundancia (número de organismos), representando el 27% del total obtenido. Los índices de diversidad, dominancia y equitatividad no mostraron diferencias significativas entre los diferentes meses o entre ambos años. De acuerdo con el análisis multivariado, la profundidad fue la variable ambiental que explicó los mayores cambios en la densidad y biomasa de los megacrustáceos y en menor porcentaje el tipo de sedimento. Se observó una clara diferencia entre las asociaciones de las zonas someras y profundas. La variabilidad registrada en el estrato somero puede ser una consecuencia de la heterogeneidad ambiental, ya que presenta varios tipos de sedimentos y es una zona de transición entre ambientes de limoarcilla y carbonatados.
Megacrustacean epibenthic assemblages of the continental shelf of Campeche Sound were analyzed using multivariate analysis. Seven cruises were done during 1994 (May, August, November) and 1995 (February, May, August and November). Benthic samples were obtained with a semicommercial trawl net (18.3 meters of mouth aperture and 2.5cm mesh size) in a depth range of 14 to 215 m. A total of 11,113 megacrustaceans belonging to 55 species and 24 families was recorded. Total biomass weighted 173.28 kg. Leucosiidae, Penaeidae and Portunidae families were the most abundant in species number and represented 27% of total species. Diversity, dominance and equitability indexes did not show marked variations either in climatic periods or between years. Depth and sediment type were the first and second environmental factors that mainly explained megacrustacean biomass and density variations. Shallow megacrustaceans assemblages were more numerous and differed clearly from the deep one. This can be attributed to substrate heterogeneity of shallow areas that have a transition zone between lime-clay and carbonate sediments.
El golfo de México posee una amplia variedad de ecosistemas y hábitats que albergan una gran diversidad de organismos bentónicos sujetos a la acción de eventos climáticos frecuentes y no frecuentes (ciclones de verano y nortes de invierno) y perturbaciones antropogénicas (pesca e industria petrolera) que tienen influencia sobre la distribución y abundancia de las comunidades (Vázquez-Bader, 1988, 1996; Vázquez-Bader y Gracia, 1994). El conocimiento de la estructura y composición de las comunidades bentónicas, así como su relación con los factores ambientales es fundamental para evaluar el estado de salud actual de los ecosistemas de manera integral y los cambios que presenten, de tal forma que sirva de base para su manejo y conservación. En el suroeste del golfo de México, la mayoría de los estudios sobre macroinvertebrados están enfocados a especies de importancia comercial (Hildebrand, 1954, 1955; Cedeño-Campos, 1976; Gracia, 1989; Gracia et al., 1997); otros más a la elaboración de listados faunísticos, principalmente enfocados a crustáceos (Hernández-Aguilera y Villalobos-Hiriart, 1980; Hernández-Aguilera y Sosa-Hernández, 1982; Vázquez-Bader y Gracia, 1994; Rodríguez-Almaraz et al., 2000; García-Madrigal et al., 2002; Wicksten y Packard, 2005; Felder et al., 2009; Reaka et al., 2009) o representan trabajos aislados de taxa específicos (García-Montes, 1985; García-Montes et al., 1988; Galván, 2010). Los crustáceos que forman parte importante de las comunidades asociadas al fondo marino han recibido particular atención dado que muchos de ellos son sujetos de explotación y constituyen un elemento relevante en la economía de los estados costeros del golfo de México donde diversas especies han contribuido históricamente como recursos pesqueros (e.g., camarones, langostas, jaibas) (Gracia y Vázquez-Bader, 1999; Gracia, 2004; CONAPESCA, 2008).
Los estudios referentes a la composición y a la estructura de las comunidades de megacrustáceos bentónicos en la bahía y banco de Campeche, se restringen específicamente a los trabajos realizados por Vázquez-Bader (1988), Vázquez-Bader y Gracia (1994) y Vázquez-Bader (1996), quienes realizan un análisis de las comunidades y de su relación con algunas variables ambientales. El presente estudio es uno de los primeros intentos por describir los patrones de distribución de los megacrustáceos epibentónicos en la plataforma continental de la bahía y banco de Campeche. El principal objetivo fue caracterizar las asociaciones epibéntónicas de crustáceos en fondos suaves en 2 años de estudio y establecer las relaciones entre estas asociaciones con respecto a la profundidad y el tipo de sedimento. Así mismo, se analizaron las tendencias en densidad, biomasa y diversidad intra e interanuales.
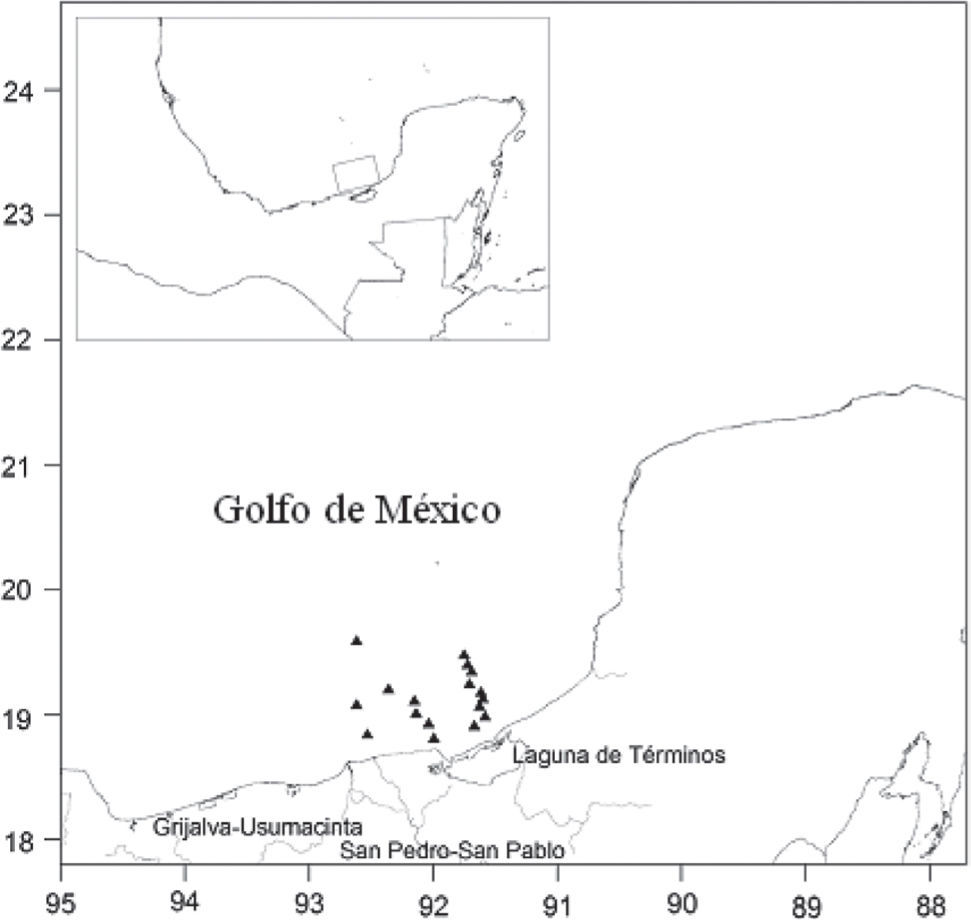
Materiales y métodosÁrea de estudio. El área de estudio se ubica geográficamente entre los 18°-20° N, y los 91°-93° O, frente a la laguna de Términos, Campeche (Fig. 1). De acuerdo con las características fisiográficas y sedimentarias de la zona, se distinguen 2 provincias: bahía y banco de Campeche. La bahía de Campeche presenta una plataforma angosta con una pendiente abrupta que recibe un aporte importante de sedimentos terrígenos a través de los sistemas fluviales Grijalva-Usumacinta y de los ríos San Pedro y San Pablo. En el banco de Campeche la plataforma continental es amplia y tiene una pendiente suave, se caracteriza por presentar un gran banco carbonatado limitado al oeste por sedimento clástico proveniente de la cuenca Tabasco-Campeche y hacia el este por el estrecho de Yucatán; el borde este es una zona de transición entre sedimentos carbonatados y sedimentos terrígenos. En esta provincia los sedimentos carbonatados están compuestos principalmente de ooides (pterópodos y foraminíferos), fragmentos de esqueletos (moluscos, foraminíferos, algas, equinodermos, corales y briozoos), cúmulos de heces y clastos carbonatados (arenas calcárea y lodos carbonatados) (Balsam y Beeson, 2003). La circulación de las aguas del golfo de México está primariamente influenciada por la corriente de Lazo que ingresa por el noroeste del canal de Yucatán, así como de los giros ciclónicos y anticlónicos que se derivan de esta corriente. Parte de la corriente de Lazo se desvía hacia el oeste y se dirige a la bahía de Campeche donde se presenta una circulación ciclónica de diferente escala a lo largo del año. El giro ciclónico se presenta durante los meses de febrero, marzo y abril en el suroeste de la bahía de Campeche y se desplaza de este a oeste de dicha bahía durante los meses de julio a diciembre (Monreal-Gómez y Salas de León, 1990). En términos generales, se presenta una corriente de salida al NE-NO del golfo de México (Nowlin, 1972; Monreal-Gómez et al., 2004).
Se efectuó un total de 82 arrastres durante las campañas oceanográficas MOPEED (Monitoreo de las Fases de Prerreclutamiento de Especies Estuario-Dependientes de Importancia Comercial frente a la Laguna de Términos) en los años de 1994 (mayo, agosto y noviembre) y 1995 (febrero, mayo, agosto y noviembre) correspondientes a las estaciones de primavera, verano, otoño e invierno a bordo del B/O Justo Sierra de la UNAM. El muestreo se llevó a cabo independientemente de la luz del día, con una red de arrastre camaronera tipo comercial de 18.3 m de apertura de boca, con luz de malla de 2.5cm, en un intervalo de profundidad de 14 a 215 m. En cada arrastre se abarcó una área promedio de 3 hectáreas. En cada lance los crustáceos fueron separados e identificados hasta especie y se determinó para cada una ellas la abundancia y el peso.
Se registraron datos de profundidad por localidad, mientras que el tipo de sedimento se determinó de acuerdo con Ramos (1996) en: carbonatado (C), limo-arcilla transicional (LAT) y arcilla terrígena (AT). Estos datos se incorporaron al análisis de ordenación como variables “Dummy”.
Los datos de densidad, biomasa, riqueza específica, así como índices de diversidad (H’n), equitatividad (J’), dominancia (1-J’) y biomasa (H’w), se compararon entre los diferentes meses y entre ambos años, utilizando análisis de varianza (ANOVA) de una vía.
La estructura de las asociaciones de megacrustáceos y sus relaciones con la profundidad y el tipo de sedimento se analizaron por correspondencias canónicas (CCA) con la ayuda del programa CANOCO, 4.5 (Ter Braak, 1986). Antes del análisis multivariado, se estandarizaron los datos mediante la transformación log (x +1), se omitieron las especies con valores de abundancia menores al 5% y los muestreos con menos de 5 especies. Se aplicaron Pruebas de Monte Carlo usando el modelo reducido con 999 permutaciones para determinar la significancia de los ejes canónicos (Leps y Smilauer, 1999).
ResultadosDensidad, biomasa, riqueza y diversidad. Durante las 7 campañas oceanográficas se recolectó un total de 11 113 megacrustáceos con un peso de 173.28 kg, pertenecientes a 55 especies y 24 familias (Cuadro 1). Los valores de densidad y de biomasa media por hectárea, en ambos estudios, fueron de 5 ± 2 ind ha-1 y 0.089 ± 0.039 kg ha-1, respectivamente. Las familias Leucosiidae, Penaeidae y Portunidae fueron las que presentaron mayor riqueza específica, conformando el 27% del total de especies recolectadas. Los mayores porcentajes de densidad correspondieron a las familias Penaeidae (38%) y Portunidae (31%). Asimismo, las mayores biomasas relativas, en ambos años de estudio, se observaron en las familias Penaeidae (29%), Diogenidae (26%) y Portunidae (23%). Callinectes similis Williams, 1966, Portunus spinicarpus (Stimpson, 1871) (=Achelous spinicarpusMantelatto et al., 2009), Farfantepenaeus duorarum (Burkenroad, 1939) y Farfantepenaeus aztecus (Ives, 1891) fueron las que tuvieron mayor densidad en ambos años, mientras que las mayores biomasas se encontraron en Petrochirus diogenes (Linnaeus, 1758), F. duorarum y C. similis.
Densidad y biomasa de megacrustáceos en orden descendente por año. Clave de las especies utilizadas en el análisis de CCA (clave)
| Densidady biomasa por especie 1994. | Densidad y biomasa por especie 1995. | ||||||
|---|---|---|---|---|---|---|---|
| Especie | Densidad ind/ha (±2ind) | Biomasa kg/ha (± 0.039kg) | Clave CCA | Especie | Densidad ind/ha (±2ind) | Biomasa kg/ha (± 0.039kg) | Clave CCA |
| Portunus spinicarpus | 600.7 | 1111.53 | Por spc | Farfantepenaeus duorarum | 326.97 | 4420.63 | Far duo |
| Callinectes similis | 541.9 | 9207.06 | Cal sim | Callinectes similis | 195.59 | 2238.16 | Cal sim |
| Xiphopenaeus kroyeri | 446.61 | 1967.71 | Xip kro | Squilla empusa | 159.34 | 914.95 | Squ emp |
| Farfantepenaeus aztecus | 288.9 | 4754.34 | Far azt | Iliacantha liodactylus | 101.69 | 463.91 | Ili lio |
| Farfantepenaeus duorarum | 191.69 | 2184.5 | Far duo | Rimapenaeus similis | 84.57 | 367.27 | Rim sim |
| Squilla empusa | 134.36 | 722.95 | Squ emp | Portunus spinicarpus | 78.39 | 279.67 | Por spc |
| Rimapenaeus similis | 76.4 | 497.48 | Rim sim | Persephona crinita | 64.5 | 310.02 | Per cri |
| Squilla chydaea | 57.1 | 229.94 | Squ chy | Litopenaeus setiferus | 34.62 | 1423.34 | Lit set |
| Sicyonia dorsalis | 47.35 | 106.56 | Sic dor | Xiphopenaeus kroyeri | 30.85 | 311.49 | Xip kro |
| Solenocera vioscai | 40.58 | 265.38 | Sol vio | Acanthocarpus alexandri | 29.79 | 323.09 | Aca ale |
| Persephona crinita | 36.83 | 97.56 | Per cri | Solenocera vioscai | 24.88 | 184.44 | Sol vio |
| Acanthocarpus alexandri | 34.693 | 381.35 | Aca ale | Petrochirus diogenes | 21.56 | 7625.34 | Pet dio |
| Sicyonia burkenroadi | 34.41 | 63.17 | Sic bre | Ethusa microphthalma | 17.42 | 121.54 | Eth mic |
| Palicus obesus | 27.316 | 90.41 | Pal obe | Hepatus epheliticus | 11.93 | 175.68 | Hep eph |
| Leiolambrus nitidus | 24.32 | 46.33 | Lei nit | Tetraxanthus rathbunae | 11.64 | 70.63 | Tet rat |
| Ethusa microphthalma | 21.008 | 164.6 | Eth mic | Farfantepenaeus aztecus | 11.48 | 152.63 | Far azt |
| Tetraxanthus rathbunae | 18.72 | 112.62 | Tet ret | Platylambrus serratus | 10.61 | 16.79 | Pla ser |
| Persephona mediterranea | 15.38 | 150.22 | Per med | Squilla chydaea | 10.32 | 86.1 | Squ chy |
| Myropsis quinquespinosa | 15.246 | 144.11 | Myr qui | Myropsis quinquespinosa | 9.56 | 86.37 | Myr qui |
| Petrochirus diogenes | 14.74 | 4511.06 | Pet dio | Leiolambrus nitidus | 6.93 | 7.72 | Lei nit |
| Iliacantha liodactylus | 14.15 | 66.19 | Ili lio | Pagurus bullisi | 6.84 | 84.78 | Pag bul |
| Hepatus epheliticus | 12.75 | 184.67 | Hep eph | Portunus spinimanus | 6.56 | 53.33 | Por spm |
| Dardanus insignis | 11.23 | 2098.69 | Dar ins | Sicyonia dorsalis | 6.28 | 16.5 | Sic dor |
| Calappa sulcata | 10.56 | 2864.89 | Cal sul | Anasimus latus | 5.64 | 29.93 | Ana lat |
| Litopenaeus setiferus | 7.06 | 283.28 | Lit set | Callinectes sapidus | 5.63 | 810.93 | Cal sap |
| Portunus spinimanus | 5.27 | 45.22 | Por spm | Palicus obesus | 5.61 | 16.44 | Pal obe |
| Pagurus bullisi | 3.553 | 24.67 | Pag bul | Palicus faxoni | 5.02 | 16.72 | Pal fax |
| Libinia dubia | 2.86 | 57.45 | Lib dub | Calappa sulcata | 3.74 | 141.15 | Cal sul |
| Raninoides loevis | 2.655 | 22.57 | Ran loe | Raninoides louisianensis | 2.96 | 24.06 | Ran lou |
| Stenocionops spinimanus | 2.616 | 2136.81 | Ste spi | Euphrosynoplax clausa | 2.27 | 27.1 | Eup cla |
| Anasimus latus | 2.541 | 80.08 | Ana lat | Calappa flammea | 2.11 | 135.22 | Cal fla |
| Calappa flammea | 1.86 | 150.72 | Cal fla | Libinia dubia | 1.65 | 90.69 | Lib dub |
En 1994, se recolectaron 45 especies de megacrustáceos, con una densidad y biomasa total de 7524.61 ind ha-1 y 102.83 kg ha-1. En 1995, se identificaron 46 especies, constituidas por una densidad de 3 588.39 ind ha-1 y una biomasa de 70.45 kg ha-1 (Fig. 2). Los valores máximos de densidad se estimaron en los muestreos realizados frente al sistema fluvial San Pedro y San Pablo (SP y SP) y frente a las bocas, este (boca del Carmen, BC) y oeste (boca de Puerto Real, BPR), de la laguna de Términos.
A pesar de que se observaron diferencias en la riqueza, densidad y biomasa interanuales y entre los diferentes meses de los 2 años, los ANOVA mostraron que la densidad sólo fue significativamente diferente entre agosto y noviembre de 1994 (p= 0.01), agosto 1994 y noviembre 1995 (p= 0.02) y agosto 1994 y febrero 1995 (p= 0.01). No se encontraron diferencias significativas (p> 0.05) en los datos de biomasa calculados entre ambos años, así como tampoco entre los diferentes meses, aunque en estos últimos se observó un incremento en mayo-agosto y una disminución en noviembre (Fig. 2). La densidad fue mayor en mayo y agosto de 1994, mientras que la mayor riqueza específica y la menor densidad correspondieron a noviembre.
Las especies Callinectes similis, F. aztecus y F. duorarum, contribuyeron con el mayor porcentaje de la densidad total de mayo de 1994 (58.8%); mientras que en términos de biomasa, el pagúrido Dardanus insignis (de Saussure, 1858), fue el que contribuyó con mayor proporción (20%). P. spinicarpus, Xiphopenaeus kroyeri (Heller, 1862), C. similis y F. aztecus representaron el 82.6% de la densidad registrada en agosto y P. diogenes contribuyó con el 18% de la biomasa. C. similis, Acanthocarpus alexandri Stimpson, 1871, F. duorarum, Palicus obesus (A. Milne-Edwards, 1880) y Ethusa microphthalma, Smith, 1881 contribuyeron con el 62.2% de la densidad en noviembre y P. diogenes la mayor biomasa.
Farfantepenaeus duorarum, C. similis y Persephona crinita Rathbun, 1931 fueron las especies dominantes en mayo de 1995 y representaron 60.2% de la densidad total. F. duorarum, P. spinicarpus y Rimapenaeus similis (Smith, 1885) contribuyeron con el 64.4% en agosto. En noviembre, C. similis, F. duorarum, X. kroyeri, A. alexandri y Squilla empusa Say, 1818 constituyeron el 60.3% y por último en febrero, F. duorarum, C. similis,Iliacantha liodactylus Rathbun, 1898 y P. crinita aportaron en mayor proporción a la densidad (55.9 %).
Los índices ecológicos, en ambos años presentaron variaciones poco relevantes durante los diferentes meses (Fig. 3). Los índices H’n y H’w presentaron valores altos en noviembre y mayo, mientras que los más bajos se observaron en agosto y febrero. Los índices J’ y J-1 mostraron valores similares a lo largo de los diferentes meses, con un ligero incremento en la dominancia en agosto de 1994.
De manera general se observó que en mayo los valores altos de diversidad se detectaron en los muestreos realizados en los 30 y 60 m de profundidad asociados a sedimentos de limoarcilla transicional, frente a los ríos Grijalva-Usumacinta y a la boca del Carmen en la laguna de Términos. La mayor dominancia y biomasa se observó en la boca de Puerto Real a 18 m y 42 m, respectivamente. En agosto, los valores máximos de diversidad y biomasa se localizaron a profundidades mayores (150 m), frente al sistema fluvial San Pedro y San Pablo en sedimento arcilloso. A pesar de estas fluctuaciones, los resultados del ANOVA no mostraron diferencias significativas interanuales (p> 0.05).
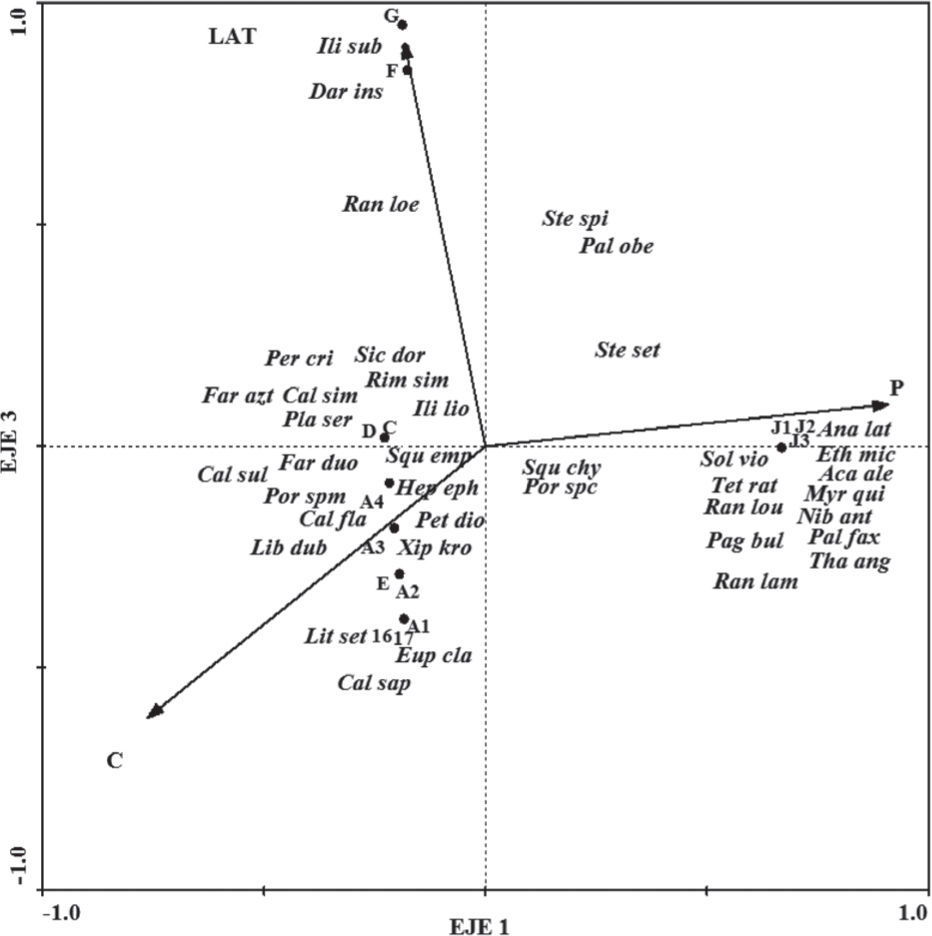
Asociaciones de megacrustáceos. Los diagramas de ordenación realizados con base en la densidad de organismos en los 2 años de estudio mostraron que la profundidad está fuertemente correlacionada con el eje 1, mientras que el tipo de sedimento fue el segundo factor determinante en su composición. El tipo de sedimento arcilla terrígena se omitió de los análisis ya que presentó una alta colinearidad con los arrastres mayores a 100 m.
Los resultados del CCA estimados en 1994 mostraron que los 3 primeros ejes explican el 62% de la variabilidad en la composición faunística y el 100% de la relación con las variables ambientales. La profundidad fue el factor que explicó en mayor porcentaje la variabilidad en el eje 1, mientras que los tipos de sedimento limo-arcilla transicional y carbonatado correspondieron al eje 3 (Cuadro 2a). La prueba de Monte Carlo indicó que tanto el primer eje como la suma de todos los ejes canónicos fueron significativos (p= 0.002), lo que sugiere que las variables utilizadas determinan la variación en la composición faunística (Cuadro 2a). El diagrama de ordenación mostró 3 asociaciones relacionadas con la profundidad y el tipo de sedimento, denominadas A, B y C (Fig. 4). La asociación A correspondió a los arrastres realizados en la región oeste de la laguna de Términos, frente al sistema fluvial Grijalva-Usumacinta y los ríos San Pedro y San Pablo entre 45 y 57 m de profundidad y sedimentos de limo-arcilla transicional.
Resultados de los análisis de correspondencias canónicas (CCA) para los tres primeros ejes de ordenación y prueba de Monte Carlo. a) 1994; b) 1995
| a) Ejes | 1 | 2 | 3 |
|---|---|---|---|
| Eigenvalores | 0.819 | 0.229 | 0.084 |
| Correlaciones especies-variables | 0.999 | 0.951 | 0.836 |
| Varianza de especies | 44.7 | 57.2 | 61.8 |
| Prueba de Monte carlo (499 permutaciones) | |||
| Significancia del primer eje canónico = | 0.819 | ||
| F = | 12.135 | ||
| P = | 0.002 | ||
| Significancia de todos los ejes canónicos Traza = | 1.133 | ||
| F = | 8.100 | ||
| P = | 0.002 |
| b) Ejes | 1 | 2 | 3 |
|---|---|---|---|
| Eigenvalores | 0.685 | 0.242 | 0.159 |
| Correlaciones especies-variables | 0.984 | 0.964 | 0.952 |
| Varianza de especies | 29.7 | 40.2 | 47.1 |
| Prueba de Monte Carlo (499 permutaciones) | |||
| Significancia del primer eje canónico = | 0.685 | ||
| F = | 4.224 | ||
| P = | 0.002 | ||
| Significancia de todos los ejes canónicos Traza = | 1.086 | ||
| F = | 2.965 | ||
| P = | 0.002 |
Las especies de este grupo contribuyeron con el 56.6% de la densidad y el 46.3% de biomasa del total de este año. Los portúnidos C. similis y P. spinicarpus y el peneido F. aztecus dominaron claramente esta asociación contribuyendo con el 88.4% de la densidad y con el 93.4% de la biomasa total obtenida en la asociación A. Los lances realizados en esta misma área, pero en un intervalo batimétrico somero entre 22 y 24 m, se separaron claramente de esta asociación en los valores más altos del gradiente LAT en los que se distribuyeron preferentemente las especies Leiolambrus nitidus Rathbun, 1901, Hepatus epheliticus (Linnaeus, 1763) y P. crinita. La asociación B, agrupó los arrastres realizados en la región este de la laguna de Términos entre 15 y 41 m de profundidad sobre sedimentos carbonatados. Esta asociación presentó una mayor riqueza específica (20 especies) pero una menor contribución a la densidad (33.4%) y biomasa totales (35.6%) en comparación con la asociación A. Las mayores densidades se debieron a las grandes abundancias de los peneidos F. duorarum y X.kroyeri y del esquílido S. empusa, que contribuyeron con el 86.5% de la densidad. El 39.2% de biomasa correspondiente a esta asociación se debió principalmente a la presencia del pagúrido P. diogenes. En los valores más altos del gradiente C se presentaron las especies Portunus gibbesii (Stimpson, 1859) (= Achelous gibbesiiMantelatto et Al., 2009) y X. kroyeri, ésta última especie presentó una gran densidad en verano. La asociación C, se separa claramente en la porción mayor del gradiente de profundidad donde predominaron los sedimentos de arcilla terrígena con profundidades mayores a los 100 m. Los porcentajes de densidad (6.3%) y de biomasa (9.3%) en esta asociación fueron los menores obtenidos en este año, los cuales están constituidos por: Solenocera vioscai Burkenroad, 1934, A. alexandri, P. obesus, E. microphthalma y Tetraxanthus rathbunae Chace, 1939.
En 1995, los 3 primeros ejes explicaron el 47% de la variabilidad en la composición faunística y el 100% de la relación con las variables ambientales (Cuadro 2b). La profundidad fue la variable que explicó en mayor porcentaje la variabilidad en el eje 1, mientras que los tipos de sedimento carbonatado y limo-arcilla transicional lo hicieron en el eje 3. La prueba de Monte Carlo indicó que tanto el primer eje como la suma de todos los ejes canónicos fueron significativos (p= 0.002), lo cual sugiere que las variables utilizadas son las responsables de la variabilidad en la composición faunística (Cuadro 2b).
El diagrama de ordenación para este año mostró las asociaciones A y B relacionadas con la profundidad y el tipo de sedimento (Fig. 5). En este año no es muy clara la separación entre las asociaciones de LAT y C, aunque se observó que los arrastres realizados entre 29 y 41 m de profundidad, en la región este de la laguna de Términos, se localizaron en los valores bajos del gradiente LAT, mientras que los realizados en esta misma región pero a profundidades más bajas (16 a 26 m) se ubicaron en los valores medios y altos del gradiente C. La asociación concentró 18 especies que aportaron el 75.8% de la densidad y el 76.6% de biomasa total del año. Callinectes similis, F. duorarum, I. liodactylus y S. empusa, dominaron en densidad con el 71.7%, mientras que P. diogenes contribuyó con 31.7% al total de la biomasa en A. Las especies restantes presentaron porcentajes de densidad y biomasa inferiores al 10%.
Litopenaeus setiferus (Linnaeus, 1767), Callinectes sapidus Rathbun, 1896 y Euphrosynoplax clausa Guinot, 1969, se localizaron en los valores más altos del gradiente carbonatado. En este año los arrastres realizados entre 20 y 23 m de profundidad frente al sistema fluvial Grijalva-Usumacinta y los ríos San Pedro y San Pablo se separaron en la porción de mayor influencia del gradiente de limo-arcilla transicional, donde se presentaron Iliacantha subglobosa Stimpson, 1871 y D. insignis. Squilla chydaea Manning, 1962 y P. spinicarpus se separaron de esta asociación en los valores medios con respecto a la profundidad.
La asociación B estuvo formada por los arrastres realizados frente a la laguna de Términos entre 159 y 172 m de profundidad con sedimentos de arcilla terrígena. Esta asociación presentó porcentajes bajos de densidad (9.8%) y de biomasa (8.4%) y estuvo dominada, en términos de densidad, por A. alexandri, E. microphthalma y S. vioscai, mientras que en biomasa por Nibilia antilocapra (Stimpson, 1871) con el 50% del total de este año.
DiscusiónA pesar de que la densidad y biomasa de los megacrustáceos presentaron fluctuaciones entre los diferentes meses y entre los 2 años, éstas sólo fueron significativas entre agosto y noviembre de 1994, agosto de 1994 y febrero de 1995, y entre agosto de 1994 y noviembre de 1995, principalmente debido a las altas densidades estimadas en agosto de 1994 de C. similis, P. spinicarpus, F. duorarum, F. aztecus y X. kroyeri, en comparación con las densidades tan bajas encontradas en estas mismas especies en noviembre y febrero de 1995, así como la ausencia de F. aztecus y X. kroyeri en noviembre de 1995. C. similis y P. spinicarpus fueron los decápodos más abundantes en agosto de 1994 y 1995 en el área frente al sistema fluvial de San Pedro y San Pablo a 62 m de profundidad, aunque en mayo C. similis presentó la máxima densidad en esta misma área pero a menor profundidad. En el grupo de los peneidos se observaron diferencias espaciales y batimétricas de la abundancia. En mayo, la máxima densidad observada fue en F. duorarum frente a la boca de Puerto Real entre 35 y 41 m de profundidad, mientras que en agosto ésta se observó frente a la boca del Carmen a 23 m. X. kroyeri, como la segunda especie con mayor abundancia total dentro de los peneidos, presentó 2 máximos en agosto, uno frente a la boca de Puerto Real (42 m) y el otro frente a los ríos San Pablo y San Pedro (62 m de profundidad), mientras que en F. aztecus la máxima densidad se obtuvo en este mismo mes frente a los ríos San Pablo y San Pedro a 62 m de profundidad. En investigaciones previas, Vázquez-Bader (1996) reportó en ésta área las mismas especies; sin embargo, las densidades en primavera y verano son mayores a las reportadas en este estudio; también señaló la clara dominancia de C. similis y de F. duorarum en las capturas, particularmente en verano frente a la boca del Carmen a 24 m de profundidad. Otros componentes faunísticos característicos por su gran abundancia fueron los estomatópodos S. empusa y S. chydaea, que aunque en el presente estudio presentaron alta dominancia, las densidades fueron menores a las registradas en años anteriores.
Las diferencias en los valores de biomasa y densidad registrados entre los 2 años, principalmente en agosto y mayo, pueden explicarse en función de las variaciones ambientales temporales; sin embargo, también es conveniente contemplar las variaciones en el esfuerzo de muestreo, ya que no se cubrieron las mismas estaciones en los distintos años (Fig. 5). Esto último también podría explicar las altas densidades registradas por Vázquez-Bader en 1996, ya que se cubrió un gradiente batimétrico y geográfico más amplio y continuo en comparación con el presente estudio. Otro factor importante de considerar es el impacto de la pesca de arrastre de camarón sobre las comunidades bentónicas, porque puede tener un efecto perturbador y causar cambios en la estructura y abundancia por la remoción constante tanto del camarón como de la fauna acompañante (Gracia et al., 1997). Cabe mencionar que el área de estudio ha estado sujeta a un esfuerzo pesquero constante y creciente desde finales de 1950, cuando dio inicio la explotación del camarón. Incluso el esfuerzo pesquero artesanal e industrial ha originado una sobrepesca en las principales especies de camarón de la Sonda de Campeche (Gracia y Vázquez-Bader, 1998; Gracia, 2004) por lo que es posible que también pueda haber un efecto asociado sobre la abundancia de las principales especies que componen las comunidades bentónicas asociadas al camarón.
Las asociaciones de megacrustáceos en la Sonda de Campeche estuvieron determinadas principalmente por un efecto combinado entre la profundidad y el tipo de sedimento, lo cual coincide en gran medida con otros estudios realizados en otras longitudes y/o latitudes (Haedrich et al., 1975, 1980; Wenner y Boesch, 1979; Abelló et al., 1988, 2002; Wei-Rung et al., 1999; Lopes dos Santos et al., 2004; Serrano et al., 2006, 2008; Fanelli et al., 2007). La profundidad fue el factor de mayor influencia en la distribución de la densidad de los crustáceos en los diagramas de ordenación, lo que concuerda con los estudios previos realizados en el golfo de México por Vázquez-Bader (1988, 1996), donde se reportó que la profundidad y el tipo de sedimento explicaron cerca del 90% de la variación de la densidad de las especies, cifra que sobrepasa lo encontrado en esta investigación, aunque cabe aclarar que fue llevada a cabo en menor área e intervalo batimétrico.
Los megacrustáceos dominantes presentaron una distribución espacial y batimétrica amplia; sin embargo, el análisis multivariado permitió diferenciar 3 asociaciones que fluctuaron en densidad, biomasa y composición, en respuesta a los gradientes profundidad y sedimento. La zona de menor profundidad (15-41 m) arrojó como resultado una separación entre los grupos de especies en respuesta al gradiente sedimento, en el que se observó que las variaciones se debieron más a los cambios de densidad y biomasa que a la composición faunística. El tipo de sedimento se ha relacionado a su vez con una amplia gama de variables ambientales tales como la velocidad de las corrientes y el contenido de materia orgánica, como factores secundarios que influyen en el asentamiento de organismos bentónicos (Fanelli et al., 2007). Duineveld et al., (1991) mencionan que además del tipo de sedimento habría que considerar la morfología del fondo marino como un factor determinante en la distribución de las asociaciones bentónicas. Aunado a ésto, en las asociaciones de zonas someras, el aporte de los sistemas fluviales podría ser un factor determinante para explicar las diferencias en abundancia y biomasa de los megacrustáceos estudiados. Como se mencionó anteriormente, el estrato profundo presenta una mayor estabilidad al presentar un sólo tipo de sedimento (arcilla) y un mínimo aporte terrígeno, por lo que dadas estas condiciones, la profundidad es la variable que influye directamente en la presencia de las especies en este estrato, mostrando una asociación definida de especies, como lo señala Vázquez-Bader (1996).
Vázquez-Bader (1988, 1996) mostró la existencia de una asociación muy variable en el estrato somero (15-45 m de profundidad), una más estable en el estrato profundo (107-202 m) y una asociación de transición en el estrato medio (46-70 m) que comparten especies de ambos estratos (somero y profundo). Los resultados obtenidos en esta investigación no mostraron una clara diferenciación del estrato medio, debido principalmente a la diferencia en el esfuerzo de muestreo. Yáñez-Arancibia y Sánchez-Gil (1983), señalan la existencia de 2 subsistemas definidos en términos ambientales cuyos límites quedan situados frente a la laguna de Términos y que se refleja en las comunidades de peces demersales. Estos autores mencionan una zona “A”, altamente heterogénea influenciada por la descarga de los ríos y una zona “B”, situada en el banco de Campeche, homogénea y de bajo contenido orgánico. La presencia de estos subsistemas en el estrato somero le confiere una gran variabilidad ambiental, por lo que puede propiciar la movilidad de especies en las zonas limítrofes entre ambos ambientes y consecuentemente la presencia de una asociación de especies de transición que no muestren una preferencia definida por cierto tipo de sustrato, como lo que se ha propuesto para la composición de comunidades bentónicas en el área (Vázquez-Bader, 1988, 1996).
Aunque las variables analizadas se restringieron a 2 factores ambientales, los resultados obtenidos en esta investigación y en estudios previos, muestran que la variación observada en la composición de las asociaciones de los megacrustáceos bentónicos es explicada mayoritariamente por la profundidad y en menor grado por el tipo de sedimento. Es importante considerar que los organismos habitan en ambientes cuyos factores ambientales se encuentran en constante interacción a través del tiempo, por lo que la respuesta de las especies a estas variables no puede ser determinada por un factor ambiental único. En las zonas de menor profundidad, la influencia del aporte de materia orgánica proveniente de sistemas fluviales y de la laguna de Términos podría tener un efecto importante sobre las asociaciones, ya que afecta a la macrofauna, la cual es uno de los principales recursos alimenticios de organismos bentónicos mayores y de la fauna demersal. Con base en este estudio, se puede decir que las asociaciones se caracterizaron en la zona somera por especies que se presentaron en ambos tipos de sedimento aunque con diferentes densidades y biomasas, mientras que la asociación de zona profunda se diferenció en hábitat y composición faunística.
AgradecimientosNuestro sincero agradecimiento a la tripulación del B/O Justo Sierra por su apoyo durante la realización de las campañas oceanográficas. Agradecemos también el apoyo de la Dirección General de Apoyo al Personal Académico, UNAM, a través del Proyecto PAPIIT IN203893.