En este trabajo se describen por primera vez las características morfológicas y térmicas de los nidos de la lagartija Aspidoscelis costata. Todos los nidos (n=23) se encontraron bajo rocas expuestas a luz solar directa. Las rocas midieron (Media±1ES) 65.8±3.6cm de largo, 43.7±2 de ancho y 28.7±3.2 de alto. La forma general del nido fue elíptica y midió 6.1±0.5cm de largo, 4.4±0.4 de ancho y 2.4±2.4 de alto, la profundidad de la cámara fue 5.98±0.6cm. El número de nidos por roca en promedio fue 1.7±0.3, el número de huevos por nido fue en promedio 6.3±0.5, los huevos midieron 1.5±0.02cm de largo, 1.1±0.04cm de ancho y pesaron 0.92±0.08g. La temperatura dentro del nido fue de 28.4±0.2 y varió entre 21.1 y 38.5° C. La anidación ocurre durante el periodo de lluvias (junio-septiembre), las cuales amortiguan la temperatura ambiental para el desarrollo embrionario de Aspidoscelis costata.
For the first time, the morphological and thermal traits of the nests of the Aspidoscelis costata lizard are described in this study. All nests (n=23) were found under rocks, which were exposed directly to the sunlight. The rocks measured (Mean±1SE) 65.8±3.6cm in length, 43.7±2cm in width, and 28.7±3.2cm in height. The general shape of the nest was elliptical and measured 6.1±0.5cm in length, 4.4±0.4cm in width, and 2.4±2.4cm in height, while the depth of the chamber was 5.98±0.6cm. There was 1.7±0.3 nests per rock, 6.3±0.5 eggs per nest, and the eggs measured 1.5±0.02cm in length, 1.1±0.04cm in width, and weighed 0.92±0.08g. The mean temperature inside the nest was 28.4±0.2°C and ranged from 21.1°C to 38.5°C. Nesting occurred during the rainy season (June to September), which dampen the ambient temperature for the embryonic development of the Aspidoscelis costata lizard.
La selección del sitio de anidación por parte de la madre determina aspectos del fenotipo de las crías (Shine y Harlow, 1996; Pike et al., 2010). Se ha documentado que las condiciones térmicas en las cuales se incuban los huevos de los reptiles afectan características como el tamaño, sexo, crecimiento, preferencias térmicas, rendimiento locomotor y escape de depredadores (Andrews et al., 2000; Qualls y Shine, 2000; Brown y Shine, 2006). Los huevos en el nido están sujetos a la temperatura del sitio donde fueron depositados. Por lo tanto, la elección correcta del sitio de ovoposición contribuye a aumentar el éxito de eclosión de las crías y previene la exposición a temperaturas extremas que producen efectos letales para los embriones (Telemeco et al., 2009).
El conocimiento sobre la ecología térmica de anidación en poblaciones silvestres de lagartijas es mínimo y se desconocen las variables que pueden afectar su desarrollo embrionario. Asimismo, ante el cambio climático, la temperatura es un factor determinante en la supervivencia de especies ectotermas (Sinervo et al., 2010). Por lo anterior, en este trabajo se describen la morfología y las características térmicas de los nidos de lagartijas Aspidoscelis costata.
El área de anidación de A. costata se encuentra en los límites del Parque Nacional Grutas de Cacahuamilpa en el municipio de Pilcaya (18°39'54” N, 99°28'51” O a 1 150m de altitud). La zona tiene una temperatura media anual de 21.6°C (20-29°C) con una precipitación media anual de 1 432mm, y está cubierta con áreas de bosque tropical caducifolio y pastizal inducido (Conanp, 2006).
Los nidos fueron localizados bajo rocas dentro de un área aproximada de 1.5ha. El área fue recorrida moviendo cuidadosamente las rocas que potencialmente podrían estar cubriendo los nidos. Cuando los nidos fueron localizados se midió el largo, ancho y alto de las rocas empleando una cinta métrica. Las medidas internas del nido fueron largo, ancho, altura de la cámara y la profundidad a la que se encontraba el nido (medida como la distancia de la base del nido al sustrato fuera de la roca). Para obtener las medidas de los huevos y nidos, se utilizó un vernier de 0.1mm de precisión. Se realizó un conteo del número de huevos por nido y el número de nidos debajo de cada roca. Asimismo, se registró el largo, ancho y peso de 10 huevos de diferentes nidos. Además, se realizó una correlación de Pearson entre el tamaño de la roca (largo, ancho y alto) con el número de nidos debajo de las rocas, esto para determinar si el tamaño de las rocas define el número de nidos. También se fijaron 10 huevos con formol al 4% de nidos recientemente ovopositados, ésto se determinó por el color del cascarón (blanco brillante) y menor turgencia para un futuro estudio de desarrollo embrionario. Además se incubaron 5 huevos de diferentes nidos en el laboratorio para confirmar que se trababa de A. costata. Por otro lado, aunque para Guerrero se ha registrado la presencia de otros teiidos como A. sacki, A. deppii y Ameiva undulata, en el área de estudio no se registró la presencia de éstos. Después del registro de las medidas, la roca fue colocada cuidadosamente en el mismo lugar y posición como se encontraba originalmente para evitar la modificación del microambiente en el nido y la entrada de depredadores.
Se colocaron 7 sensores de temperatura tipo dataloggers (Hobo H8 series) en 7 nidos diferentes. El sensor fue colocado a un centímetro de los nidos y fue programado para registrar la temperatura durante cada hora. Las temperaturas fueron analizadas desde el 13 de agosto hasta el 2 de septiembre de 2008 (fecha de la última eclosión registrada).
Se encontraron un total de 23 nidos en la zona de estudio debajo de 13 rocas. Desafortunadamente no se pudo evaluar el éxito de los nidos, pero en 18 de ellos (78% del total estudiado) se encontraron restos de cascarones durante los últimos días de agosto y primeros de septiembre. El número de nidos por roca fue de 1.7±0.26 (intervalo: 1-4) y el número de huevos encontrados por nido fue de 6.3±0.51 (intervalo: 2-8). Las rocas bajo las cuales estaban los nidos eran de muy diversos tamaños. Los valores promedio de las medidas de 13 rocas que cubrían los nidos fueron: longitud de 65.8±3.61cm (intervalo: 45-87), ancho de 43.7±1.99cm (intervalo: 30-56) y altura de 28.7±3.19cm (intervalo: 11-52). No se encontró correlación significativa entre el largo, ancho y alto de las rocas con el número de nidos debajo de estas (largo: r=0.29, n=13, p=0.33; ancho: r=0.05, n=13, p=0.87; alto: r=−0.28, n=13, p=0.35).
Por otro lado, la forma general de los nidos fue elíptica, el largo promedió 6.11±0.48cm (intervalo: 2.3-10.2cm), el ancho 4.45±0.38cm (intervalo: 1.27-9.3), la altura de la cámara de incubación fue de 2.36±0.17cm (intervalo: 1.35-4.24) y la profundidad del nido de 5.98±0.59cm (intervalo: 1.6-11). La longitud promedio de los huevos fue de 1.51±0.02cm (intervalo: 1.4-1.71) con un ancho de 1.1±0.04cm (intervalo: 0.9-1.29) y 0.92±0.08 g de peso en promedio (intervalo: 0.70-1.37).
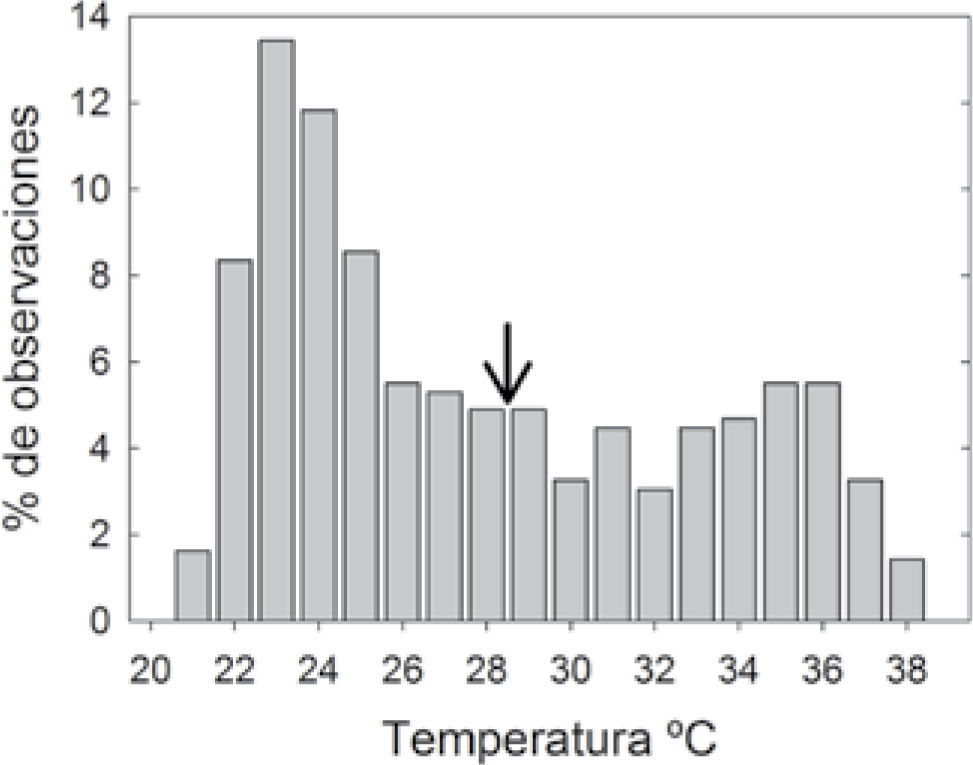
La disponibilidad de luz en la zona de anidación durante el periodo de estudio fue de 12:46h (el alba fue a las 8:19 y el crepúsculo a las 21:05h). Todas las rocas estuvieron expuestas a la luz solar directa. El monitoreo diario de temperatura se muestra en la figura 1 y la distribución de temperaturas dentro del nido en la figura 2. La temperatura dentro de los nidos promedió 28.4±0.22° C (intervalo: 21.1-38.5°C).
Variación de temperatura de los nidos de la lagartija Aspidoscelis costata en Guerrero, México. Los círculos blancos indican el promedio ± error estándar, la línea punteada indica el promedio general en ° C. Las líneas discontinuas indican la variación ontogenética de A. costata en la temperatura corporal (datos obtenidos de Rubio-Blanco, 2010).
Pianka y Vitt (2003) mencionan que dentro de la familia Teiidae los diferentes géneros presentan temperaturas corporales (Tc) de actividad conservativas y elevadas (>36°C), las cuales están relacionadas con altos niveles de actividad y forrajeo. A pesar de esto, la temperatura de incubación de A. costata es relativamente más baja que la Tc mantenida por la especie después de la eclosión (Rubio-Blanco, 2010; Fig. 1)
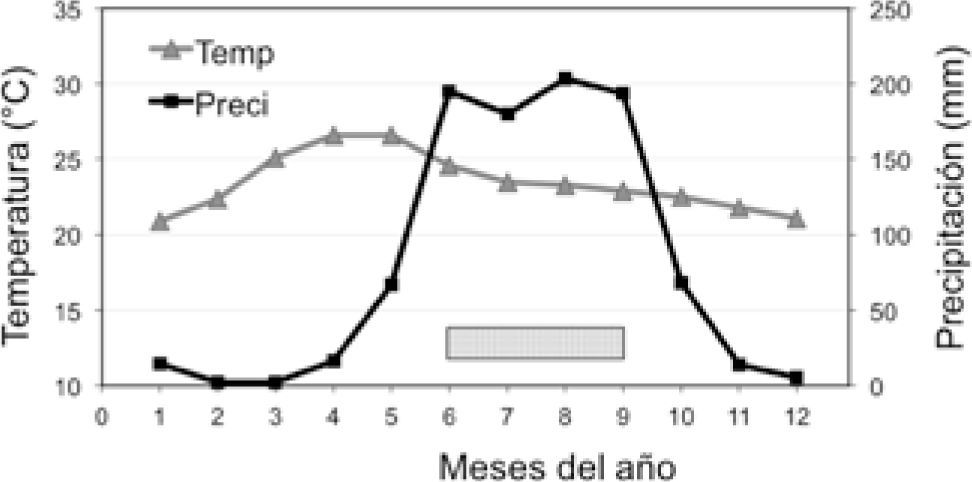
Además, el intervalo térmico de los nidos debajo de las rocas no mostró grandes fluctuaciones. La temporada de anidación de Aspidoscelis ocurre entre los meses de junio a septiembre, cuando se presentan las lluvias y temperaturas ambientales con menor variación (Fig. 3).
Temperatura y precipitación promedio de la zona de estudio (datos climatológicos de García, 2004 de la estación meteorológica El Rodeo, Morelos); el rectángulo sombreado indica el periodo de anidación de Aspidoscelis costata.
Aunque Pérez-Almazán (2007) registró que A. costata tiene el tamaño de nidada más grande para el género Aspidoscelis (promedio: 7.6±0.55 huevos), en este trabajo se registró un promedio más bajo con 6.3±0.51, el cual podría estar asociado a variaciones interpoblacionales debidas a factores genéticos, ecológicos y/o ambientales (Méndez-de la Cruz et al., 1993). Por otro lado, Aguilar-Moreno et al. (2010) menciona que en A. costata no existe evidencia de nidadas múltiples por estación reproductora, lo cual indica que los nidos encontrados potencialmente fueron datos independientes.
Son necesarios más trabajos de investigación de los aspectos térmicos sobre los nidos en reptiles para determinar la respuesta a factores selectivos como el cambio climático (Deutsch et al., 2008; Telemeco et al., 2009; Sinervo et al., 2010). En este estudio se documenta que la temporada de anidación ocurre cuando las temperaturas en la zona son amortiguadas por las lluvias y son térmicamente más estables para los nidos (Fig. 3). Finalmente, A. costata seleccionó sitios de anidación en microhábitats con propiedades térmicas benéficas posiblemente para el desarrollo embrionario.
Agradecemos al director del Parque Nacional Grutas de Cacahuamilpa, MVZ José Reyes y a los integrantes del departamento de Monitoreo de Fauna Silvestre por su apoyo otorgado en el sitio durante el desarrollo del trabajo en campo, en el que también fuimos asistidos por Eric Centenero y Norberto Martínez. Al Posgrado en Ciencias Biológicas, UNAM. A 2 revisores anónimos y Nancy de León por la sugerencias sobre el manuscrito. Al Consejo Nacional de Ciencia y Tecnología (CONACyT) por las becas de posgrado otorgadas (165066, 165067 y 290541). Finalmente, a la Dirección General de Asuntos del Personal Académico- Programa de Apoyo a Proyectos de Investigación e Innovación Tecnológica (DGAPA-PAPIIT) (IN224208, IN 215011-3) por el financiamiento.