Euterpe oleracea Mart. (Arecaceae) es una palma cespitosa y dominante en bosques de zonas inundables de la cuenca del río Atrato, Colombia. Es considerada de importancia económica por el palmito que se extrae de ella y por los múltiples productos que se derivan de sus frutos. Se estudió la fenología reproductiva de Euterpe oleracea en 2 comunidades vegetales: murrapal mixto, donde E. oleracea ocurre junto a otras especies, y murrapal puro, dominado casi en su totalidad por E. oleracea. Los registros fenológicos se llevaron a cabo en 2 periodos: entre octubre de 1999 y diciembre de 2001, en ambos tipos de bosque; y entre octubre de 2006 y mayo de 2009, sólo en el murrapal mixto. La fenología reproductiva de Euterpe oleracea respondió a un patrón anual en ambos ecosistemas; sin embargo, las épocas de mayor producción de flores y frutos no coincidieron entre ellos. Se encontró una correlación significativa entre la precipitación y las fenofases, frutos verdes y frutos maduros en el murrapal puro; lo que sugiere un efecto de la inundabilidad sobre la producción temporal de flores y frutos. En el murrapal mixto no se halló relación significativa entre la pluviosidad y las fenofases reproductivas, probablemente debido a que en esta posición topográfica la inundación durante la estación lluviosa no fue tan severa y, por tanto, no alcanzó a cubrir los neumatóforos de las palmas.
Euterpe oleracea Mart. (Arecaceae) is a clustered palm tree occurring in seasonally flooded areas of the Atrato river basin, where it forms homogeneous forests. This palm has economic importance because of the production of palm hearts and numerous products derived from its fruits. The reproductive phenology of Euterpe oleracea was studied in 2 forest types: mixed murrapal, where other species occur, and pure murrapal, almost totally dominated by this palm tree. Phenological observations were made in 2 periods: from October 1999 to December 2001 in both forest types, and from October 2006 to May 2009 in the mixed murrapal only. The reproductive phenology showed an annual pattern in both ecosystems; however, the timing of flowering and fruiting in each forest type was different. A significant correlation was found between rainfall and reproductive structures (fruits) in the pure murrapal, suggesting an effect of flooding on timing of flowering and fruiting. Contrarily, no significant correlation was found in the mixed murrapal, probably because flooding during rainy season was less severe in this topographic position, and therefore, water did not cover the palm pneumatophores.
Las palmas son un componente abundante de los bosques tropicales (Henderson, 1995). En áreas inundables de la cuenca del río Atrato (Chocó biogeográfico-Colombia), es común encontrar extensas zonas de bosque dominadas por la palma Euterpe oleracea Mart. (Arecaceae) (Universidad Nacional de Colombia, 1995). El potencial económico de esta especie es considerable, ya que de sus frutos se extraen valiosos recursos alimenticios y sus semillas se usan en la industria (Calzavara, 1987; Jardim y Anderson, 1987; Melo et al., 1988; Iaderozat et al., 1992; Bobbio et al., 2000; Tinoco, 2005; Menezes et al., 2008),
Por lo anterior, el manejo sostenible de esta especie podría contribuir de manera significativa a mejorar la calidad de vida de los habitantes de la región, quienes viven en extrema pobreza, así como a conservar los demás ecosistemas, pues permitiría reducir la presión sobre los recursos maderables. Estas características sumadas a su crecimiento cespitoso y alta dominancia, la convierten en una de las especies económica y ecológicamente más importantes de estos ecosistemas. No obstante, se ha publicado poca información ecológica que sirva como base para comprender su biología y para el manejo de los bosques dominados por ella. Alcanzar las expectativas de su aprovechamiento futuro y conservación, requiere conocer la base de recursos ofertados por estos bosques, comprender la estacionalidad de los eventos biológicos y si éstos están ligados a la inundación.
De aquí se deriva el principal objetivo de esta investigación, el cual consiste en evaluar el comportamiento de la fenología reproductiva de E. oleracea en los bosques inundables de la parte media del río Atrato (Colombia). En particular, el presente trabajo responde las siguientes preguntas: 1) ¿los eventos fenológicos ocurren de manera sincrónica?, 2) ¿cuál es el patrón reproductivo de E. oleracea?, 3) ¿cuál es la duración de cada estructura reproductiva? y 4) ¿existe alguna relación entre los patrones fenológicos y el clima?
La fenología estudia la ocurrencia de eventos biológicos repetitivos y su relación con factores bióticos y abióticos. Conocer el comportamiento fenológico de las poblaciones vegetales ayuda a comprender su dinámica y a determinar la disponibilidad de recursos a lo largo del tiempo (Morellato et al., 2000), ambos aspectos de gran importancia para el manejo sostenible de los bosques. Diversos estudios se han enfocado en describir la fenología de las palmas y su relación con factores ambientales en diferentes tipos de ecosistemas (De Steven et al., 1987; Peres, 1994; Scariot et al., 1995; Henderson et al., 2000; Miller, 2002; Ruiz y Alencar, 2004; Inkrot et al., 2007; Genini et al., 2009; Rojas-Robles y Stiles, 2009). No obstante, pocas investigaciones se han ocupado en comprender el comportamiento fenológico de las palmas en ecosistemas inundables, como los estudiados en este trabajo (Piedade et al., 2006; Cifuentes et al., 2010).
Se ha comprobado que los eventos fenológicos de las plantas se asocian con distintas variables ambientales. En bosques tropicales, por ejemplo, es notoria la relación con la disponibilidad de agua en el suelo, la cual depende principalmente de la precipitación en ecosistemas de tierra firme y de los niveles de los ríos en ecosistemas inundables (Borchert, 1994, 1999; Schöngart et al., 2002; Borchert et al., 2004). La intensidad y duración de las crecientes son factores que generan desbalances fisiológicos y cambios morfológicos en plantas de bosques sujetos a inundaciones periódicas (Kozlowski, 1997; Pimenta et al., 1998; Parolin, 2001). En estos ecosistemas, se ha mostrado que la variación estacional de la fenología ocurre como respuesta al estrés inducido por la inundación; así, el patrón de esta última es probablemente el mayor determinante de su comportamiento fenológico (Blom et al., 1990; Kubitzki y Ziburski, 1994; Schöngart et al., 2002). En consecuencia, esperamos que la floración y fructificación de E. oleracea esté asociada con los periodos de mayor inundación.
Materiales y métodosÁrea de estudio. La investigación se llevó a cabo en la llanura de inundación del río Atrato (Pacífico colombiano), entre los municipios de Vigía del Fuerte y Bojayá, región que pertenece a la provincia del Chocó Biogeográfico (6°34'50” N, 76°52'09” O). Con base en el diagnóstico del componente arbóreo y el mapa de asociaciones vegetales de la zona (Universidad Nacional de Colombia, 1995), se seleccionó un ecosistema sometido a inundaciones periódicas, conocido localmente como murrapal mixto, dominado medianamente por E. oleracea y con presencia significativa de Oenocarpus bataua Mart. (Arecaceae), Manicaria saccifera Gaertn. (Arecaceae) y Swartzia sp. (Fabaceae), entre otras.
De acuerdo con la clasificación ecológica de Holdridge (1978), el lugar de trabajo se encuentra en la zona de vida bosque muy húmedo tropical (bmh-T). Su temperatura media anual es 28°C, humedad relativa de 89% y precipitación media anual entre 5 000 y 7 000mm, con distribución bimodal (alternancia de 2 temporadas muy lluviosas y otras 2 relativamente poco lluviosas). La época menos húmeda del año tiene lugar entre diciembre y marzo, sin meses ecológicamente secos (Eslava, 1993). Los suelos son de origen aluvial, poseen fertilidad natural baja y están sometidos a inundaciones periódicas, cuya intensidad depende de la variación en la topografía (Cortés, 1993), la que, a su vez determina la distribución de los diferentes tipos de hábitats.
Especie estudiada. Euterpe oleracea se conoce localmente con el nombre de murrapo y forma densas y extensas poblaciones en tierras bajas inundables del neotrópico. Es una palma cespitosa de estipes delgados, cuya cepa puede contener más de 45 estipes en diferentes estados de desarrollo y superar 20m de altura, por lo que hace parte del dosel superior del bosque. Es una especie monoica, con inflorescencias infrafoliares, protándricas; las flores estaminadas maduran su polen antes de que las flores pistiladas estén receptivas. Sus frutos son globosos, de 1.1 a 1.5cm de diámetro, verde cuando están inmaduros y morado oscuro cuando alcanzan la madurez; las semillas son globosas y con endospermo profundamente ruminado. Las raíces forman un cono en la base de los estipes y poseen estructuras especiales llamadas neumatóforos, que permiten la respiración de la planta en suelos inundados; algunas raíces aéreas pueden alcanzar 80cm por encima de la superficie del suelo (Henderson y Galeano, 1996).
Trabajo de campo. Para llevar a cabo el seguimiento de los eventos fenológicos reproductivos, se estableció un bloque rectangular de 100x210m en un bosque de murrapal mixto, conformado por 12 parcelas de 20x25m (500m2), dispuestas en 2 hileras paralelas de 6 unidades y separadas entre sí por corredores de 10m de ancho. Una cepa de E. oleracea fue seleccionada en cada parcela, donde se marcaron todos los estipes adultos con evidencias de estructuras reproductivas; en total, 72 estipes fueron analizados. Otros estudios sobre dinámica del ecosistema se llevaron a cabo en estas mismas parcelas en el marco de un proyecto de investigación mayor sobre demografía, crecimiento y biología reproductiva de las palmas E. oleracea y O. bataua.
Los eventos fenológicos fueron registrados cada 15 días durante 2 periodos: 1) entre octubre de 1999 y diciembre de 2001 (26 meses) y 2) entre octubre de 2006 y mayo de 2009 (32 meses); cada periodo de medición corresponde a la vigencia de un proyecto diferente. Con el propósito de realizar comparaciones entre ecosistemas, se utilizaron datos fenológicos de la misma especie en un bosque cercano, denominado localmente murrapal puro, donde E. oleracea forma rodales completamente homogéneos; allí se estableció un bloque con un diseño idéntico al del murrapal mixto. Las observaciones se llevaron a cabo cada 15 días entre febrero de 2000 y diciembre de 2001 (23 meses), se monitorearon 69 estipes adultos. La duración y el nivel de la inundación en el murrapal puro durante gran parte del segundo periodo de monitoreo (2007-2008) impidieron el acceso y por lo tanto, el registro de datos continuos; por esta razón no fue posible incluirlos en el análisis.
Estos eventos fueron observados directamente con binoculares sobre los estipes marcados y se clasificaron así: 1) espata, bráctea peduncular leñosa que envuelve y protege la inflorescencia; 2) flores, cuando se abre la espata y se expone la inflorescencia hasta que las flores femeninas se fecundan o caen; 3) frutos verdes, desde que se forman los frutos en las infrutescencias hasta que cambian de color verde a morado y 4) frutos maduros, desde que los frutos cambian de color verde a morado hasta que caen o son consumidos.
Análisis de datos. La sincronía de la población, entendida como la ocurrencia simultánea del mismo evento fenológico en los individuos muestreados (Newstrom et al., 1994), se evaluó mediante el índice de actividad propuesto por Bencke y Morellato (2002). Éste es un índice cuantitativo que indica la proporción de individuos observados que manifiesta determinado evento fenológico en una población. Así, un evento fue considerado como no sincrónico o asincrónico cuando menos del 20% de los individuos presentaba la fenofase en cuestión, poco sincrónico o con sincronía baja cuando la fenofase ocurrió entre 21 y 60% de los individuos, y con sincronía alta cuando más de 60% de los individuos exhibió la fenofase (Bencke y Morellato, 2002). La sincronía intraespecífica se evaluó para flores, frutos verdes y frutos maduros.
Para definir la estacionalidad de cada fenofase (flores, frutos verdes y frutos maduros) y comparar patrones reproductivos entre años, se realizaron análisis de estadística circular (Zar, 1999; Morellato et al., 2000). Las fechas de las observaciones se convirtieron a ángulos con intervalos de 15 grados, aproximadamente. Para ello, se utilizó la fórmula a=360X/k, donde a es la dirección angular en grados, X es el día del año correspondiente a la fecha de observación y k es el tiempo total de un ciclo completo; para este caso un año o 360 días. Los parámetros calculados fueron: ángulo medio (μ), longitud del vector medio (r), desviación angular y los límites de confianza de μ (Zar, 1999).
El ángulo medio corresponde al centro del periodo de ocurrencia de la fenofase. La longitud del vector medio mide la concentración temporal de la actividad fenológica alrededor del ángulo medio y permite probar las siguientes hipótesis (Morellato et al., 2000): 1) la ocurrencia de los eventos fenológicos está distribuida uniformemente a lo largo del año, es decir, no existe estacionalidad alguna y 2) los patrones estacionales o los ángulos medios para cada fenofase son iguales entre años. Para confirmar la estacionalidad anual se utilizó la prueba de Rayleigh (z), que determina la significancia del ángulo medio; para probar la segunda hipótesis se empleó la prueba de Watson-Williams (F).
La duración de las estructuras reproductivas individuales se determinó mediante la diferencia de días entre la aparición y desaparición de cada una de ellas. Para esto, se utilizó la información de todas las estructuras que alcanzaron completamente su desarrollo. Luego, a partir de los valores individuales, se calcularon la duración media, desviación estándar, coeficiente de variación e intervalos de confianza para cada fenofase.
Las relaciones entre precipitación mensual y la proporción media mensual de individuos con flores, frutos verdes o frutos maduros, se determinaron mediante el coeficiente de correlación de Pearson (r). Además, se evaluó la asociación de cada evento fenológico con la precipitación hasta de 10 meses atrás (time lag).
ResultadosEn el murrapal mixto, la ocurrencia de flores fue irregular a lo largo del año y asincrónica, ya que se registraron valores de frecuencia inferiores a 20% en la mayoría de los meses (Fig. 1a). Los frutos verdes mostraron un comportamiento sincrónico, puesto que durante los meses de mayor producción, más de 60% de los individuos evidenció esta fenofase (Fig. 1b). Por su parte, los frutos maduros tuvieron una sincronía baja; durante los picos de mayor producción, entre 20 y 60% de los individuos exhibieron tales estructuras (Fig. 1c). En el murrapal puro, durante el periodo de observación registrado allí, la sincronía de cada fenofase fue similar a las del murrapal mixto.
La presencia de flores, frutos verdes y frutos maduros tuvo lugar durante todo el año, con épocas de mayor actividad claramente identificables (Figs. 1a-c). En el murrapal mixto, el pico máximo referido a las flores ocurrió entre agosto y octubre (Fig. 1a), con valores significativos de r entre 0.34 y 0.65, que indican estacionalidad (Cuadro 1); sin embargo, en el murrapal puro, el pico se produjo en abril (año 2000). Las comparaciones del ángulo medio (fecha media) entre años para esta fenofase, en el murrapal mixto, fueron significativamente diferentes entre 2000 y 2001 (F [1 119]=9.49, p<0.05), y entre 2000 y 2007 (F [1 132]=6.52, p<0.05).
Parámetros obtenidos mediante estadística circular para las fenofases de Euterpe oleracea (fl: flores, fv: frutos verdes, fm: frutos maduros)
| Parámetro | 2000 | 2001 | 2007 | 2008 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| fl | fv | fm | fl | fv | fm | fl | fv | fm | fl | fv | fm | |
| Murrapal mixto | ||||||||||||
| Observaciones | 85 | 123 | — | 35 | 62 | 55 | 49 | 48 | 18 | 25 | 36 | 31 |
| Ángulo medio (μ) | 233.39 | 257.65 | — | 277.05 | 284.31 | 43.52 | 263.92 | 284.04 | 74.04 | 264.34 | 289.20 | 75.00 |
| Fecha media | 25-ago | 18-sep | — | 08-oct | 15-oct | 13-feb | 25-sep | 15-oct | 16-mar | 25-sep | 20-oct | 17-mar |
| Desviación estàndar | 66.74 | 50.95 | — | 52.82 | 33.49 | 53.77 | 60.76 | 60.87 | 55.67 | 83.87 | 65.27 | 48.12 |
| Mediana | 225 | 255 | — | 270 | 285 | 60 | 270 | 285 | 90 | 285 | 285 | 75 |
| Longitud del vector medio (r) | 0.51 | 0.67 | — | 0.65 | 0.84 | 0.64 | 0.57 | 0.57 | 0.62 | 0.34 | 0.52 | 0.70 |
| Rayleigh test (p) | 0.00 | 0.00 | — | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.05 | 0.00 | 0.00 |
| Murrapal puro | ||||||||||||
| Observaciones | 77 | 103 | 50 | |||||||||
| Ángulo medio (μ) | 95.08 | 157.74 | 313.34 | |||||||||
| Fecha media | 06-abr | 09-jun | 14-nov | |||||||||
| Desviación estándar | 101.40 | 81.41 | 47.64 | |||||||||
| Mediana | 75 | 135 | 330 | |||||||||
| Longitud del vector medio (r) | 0.21 | 0.36 | 0.71 | |||||||||
| Rayleigh test (p) | 0.04 | 0.00 | 0.00 | |||||||||
Los ángulos medios para los frutos verdes en el murrapal mixto fueron significativos en todos los casos, con valores de r entre 0.52 y 0.84 (Cuadro 1); igual sucedió con el pico que ocurrió en el murrapal puro. También se encontraron diferencias significativas de los ángulos medios entre 2000 y 2001 (F [1 183]=14.80, p<0.05), entre 2000 y 2007 (F [1 169]=7.32, p<0.05), y entre 2000 y 2008 (F [1 157]=7.67, p<0.05). En general, los picos máximos de producción de frutos verdes en el murrapal mixto ocurrieron entre septiembre y noviembre de cada año; mientras que en el murrapal puro tuvo lugar en el mes de junio (Fig. 1b).
Las épocas de mayor producción de frutos maduros en el murrapal mixto, durante 2001, 2007 y 2008, se evidenciaron entre febrero y abril, con valores de r entre 0.62 y 0.70 (Cuadro 1); asimismo, en 2009 se presentó un pico durante dichos meses (Fig. 1c). Durante el año 2000 prácticamente no se observaron frutos, por lo que no se evaluó la estacionalidad en dicho lapso. En el murrapal puro, el pico de producción se registró en noviembre de 2000. Para esta fenofase, los ángulos medios sólo mostraron diferencias significativas entre 2001 y 2008 (F [1,84]=7.338, p<0.05).
La duración de cada estructura reproductiva fue variable. El tiempo medio de permanencia de la espata, desde su aparición hasta que se rompe y expone las flores, fue 23.10 días (desviación estándar DE=9.22); para la fenofase flores, fue 12.52 días (DE=3.83). Los frutos verdes tuvieron una duración media de 151.35 días (DE=36.10), mientras que la duración de los frutos maduros fue 42.02 días (DE=13.96). El tiempo transcurrido desde la aparición de una espata hasta la maduración y caída de sus frutos fue, en promedio, 228.9 días (Cuadro 2).
Duración de las estructuras reproductivas de Euterpe oleracea
| Estructura reproductiva | Duración media (días) | Desviación estándar | Coeficiente de variación (%) | Intervalo de confianza (95%) | Valor mínimo | Valor máximo | n | |
|---|---|---|---|---|---|---|---|---|
| Límite inferior | Límite superior | |||||||
| Espata | 23.10 | 9.22 | 39.96 | 19.72 | 42.00 | 10.0 | 42.00 | 45 |
| Flores | 12.52 | 3.83 | 30.58 | 11.47 | 25.00 | 9.00 | 25.00 | 62 |
| Frutos verdes | 151.35 | 36.10 | 23.86 | 141.55 | 263.00 | 62.50 | 263.00 | 103 |
| Frutos maduros | 42.02 | 13.96 | 33.21 | 38.16 | 86.00 | 20.00 | 86.00 | 88 |
Generalmente, se observaron 1 o 2 estructuras reproductivas simultáneas por individuo en igual estado de desarrollo; en pocos casos se encontraron 3 de ellas (Figs. 2a, b). No todas las espatas alcanzaron la fase frutos maduros. En el murrapal mixto, 65.3% se convirtió en frutos verdes y sólo 15.6% alcanzó su maduración (que equivale al 23.84% de los racimos con frutos verdes); en el murrapal puro, 68.8% se desarrolló hasta frutos verdes y 22.8% alcanzó la condición de frutos maduros. El porcentaje de palmas con infrutescencias maduras fue más alto en el murrapal puro (Fig. 2b). Con base en los registros de 2000 y 2001, estos resultados reflejan un alto porcentaje de aborto de frutos durante su desarrollo, especialmente en el murrapal mixto.
Como se mencionó anteriormente, las fenofases, por lo general se relacionan más con la disponibilidad de agua en el suelo que con la precipitación; en estos bosques inundables dicha disponibilidad depende del nivel del río Atrato. Desafortunadamente, estos registros son escasos y se restringen al primer periodo de seguimiento fenológico (1999-2001). Por lo anterior, se utilizó la precipitación como variable sustituta de la disponibilidad de agua en el suelo, pues su relación con el nivel del río durante el periodo citado fue significativa (r=0.76; p=0.0000). Un análisis similar, pero con datos climáticos históricos, correspondientes a un lapso de 15 años (1985-2000), arrojó una correlación menor, pero aun significativa (r=0.64, p<0.000), lo cual confirma que la precipitación local ejerce una influencia evidente sobre el nivel del río en este sitio.
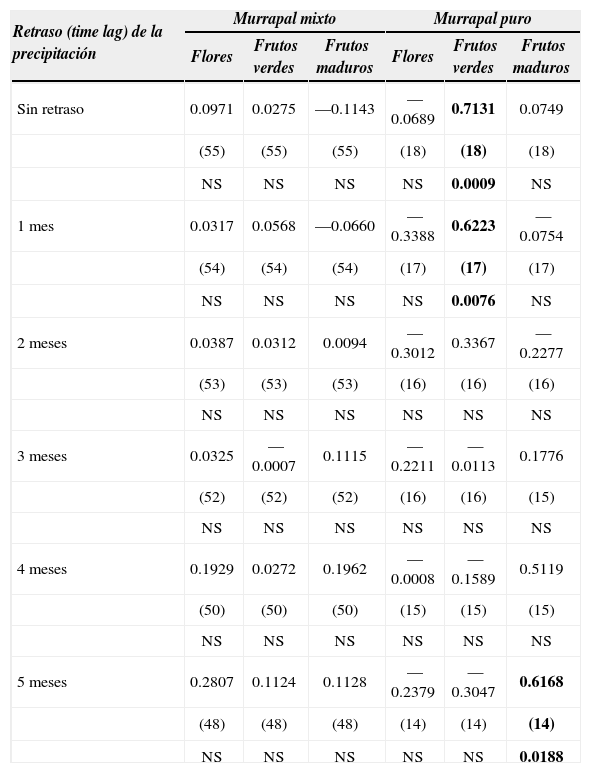
La precipitación fue menor durante los primeros meses del año (enero-marzo). En el murrapal mixto no se encontró relación significativa entre las proporciones de individuos que presentaban cada fenofase y la precipitación ni con la precipitación mensual retrasada hasta 10 meses. Sin embargo, en el murrapal puro se encontraron correlaciones significativas entre la producción de frutos verdes y la precipitación sin retraso temporal, así como entre la producción de frutos maduros y la precipitación con un retraso de 5 meses (Cuadro 3).
Relaciones entre la precipitación y la ocurrencia de las diferentes fenofases de Euterpe oleracea. El valor superior corresponde el coeficiente de correlación de Pearson (r), el valor entre paréntesis indica el número de observaciones y el valor inferior muestra la significancia estadística de cada correlación
| Retraso (time lag) de la precipitación | Murrapal mixto | Murrapal puro | ||||
|---|---|---|---|---|---|---|
| Flores | Frutos verdes | Frutos maduros | Flores | Frutos verdes | Frutos maduros | |
| Sin retraso | 0.0971 | 0.0275 | —0.1143 | —0.0689 | 0.7131 | 0.0749 |
| (55) | (55) | (55) | (18) | (18) | (18) | |
| NS | NS | NS | NS | 0.0009 | NS | |
| 1 mes | 0.0317 | 0.0568 | —0.0660 | —0.3388 | 0.6223 | —0.0754 |
| (54) | (54) | (54) | (17) | (17) | (17) | |
| NS | NS | NS | NS | 0.0076 | NS | |
| 2 meses | 0.0387 | 0.0312 | 0.0094 | —0.3012 | 0.3367 | —0.2277 |
| (53) | (53) | (53) | (16) | (16) | (16) | |
| NS | NS | NS | NS | NS | NS | |
| 3 meses | 0.0325 | —0.0007 | 0.1115 | —0.2211 | —0.0113 | 0.1776 |
| (52) | (52) | (52) | (16) | (16) | (15) | |
| NS | NS | NS | NS | NS | NS | |
| 4 meses | 0.1929 | 0.0272 | 0.1962 | —0.0008 | —0.1589 | 0.5119 |
| (50) | (50) | (50) | (15) | (15) | (15) | |
| NS | NS | NS | NS | NS | NS | |
| 5 meses | 0.2807 | 0.1124 | 0.1128 | —0.2379 | —0.3047 | 0.6168 |
| (48) | (48) | (48) | (14) | (14) | (14) | |
| NS | NS | NS | NS | NS | 0.0188 | |
La poca regularidad observada en la ocurrencia anual de flores probablemente no se debe a un patrón irregular, sino que es consecuencia del poco tiempo requerido para su desarrollo y conversión a la fenofase posterior. En efecto, la floración fue tan efímera que, en la mayoría de los casos, ocurrió entre una observación y la siguiente, pasando de espata a frutos verdes sin haber sido registrada. De igual forma, el rápido desarrollo de la flor no refleja la verdadera sincronía de la fenofase, ya que, aunque parece comportarse de forma asincrónica, la aparición de frutos verdes sí fue sincrónica (Figs. 1a, b) y necesariamente debió ser precedida por un evento de floración sincronizado. Estos resultados sugieren que el adecuado registro de la floración requiere monitoreo más frecuente, al menos semanal y preferiblemente diario.
La baja sincronía observada en los frutos maduros puede ocurrir por 2 causas principales: 1) el alto porcentaje de frutos verdes abortados, lo que sucede probablemente por la alta demanda energética requerida para su crecimiento y maduración (Ataroff y Schwarzkopf, 1992). No obstante, las causas de los abortos no están bien determinadas y deberían evaluarse en investigaciones posteriores, no sólo por su efecto sobre la demografía de la especie, sino también por su importancia económica para el suministro de frutos cosechables; 2) la alta variabilidad temporal de la duración de la fenofase frutos verdes (intervalo de confianza del 95% entre 141.6 y 263 días [Cuadro 2]) hace que durante gran parte del año se encuentren frutos verdes en proceso de maduración.
A nivel poblacional, la floración y fructificación de E. oleracea presentó picos de máxima producción cada año, lo que da lugar a un patrón fenológico anual, de acuerdo con la clasificación de Newstrom et al. (1994). Aunque no se tomaron datos entre los años 2002 y 2006, los resultados obtenidos a través de la estadística circular son contundentes en detectar un patrón anual. Por ello, existe una alta probabilidad de que el patrón fenológico durante este periodo siguió el mismo comportamiento.
En otros estudios desarrollados en el estuario amazónico (Jardim y Anderson, 1987) y en el Pacífico colombiano (Urrego y del Valle, 2001), también se hallaron patrones anuales de la fenología reproductiva de la especie. Igualmente, otras especies del género, como E. precatoria Mart. (Arecaceae) (Cabrera y Wallace, 2007) y E. edulis Mart. (Arecaceae) (Talora y Morellato, 2000; Petene y Piña-Rodrigues, 2005; Castro et al., 2007), han evidenciado picos de mayor actividad cada año, lo que parece ser un comportamiento generalizado para el género Euterpe.
A pesar de que el patrón reproductivo de E. oleracea fue anual, los picos de floración y fructificación en el murrapal mixto no se correlacionaron con la precipitación (expresión indirecta del nivel del río). Este resultado difiere de la alta sincronía, comúnmente reportada, en la floración durante las épocas de máxima inundación en este tipo de ecosistemas (Schöngart et al., 2002; Mony et al., 2010). De esta manera, la vegetación entra en un estado de latencia que le permite evadir los efectos negativos del exceso de agua. También se ha reportado alta fructificación de algunas especies durante estos periodos, asociada principalmente con síndromes de dispersión de semillas por agua y peces (Kubitzki y Ziburski, 1994; Cattanio et al., 2004).
No obstante, existen especies de árboles que producen flores y frutos de manera continua, independientemente de las fluctuaciones del nivel del río (Oliveira y Piedade, 2002); incluso, algunas especies sometidas a diferentes niveles de inundación no exhiben diferencias en su comportamiento fenológico (Ferreira, 1991; Marques y Oliveira, 2008). Con base en resultados similares en diferentes especies de árboles de los bosques inundables de la Amazonia, Ferreira y Parolin (2007) concluyeron que la inundación no es el único factor que explica los cambios en la fenología reproductiva en estos ecosistemas. La falta de relación significativa entre precipitación y proporción de individuos con flores o frutos en el murrapal mixto, responde probablemente a la habilidad de E. oleracea para eludir los efectos de la inundación. Esta especie coloniza áreas inundables y desarrolla neumatóforos (Henderson y Galeano, 1996), que facilitan el movimiento de oxígeno entre raíces, hojas y tallos (Kimmins, 1997). Su sistema radical es considerado, anatómica y fisiológicamente, como uno de los mejor adaptados a condiciones hipóxicas (de Carvalho et al., 1998; Cattanio et al., 2004).
Contrario a lo esperado, a pesar de la proximidad geográfica entre los dos bosques estudiados (cerca de 2km), las épocas de producción de flores y frutos fueron diferentes entre estos ecosistemas; al menos durante el año 2000 (Figs. 1a-c). Además, se presentó alta correlación entre la precipitación (y, por tanto, el nivel de inundación) y la producción de frutos en el murrapal puro. Por su parte, la falta de correlación entre la floración y la precipitación en este ecosistema, se debe probablemente a que la frecuencia mensual de monitoreo no logró captar adecuadamente los eventos de floración, debido a su corta duración. En este ecosistema, donde la inundación es permanente, la máxima producción de frutos verdes ocurrió durante la época de mayor precipitación (Cuadro 3), lo que sugiere (dado el corto tiempo necesario para el desarrollo de la flor) que la mayor producción de flores también ocurrió durante este lapso, que corresponde al periodo de mayor intensidad y duración de la inundación.
Según se mencionó anteriormente, algunos estudios desarrollados en el estuario amazónico, como el de Cattanio et al. (2004), plantean que E. oleracea es una de las especies mejor adaptadas a suelos inundables gracias a sus neumatóforos; no obstante, el nivel y duración de la inundación parecen afectar la producción de flores y frutos. En los periodos de mayor inundación, el agua puede alcanzar niveles que superan los 4m por encima de la superficie del suelo en el murrapal puro; en estas condiciones el cono de raíces y los neumatóforos de E. oleracea permanecen sumergidos por largo tiempo.
Varios estudios, como el de Blom et al. (1990) plantean que algunas especies pueden cambiar el tiempo de reproducción para sobrevivir a la inundación y que la producción de flores resulta favorecida durante estos periodos. Mony et al. (2010) al evaluar estrategias reproductivas para tolerar la inundación en bosques pantanosos, encontraron que algunas especies produjeron un mayor número de flores y permanecían en estado de latencia a medida que aumentaba la duración de la inundación. Este fenómeno también podría estar ocurriendo en E. oleracea en el murrapal puro, donde la inundación aparentemente es el principal factor que controla el crecimiento y la fenología de la especie. Contrariamente, en el murrapal mezclado no se encontraron correlaciones significativas entre las fenofases reproductivas y la precipitación, debido probablemente a que la inundación en este bosque no actuó como factor limitante para la especie, ya que las raíces y neumatóforos permanecen por encima del nivel máximo de inundación durante los lapsos de mayor precipitación.
Los autores agradecen al Departamento Administrativo de Ciencia, Tecnología e Innovación (COLCIENCIAS) por el financiamiento parcial a esta investigación, mediante el contrato 404/1998: Fundamentos biológicos para el aprovechamiento sostenible de productos de las especies Euterpe oleracea y Oenocarpus bataua en la región del Medio Atrato, Colombia y el programa Jóvenes Investigadores e Innovadores 2007; así como por la Dirección Nacional de Investigaciones de la Universidad Nacional de Colombia, por medio del proyecto 30803997: Estructura y dinámica de bosques inundables en el Pacífico Colombiano. También expresan su gratitud a la Corporación para el Desarrollo Sostenible del Urabá (CORPOURABA), subregional Atrato, por el apoyo logístico; los consejos comunitarios de San Miguel y San Martín (Vigía del Fuerte, Antioquia, Colombia) y al guía de campo Arquímedes Quinto Mosquera.