En el presente estudio se exponen datos sobre riqueza de especies, temporada de vocalización y microhábitats utilizados por las especies durante las emisiones acústicas en un ensamble de anuros en San Cosme, Corrientes, Argentina. Se realizaron 22 muestreos desde octubre de 2010 hasta septiembre de 2011. Se seleccionaron 4 ambientes, en los cuales se aplicaron las técnicas: relevamientos de encuentros visuales y transectos de bandas auditivas. Se registró un total de 27 especies pertenecientes a 5 familias: Hylidae (11), Leptodactylidae (13), Microhylidae (1), Odontophrynidae (1) y Bufonidae (1). Se le asignó a cada especie un patrón de acuerdo con el periodo de vocalización: prolongado, intermedio y explosivo. La mayoría de las especies presentó un patrón de vocalización intermedio y 3 especies mostraron patrón de vocalización prolongado. El mayor número de especies se registró en diciembre de 2010 y el menor en junio y julio de 2011. El número de machos en actividad de vocalización se vio influenciado por la temperatura media diaria y la temperatura media mensual. Sin embargo, la actividad reproductiva ha sido confirmada solamente en un 37% de las especies. La distribución espacial resultó más importante que la temporal para explicar la coexistencia de las especies del ensamble estudiado.
In this study is presented information about species richness, vocalization season and calling site used in anurans assemblage located in San Cosme, Corrientes, Argentina. A total of 22 samplings were made between October of 2010 and September of 2011. Four sites were selected and the techniques applied were: visual encounter surveys and auditives bands transects. A total of 27 species of anurans were registered belonging to 5 families: Hylidae (11), Leptodactylidae (13), Microhylidae (1), Odontophrynidae (1) and Bufonidae (1). Three patterns with regard to vocalization season were assigned: prolonged, intermediate and explosive. Most of the species (20) showed intermediate vocalization pattern and 3 species showed prolongated vocalization pattern. The largest aggregations were observed in December of 2010 and the smallest in June and July of 2011. The number of males in activity of vocalization was influenced by the daily mean temperature and monthly mean temperature. Also, the reproductive activity was registered only in 37% of anurans species. Spatial distribution was more important than temporal distribution to explain the coexistence of this anuran assemblage.
Los anuros comprenden un grupo cosmopolita y altamente diverso en la región Neotropical. En la provincia de Corrientes, Argentina, están representados un 34% de los anfibios presentes en dicho país, con un total de 56 especies de anuros (Álvarez et al., 2002). Como consecuencia de esta alta diversidad, y debido a que los anuros forman agregados conspicuos durante la época reproductiva, son usualmente utilizados en estudios ecológicos (Duellman y Trueb, 1986).
Durante la estación reproductiva, la partición y la sobreposición en la utilización de los recursos en una comunidad se vuelven más intensos (Bertoluci y Rodrigues, 2002). Las especies de una comunidad pueden presentar partición espacial y/o temporal completa o superposición en distintos grados en el uso de los recursos (Rossa-Feres y Jim, 2001). La partición temporal puede estar directamente relacionada con las condiciones físicas de la región. En algunas especies, la temporada reproductiva está directamente relacionada con la temperatura ambiente y con la disponibilidad de ambientes acuáticos que son utilizados para la reproducción (Bernarde y Anjos, 1999).
Diversos estudios indican que ambientes complejos o heterogéneos permiten la coexistencia de un mayor número de especies de anuros que ambientes homogéneos, por proveer una mayor diversidad de microhábitats (Cardoso et al., 1989; Pombal, Jr., 1997; Bernarde y Kokubum, 1999). Es por ello, que la forma en que las especies se distribuyen en el ambiente puede influenciar en la toma de decisiones sobre la conservación de diferentes hábitats (Pombal, Jr., 1997; Vasconcelos y Rossa-Feres, 2005).
La actividad de vocalización constituye el mecanismo primario de comunicación en los anuros y está relacionado a la actividad reproductiva. Dentro de un ensamble de anuros, diferentes especies vocalizan en distintos microhábitats y la elección de los mismos puede estar relacionada a las necesidades impuestas por los modos reproductivos, a adaptaciones morfológicas, fisiológicas y conductuales de cada especie (Prado et al., 2005). Las vocalizaciones en los anuros, además de facilitar el monitoreo poblacional y permitir estimar la abundancia de machos, sirve para localizar los posibles sitios de reproducción de las especies (Scott y Woodward, 2001; Zimmerman, 2001).
Se pueden citar numerosos estudios a cerca de comunidades de anuros en Brasil, en los que se estudian los sitios de vocalización, hábitats para la reproducción y periodos o turnos de vocalización (Cardoso et al., 1989; Heyer et al., 1990; Rossa-Feres y Jim, 1994; Pombal, Jr., 1997; Bertoluci y Rodrigues, 2002, entre otros). En cambio, en Argentina, son escasos los trabajos sobre ensambles de anuros, destacándose los de Basso (1990); Perotti (1997); Vaira (2001); Sánchez et al. (2007); Stellatelli y Vega (2010); Gangenova et al. (2012) y Lescano et al. (2013).
En este marco, el presente trabajo describe la composición de un ensamble de anuros de la provincia de Corrientes, analiza la temporada de vocalización y la influencia que tienen los factores abióticos (temperatura, humedad y precipitaciones) sobre la misma, así como también registra el microhábitat utilizado por las especies para la actividad de vocalización y las evidencias que indiquen el posible periodo reproductivo de las mismas.
Materiales y métodosÁrea de estudio. El trabajo de campo se realizó en una estancia privada llamada Santa Catalina, localizada en el departamento San Cosme, provincia de Corrientes (27°25'42” S, 58°37'59” O). Fitogeográficamente el área de estudio se encuentra en el distrito Chaqueño Oriental dentro de la provincia Chaqueña (Cabrera, 1976). El clima es caracterizado como Subtropical o Mesotermal (Carnevalli, 1994), con un gradiente de temperatura media anual que oscila entre los 19.5–21° C, siendo enero el mes más cálido. Las temperaturas máximas absolutas del verano se ubican entre los 42– 46° C y las mínimas en invierno entre 1–5.5° C. Las lluvias son irregulares a lo largo de todo el año, presentando su nivel mínimo en el invierno (Bruniard, 1999).
Trabajo de campo. Dentro del área de estudio se seleccionaron los siguientes ambientes: a) restos de bosque higrófilo: compuesto principalmente por quebracho blanco (Aspidosperma quebracho-blanco) y quebracho colorado (Schinopsis balansae), timbó (Enterolobium contortisiluquum), espinillo o ñandubay (Prosopis afinis), aromito (Acacia caven). Estos bosquecillos son pequeños, generalmente se inundan y retienen gran cantidad del agua de lluvia; b) pastizales altos: compuestos, principalmente por paja colorada (Andropogon lateralis) y pasto bahia (Paspalum notatum), entre los pastizales se hallan algarrobillos aislados (Prosopis sp.) y algunas palmeras como el cocotero (Acrocomia aculeata) y el pindó (Syagrus romansoffianum); c) pastizales bajos: compuestos, principalmente por pasto bahía (P. notatum), cipero (Cyperus entrerrianus), entre otros, estos pastizales bajos suelen inundarse durante la temporada lluviosa y se forman cuerpos de aguas temporarios en ciertas zonas, y d) laguna y zonas inundables cercanas a la misma: con abundante vegetación acuática (camalotes (Eichhornia sp.), helechitos de agua (Salvinia sp.), entre otras, y marginal (Cyperus giganteus, C. entrerrianus, Thalia geniculata, Hypomoea fistulosa, Ludwigia sp., Eryngium sp.).
Muestreos. Se realizaron 22 muestreos sistemáticos con una frecuencia quincenal durante octubre de 2010 y septiembre de 2011. Para ello, se trazaron 12 transectos de 100m de longitud y 10m de ancho cada uno, los cuales fueron distribuidos en un número de 3 en cada ambiente. A lo largo de los mismos se aplicaron las técnicas de “relevamiento por encuentros visuales” (Crump y Scott, 2001) y “transectos de bandas auditivas” (Zimmerman, 2001). Éstos fueron recorridos durante el horario preestablecido para el muestreo, de 17:00 a 22:00h, procurando muestrear todas en diferentes franjas horarias. A lo largo de los mismos, se registraron las especies escuchadas y observadas, así como la presencia de puestas de huevos, larvas o juveniles y, en el caso de los machos se registró el sustrato o microhábitat utilizado para la emisión del canto, describiendo las características del mismo. Se colectó una muestra mínima de cada especie, en especial de aquellos individuos cuya identidad resultó dudosa a primera vista. Con el fin de correlacionar la actividad de las especies con las variables ambientales, los datos se tomaron de 2 fuentes, en primer lugar in situ, temperatura ambiental y humedad ambiente, mediante un termohigrómetro digital y, en segundo lugar, en la Estación Meteorológica Corrientes; temperatura, precipitación y humedad media mensual; situada en el Aeropuerto Internacional “Dr. Fernando Piragine Niveyro”, localizado aproximadamente a unos 10km del lugar de muestreo por Ruta Nacional 12,km 7 (27°26'57” S, 58°45'31” O).
Trabajo de laboratorio. Los ejemplares recolectados fueron sacrificados siguiendo el protocolo establecido en la guía para la eutanasia animal propuesta por la AVMA (American Veterinary Medical Association, 2007). Posteriormente, fueron fijados con formol bufferado al 10%, identificados e incorporados a la Colección Herpetológica Corrientes de la Facultad de Ciencias Exactas y Naturales y Agrimensura-UNNE, acrónimo: UNNEC (Apéndice). En el caso de las hembras, fueron diseccionadas en la región abdominal para evaluar la presencia de ovocitos maduros, los cuales fueron identificados siguiendo a Valdez-Toledo y Pisanó (1980).
Ejemplares incorporados a la Colección Herpetológica Corrientes de la Facultad de Ciencias Exactas y Naturales y Agrimensura-UNNE.
| Género y especie | UNNEC |
|---|---|
| Dendropsophus nanus | 11782 11785 11787 11800 11819 11821 |
| Dendropsophus sanborni | 11779 11783 11786 11788 11789 11790 11791 11801 11805 11806 11808 11818 11822 |
| Lysapsus limellum | 11808 11810 11811 11812 |
| Pseudis platensis | 11770 |
| Scinax fuscomarginatus | 11780 |
| Scinax nasicus | 11778 11813 11814 11816 11817 |
| Scinax acuminatus | 11793 11795 11797 11794 11796 |
| Physalaemus albonotatus | 11773 11777 11781 |
| Physalaemus santafecinus | 11771 11775 11815 |
| Leptodactylus chaquensis | 11769 11792 |
| Leptodactylus elenae | 11774 11776 |
| Leptodactylus latinasus | 11772 |
| Elachistocleis bicolor | 11825 |
Análisis de datos. Los patrones de vocalización fueron clasificados como Prolongado, cuando vocalizan durante 5 meses o más (Crump, 1974), intermedio, si vocalizan desde 2 semanas hasta 5 meses (Wells, 1977) y Explosivo cuando la vocalización sucede durante cortos periodos de tiempo, varias veces al año (Wells, 1977).
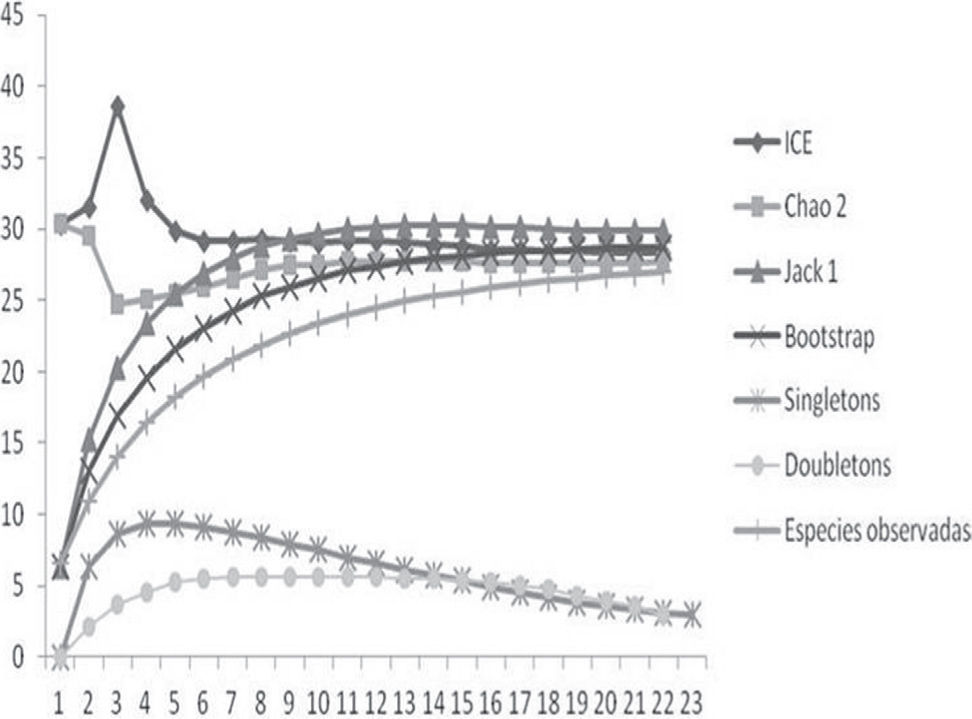
Se calculó la diversidad alfa, como la riqueza o número total de especies encontradas en cada uno de los 4 ambientes. La eficiencia de los muestreos en los distintos ambientes, así como en la totalidad de los sitios analizados, se estableció mediante la comparación de la riqueza observada y un valor de riqueza teórico obtenido a partir de estimadores no paramétricos (bootstrap, Jacknife 1, ICE y Chao 2), los cuales se calcularon utilizando el software EstimateS, versión 8.2.0 (http://viceroy.eeb.uconn.edu/estimates) (Colwell, 2006). Todos los estimadores se corrieron con 999 permutaciones y se calcularon las especies raras o únicas (singletons) y duplicadas (doubletons), para determinar si se reducían a medida que avanzaba el muestreo. Con base en los valores máximos de riqueza estimados y asumiendo este valor como el 100%, se determinó el porcentaje de representatividad de las especies encontradas durante el estudio (Soberón y Llorente, 1993).
Se utilizó el índice de Similitud Cualitativo de Jaccard para determinar el grado de similitud entre los 4 ambientes con respecto a las especies presentes en ellos, y para determinar la semejanza entre las especies con respecto al microhábitat utilizado para la actividad de vocalización. Por último, se utilizó el coeficiente de correlación no paramétrico de Spearman (rs) (Zar, 1999) con significancia del 5% para verificar la existencia de una relación entre las variables ambientales; temperatura media diaria, temperatura media mensual, humedad media diaria, humedad media mensual y precipitaciones medias mensuales; y el número de machos en actividad de vocalización mediante el software Past, version v1.99 (http://folk.uio.no/ohamer/past) (Hammer et al., 2001).
ResultadosRiqueza y diversidad de especies. Se registraron 27 especies correspondientes a 5 familias (Bufonidae, Odontophrynidae, Hylidae, Leptodactylidae, Microhylidae) pertenecientes a 12 géneros. Hylidae (41%) y Leptodactylidae (48%) fueron las familias con mayor número de especies (Cuadro 1).
Especies de anuros registradas en los 4 ambientes estudiados (bosque, pastizal alto, pastizal bajo y laguna), en la estancia Santa Catalina, San Cosme, provincia de Corrientes, Argentina
| Especies | Bosque | Pastizal alto | Pastizal bajo | Laguna |
|---|---|---|---|---|
| Bufonidae | ||||
| Rhinella bergi | X | |||
| Odontophrynidae | X | |||
| Odontophrynus americanus | X | |||
| Hylidae | ||||
| Dendropsophus nanus | X | X | ||
| Dendropsophus sanborni | X | X | ||
| Hypsiboas pulchellus | X | |||
| Hypsiboas raniceps | X | |||
| Phyllomedusa azurea | X | |||
| Lysapsus limellum | X | |||
| Pseudis platensis | X | |||
| Scinax acuminatus | X | |||
| Scinax fuscomarginatus | X | X | ||
| Scinax nasicus | X | X | ||
| Scinax squalirostris | X | X | ||
| Leptodactylidae | ||||
| Physalaemus albonotatus | X | X | ||
| Physalaemus santafecinus | X | X | ||
| Pseudopaludicola boliviana | X | X | ||
| Pseudopaludicola falcipes | X | X | ||
| Leptodactylus chaquensis | X | X | X | |
| Leptodactylus elenae | X | X | ||
| Leptodactylus bufonius | X | X | X | |
| Leptodactylus gracilis | X | |||
| Leptodactylus fuscus | X | X | ||
| Leptodactylus latinasus | X | X | ||
| Adenomera diptyx | X | X | ||
| Leptodactylus latrans | X | X | ||
| Leptodactylus podicipinus | X | |||
| Microhylidae | ||||
| Elachistocleis bicolor | X | X | ||
| Núm. total especies por ambiente | 6 | 4 | 20 | 16 |
Según los estimadores de riqueza bootstrap, Jacknife 1, ICE y Chao 2, la representatividad del muestreo osciló entre el 90 y el 97% de las especies esperadas para el área de estudio. A medida que avanzó el muestreo, las especies únicas (singletons) mostraron una clara reducción en número, mientras que la disminución fue leve para el número de especies duplicadas (doubletons), lo cual prueba la eficiencia del muestreo (Fig. 1).
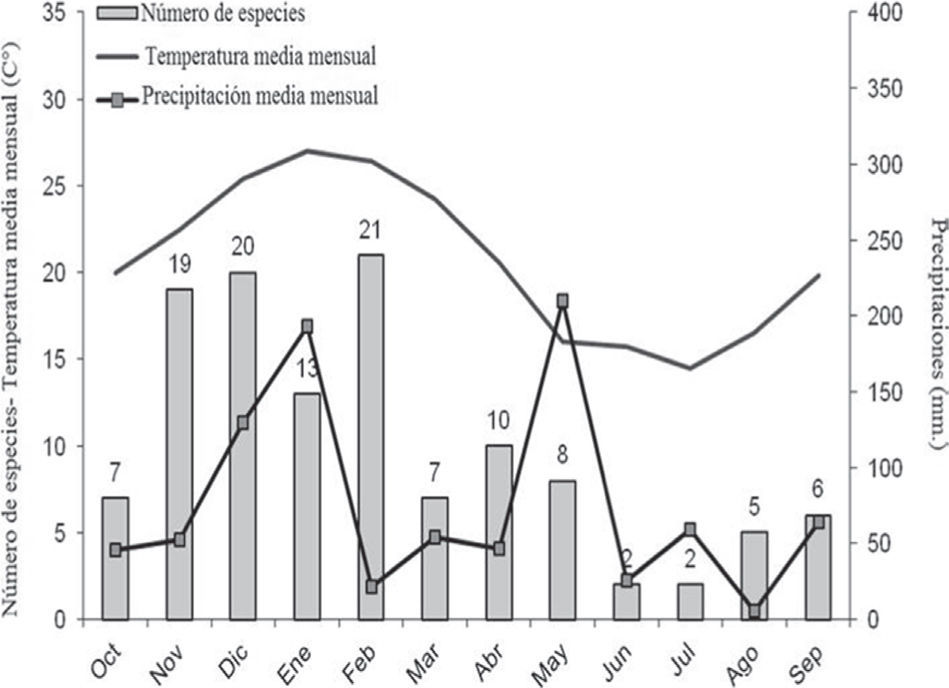
La diversidad alfa fue mayor en el pastizal bajo, con un total de 20 especies; en la laguna se registraron un total de 16; 6 en el bosque y 4 especies en el pastizal alto (Cuadro 1). Según los estimadores de riqueza calculados para cada uno de los ambientes, la representatividad del muestreo osciló entre 75.8 y 100%. La mayor riqueza de especies fue registrada entre los meses de noviembre y febrero de 2010 y la menor riqueza en los meses de junio y julio de 2011 (Fig. 2).
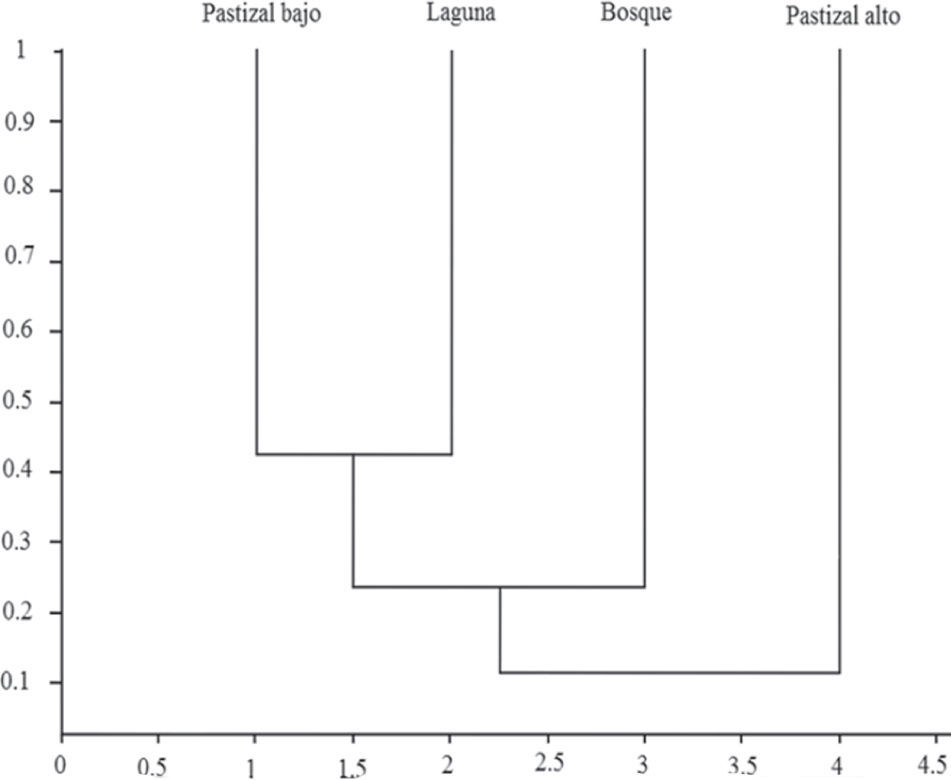
El índice de similitud cualitativo de Jaccard arrojó un valor de Ij=0.42 entre el pastizal bajo y la laguna, ya que representaron los ambientes con más especies en común, y un valor de Ij=0.00 entre la laguna y el pastizal alto, debido a la ausencia de especies compartidas entre ambos (Fig. 3)
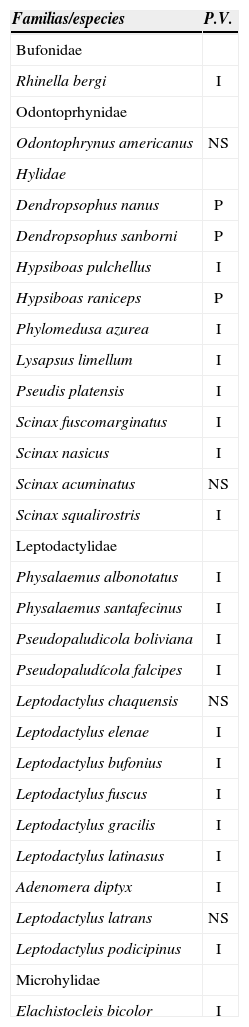
Actividad de vocalización. Del total de especies, 23 fueron registradas emitiendo vocalizaciones. De éstas, 20 mostraron patrón de vocalización Intermedio, 3 de vocalización Prolongado, y no se pudo asignar un patrón de vocalización para 4 de las especies, ya que no han sido registradas emitiendo vocalizaciones (Cuadro 2).
Patrones con respecto a la temporada de vocalización (P.V.): I=intermedio, P=prolongado, NS=no se pudo determinar
| Familias/especies | P.V. |
|---|---|
| Bufonidae | |
| Rhinella bergi | I |
| Odontoprhynidae | |
| Odontophrynus americanus | NS |
| Hylidae | |
| Dendropsophus nanus | P |
| Dendropsophus sanborni | P |
| Hypsiboas pulchellus | I |
| Hypsiboas raniceps | P |
| Phylomedusa azurea | I |
| Lysapsus limellum | I |
| Pseudis platensis | I |
| Scinax fuscomarginatus | I |
| Scinax nasicus | I |
| Scinax acuminatus | NS |
| Scinax squalirostris | I |
| Leptodactylidae | |
| Physalaemus albonotatus | I |
| Physalaemus santafecinus | I |
| Pseudopaludicola boliviana | I |
| Pseudopaludícola falcipes | I |
| Leptodactylus chaquensis | NS |
| Leptodactylus elenae | I |
| Leptodactylus bufonius | I |
| Leptodactylus fuscus | I |
| Leptodactylus gracilis | I |
| Leptodactylus latinasus | I |
| Adenomera diptyx | I |
| Leptodactylus latrans | NS |
| Leptodactylus podicipinus | I |
| Microhylidae | |
| Elachistocleis bicolor | I |
El número de machos en actividad de vocalización estuvo correlacionado con la temperatura media mensual (rs=0.810, p=0.001) y con la temperatura media diaria (rs=0.749, p=0.000), pero no se obtuvo relación con las precipitaciones medias mensuales (rs=0.380; p=0.223), con la humedad media diaria (rs=−0.404; p=0.087) ni con la humedad media mensual (rs=−0.554, p=0.062). El mayor número de machos en actividad de vocalización (19 especies) fue registrado en diciembre de 2010 y el menor número (2 especies) en junio de 2011 (Cuadro 3).
Actividad reproductiva. Se ha comprobado la actividad reproductiva mediante el registro de parejas en amplexo, hembras con huevos maduros, desoves, presencia de larvas o juveniles, en las siguientes especies: Dendropsophus nanus, D. sanborni, Scinax nasicus, Physalaemus albonotatus, Physalaemus santafecinus, Pseudopaludicola falcipes, Leptodactylus chaquensis, Elachistocleis bicolor, Hypsiboas raniceps y Lysapsus limellum (Cuadro 3).
Especies de anuros halladas en la estancia Santa Catalina, San Cosme, Corrientes, Argentina, durante octubre del 2010 a septiembre del 2011. V= especies registradas visualmente sin vocalizar, A= especies registradas en actividad de vocalización; otras evidencias de reproducción: L= larvas, J= juveniles, •= hembras con huevos maduros
| Familias/especies | Oct | Nov | Dic | Ene | Feb | Mar | Abr | May | Jun | Jul | Ago | Sep |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Bufonidae | ||||||||||||
| Rhinella bergi | ||||||||||||
| Odontoprhynidae | ||||||||||||
| Odontophrynus americanus | V | V | ||||||||||
| Hylidae | ||||||||||||
| Dendropsophus nanus | V A • | V A • J | V A L J | V A | V A | A | V A | A | ||||
| Dendropsophus sanborni | V A • | V A • J | V A L J | V A | V A | A | V A | A | A | A • | A • | |
| Hypsiboas pulchellus | V A | A | A | A | A | A | ||||||
| Hypsiboas raniceps | A | A | A | V A | A J | A | A | |||||
| Phyllomedusa azurea | A | A | A | |||||||||
| Lysapsus limellum | A | A | V A | A • | V A | A | ||||||
| Pseudis platensis | A | V A | A | A | A | |||||||
| Scinax fuscomarginatus | V A | A | A | A | A | |||||||
| Scinax nasicus | V A • | V A | V A | A L | ||||||||
| Scinax acuminatus | V | |||||||||||
| Scinax squalirostris | A | V A | A | A | A | A | ||||||
| Leptodactylidae | ||||||||||||
| Physalaemus albonotatus | V | V A L | V A | A L J | A | |||||||
| Physalaemus santafecinus | V • | V A | A | V A L J | ||||||||
| Pseudopaludicola boliviana | A | V A | A | |||||||||
| Pseudopaludicola falcipes | V A | A • | A | |||||||||
| Leptodactylus chaquensis | V • | V J | V | V L | ||||||||
| Leptodactylus elenae | V | V A | V A | |||||||||
| Leptodactylus bufonius | A | A | ||||||||||
| Leptodactylus fuscus | A | A | AV | V | ||||||||
| Leptodactylus gracilis | A | A | A | A | ||||||||
| Leptodactylus latinasus | V A | A | V A | V A | A | A | ||||||
| Adenomera diptyx | A | A | V | A | ||||||||
| Leptodactylus latrans | V | V | V | |||||||||
| Leptodactylus podicipinus | A | A | V A | A | A | V | ||||||
| Microhylidae | ||||||||||||
| Elachistocleis bicolor | V • | A L | A L | |||||||||
| Núm. total especies por mes | 7 | 19 | 20 | 13 | 21 | 7 | 10 | 8 | 2 | 2 | 5 | 6 |
| Núm. de machos vocalizando | 7 | 13 | 19 | 10 | 16 | 7 | 8 | 6 | 2 | 3 | 6 | 6 |
Utilización de microhábitats. Fueron reconocidos 6 microhábitats como sitios de vocalización utilizados por las especies del ensamble estudiado (Cuadro 4). El índice de similitud de Jaccard arrojó un valor de Ij=0.375 al comparar los microhábitats 5 y 6, ya que hubo 2 especies que hicieron uso de ambos, y un valor de Ij=0.1 entre el microhábitat 3 y 4, ya que solamente tenían 1 especie en común, los demás no presentaban especies compartidas (Cuadro 4).
Microhábitat utilizado por los machos para la actividad de vocalización: 1) agua; 2) suelo encharcado; 3) suelo no encharcado a más de 10m de algún cuerpo de agua; 4) suelo no encharcado a menos de 10m de algún cuerpo de agua; 5) plantas acuáticas emergentes, arbustos; 6) árboles
| Especies | 1 | 2 | 3 | 4 | 5 | 6 |
|---|---|---|---|---|---|---|
| Rhinella bergi | x | |||||
| Dendropsophus nanus | x | |||||
| Dendropsophus sanborni | x | |||||
| Hypsiboas pulchellus | x | |||||
| Hypsiboas raniceps | x | x | ||||
| Phyllomedusa azurea | x | |||||
| Lysapsus limellum | x | |||||
| Pseudis platensis | x | |||||
| Scinax fuscomarginatus | x | |||||
| Scinax nasicus | x | x | ||||
| Scinax squalirostris | x | |||||
| Physalaemus albonotatus | x | |||||
| Physalaemus santafecinus | x | |||||
| Pseudopaludicola boliviana | x | |||||
| Pseudopaludicola falcipes | x | |||||
| Leptodactylus elenae | x | |||||
| Leptodactylus bufonius | x | |||||
| Leptodactylus gracilis | x | |||||
| Leptodactylus fuscus | x | |||||
| Leptodactylus latinasus | x | x | ||||
| Adenomera diptyx | x | |||||
| Leptodactylus podicipinus | x | |||||
| Elachistocleis bicolor | x | |||||
| Total de especies | 2 | 3 | 5 | 6 | 8 | 2 |
Las especies de anuros del presente estudio representan un 48% del total registrado en la provincia de Corrientes (56 especies) por Álvarez et al (2002). La familia con mayor número de especies fue Leptodactylidae (14), seguida por Hylidae (11), coincidiendo con lo observado en otras zonas dentro de la región neotropical (Duellman y Trueb, 1986). La representatividad alcanzada por el muestreo fue superior al 90%, lo que constituye un valor alto y satisfactorio (Soberón y Llorente, 1993). Las curvas construidas a partir de los estimadores no paramétricos demostraron que el inventario de las mismas estuvo relativamente completo, aunque un mayor número de muestreos podría incrementar el número de especies y reducir los singletons y doubletons.
La variedad de ambientes presentes en el área de estudio y la existencia de cuerpos de agua con duración permanente y temporaria, podrían explicar la alta diversidad de especies registradas. El pastizal bajo y la laguna y zonas inundables cercanas a la misma, fueron los ambientes con más especies compartidas y los que presentaron la mayor riqueza. Esto se podría relacionar al hecho de que ofrecen sitios para la reproducción, sobre todo, a las especies que dependen del agua para la misma, o a que estas especies son más generalistas en el uso del hábitat, y por ello, hacen uso de ambos.
La mayoría de las especies (87%) presentaron patrón de vocalización Intermedio, seguido de un 13% con patrón de vocalización Prolongado. Scinax acuminatus, Leptodactylus latrans, L. chaquensis, Odontophrynus americanus podrían presentar un patrón de vocalización Explosivo, es decir, vocalizar durante cortos periodos de tiempo, probablemente con relación a grandes lluvias. Toledo et al. (2003), en un estudio realizado en Sao Paulo, asignaron un patrón de vocalización Prolongado a D. nanus y D. sanborni, y un patrón de vocalización Intermedio a Leptodactylus fuscus, lo cual coincide con lo observado en el presente estudio.
Durante todos los meses de muestreo fueron halladas especies en actividad de vocalización, pero el mayor número de especies con machos vocalizando fue registrado en los meses más cálidos, de octubre a abril. Sin embargo, se encontraron especies activas en los meses fríos como Hypsiboas pulchellus y Scinax squalirostris. Dendropsophus sanborni se encontró vocalizando tanto en meses fríos como en los más cálidos. Es de destacar que algunas especies filogenéticamente próximas utilizaban periodos de vocalización semejantes, tales como D. nanus y D. sanborni, Pseudis platensis y L. limellum, P. albonotatus y P. santafecinus, lo que demuestra que entre éstas ocurre superposición temporal. Toledo et al. (2003) documentaron el mismo resultado para D. nanus y D. sanborni y mencionaron que en estos casos la diferencia en los cantos sería el principal factor responsable del aislamiento reproductivo; sin embargo, hubo otras especies como H. pulchellus e H. raniceps y S. squalirostris y Scinax fuscomarginatus que no se superponían temporalmente, ya que las primeras vocalizaban en los meses más fríos del año y las segundas en los más cálidos, pero, sin embargo, utilizaban el mismo microhábitat para la actividad de vocalización.
Diversos estudios analizan la importancia de las precipitaciones y/o de la temperatura en la actividad de vocalización de los anuros (Toledo et al., 2003; Conte y Machado, 2005). En el presente estudio, solamente se obtuvo correlación positiva entre el número de machos en actividad de vocalización y la temperatura media mensual y temperatura media diaria. De la misma manera, Conte y Machado (2005) en Paraná, Brasil, encontraron una relación positiva entre la temperatura máxima mensual y la actividad de vocalización de los machos. Sin embargo, Ávila y Ferreira (2004) en Mato Grosso do Sul, Bernarde (2007) en el suroeste del Amazonas y Gomes dos Santos et al (2007) en el sureste de Brasil, encontraron una correlación positiva entre la temporada de vocalización y las precipitaciones. Toledo et al. (2003) en Sao Paulo concluyeron que el número de especies en actividad de vocalización fue influenciado por la pluviosidad total mensual y por la temperatura media mensual.
Sin embargo, la actividad de vocalización en anuros no necesariamente indica que éstos se están reproduciendo (Donelly y Guyer, 1994; Rossa-Feres y Jim, 1994). La actividad reproductiva ha sido registrada en los meses más cálidos y húmedos, tal como es esperado para especies de regiones subtropicales (Cardoso y Haddad, 1992; Haddad y Sazima, 1992).
En el presente trabajo, a pesar de haber registrado 23 especies vocalizando, solamente se corroboró la actividad reproductiva en 10 de ellas. Lo que sugiere que con un incremento del esfuerzo de muestreo se podrían registrar evidencias reproductivas en un mayor número de especies.
El tamaño corporal de las especies actuaría como un factor determinante en la elección del sitio de vocalización (Duellman, 1967). Se observó que las especies más pequeñas como D. nanus y D. sanborni, utilizaban pequeñas ramas de vegetación emergente u hojas de camalote, mientras que las de mayor tamaño utilizaban ramas de arbustos más robustas, como es el caso de H. raniceps e H. pulchellus. El mismo patrón fue observado por Crump (1974) y Pombal, Jr. (1997). Además, diferencias fisiológicas como la resistencia a la pérdida de agua o las oscilaciones de la temperatura, influyen en la elección del sitio de vocalización (Pough et al., 1977). Es por ello, que las especies del género Leptodactylus fueron las únicas que vocalizaron en el pastizal alto, ya que al mantenerse en contacto con el suelo sufrirían menos pérdida de agua. En el presente trabajo se observó que la segregación en el uso del microhábitat no ha sido completa, porque ocurrió superposición espacial entre especies cercanas filogenéticamente y de tamaños similares. Así es que D. nanus y D. sanborni, S. fuscomarginatus y S. squalirostris, H. raniceps y H. pulchellus, Pseudopaludicola boliviana y P. falcipes, P. albonotatus y P. santafecinus utilizaban los mismos sitios para la vocalización. Resultados similares han sido observados por Toledo et al. (2003) en una comunidad de anfibios en Sao Paulo, Brasil.
Según Donelly y Guyer (1994) la partición espacial y/o temporal de los recursos constituye un mecanismo por el cual las especies sintópicas pueden evitar la competencia. No obstante, hay otros aspectos a tener en cuenta que no han sido analizados en el presente trabajo y que pueden jugar un papel importante en la organización de una comunidad de anuros, como son el periodo diario de vocalización (Conte y Machado, 2005), la distribución vertical de las especies (García et al., 2005), las diferencias en las estrategias reproductivas (Perotti, 1994) y las diferencias acústicas (Toledo et al., 2003), entre otros.
A la jefa de la Estación Meteorológica Corrientes, Susana Soto, quien facilitó los datos climáticos.