Analizamos la ecología de Hydrodynastes gigas, una de las serpientes de mayor tamaño en Sudamérica. Estudiamos 342 ejemplares obtenidos durante 21 años de muestreos en rutas, búsquedas intensivas y capturas ocasionales. Las hembras maduraron sexualmente con mayor tamaño corporal que los machos, adicionalmente fueron más largas, tuvieron cabezas más grandes y más escamas ventrales. Los machos tuvieron mayor longitud de cola y más escamas subcaudales. Este dimorfismo sexual, común en serpientes, puede estar relacionado con el aumento del potencial reproductivo. El ciclo reproductivo fue estacional y anual en hembras, mientras que fue continuo y anual en machos. El potencial reproductivo fue alto, 16.3 huevos/hembra/año, con una tendencia a ser mayor en hembras más grandes. Hydrodynastes gigas es diurna y se alimenta de todo tipo de vertebrados frecuentes en los humedales que habita, incluyendo anfibios, reptiles, peces, mamíferos y aves, en orden de importancia. Los individuos se mantuvieron activos todo el año, siendo una de las 4 especies de serpientes más abundantes en las planicies de inundación de grandes ríos sudamericanos. Su abundancia, dieta generalista, gran tamaño y capacidad reproductiva sugieren que esta especie es un importante depredador en los ecosistemas acuáticos de Sudamérica.
We analyzed the ecology of Hydrodynastes gigas, one of the largest snakes of South America, studying 342 specimens obtained during 21 years of field sampling including road sampling, intensive searches and opportunistic encounter methods. Females attained sexual maturity at larger relative body size than males, and were largest, had biggest heads and more ventral scales. Males had larger tails and more subcaudal scales than females. This sexual dimorphism, common among snakes, would be related to an increment in its reproductive potential. The females' reproductive cycle was seasonal and annual; while in males it was continuous and annual. The reproductive potential was high, 16.3 eggs/female/year, with a clear tendency to be higher in larger females. Hydrodynastes gigas is a diurnal snake and preys on all kinds of common vertebrates in wetlands habitats, including amphibians, reptiles, fish, mammals and birds, in order of importance. Individuals were active throughout the year, being one of the 4 most abundant species of snakes in the floodplains of large South American rivers. Due to its abundance, generalist diet, higher size and reproductive potential, we suggest that this species is an important predator in South America's aquatic ecosystems.
El género Hydrodynastes Fitzinger, 1843, comprende 3 especies endémicas de la región Neotropical de Sudamérica que se distribuyen desde la Amazonia hasta el noreste de Argentina (Cunha y Nascimento, 1978, 1993; Giraudo, 2001; Franco et al., 2007). Es un género poco conocido, como lo demuestra la descripción reciente de una nueva especie (Franco et al., 2007). Hydrodynastes gigas (Dúmeril; Bibron y Dúmeril, 1854), denominada ñacaniná por los aborígenes guaraníes, es una de las serpientes sudamericanas más grandes, alcanzando hasta 3m de longitud total (Bernarde y Moura-Leite, 1999). Algunas características intrínsecas de su historia de vida como su gran tamaño corporal y sus necesidades de termorregulación han determinado que sea una especie frecuentemente amenazada por las actividades humanas (Giraudo et al., 2012). En muchos ecosistemas de la región subtropical de Sudamérica esta especie es uno de los depredadores tope más importante, debido a que varios de los grandes mamíferos como el jaguar, Panthera onca, y la nutria gigante, Pteronura brasiliensis, se han extinguido o disminuido por la intervención humana (Giraudo et al., 2007). Por su función como depredadores, las serpientes merecen mayor atención por parte de ecólogos involucrados en el estudio de dinámicas de los ecosistemas (Akani et al., 2003), no obstante, han sido poco estudiadas debido a dificultades para su muestreo, a sus hábitos secretivos y miméticos, bajas densidades, peligrosidad y riesgos durante su manipulación. Hydrodynastes gigas, por ejemplo, ha producido accidentes ofídicos (Seigel, 1993; Salomão et al., 2003). Por otra parte, la mayoría de los estudios ecológicos sobre serpientes se han realizado en el hemisferio norte y en Australia (e. g., Fitch, 1975; Shine, 2003; Vincent y Herrel, 2007), y es un hecho que aspectos de la ecología e historia natural de gran parte de la enorme diversidad de serpientes sudamericanas permanece aún poco conocida, aunque se está avanzando en su conocimiento en las últimas décadas (e. g., Chiaraviglio, 2001; Martins et al., 2002; Bertona y Chiaraviglio, 2003; López y Giraudo, 2008; Pizzatto, 2005; Bellini et al., 2013, 2014). Adicionalmente, varios clados de serpientes neotropicales son endémicos, por ejemplo, la familia Dipsadidae (o subfamilia Dipsadinae, sensuPyron et al., 2013) y la tribu Hydrodynastini, que incluye sólo al género Hydrodynastes (Zaher et al., 2009; Grazziotin et al., 2012). En la familia Dipsadidae, antes denominadas Xenodontinos sudamericanos, se ha documentado una fuerte influencia filogenética sobre diferentes aspectos de su ecología y morfología (Cadle y Greene, 1993; Colston et al., 2010; Bellini et al., 2013). Esto implica que muchas generalizaciones sobre la ecología e historia natural de las serpientes sudamericanas, muy probablemente reflejan mejor los conocimientos obtenidos en serpientes en el hemisferio norte o en Australia (que pertenecen a otros clados como Colubridae, Natricidae y Elapidae sensuZaher et al., 2009) y, por lo tanto, no son directamente aplicables o comparables con los grupos filogenéticos endémicos del Neotrópico. La comparación directa, suponiendo similitudes ecológicas con las comunidades de serpientes del hemisferio norte, ha llevado a sesgos de interpretación sobre la ecología y estructuración de las comunidades de serpientes neotropicales (ver, por ejemplo, Vitt y Vangilder, 1983 y posterior discusión en Cadle y Greene, 1993).
La biología de las serpientes refleja 3 características importantes: diversidad, plasticidad y covarianza con otras características. La covarianza es evidente en las estrategias alimentarias que influencian el éxito reproductivo (Barron y Andraso, 2001; Bonnet et al., 2000) y los patrones de crecimiento (Madsen y Shine, 1993). La ecología trófica de las serpientes puede verse influenciada por sus características morfológicas –tamaño del cuerpo, largo y ancho de la cabeza– adquiridas a lo largo de su historia evolutiva (Rodríguez-Robles et al., 1999), su dimorfismo sexual, los hábitats que frecuentan y el tamaño de las presas (Arnold, 1993; Madsen y Shine, 1993; Shine et al., 2002). La morfología de las serpientes influencia su capacidad reproductiva y el dimorfismo sexual puede relacionarse con aspectos reproductivos (López y Giraudo, 2008). Además, la reproducción también está influenciada por factores geográficos, ecológicos y filogenéticos (Pizzato y Márquez, 2006).
La historia natural y ecología de las especies de Hydrodynastes es muy poco conocida y los datos disponibles están basados, principalmente en observaciones ocasionales (e. g., Cunha y Nascimento, 1978, 1993; Cei, 1993; Achaval y Olmos, 2007). En el caso de H. gigas, se ha observado que pueden existir diferencias entre reportes anecdóticos de dieta y reproducción (e. g., Cei, 1993; Williams y Scrocchi, 1994) y el estudio mediante muestras más grandes del contenido estomacal (López y Giraudo, 2004) y parámetros reproductivos —número de puesta de huevos— en cautiverio (Astort, 1984) y morfometría de las crías (Halloy y Belmonte, 1984).
En este estudio ampliamos significativamente la información sobre la ecología e historia natural de H. gigas, incluyendo datos sobre su madurez y dimorfismo sexual, biología reproductiva, dieta y hábitos alimenticios, actividad estacional y uso del hábitat. Dichos datos se obtuvieron a partir de muestreos de más de 2 décadas desarrollados en la región neotropical.
Materiales y métodosÁrea de estudio. Los estudios fueron realizados en la región Subtropical de Sudamérica en el nordeste de Argentina –Formosa, Chaco, Corrientes, Entre Ríos y Santa Fe– y sur del Paraguay –Ñeembucú e Itapúa–. La geomorfología y el paisaje de esta región están fuertemente influenciados por los grandes ríos de la cuenca del Plata: el Paraná, Uruguay y Paraguay que se unen para formar el río de La Plata. Estos ríos y sus tributarios presentan amplias llanuras de inundación que dan origen a diferentes tipos de humedales (Dinerstein et al., 1995; Arzamendia y Giraudo, 2009). La vegetación es un mosaico formado por sabanas y pastizales húmedos, bosques subtropicales húmedos a subxerófilos, bosques en galería y una amplia variedad de humedales –ríos, arroyos, lagunas, esteros– (Cabrera, 1976; Prado, 1993). El clima es estacional, con 4 estaciones marcadas, las temperaturas medias varían entre 17 y 21° C con mínimas rondando 0° C en otoño e invierno, y máximas de 35 a 40° C en primavera y verano. Las precipitaciones anuales varían entre 1 000 y 1 800mm (Prado, 1993).
Recolección de datos. Los ejemplares analizados se obtuvieron mediante 330 muestreos de campo, entre enero de 1990 y diciembre de 2011. Se utilizaron 2 métodos de muestreo (Campbell y Cristman, 1982): 1) búsquedas con un vehículo por rutas y caminos, a velocidades bajas y constantes (40–50km/h); 2) búsquedas intensivas a pie sin rutas o caminos y encuentros ocasionales en recorridos en embarcaciones por los diferentes hábitats y horas del día, registrando ejemplares activos y ocultos en refugios (Scott, 1994 y Valdujo et al., 2002). Siempre que fue posible, se capturaron los especímenes vivos para medirlos y obtener las presas induciendo suavemente, por palpación, la regurgitación del contenido del tracto digestivo (López y Giraudo, 2004; Tuttle y Gregory, 2009), para luego ser liberados (n=23). Los ejemplares atropellados y los muertos por lugareños encontrados en buenas condiciones fueron conservados para el estudio de su tractos digestivo y reproductivo (n=149) y depositados en las colecciones del Instituto Nacional de Limnología (INALI-CONICET-UNL), Félix Azara (CFA) del Museo Argentino de Ciencias Naturales “Bernardino Rivadavia” (MACN) y Cátedra de Anatomía Comparada (AC), Universidad Nacional de Córdoba. Adicionalmente, se examinaron ejemplares del Museo Provincial de Ciencias Naturales “Florentino Ameghino”, Santa Fe (MFA); Museo Argentino de Ciencias Naturales “Bernardino Rivadavia”, Buenos Aires (MACN); Universidad Nacional del Nordeste, Corrientes (UNNEC).
Registros morfológicos y análisis. Los ejemplares conservados fueron sexados por medio de una incisión debajo de la cloaca para observar la presencia de hemipenes y se les tomaron las siguientes caracteres: 1) número de escamas ventrales (VEN) y escamas subcaudales (SUB); 2) longitud hocico cloaca (LHC); 3) longitud de la cola (LCO); 4) longitud de la cabeza (LCA, desde el hocico hasta el ángulo posterior de la unión mandibular); 5) ancho de la cabeza (ACA, en su parte más ancha); 6) largo, ancho y alto del testículo derecho; 7) largo del mayor folículo ovárico o huevo oviductal; 8) alto y ancho a la mitad del cuerpo en hembras con huevos. Todas las medidas fueron tomadas en milímetros utilizando cinta métrica y calibre de vernier.
El dimorfismo sexual se analizó por separado enjuveniles y adultos conservados. Las hembras se consideraron adultas cuando tuvieron folículos vitelogénicos secundarios, huevos oviductales o úteros plegados que indican puesta reciente de huevos; los machos adultos cuando tuvieron testículos túrgidos y conductos deferentes enrollados y opacos (Pizzatto et al., 2008; Leite et al., 2009b). Se calculó el volumen testicular que refleja actividad reproductiva, usando la fórmula del elipsoide (4/3πabc, donde a= largo/2, b= ancho/2, c= alto/2, Pleguezuelos y Feriche, 1999). El índice de dimorfismo sexual (SSD, por sus siglas en inglés) se calculó como la media LHC del sexo más largo/media del sexo más corto-1 (Shine, 1994) y se expresa en positivo si las hembras son el sexo más largo, y negativo en caso inverso. El dimorfismo sexual se analizó comparando la LHC, las escamas ventrales y subcaudales entre sexos mediante la pruebas t-Student, cuando cumplieron el supuesto de normalidad, o Mann-Whitney, en caso contrario. Debido a que el largo de la cola covaría con la LHC, fue comparado mediante un análisis de covarianza (Ancova). De la misma manera, se usó como covariable la longitud del tronco (LHC-LCA) para comparar el largo y el ancho de la cabeza. La frecuencia reproductiva fue estimada mediante el porcentaje de hembras maduras reproductivamente activas en la muestra (con folículos > 10mm o huevos), respecto al total de hembras maduras. Contamos la cantidad de huevos —oviductales y puestos— por hembra para estimar la fecundidad (Pizzatto, 2005). Estimamos el potencial reproductivo (número potencial de neonatos por hembra por año): (fecundidad media) x (frecuencia reproductiva) (Bellini et al., 2013). Para determinar la relación entre el tamaño del cuerpo –LHC, ancho y alto del cuerpo– y la fecundidad, se realizó un análisis de correlación de Spearman. En los machos se comparó la variación del volumen testicular entre estaciones mediante un Ancova, usando la LHC como covariable.
Se examinaron los tractos digestivos de los ofidios y se registraron el tipo y número de presas ingeridas. Identificamos las partes (ítems) de las presas hasta el menor nivel taxonómico posible, mediante comparación con ejemplares de referencia depositados en la colección del Instituto Nacional de Limnología y con claves científicas. Siempre que su grado de digestión lo permitió, se estimó el largo total de las presas (LTp) mediante comparaciones con especímenes intactos cuando fue necesario y se registró el sentido de ingestión (López y Giraudo, 2008). Los anfibios fueron medidos, incluyendo sus patas traseras estiradas, con base en López y Giraudo (2004), por la importante biomasa que éstas representan. Los invertebrados fueron considerados presas secundarias y no se utilizaron en los análisis, de acuerdo con López y Giraudo (2004), debido a su pequeño tamaño y a que fueron registrados con restos de vertebrados. Para probar diferencias en la frecuencia de ítems presas de diferentes grupos taxonómicos, se realizó una prueba de Chi-cuadrado (χ2). La relación entre la LHC y el ACA de machos y hembras con el LTp consumidas, se determinó con un análisis de correlación de Spearman. Se comparó el solapamiento de la dieta de machos y hembras de acuerdo con Pianka (1973), mediante el programa EcoSim 7,0 (Gotelli y Entsminger, 2001), evaluada a nivel de grupos superiores —peces, anfibios, reptiles, aves y mamíferos—. Se utilizaron las siguientes opciones de EcoSim: índice de solapamiento de nicho de Pianka, algoritmo de asignación al azar 3 (RA3), y 1 000 resultados al azar de la matriz original. El algoritmo RA3 retiene la categoría de presa en la matriz original, pero señala de forma aleatoria cuáles estados de recurso se utilizan (Winemiller y Pianka, 1990). Se usó este algoritmo para mantener la cantidad de especialización para cada sexo, permitiéndole a su vez el uso potencial de otro estado del recurso (Gotelli y Entsminger, 2001). El índice de Pianka (1973) varía entre 0 (sin superposición) y 1 (superposición total). Para determinar la actividad estacional, se recorrió un total de 7 378km en rutas durante 91 muestreos, incluyendo 2 434km en verano (diciembre a febrero), 1 478km en otoño (marzo a mayo), 1 950km en invierno (junio a agosto) y 1 877km en primavera (septiembre a noviembre). Debido a las diferencias en los esfuerzos de muestreos indicados, los datos se compararon y estandarizaron como número de individuos cada 100km de recorrido, por medio de la prueba de Kruskal-Wallis. Se registró el tipo de hábitat, donde los especímenes fueron encontrados con base en Bellini et al. (2013).
Los análisis estadísticos se realizaron con el software Infostat, versión 5.1 (Di Rienzo et al., 2005), con un nivel de significancia del 5% para rechazar la hipótesis nula. La asunción de normalidad fue probada con la prueba Shapiro-Wilk y la homogeneidad de la varianza con el estadístico F.
ResultadosMorfología, dimorfismo y madurez sexual. De 149 individuos conservados, 50 fueron machos maduros (34%), 61 hembras maduras (41%), 20 machos juveniles (13%) y 18 hembras juveniles (12%). En los juveniles el intervalo de LHC en los machos fue 165–800mm (x=467, n=20) y en las hembras de 242–959mm (x=426, n=18). El intervalo de LCO en los machos fue 33–230mm (x=129, n=19) y en las hembras 43–240mm (x=116mm, n=18). El intervalo de LCA fue 21–43 en los machos (x=28.5, n=18) y en las hembras 21–45mm (x=mm, n=15). El intervalo de ACA fue 11–28 en los machos de (x=17.7, n=17) y en las hembras 11–28mm (x=17.5mm, n=12). Los juveniles no presentaron dimorfismo sexual en ninguna de las variables analizadas (LHC: H=2.59, p=0.11; LCO: H=1.48, p=0.22; LCA: H=0.36, p=0.58; ACA: H=0.20, p=0.98). Las hembras adquirieron la madurez sexual (LHC entre la menor hembra madura y la mayor inmadura es de 925 y 959mm, respectivamente) con mayor longitud corporal que los machos (LHC de los machos entre 800 y 853mm).
Los adultos mostraron dimorfismo sexual en todas las variables comparadas (Cuadro 1), teniendo las hembras mayor longitud corporal (LCH), mayores dimensiones de cabeza (LCA, ACA) en proporción al cuerpo, y mayor número de ventrales respecto a los machos. Estos últimos, mostraron colas proporcionalmente más largas y más subcaudales que las hembras (Cuadro 1). El índice de dimorfismo sexual de los adultos fue SSD=0.148, debido a que las hembras tienen mayor LHC que los machos.
Variación de caracteres merísticos y morfométricos de individuos adultos de H. gigas. Número de individuos (n), media aritmética (x), desviación estándar (DE), largo de la cabeza (LCA), ancho de la cabeza (ACA), largo de la cola (LCO), número de escamas ventrales (V), número de escamas subcaudales (S), largo hocico-cloaca (LHC). Diferencias significativas con p<0.025 *, p<0.0025** y p<0.0001***
| Variable | Hembras | Machos | Estadístico | ||||||
|---|---|---|---|---|---|---|---|---|---|
| n | x | DE | Intervalo | n | x | DE | Intervalo | ||
| LCA | 43 | 52.3 | 7.30 | 39.1–75.2 | 57 | 54.5 | 6.9 | 31.4–65 | * F=5.33 |
| ACA | 51 | 38.9 | 7.39 | 23.2–57.3 | 40 | 33.6 | 4.6 | 24.9–44.3 | * F=11.71 |
| LCO | 48 | 357.7 | 67.4 | 194–510 | 43 | 429.2 | 79.6 | 255–565 | * F=27.14 |
| V | 77 | 162.5 | 4.4 | 143–174 | 69 | 156 | 5.9 | 133–175 | *** U=264 |
| S | 68 | 63.7 | 4.3 | 47–70 | 65 | 72.6 | 4.3 | 61–80 | *** U=136.5 |
| LHC | 60 | 1436.1 | 305.7 | 925–2360 | 49 | 1250.9 | 212.4 | 853–1632 | ** t=3.72 |
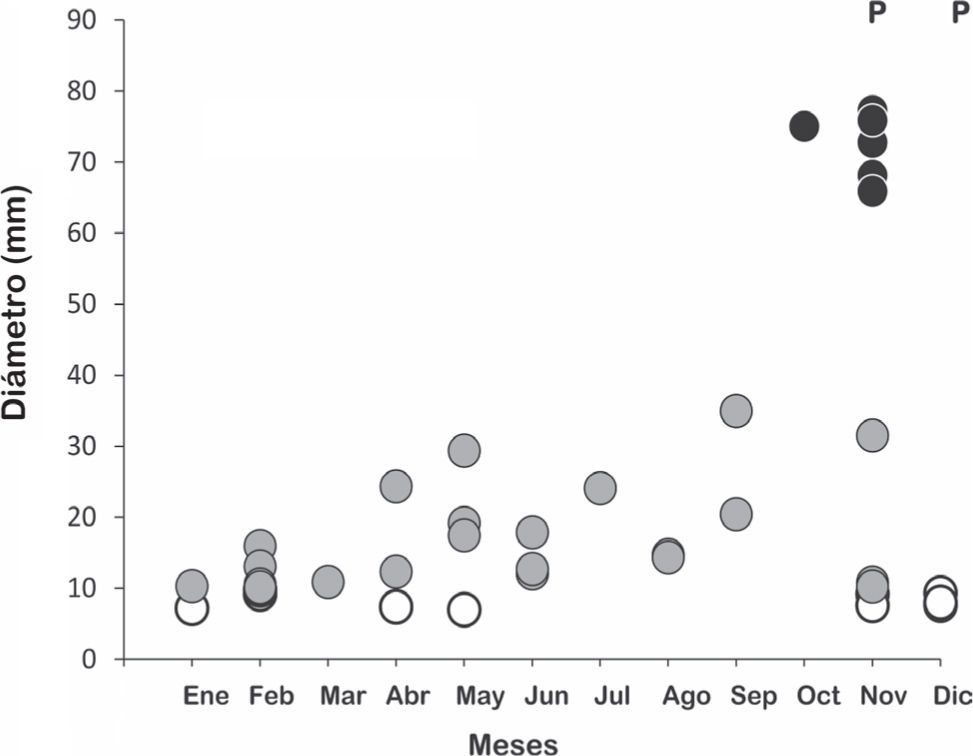
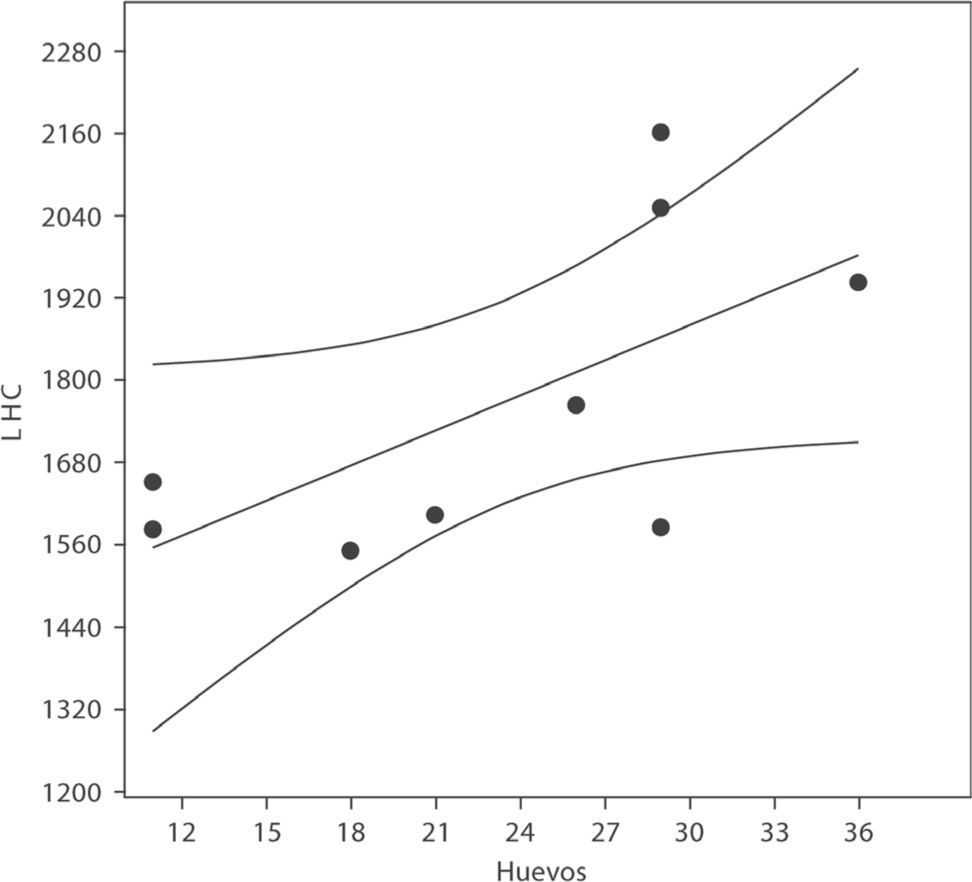
Biología reproductiva. Las hembras de H. gigas mostraron un ciclo estacional, con folículos vitelogénicos (10 a 35mm) desde enero a noviembre y huevos oviductales (45 a 77mm) entre octubre y noviembre, con puesta en noviembre y diciembre (Fig. 1). Su frecuencia reproductiva (71%), superior al 50%, sugiere que esta especie podría reproducirse anualmente. La fecundidad media fue 23, con un tamaño de puesta entre 11 y 36 (n=9). El potencial reproductivo fue 16.33 huevos por hembra por año. La relación entre el tamaño de puesta con la LHC tiene un coeficiente de correlación relativamente alto y significativo al 94% de nivel de confianza (r=0.645, p=0.060, n=9), que muestra una clara tendencia al aumento de número de huevos en hembras más grandes (Fig. 2). El alto (r=0.278, p=0.468, n=9) y el ancho corporal (r=0.532, p=0.14, n=9) de las hembras no se correlacionó significativamente con el tamaño de puesta. El 38% de las hembras con huevos oviductales tenían alimento en su tracto digestivo, por ejemplo, una hembra con 11 huevos se había comido 2 peces (Callichthys callichthys). El ciclo de los machos fue continuo y anual, sin diferencias significativas a lo largo de los meses en el volumen testicular (Ancova F=0.37; P=0.37; P=0.939), con conductos deferentes enrollados y opacos desde marzo a diciembre.
Ciclo reproductivo femenino de Hydrodynastes gigas en el subtrópico Sudamericano, mostrando la variación estacional en el diámetro (mm) de folículos oválicos no vitelogénicos (círculos blancos), folículos vitelogénicos (círculos grises), huevos oviductales (círculos negros) y las puestas de huevos (P).
Hábitos alimenticios y dieta. De 152 especímenes, 54 (36%) contenían 70 ítems presa pertenecientes a 5 clases taxonómicas y 10 familias, además de 4 vertebrados no identificados (5.7%) (Cuadro 2). Los anfibios (41.4%, n=29) corresponden a las familias Leptodactylidae (11.4%), Bufonidae (14.3%) e Hylidae (2.9%), además de 9 anfibios no identificados (12.9%). Los reptiles (20%, n=14) son ofidios de la familia Colubridae (18.6%), sensu Pyron et al. (2013), y saurios Teiidae (1.4%). Los peces (15.7%, n=11) son de las familias Callichthyidae (4.3%) y Symbranchidae (10%), además de registrarse entre los contenidos una masa de huevos (1.4%). Los mamíferos (14.3%, n=10) pertenecen a Muridae (1.4%), Caviidae (1.4%) y Cricetidae (1.4%), además de 5 mamíferos (7.1%) y 2 roedores (2.9%) no identificados. Último en abundancia se encuentran las aves (2.9%, n=2), las cuales no se pudieron identificar. De 23 presas para las que se pudo determinar la dirección de ingestión, 19 (83%) fueron consumidas desde la cabeza y 4 (17%) desde la cola. Al comparar la alimentación entre machos y hembras a nivel de grupos superiores, la superposición de nicho es elevada (0.94), ya que ambos sexos depredan todos los grupos de presas analizados. Sin embargo, los machos consumieron presas más grandes que las hembras (t=−3.10; p=0.0054, n=34). Las hembras mostraron una preferencia significativa por los anfibios (χ2=7.32, p=0.0063, gl=3, n=31), tendencia también observada en los machos, con un valor aproximado de significancia al 93% de nivel de confianza (χ2=9.85, p=0.043, gl=4, n=27). Las correlaciones entre el largo de la presa y el largo corporal y ancho de la cabeza de H. gigas no fueron significativas para ambos sexos.
Presas ingeridas por Hydrodynastes gigas
| Tipo de presa | Items-presa | Número de presas | Frecuencia % |
|---|---|---|---|
| Peces | Synbranchus marmoratus | 7 | 10 |
| Callichthys callichthys | 3 | 4.3 | |
| Huevos de peces | 1 | 1.4 | |
| Anfibios | Leptodactylus sp. | 2 | 2.9 |
| Leptodactylus grupo ocellatus | 3 | 4.3 | |
| Leptodactylus latrans | 3 | 4.3 | |
| Pseudis paradoxus | 2 | 2.9 | |
| Rhinella grupo fernandezae | 1 | 1.4 | |
| Rhinella fernandezae | 7 | 10 | |
| Rhinella schneideri | 2 | 2.9 | |
| Anfibios no identificado | 9 | 12.9 | |
| Reptiles | Helicops leopardinus | 2 | 2.9 |
| Helicops sp. | 3 | 4.3 | |
| Erythrolamprus jaegeri | 1 | 1.4 | |
| coralliventris | |||
| Erythrolamprus semiaureus | 2 | 2.9 | |
| Erythrolamprus poecilogyrus | 1 | 1.4 | |
| Thamnodynastes hypoconia | 1 | 1.4 | |
| Thamnodynastes strigatus | 1 | 1.4 | |
| Colubridae no identificados | 2 | 2.9 | |
| Teius oculatus | 1 | 1.4 | |
| Aves | Ave no identificadas | 2 | 2.9 |
| Mamíferos | Cavia aperea | 1 | 1.4 |
| Holochilus brasiliensis | 1 | 1.4 | |
| Cricetidae no identificados | 1 | 1.4 | |
| Roedores no identificados | 2 | 2.9 | |
| Mamíferos no identificados | 5 | 7.1 | |
| Vertebrados | Vertebrados no identificados | 4 | 5.7 |
| Total | 70 | 100 |
Actividad estacional y abundancia. Durante los muestreos sistemáticos en caminos se registraron 91 especímenes de H. gigas, siendo la cuarta especie más abundante (9%), luego de Philodryas patagoniensis (26%), Helicops leopardinus (20%) y Erythrolamprus semiaureus (13%), sobre un total de 22 especies y 1 074 ejemplares registrados. Hydrodynastes gigas estuvo activa durante todo el año (Fig. 3). Si bien, fue registrada con mayor frecuencia entre noviembre y marzo (primavera-verano) no existieron diferencias significativas entre los meses del año (H=6, 102; p=0.7374) ni entre las estaciones (H=0.8782; p=0.7968), comparando los individuos registrados en muestreos sistemáticos en caminos (Fig. 3). En estos muestreos no se registraron individuos en octubre, no obstante, si se registraron individuos en búsquedas activas y encuentros ocasionales en dicho mes con valores similares a septiembre y agosto (Fig. 3).
Uso del hábitat. Hydrodynastes gigas se registró, principalmente asociada a humedales (88%, n=301), incluyendo dentro de esta categoría planicies de inundación de grandes ríos (66%), esteros (15%) y humedales artificiales (7%). Menos frecuentemente fue registrada en sabanas (8%, n=27), bosques fluviales cercanos a humedales (2%, n=7) y ambientes suburbanos (2%, n=7). Nunca fue registrada en sectores de selva o bosque atlántico, donde habita sólo marginalmente en las planicies de inundación del río Paraná.
DiscusiónVarias hipótesis han sido propuestas para explicar la evolución del dimorfismo sexual en el tamaño corporal y la morfología de los animales; sin embargo, la competencia sexual y la divergencia intraespecífica de nicho han sido las más aceptadas (Shine, 1989, 1994). En el presente trabajo encontramos dimorfismo sexual en los números de escamas ventrales y subcaudales, en coincidencia con los datos preliminares presentados por López y Giraudo (2004). Sin embargo, a diferencia del artículo último, una muestra mayor de H. gigas nos permitió comparar individuos juveniles y adultos por separado, mostrando que no existe dimorfismo en los juveniles, pero sí entre adultos (LCA, LHC y LCO). López y Giraudo (2004) no documentaron dimorfismo sexual en las dimensiones LCA, LHC y LCO, lo que tendría relación con que estos autores compararon juveniles y adultos en conjunto, mezclando dichas clases de edad en una muestra más pequeña. En serpientes se ha postulado que el tamaño de la cabeza no se encuentra bajo selección sexual (Shine, 1991), por lo que el dimorfismo se atribuye al consumo de presas de diferente tamaño por parte de machos y hembras (Vincent et al., 2004; Vincent y Herrel, 2007). López y Giraudo (2004) indicaron que la falta de dimorfismo en el largo de la cabeza puede deberse a que no registraron diferencias dietarias entre ambos sexos. En este trabajo observamos que las hembras tuvieron cabezas más largas, aunque fueron los machos los que consumieron presas más grandes. Esto no coincide con la propuesta de Vincent y Herrel (2007) para serpientes acuáticas y semiacuáticas de otros continentes, en la que las hembras tienden a ser más largas, con cabezas más grandes y consumen presas más grandes que los machos conespecíficos. Aunque ellos sugieren que este tipo de dimorfismo ha evolucionado de manera convergente en serpientes acuáticas, en general, nuestros resultados no apoyan esta hipótesis para H. gigas, lo que también se ha corroborado en otras especies acuáticas neotropicales como Thamnodynastes hypoconia y T. chaquensis (Bellini et al., 2013, 2014). No se descarta la posibilidad de que existan diferencias en el tamaño de las presas que consumen machos y hembras si se consideran otras variables como el volumen, peso o diámetro, atributos que no pudieron ser cuantificados en las presas analizadas, debido a que varias de ellas tenían un estado de digestión que provocaría sesgos importantes.
Una hipótesis plausible para explicar la mayores dimensiones de la cabeza en hembras, podría relacionarse con diferencias en la mortalidad entre sexos (Ávila et al., 2006). Hydrodynastes gigas tiene notables comportamientos antidepredatorios de ensanchamiento del cuello y la cabeza (Fig. 4), tal como discuten Keogh et al. (2000) para el colúbrido africano Crotaphopeltis hotamboeia, quienes presumen que el mayor tamaño relativo de la cabeza en las hembras puede permitir un despliegue antidepredatorio más eficaz. Se ha postulado que las hembras por sus necesidades de termorregulación, mayor tamaño o hábitos más conspicuos cuando buscan sitios de oviposición pueden tener mayor incidencia de depredación (Shine, 1980, 2003). De esta forma, un mayor tamaño de la cabeza resultaría favorable y redundaría en comportamientos antidepredatorios más eficientes (Fig. 4).
Un escenario evolutivo alternativo que puede explicar el desarrollo del dimorfismo sexual, es la selección que actuaría para reducir la competencia entre los sexos (Vincent et al., 2004). La mayor longitud del cuerpo de las hembras puede explicarse en este contexto, debido a que la selección natural favorecería hembras más largas que podrían producir mayor cantidad de huevos (Ford y Seigel, 1989; Shine, 1994; Martins et al., 2002; Leite et al., 2009a). Observamos que hembras con mayor longitud mostraron una clara tendencia a producir mayor cantidad de huevos. De esta manera, el aumento del tamaño del cuerpo en las hembras estaría positivamente relacionado con la fecundidad (Ford y Seigel, 1989; Shine, 2003). La tendencia a que hembras más grandes produzcan camadas o puestas mayores es común en las serpientes, pero las especies difieren en relación entre el tamaño de la madre y el número de crías o huevos (Bertona y Chiaraviglio, 2003). Según Shine (2003), las hembras pueden demorar su maduración sexual con respecto a los machos, ya que su tamaño corporal determinará el tamaño y masa de la puesta o camada, sólo si éstas retrasan la reproducción hasta que tengan suficiente energía para desarrollar huevos o embriones. De acuerdo con esta estrategia reproductiva, las hembras de H. gigas alcanzan la madurez sexual a mayores tamaños que los machos. Shine (2003) postula que las hembras son capaces de controlar y seleccionar ciertas variables relacionadas a su reproducción. En climas templados los requerimientos termales para llevar a cabo la embriogénesis limitan la reproducción en los meses cálidos, tal como sucede en H. gigas, dando como resultado un ciclo reproductivo estacional. Las especies ovíparas deben poner sus huevos en primavera-verano para que se incuben correctamente, mientras que las especies vivíparas pueden, mediante la termorregulación, elevar su temperatura corporal reteniendo sus embriones durante más tiempo y prolongando su periodo reproductivo hasta fines del verano y principios del otoño (Aguiar y Di-Bernardo, 2005; Giraudo et al., 2007, 2008; Bellini et al., 2014). Además, en los hábitats que frecuenta H. gigas, los huevos pueden quedar expuestos al aumento del nivel del agua o a los primeros fríos, provocando que las especies ovíparas realicen sus puestas lo suficientemente temprano como para evitar la pérdida de su prole (Giraudo et al., 2007; López et al., 2009). Conforme a esto, encontramos hembras con huevos en el oviducto o con el útero plegado —del tipo que indica una puesta reciente— a fines de la primavera (noviembre -diciembre), lo que a su vez coincide con los meses previos al ascenso del nivel hidrométrico de los humedales regionales, como fue registrado para otras especies ovíparas (P. patagoniensis, E. semiaureus) en las planicies de inundación de los ríos de la cuenca del Plata (Giraudo et al., 2007; López et al., 2009).
Estudios previos han manifestado que la falta de alimento de hembras grávidas es atribuible a limitaciones físicas sobre el volumen abdominal, sin embargo, Brischoux et al. (2011) sugieren que hay poco solapamiento entre el estómago y los oviductos de las hembras, por lo que éstas dejan de alimentarse debido a una disminución en la capacidad locomotora, que las hace menos eficaces en la búsqueda de alimento y más vulnerables a los depredadores. A diferencia de lo enunciado anteriormente, en este estudio encontramos 3 hembras con huevos y presas simultáneamente (38% de las hembras grávidas, proporción similar al total de individuos con presas, un 36%). Esto puede deberse a que la reproducción puede afectar el balance energético de las serpientes mediante el aumento de su metabolismo (Shine, 2003), por lo que éstas necesitan seguir alimentándose. Además, la inversión energética que una hembra debe realizar para reproducirse condiciona, tanto la fecundidad como la frecuencia reproductiva, siendo más marcado el efecto en especies vivíparas que en ovíparas (Shine, 2003). Las especies ovíparas tienen un ciclo reproductivo más corto, ya que la mayor parte del desarrollo embrionario se da fuera del cuerpo materno, por lo que el tiempo para acumular energía para el siguiente periodo reproductivo es mucho más largo respecto a las vivíparas, posibilitando así una puesta anual de huevos (Ibargüengoytía y Casalins, 2007; Bellini et al., 2013). De acuerdo con esto, H. gigas mostraría la capacidad de reproducirse todos los años, lo que también ha sido documentado para otras serpientes ovíparas de la región (López y Giraudo, 2008; López et al., 2009). Aunque los machos de algunas especies de serpientes tropicales tienen ciclos reproductivos estacionales, la producción de espermatozoides es, por lo general, energéticamente menos costosa que la producción de gametos femeninos, siendo esperable que los machos de zonas tropicales y templadas posean ciclos continuos y permanezcan reproductivamente activos durante todo el año (Pizzatto, 2005). Este es el caso de los machos de H. gigas, que parecen tener un ciclo reproductivo continuo.
El aumento en el número de presas registradas por nosotros, respecto a López y Giraudo (2004), confirma que H. gigas es una culebra generalista que consume todo tipo de vertebrados, principalmente aquellos que captura en los ambientes acuáticos que frecuenta. Los nuevos datos obtenidos permiten adicionar 4 nuevos ítems: 2 especies de serpientes semiacuáticas (Erythrolamprus jaegeri coralliventris y E. semiaureus), una de anfibio (Rhinella fernandezae) y un saurio terrestre (Teius sp.), lo que refuerza la determinación de una dieta generalista y plástica en H. gigas. Nuestros datos coinciden con los antecedentes existentes sobre aspectos de su dieta, por ejemplo, Strüssmann y Sazima (1990) mencionan que es una especie generalista que incluye también carroña en su dieta, mientras que Strüssmann y Sazima (1993); Astort (1984) y Weiler y Airaldi (2010) describen su actividad de forrajeo en relación con los ambientes acuáticos que frecuenta. Se refuerza con nuestros datos la inclusión de animales serpentiformes (serpientes 18% y anguilas 11%), constituyendo un 29% de su dieta, por lo que destaca que Hydrodynastes haya sido propuesta, en algunas hipótesis filogenéticas (Vidal et al., 2000; Pyron et al., 2013), como el grupo hermano de los Pseudobinae, que incluye los géneros Boiruna y Clelia, con especies con notables tendencias a la ofiofagía, aunque consumen otros vertebrados, y que también realizan constricción. Otra característica que relaciona a estos grupos, es que los juveniles de H. gigas presentan una pigmentación oscura progresiva en la parte posterior del vientre, carácter observable en varios Pseudoboini, tanto jóvenes como adultos, como Boiruna y Rhachidelus (Giraudo, 2001).
Estudios previos han demostrado que las serpientes muestran una notable variedad de adaptaciones en sus historias de vida en relación con factores ambientales (Brown y Shine, 2002). En este estudio, H. gigas mostró una actividad reproductiva estacional; sin embargo, entre estaciones no mostró diferencias significativas en su abundancia. En noviembre se detectó un pico de registros, probablemente debido a la presencia de hembras con huevos que termoregulan o buscan lugares para poner sus huevos en esta época. En invierno los encuentros fueron menos frecuentes, posiblemente en relación con mayor frecuencia de bajas temperaturas, aunque en varias ocasiones la observamos asoleándose para termorregular, ya que en la región subtropical muestreada las temperaturas bajas extremas son ocasionales.
El uso del hábitat y la composición de la dieta en las serpientes parecen estar estrechamente relacionadas y algunos autores sugieren que las preferencias de microhábitat están relacionadas con la búsqueda local de la presa (Martins et al., 2002.). Los diferentes tipos de presas consumidas por H. gigas son relativamente abundantes en los distintos hábitats que utiliza, sin embargo, el mayor uso que hace de los humedales se ve reflejado en su dieta, ya que los ítem presa que ingiere son en su mayoría especies dependientes o relacionadas al medio acuático. A su vez, la disponibilidad de alimento es un importante factor que influye en la abundancia de las especies dentro de una comunidad de serpientes (Gibbons y Semlitsch, 1987). En el caso de H. gigas, se conjugan 2 factores: una dieta basada en un amplio espectro de presas disponibles alternativamente durante todo el año, que convierten a la ñacaniná en una de los depredadores más abundantes en los ecosistemas, a pesar de su gran tamaño (hasta 3 m) y la conexión entre los hábitats acuáticos y terrestres en ambientes temporalmente muy fluctuantes y dinámicos, como son los grandes ríos y humedales de las planicies de inundación en Sudamérica.
Agradecemos el apoyo financiero a este trabajo con proyectos otorgados por el Consejo Nacional de Investigaciones Científicas y Técnicas (PIP# 2008 6487, PIP 2011-0355); la Universidad Nacional del Litoral (CAI+D 2009 y 2011) y la Agencia Nacional de Promoción Científica y Tecnológica (PICT 2011-1526). Asimismo, agradecemos a la familia Escalante y Raúl Abramson por su valiosa ayuda en el campo. A Silvia Regner del Instituto Nacional de Limnología (CONICET-UNL) que facilitó nuestro trabajo. A Javier López por el aporte de datos de anfibios. A Soledad M. López por aportar algunos especímenes. A los curadores de los museos J. Faivovich (MACN), C. Virasoro (MFA), Beatriz B. Álvarez (UNNE), Gisela Bhaler (MER) y Mario Cabrera (CD).