Se describe la composición, estructura y diversidad de los árboles del bosque tropical caducifolio en Tziritzícuaro, municipio de La Huacana, en la Depresión del Balsas, Michoacán. Se censaron todos los árboles enraizados dentro de 36 parcelas de 100m2 (0.36 ha) con un diámetro a la altura del pecho (DAP) ≥1cm. Se registraron 78 especies, incluidas en 50 géneros y 24 familias. La familia Fabaceae fue la más importante respecto a su número de especies (24), géneros (14) e individuos (274). En total se registraron 1 013 individuos y 2 313 tallos. Los valores promedio del área basal, cobertura y altura fueron de 0.18m2, 310m2 y 5m, respectivamente. El número promedio de especies por parcela fue 10, mientras que el valor medio del índice a de Fisher= 8. El bosque tropical caducifolio estudiado comparte características similares a comunidades análogas situadas en otras partes de México y del neotrópico, lo que permite ratificar patrones previamente detectados en la composición, estructura y diversidad de este tipo de vegetación.
We characterized the composition, structure and diversity of tropical dry forest trees at Tziritzícuaro, municipality of La Huacana, in the Depresión del Balsas, Michoacán. We sampled all trees that were rooted inside 36 plots of 100m2 (0.36 ha) with a diameter at breast height (DBH) ≥1cm. A total of 78 species, including 50 genera and 24 families were recorded. Fabaceae was the most important family respect to the number of species (24), genera (14) and individuals (274). It was recorded a total of 1 013 individuals and 2 313 stems. Basal area, cover and height average were of 0.18m2, 310m2 and 5m, respectively. The average of species richness was of 10 species, with a mean value of Fisher α=8. The tropical dry forest studied shares comparable characteristics to similar communities located in other parts of Mexico and the Neotropics, this enable to confirm patterns previously detected in the composition, structure and diversity of this vegetation type.
La vegetación localizada en las regiones tropicales estacionalmente secas es heterogénea y está influida por una compleja historia ambiental y biogeográfica (Pérez-García et al., 2012). Los autores anteriormente citados indican que dentro de este tipo de vegetación el bosque tropical caducifolio (Rzedowski, 1978) es el mejor representado en México, aunque sus límites geográficos no son fáciles de circunscribir. En el país se han llevado a cabo distintos estudios para documentar su estructura y diversidad, resaltando por su amplitud espacial el de Trejo y Dirzo (2002), quienes caracterizaron 20 localidades con bosque tropical caducifolio (BTC) a lo largo de su área distribución. A una escala más regional, se cuenta con estudios similares para las penínsulas de Baja California y Yucatán, y los estados de Chiapas, Guerrero, Jalisco, Oaxaca, Sonora y Veracruz (Lott et al., 1987; Rico-Gray et al., 1988; Martínez-Yrízar et al., 1996, 2000; Balvanera et al., 2002; Segura et al., 2002; White y Hood, 2004; Pérez-García y Meave, 2004; Gallardo-Cruz et al., 2005; Durán et al., 2006; Pineda-García et al., 2007; Lebrija-Trejos et al., 2010, 2011; Rocha-Loredo et al., 2010; Almazán-Núñez et al., 2012; Martínez-Cruz et al., 2013; Dzib-Castillo et al., 2014). La información disponible en los estudios previamente mencionados permite resaltar algunas tendencias del BTC de México: 1) las familias Burseraceae, Euphorbiaceae, Rubiaceae, y en especial Fabaceae, son importantes en cuanto al número de especies o individuos; 2) la predominancia de los árboles sobre las lianas es evidente, aunque su variación es considerable entre sitios; 3) el área basal presenta una marcada oscilación, con intervalos entre 10.5 y 78.8m2 ha−1; 4) el número total de especies también es muy fluctuante, con valores de riqueza extremos de 22 a 97 especies en 0.1 ha (plantas ≥2.5cm DAP) y 5) presenta una diversidad beta alta.
Este tipo de vegetación se localiza en 6 provincias biogeográficas de México, las cuales se distribuyen, principalmente, en ambas vertientes del país (Rzedowski, 1978; Lott y Atkinson, 2006). Una excepción a lo anterior es la Provincia de la Depresión del Balsas, ya que se registra hacia la parte continental, abarcando aproximadamente 112 320km2. En esta provincia la vegetación con mayor extensión es el BTC (Rzedowski, 1978; Morrone, 2005), el cual se caracteriza por presentar un notable porcentaje de biota endémica (Rzedowski, 1991; Rodríguez-Jiménez et al., 2005; Lott y Atkinson, 2006; Ceballos et al., 2010).
En general, la mayoría de los estudios realizados en el BTC en esta provincia han tenido como objetivo su descripción fisonómica y florística (Miranda, 1947; Miranda y Hernández-X, 1963; Rzedowski, 1978). Dentro de las publicaciones con un enfoque cuantitativo se puede mencionar la de Trejo y Dirzo (2002), quienes por medio del censo de los árboles y lianas > de 1cm DAP, en unidades de muestreo de 0.1 ha, incluyen 4 sitios de la Depresión del Balsas (Cañón del Zopilote, Guerrero; Cerro Tuxpan e Infiernillo, Michoacán y El Limón, Morelos). El número de especies en estas localidades osciló entre 76 y 115 especies, con valores del índice de Shannon de 3.64 a 4.09. Posteriormente, Pineda-García et al. (2007) realizaron 4 muestreos similares en El Tarimo, Guerrero, donde encontraron un menor número de especies (43–55) y una similitud alta entre sitios (índice de Jaccard de 0.40 a 0.58). En un estudio más reciente, Martínez-Cruz et al. (2013) censaron 3 sitios en el municipio de Francisco J. Múgica, Michoacán y, aunque su categoría diamétrica mínima fue de individuos ≥ a 2.5cm, sus resultados fueron similares a los cuantificados en El Tarimo (38 a 45 especies e índice de similitud de Sorensen entre 0.41 y 0.57).
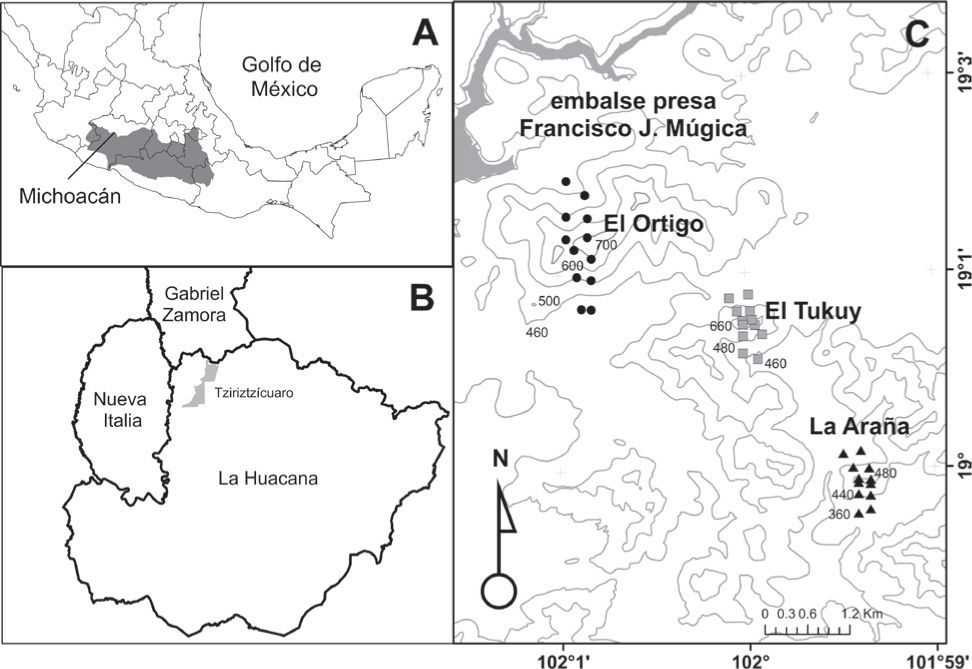
Considerando la superficie de la Provincia de la Depresión del Balsas, la importante variación observada en los atributos comunitarios del BTC en México, la amplia extensión de éste en la Depresión del Balsas, así como el limitado número de contribuciones enfocadas a estimar parámetros cuantitativos de este tipo de vegetación dentro de los límites de esta provincia, el presente estudio tiene como objetivo principal aportar una caracterización de la composición, estructura y diversidad del componente arbóreo de un BTC de la Depresión del Balsas, en el estado de Michoacán (Fig. 1). En particular, se desea determinar el grado de similitud de este bosque con respecto a otras regiones previamente estudiadas en México y en el continente americano, ya que debido a la composición florística distintiva de la Provincia Biogeográfica de la Depresión del Balsas, se podrían esperar respuestas particulares de las especies que afecten los atributos de estructura y diversidad a nivel comunitario.
A), localización geográfica de la depresión del Balsas en México (color gris). B), ubicación de Tziritzícuaro en el municipio de la Huacana en Michoacán y C), sitios donde se establecieron las parcelas para evaluar los atributos en la comunidad de árboles de la vegetación del bosque tropical caducifolio.
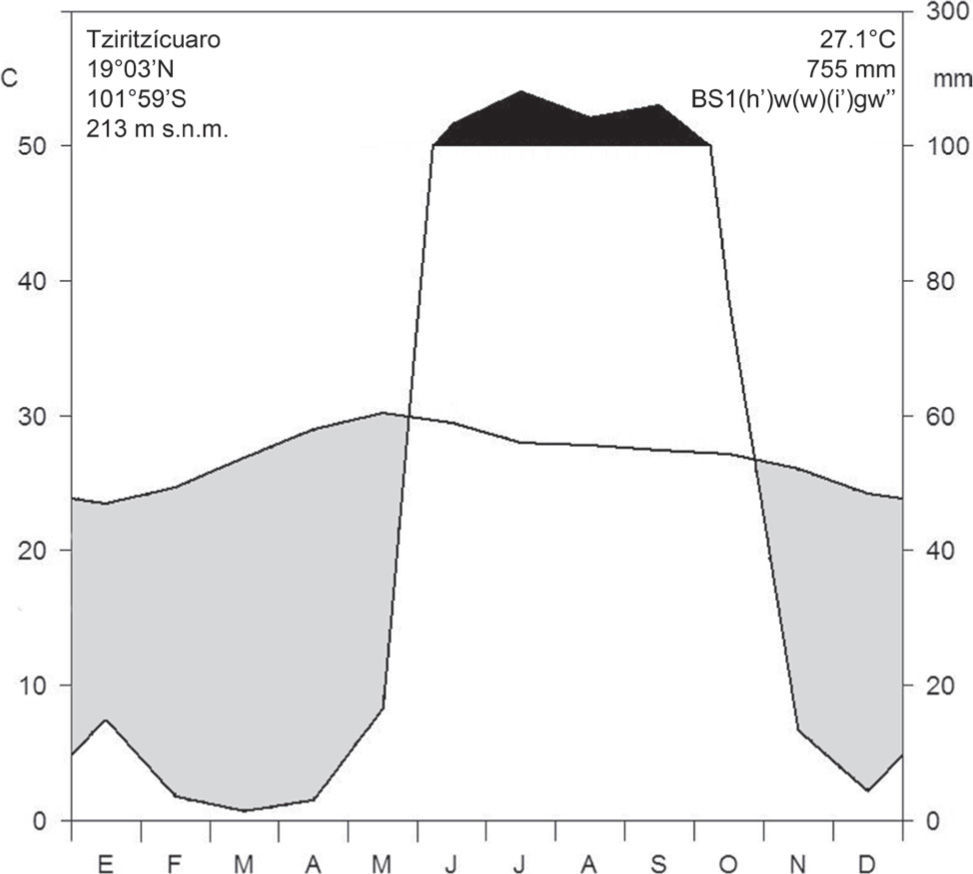
Área de estudio y sitios de muestreo. La zona de trabajo se localiza en el ejido de Tziritzícuaro, en la Provincia Morfotectónica de la sierra Madre del Sur, Subprovincia de la Depresión del Balsas, en la cuenca hidrológica del río Balsas, cuya altitud oscila entre 200 y 1 000m (Ferrusquía-Villafranca, 1993). Entre los sistemas geomorfológicos más importantes que se presentan en la región se encuentran los lomeríos, el valle de laderas tendidas con lomeríos y meseta lávica, así como el de la sierra con cañadas y mesetas (Ferrusquía-Villafranca, 1993; Nava et al., 1998). De acuerdo con la clasificación de Köppen, modificada por García (2004), el clima del área de estudio es seco cálido con régimen de lluvias de verano, isoterma intertropical y con canícula [BS1(h')w(w)(i)gw”]. La temperatura media anual es de 27.1° C y mayo es el mes que muestra la mayor temperatura (30.2° C); la precipitación total anual es de 755.4mm, de los cuales el 80% se concentra entre los meses de junio a septiembre, con una marcada estación seca que va de octubre a mayo (Fig. 2). El tipo de vegetación presente en el área corresponde al bosque tropical caducifolio (Rzedowski, 1978) o selva baja caducifolia (Miranda y Hernández-X., 1963), que generalmente se asienta sobre litosoles de textura media (Inifap y Conabio, 1995). El uso predominante de la vegetación en la zona es la crianza extensiva de ganado y la extracción de madera (Conanp, 2006).
Como una estrategia para incluir la mayor heterogeneidad florística y ambiental posible, los datos de la vegetación fueron registrados en 36 parcelas de 100m2 (10×10m), distribuidas en las partes bajas, medias y altas de 3 macizos montañosos (La Araña, El Ortigo y El Tukuy), cuya altitud oscila entre 380 y 780m. Las parcelas se establecieron en las laderas norte y sur, en sitios sin evidencia aparente de disturbio, aunque en el área la recolección de leña y el libre pastoreo de ganado, principalmente vacuno, son actividades frecuentes. En cada una de las unidades de muestreo se registraron todas las plantas arbóreas, incluyendo cactus arborescentes, que estuvieran enraizadas dentro de la parcela y con un diámetro a la altura del pecho (DAP) ≥1cm. Cada una de las plantas registradas fue identificada taxonómicamente y se midió su altura total, 2 diámetros de cobertura, lado mayor de la copa y el perpendicular a éste, así como el número y diámetro de sus tallos.
Análisis de estructura y diversidad. Se realizaron análisis de estas variables a nivel de parcela (36 de 0.01 ha) y para 0.1 ha, esto último con el objeto de contrastar estos atributos con trabajos similares que usaron esta superficie como área de muestreo. Para ello, de las 36 parcelas censadas se eligieron 10 al azar, sin reemplazo, obteniendo los valores de los atributos comunitarios de interés para las categorías diamétricas ≥1 y ≥2.5cm. Con respecto a la estructura se calcularon las siguientes variables: densidad, porcentaje de individuos policaules, cobertura, área basal, DAP y altura. De acuerdo con los procedimientos descritos por Mueller-Dombois y Ellenberg (1974), se calculó el valor de importancia de cada especie, usando los valores relativos de frecuencia, densidad y área basal (Apéndice). Asimismo, como primera medida de diversidad de la comunidad se obtuvo la riqueza de especies local (S) y se calcularon los siguientes índices (ver Magurran, 2004 para las fórmulas de éstos): i) el de dominancia de Simpson (D); ii) el de diversidad de Shannon (H'), usando el logaritmo natural para calcularlo; iii) el de equidad de H' y iv) el α de Fisher. Para este último, se usó el programa Paleontological Statistics (Hammer, 2012).
Variación de los atributos comunitarios. Para analizar la variación en la estructura y diversidad taxonómica entre las parcelas, se realizó un análisis de componentes principales (PCA) que incluyó variables de estructura (altura promedio por parcela, promedio de la cobertura, número de tallos, número de individuos, porcentaje de individuos policaules, área basal total y promedio del diámetro a la altura del pecho), de diversidad (índices de Simpson, Shannon y de a de Fisher), así como el número de familias, géneros y especies. Se realizaron correlaciones de Spearman para determinar el grado de asociación de las variables de respuesta a los ejes del PCA que mayor porcentaje de variación explicaron. Se consideró como significativa la prueba a un nivel de α≤0.05.
ResultadosComposiciónflorística. En los 3 sitios censados se registraron 78 especies, incluidas en 50 géneros y 24 familias de Magnoliophyta (Apéndice). El Cuadro 1 muestra que el 67% de la riqueza total de especies registradas pertenecen a Fabaceae (24), Burseraceae (10), Boraginaceae (8), Rubiaceae (6) y Euphorbiaceae (4). La primera de estas familias también presenta el mayor número de géneros (14), seguida de Euphorbiaceae y Rubiaceae (ambas con 4), aunque el más diverso pertenece a Burseraceae (Bursera, 10 spp.). La riqueza a nivel de familia se relaciona claramente con la abundancia de sus individuos, ya que Fabaceae (274 individuos), Rubiaceae (178), Euphorbiaceae (143), Boraginaceae (89) y Burseraceae (86) representan el 76% del total registrado. Con respecto a este último atributo, los géneros que destacan son Randia (145 individuos), Euphorbia (92), Bursera (86), Cordia (85) y Acacia (82), que en conjunto engloban el 48% del total.
Distribución del número (porcentaje) de géneros y especies en las familias más diversas, así como el número de especies en los géneros más importantes en la comunidad de árboles del bosque tropical caducifolio en Tziritzícuaro, Michoacán, México
| Familias | Géneros/Especies | Géneros | Especies |
|---|---|---|---|
| Fabaceae | 14 (28) / 24 (31) | Bursera | 10 (12) |
| Euphorbiaceae | 4 (8) / 4 (5) | Acacia | 4 (5) |
| Rubiaceae | 4 (8) / 6 (8) | Cordia | 4 (5) |
| Anacardiaceae | 3 (6) / 3 (4) | Mimosa | 4 (5) |
| Boraginaceae | 2 (4) / 8 (10) | Lonchocarpus | 3 (4) |
| Capparaceae | 2 (4) / 2 (3) | Lysiloma | 2 (3) |
| Malpighiaceae | 2 (4) / 2 (3) | Randia | 3 (4) |
| Malvaceae | 2 (4) / 2 (3) | Caesalpinia | 2 (2) |
| Polygonaceae | 2 (4) / 2 (3) | Erythroxylum | 2 (2) |
| Burseraceae | 1 (2) / 10 (12.8) | Amphipterygium | 1 (1) |
| Otras | 14 (28) / 15 (19.2) | Otros | 43 (56) |
Estructura. Se registraron 1 013 individuos y 2 313 tallos en las 36 parcelas de 100m2. Ninguna especie estuvo presente en todas las parcelas, y las de mayor frecuencia fueron Cordia elaeagnoides, Randia nelsonii, Apoplanesia paniculata y Euphorbia schlechtendalii (26, 22, 19 y 18 parcelas, respectivamente). Un total de 52 especies (66%) aparecieron en menos de 5 parcelas y 26 (33%) se registraron solamente en una. La densidad promedio fue de 28, con una desviación estándar (DE) de ±10 individuos, con valores entre 7 y 56 (Cuadro 2). Las 5 especies más abundantes fueron R. nelsonii, E. schlechtendalii, C. elaeagnoides, Acacia picachensis y Handroanthus impetiginosus (Apéndice). Con respecto al número de tallos, el promedio fue de 64±33 tallos (mínimo 17, máximo 189). El promedio del porcentaje de individuos policaules fue 54±17% y fue la variable estructural que presentó el menor coeficiente de variación (32%), con un intervalo que osciló de 17 al 100% (Cuadro 2). En cuanto al número de tallos nuevamente destacó R. nelsonii, seguida por C. elaeagnoides, A. paniculata, E. schlechtendalii y Bursera coyucensis.
Valores de los atributos estructurales y de diversidad en 36 parcelas de 100m2 del bosque tropical caducifolio en Tziritzícuaro, Michoacán. Se indica el número de parcela seguido de la abreviatura de la montaña donde se hizo el censo, OR, El Ortigo; TU, El Tukuy; AR, La Araña. Abreviaturas: CV, Coeficiente de variación; DAP, diámetro a la altura del pecho; DE, Desviación estándar; Ind Pol, individuos policaules; S, número de especies
| Diversidad | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Unidad de muestreo | Estructura densidad (individuos) | Ind Pol (%) | Cobertura (m2) | Área basal (m2) | DAP (cm) | Altura (m) | S | Simpson D | Shannon H' | Fisher α | Shannon E |
| 1 OR | 23 | 35 | 1 003 | 0.13 | 5.80 | 5.14 | 13 | 0.08 | 2.34 | 12.38 | 0.91 |
| 2 OR | 56 | 34 | 373 | 0.09 | 3.11 | 4.53 | 8 | 0.42 | 1.12 | 2.55 | 0.54 |
| 3 OR | 55 | 45 | 371 | 0.11 | 3.12 | 3.23 | 9 | 0.53 | 1.09 | 3.06 | 0.50 |
| 4 OR | 19 | 47 | 252 | 0.14 | 7.28 | 6.24 | 10 | 0.10 | 2.10 | 8.54 | 0.91 |
| 5 OR | 17 | 35 | 213 | 0.06 | 4.69 | 5.75 | 7 | 0.17 | 1.71 | 4.45 | 0.88 |
| 6 OR | 22 | 41 | 262 | 0.17 | 7.35 | 6.17 | 6 | 0.24 | 1.49 | 2.72 | 0.83 |
| 7 OR | 20 | 30 | 225 | 0.23 | 6.45 | 5.62 | 7 | 0.31 | 1.44 | 3.83 | 0.74 |
| 8 OR | 18 | 67 | 218 | 0.13 | 4.95 | 4.38 | 5 | 0.45 | 1.05 | 2.29 | 0.65 |
| 9 OR | 24 | 17 | 430 | 0.25 | 7.65 | 6.78 | 7 | 0.17 | 1.72 | 3.32 | 0.89 |
| 10 OR | 36 | 39 | 438 | 0.44 | 7.59 | 5.26 | 16 | 0.07 | 2.57 | 11.04 | 0.93 |
| 11 OR | 22 | 45 | 197 | 0.09 | 4.56 | 4.58 | 7 | 0.17 | 1.73 | 3.54 | 0.89 |
| 12 OR | 7 | 100 | 173 | 0.09 | 7.38 | 6.08 | 2 | 0.71 | 0.41 | 0.94 | 0.59 |
| 13 TU | 24 | 58 | 169 | 0.17 | 4.60 | 4.25 | 16 | 0.03 | 2.69 | 20.98 | 0.97 |
| 14 TU | 37 | 51 | 318 | 0.21 | 4.49 | 4.54 | 14 | 0.12 | 2.26 | 8.20 | 0.86 |
| 15 TU | 25 | 52 | 250 | 0.23 | 5.34 | 4.60 | 12 | 0.09 | 2.27 | 9.06 | 0.91 |
| 16 TU | 22 | 55 | 208 | 0.11 | 4.04 | 4.34 | 9 | 0.13 | 2.05 | 5.69 | 0.93 |
| 17 TU | 29 | 52 | 275 | 0.15 | 4.13 | 4.30 | 9 | 0.20 | 1.76 | 4.47 | 0.80 |
| 18 TU | 40 | 35 | 384 | 0.18 | 4.64 | 4.39 | 18 | 0.08 | 2.62 | 12.59 | 0.91 |
| 19 TU | 29 | 90 | 166 | 0.13 | 3.30 | 3.13 | 14 | 0.07 | 2.46 | 10.65 | 0.93 |
| 20 TU | 22 | 68 | 309 | 0.16 | 4.30 | 4.52 | 11 | 0.10 | 2.17 | 8.76 | 0.91 |
| 21 TU | 15 | 47 | 233 | 0.19 | 6.05 | 3.91 | 11 | 0.04 | 2.34 | 18.60 | 0.98 |
| 22 TU | 36 | 64 | 415 | 0.35 | 5.58 | 3.99 | 16 | 0.08 | 2.52 | 11.04 | 0.91 |
| 23 TU | 20 | 30 | 258 | 0.16 | 7.01 | 5.51 | 8 | 0.13 | 1.89 | 4.94 | 0.91 |
| 24 TU | 31 | 65 | 266 | 0.11 | 3.60 | 4.16 | 10 | 0.22 | 1.81 | 5.12 | 0.78 |
| 25 AR | 25 | 64 | 349 | 0.25 | 4.78 | 4.62 | 13 | 0.09 | 2.32 | 10.92 | 0.91 |
| 26 AR | 28 | 68 | 542 | 0.21 | 4.73 | 5.68 | 6 | 0.32 | 1.35 | 2.34 | 0.75 |
| 27 AR | 27 | 52 | 428 | 0.36 | 5.92 | 5.30 | 10 | 0.14 | 2.00 | 5.75 | 0.87 |
| 28 AR | 29 | 66 | 209 | 0.15 | 4.08 | 4.15 | 12 | 0.07 | 2.35 | 7.67 | 0.94 |
| 29 AR | 40 | 55 | 476 | 0.25 | 5.52 | 4.72 | 15 | 0.23 | 2.01 | 8.72 | 0.74 |
| 30 AR | 36 | 67 | 238 | 0.12 | 3.56 | 3.91 | 12 | 0.12 | 2.17 | 6.30 | 0.88 |
| 31 AR | 41 | 71 | 196 | 0.19 | 2.89 | 2.94 | 13 | 0.10 | 2.29 | 6.56 | 0.89 |
| 32 AR | 21 | 71 | 289 | 0.19 | 6.10 | 4.41 | 5 | 0.25 | 1.41 | 2.08 | 0.87 |
| 33 AR | 25 | 60 | 353 | 0.15 | 4.76 | 4.43 | 9 | 0.11 | 2.05 | 5.04 | 0.93 |
| 34 AR | 40 | 73 | 233 | 0.28 | 4.63 | 3.42 | 17 | 0.13 | 2.32 | 11.17 | 0.82 |
| 35 AR | 18 | 61 | 124 | 0.11 | 4.31 | 3.43 | 8 | 0.14 | 1.85 | 5.52 | 0.89 |
| 36 AR | 34 | 38 | 314 | 0.29 | 5.74 | 4.76 | 11 | 0.21 | 1.89 | 5.64 | 0.79 |
| Total | 1013 | 53 | 11156 | 6.65 | – | – | 78 | 0.05 | 3.50 | 21 | 0.80 |
| Promedio | 28 | 54 | 310 | 0.18 | 5.11 | 4.64 | 10 | 0.18 | 1.98 | 7.50 | 0.84 |
| DE | 10 | 17 | 154 | 0.08 | 1.35 | 0.92 | 4 | 0.15 | 0.51 | 4.99 | 0.12 |
| CV (%) | 37 | 32 | 50 | 45 | 26 | 20 | 37 | 80 | 26 | 67 | 14 |
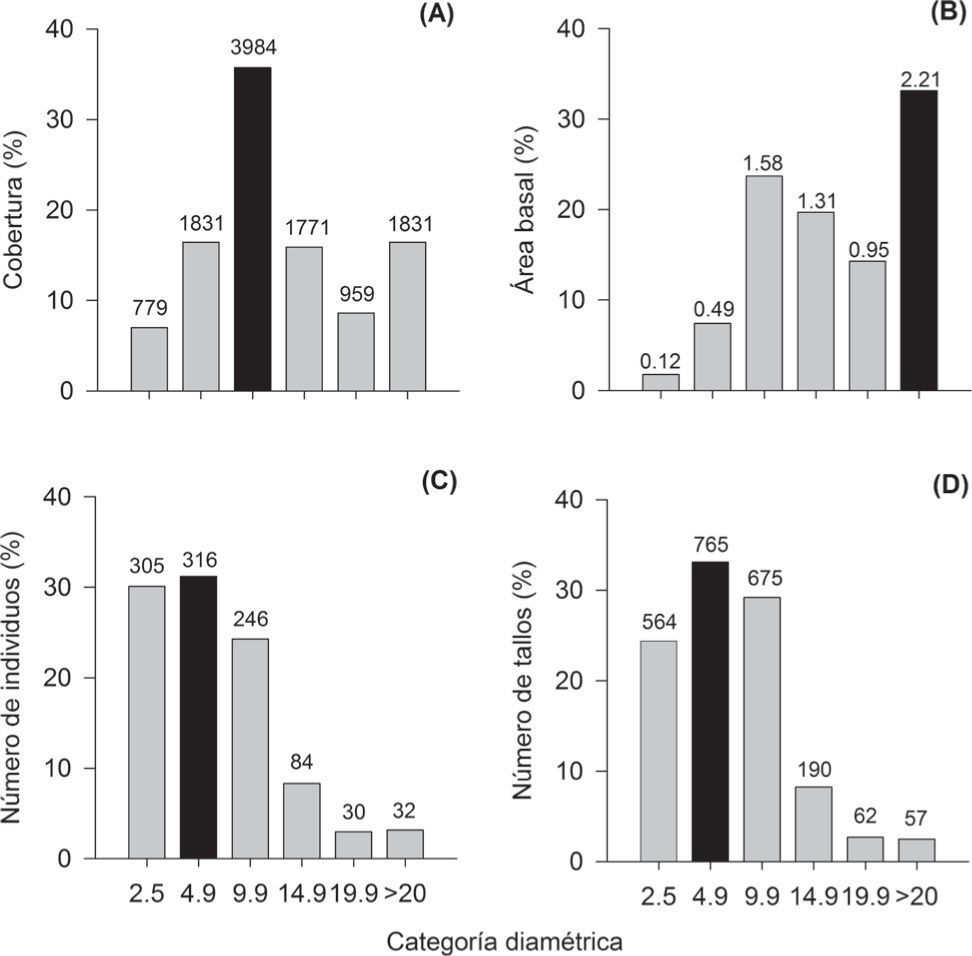
El promedio de la cobertura para el total de parcelas fue de 310±154m2. El valor mínimo fue de 124m2 y el máximo de 1 003m2 (Cuadro 2). Esta variable fue la que mostró el mayor coeficiente de variación (50%) y se caracterizó porque los individuos con DAP entre 5 a 9.9cm presentaron los valores más altos de cobertura (Fig. 3A). Las 5 especies que se destacaron, en cuanto a sus valores de cobertura fueron (Apéndice): C. elaeagnoides (1 608m2), Lysiloma microphylla (956m2), A. picachensis (799m2), Acacia cochliacantha (725m2) y R. nelsonii (722m2).
Síntesis estructural para la comunidad de árboles en 36 parcelas de 100m2 del bosque tropical caducifolio en Tziritzícuaro, Michoacán, México. Los números por encima de las barras son los valores absolutos de las variables en cada categoría diamétrica. La barra de color negro muestra el valor más alto del atributo.
El promedio del área basal fue de 0.18±0.08m2, con el valor más bajo de 0.06m2 y el mayor de 0.44m2 (Cuadro 2). Los individuos con un diámetro ≥20cm son los que tuvieron el mayor aporte al valor total de área basal (33%; Fig. 3B). Un total de 10 especies contribuyeron con más del 60% del área basal (Apéndice), destacando C. elaeagnoides (18.6%), Cyrtocarpa procera (8.2%), L. microphylla (7.9%), A. paniculata (6.7%) y Cochlospermum vitifolium (4.2%). El promedio del DAP fue de 5.1±1.4cm y el intervalo osciló entre 2.9 y 7.7cm (Cuadro 2). Los individuos y los tallos de 1 a 4.9cm representan el 61 y 54% del total registrado, respectivamente (Figs. 3C, D). Las especies con los valores promedio de DAP más sobresalientes fueron C. vitifolium (42±5.8), Pterocarpus orbiculatus (24±0), Stenocereus queretaroensis (22±6.7) y Bursera heteresthes (17±5.6).
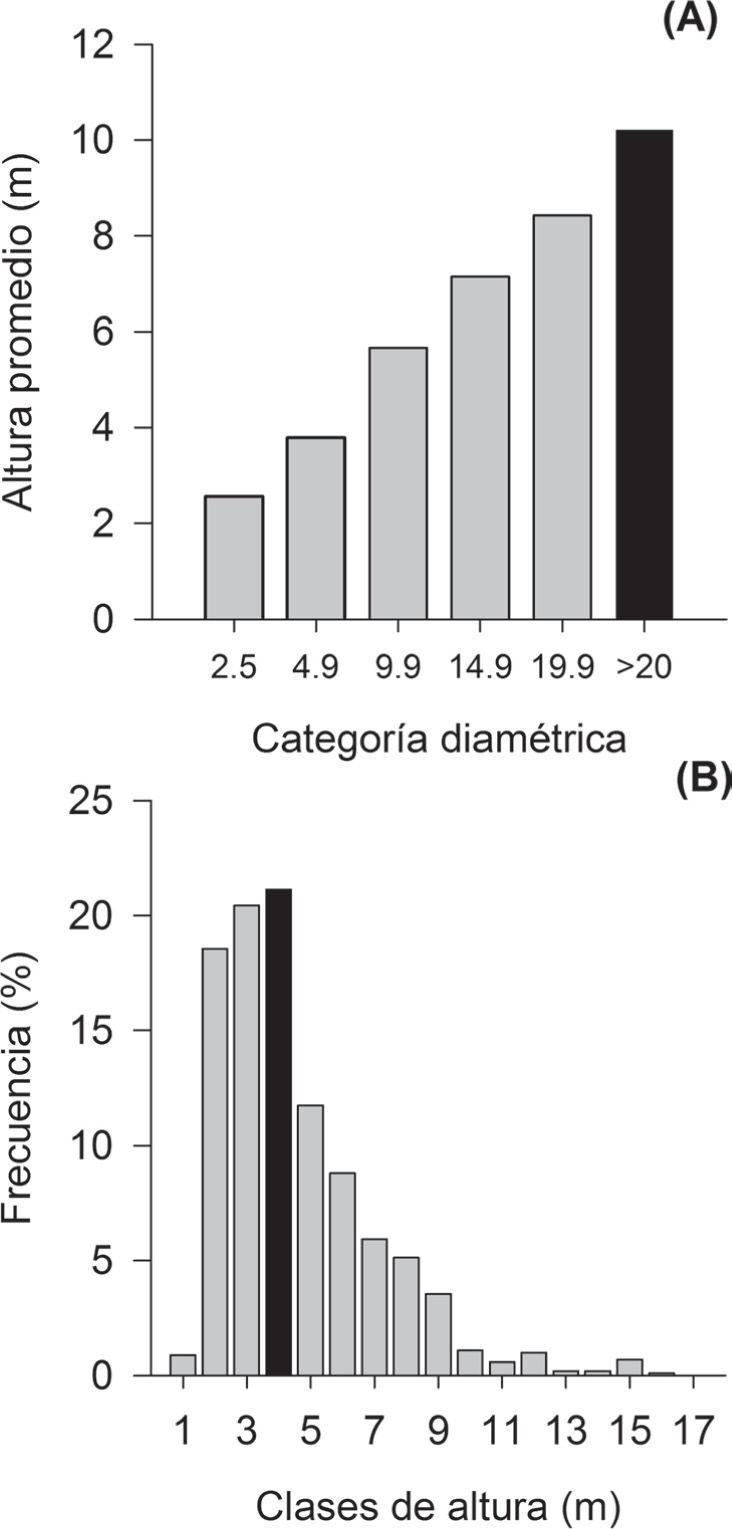
La altura promedio en el total de parcelas muestreadas fue de 4.6±0.9m, con un intervalo de 2.9 a 6.8m (Cuadro 2). Las plantas con un diámetro ≥20cm presentaron la mayor altura promedio, mientras que la frecuencia más alta se presenta en los individuos de 4m (Fig. 4). La especie con mayor estatura fue H. impetiginosus (16m), mientras que 3 alcanzaron una altura de 15m (C. vitifolium,C. elaeagnoides y L. microphylla). Los resultados de los valores de importancia relativa (VIR) muestran que las 5 especies estructuralmente más importantes en orden decreciente fueron (Apéndice): C. elaeagnoides (33.45), R. nelsonii (23.22), E. schlechtendalii (16.34), A. paniculata (15.85) y L. microphylla (15.01).
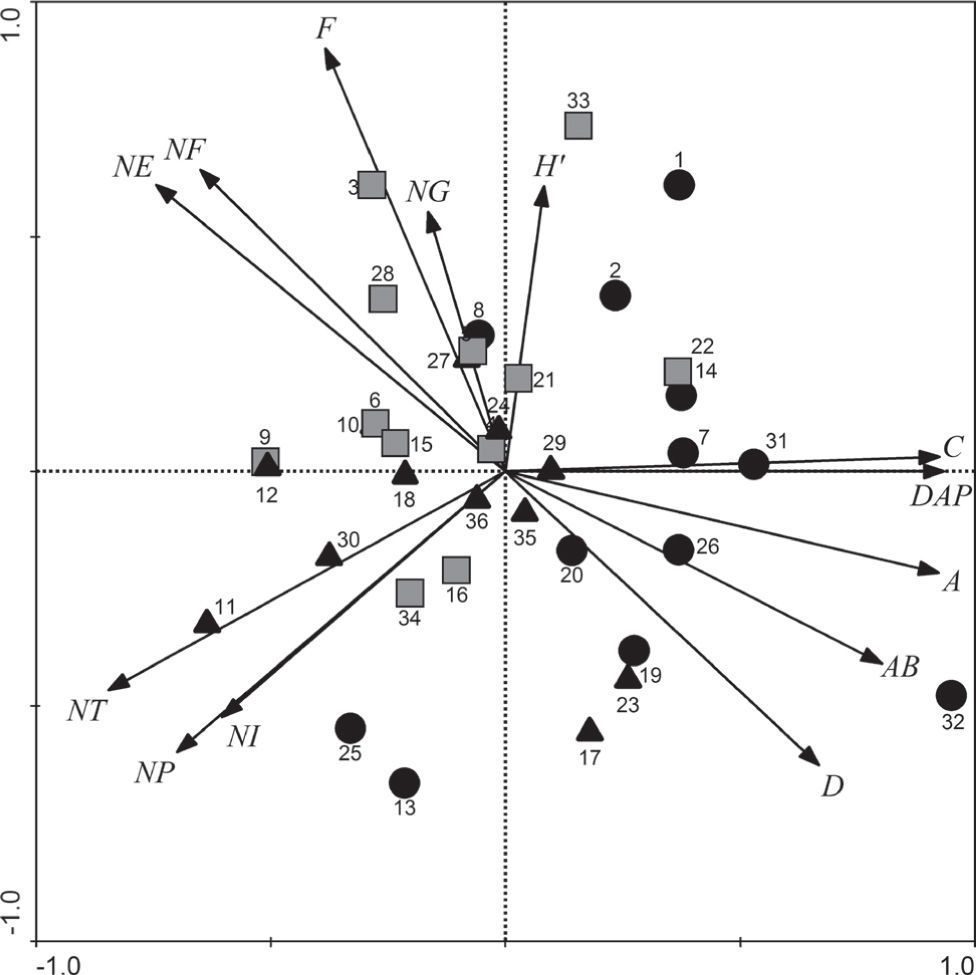
El análisis multivariado indica que el 85% de la variación en los datos es explicada por los 2 primeros ejes (eje 1, 56%; eje 2, 29%). Con la excepción del área basal, las variables estructurales se relacionan significativamente con el eje 1 del PCA, mientras que, en general, las variables de diversidad están asociadas con el eje 2 (Cuadro 3). Las parcelas ubicadas hacia el lado derecho de la figura 5 están principalmente afectadas por las variables estructurales (e. g., cobertura o altura). Por otro lado, las parcelas localizadas a la izquierda del cuadrante superior se caracterizan por tener valores altos en las distintas categorías taxonómicas que presentan y en el índice alfa de Fisher, mientras que en la parte inferior izquierda se presentan aquellas con los valores mayores de abundancia.
Coeficientes de correlación de Spearman obtenidos de relacionar los valores estructurales y de diversidad de la comunidad de árboles del bosque tropical caducifolio y los puntajes de los ejes del análisis de componentes principales. n=36; ***p≤0.001, **p≤0.01 y *p≤0.05
| Variable | Eje 1 | Eje 2 |
|---|---|---|
| Altura | 0.76** | 0.01 |
| Cobertura | 0.79*** | 0.21 |
| Número de tallos | −0 91*** | −0.30 |
| Número de individuos | −0 78*** | −0.25 |
| Individuos policuales | −0.85*** | −0.36* |
| Área basal | 0.01 | 0.25 |
| Diámetro a la altura del pecho | 0 72*** | 0.29 |
| Índice de Simpson | 0.37* | −0.79*** |
| Índice de Shannon | −0.53** | 0.73*** |
| Índice α de Fisher | −0.49* | 0.78*** |
| Número de especies | −0.72*** | 0.54*** |
| Número de géneros | −0.47** | 0.56*** |
| Número de familias | −0.64*** | 0.59*** |
Análisis de componentes principales (PCA) de los atributos estructurales y de diversidad de la comunidad arbórea del bosque tropical caducifolio en Tziritzícuaro, Michoacán. El porcentaje de varianza explicada por el eje uno y dos del PCA fue de 57% y 22%, respectivamente. Los símbolos representan a los sitios asentados en los cerros El Ortigo (•), El Tukuy (
▪) y La Araña (▴). Abreviaturas: altura (A), área basal (AB), cobertura (C), Simpson (D), diámetro a la altura del pecho (DAP), α de Fisher (F), número de familias (NF), número de géneros (NG), número de individuos (NI), número de individuos policaules (NP), número de especies (NE), número de tallos (NT) y Shannon (H').
Diversidad.La riqueza promedio en las parcelas muestreadas fue de 10±4 especies (intervalo: 2-19 especies). El valor obtenido para el índice de Simpson (0.05) y su promedio (0.18±0.15) muestran un bajo nivel de dominancia dentro de la comunidad, aunque este atributo resultó ampliamente variable entre las unidades de muestreo, lo que concuerda con los valores obtenidos para el índice de equitatividad (Cuadro 2), con un coeficiente de variación de 80%. El valor promedio del índice de Shannon fue de 2±0.5, con valores de 0.41 a 2.69 y un coeficiente de variación del 26%. El índice a de Fisher promedió 7.5±4.9, con una variabilidad alta (67%) y un valor global de 21 (Cuadro 2).
DiscusiónComposición florística. En el presente estudio se encontró que la familia con mayor número de especies, géneros e individuos fue Fabaceae (Cuadro 1). Este hallazgo coincide con numerosos estudios desarrollados en los bosques secos de México, Centro y Sudamérica (Lott et al., 1987; Gentry, 1988; Gillespie et al., 2000; Phillips y Miller, 2002; Trejo y Dirzo, 2002; Gallardo-Cruz et al., 2005; Ruiz et al., 2005; Lott y Atkinson, 2006; Pineda-García et al., 2007; Pérez-García et al., 2010; Almazán-Núñez et al., 2012; Martínez-Cruz et al., 2013). De hecho, la revisión de Rzedowski y Calderón de Rzedowski (2013), sobre la flora fanerogámica del BTC, confirma la predominancia indudable de esta familia. Asimismo, en Tziritzícuaro, las familias Burseraceae, Euphorbiaceae y Rubiaceae ocupan posiciones importantes en lo que concierne al número de especies, lo que coincide con lo documentado en estudios previos (Gentry, 1995; Phillips y Miller, 2002; Gallardo-Cruz et al., 2005; Cué-Bär et al., 2006; Sousa, 2010; Almazán-Núñez et al., 2012).
A nivel genérico no sorprende encontrar que el taxón con mayor número de especies en Tziritzícuaro sea Bursera (Cuadro 1), ya que la cuenca del Balsas ha sido reconocida como centro de endemismo y diversificación de este taxón (Rzedowski, 1978, 1991; Becerra, 2005; De-Nova et al., 2012). Cabe destacar que Michoacán y Oaxaca comparten la segunda posición a nivel nacional respecto al número de especies en este género (37), sólo superadas por Guerrero, con 47 especies (Rzedowski et al., 2005). Se postula que la gran diversidad de Bursera se debe en parte a procesos geográficos como el levantamiento de la sierra Madre Occidental y el Eje Neovolcánico Transmexicano, eventos que sucedieron durante los periodos Terciario y Cuaternario (Becerra, 2005; Rzedowski et al., 2005) y que permitieron su radiación, principalmente a lo largo de la vertiente del Pacífico y la cuenca del Balsas. Otros géneros que se destacaron también en este estudio y que han sido clasificados previamente como de amplia distribución en el neotrópico, especialmente en los bosques secos son: Acacia, Caesalpinia, Cordia, Euphorbia, Lonchocarpus, Lysiloma, Mimosa y Randia (Gentry, 1995). Todos estos taxones son mencionados por Rzedowski y Calderón de Rzedowski (2013), entre los que contienen mayor número de especies y que habitan preferencial o exclusivamente en el BTC.
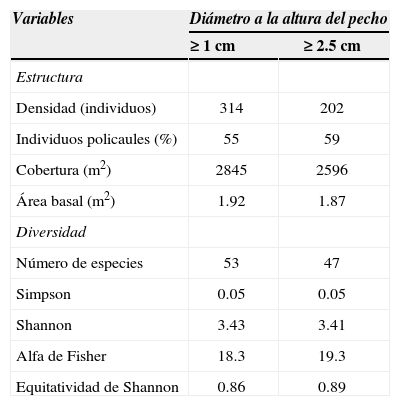
Estructura. Los valores de densidad en 0.1 ha (314 individuos ≥1cm y 202 individuos ≥2.5cm) obtenidos para Tziritzícuaro (Cuadro 4), se ubican dentro de las cifras previamente documentadas para este tipo de vegetación en México (203-583 individuos ≥1cm DAP; Lott et al., 1987; Trejo, 2005) y para otras comunidades del neotrópico seco donde se censaron entre 135 y 520 individuos ≥2.5cm de DAP (Keel et al., 1993; Gentry, 1995; Gillespie et al., 2000; Phillips y Miller, 2002; Pineda-García et al., 2007; Martínez-Cruz et al., 2013). La policaulescencia fue un atributo notable debido a su alta frecuencia, ya que 61.1% de las unidades de muestreo se caracterizaron por tener más del 50% de sus individuos con más de un tallo (Cuadro 2) y lo mismo acontece cuando se compara este porcentaje en un área de 0.1 ha (Cuadro 4). La presencia de árboles con tallos múltiples constituye un rasgo característico de los bosques tropicales secos (Dunphy et al., 2000; Gallardo-Cruz et al., 2005, 2009).
Atributos estructurales y de diversidad en 0.1 ha (10 parcelas de 100m2) para 2 categorías diamétricas de las especies arbóreas del bosque tropical caducifolio en Tziritzícuaro, Michoacán. Las parcelas fueron elegidas al azar y sin reemplazo de las 36 originalmente muestreadas en toda el área
| Variables | Diámetro a la altura del pecho | |
|---|---|---|
| ≥1cm | ≥2.5cm | |
| Estructura | ||
| Densidad (individuos) | 314 | 202 |
| Individuos policaules (%) | 55 | 59 |
| Cobertura (m2) | 2845 | 2596 |
| Área basal (m2) | 1.92 | 1.87 |
| Diversidad | ||
| Número de especies | 53 | 47 |
| Simpson | 0.05 | 0.05 |
| Shannon | 3.43 | 3.41 |
| Alfa de Fisher | 18.3 | 19.3 |
| Equitatividad de Shannon | 0.86 | 0.89 |
Los valores de cobertura promedio muestran que existe un alto porcentaje (>300) de superposición de las copas de los árboles en el dosel del BTC estudiado (Cuadro 2), en particular de los individuos con DAP cercanos a los 10cm (Fig. 3), una situación análoga a lo obtenido para el BTC de Nizanda (Gallardo-Cruz et al., 2005; Pérez-García y Meave, 2004). El área basal promedio para los individuos ≥2.5cm de DAP fue de 1.87m2 (Cuadro 4), la cual es similar a lo registrado en localidades de Jalisco y Michoacán por Lott et al. (1987) y Martínez-Cruz et al. (2013). Este valor está por debajo del promedio registrado para el neotrópico, que es de 3.2m2 (Gentry, 1995; Salas-Morales, 2002).
La altura promedio registrada en el área de estudio (4.6m; Cuadro 2) también resultó parecida a la que se obtuvo en Cerro Verde, Oaxaca (4.1m, Gallardo-Cruz et al., 2005), pero menor a los 6 y 8m registrados en distintas localidades de México e islas del Caribe (Kapos, 1986; Murphy y Lugo, 1986; Martínez-Yrízar et al., 1992, 1996; González y Zak, 1996; Salas-Morales, 2002; Segura et al., 2002; Gallardo-Cruz et al., 2005; McLaren et al., 2005; Durán et al., 2006; Álvarez-Yépiz et al., 2008).
El análisis mutivariado muestra que el BTC de Tziritzícuaro presenta una alta variación (>80%), en cuanto a sus atributos comunitarios de riqueza, estructura y diversidad, pero en términos generales reitera su equivalencia con el BTC localizado a lo largo del neotrópico (Gentry, 1995; Phillips y Miller, 2002; Trejo y Dirzo, 2002; Gallardo-Cruz et al., 2005; Lott y Atkinson, 2006; Pineda-García et al., 2007; Pérez-García et al., 2010; Martínez-Cruz et al., 2013). Esta gran heterogeneidad en los rasgos comunitarios se ha explorado con cierto detalle en diversas regiones del mundo y ha sido relacionado con la variación de factores ambientales (e. g., insolación, temperatura y humedad) que se puede presentar en los paisajes naturales debido a factores geográficos como el relieve y la geomorfología (Gallardo-Cruz et al., 2005; Durán et al., 2006; Warren, 2008, 2010; Flores et al., 2009; Reich et al., 2010; Li et al., 2011). No obstante, este tipo de relaciones aún tienen que ser evaluadas en el área de estudio.
Diversidad. En el submuestreo de 0.1 ha (Cuadro 4) se cuantificaron 53 y 47 especies, tomando en cuenta individuos ≥1 y ≥2.5cm de DAP, respectivamente; este contingente florístico incluye para la categoría diamétrica menor 20 familias y 36 géneros, mientras que para la segunda estos taxones registran valores ligeramente menores (18 y 32). Nuevamente la riqueza de las categorías supraespecíficas es casi idéntica a la registrada en varias localidades de México y del neotrópico (Murphy y Lugo, 1986; Gentry, 1995; Trejo y Dirzo, 2002; Pineda-García et al., 2007; Martínez-Cruz et al., 2013). A nivel de especie, el valor obtenido en el BTC de Tziritzícuaro se ubicó dentro del intervalo registrado para este tipo de vegetación en México (Trejo y Dirzo, 2002), aunque por debajo del promedio nacional (74±24 especies). Asimismo, la riqueza es lejana de los valores más altos (>100 especies) documentados para el BTC del neotrópico (Gentry, 1995) y a nivel mundial (Phillips y Miller, 2002). De hecho, la cifra de este atributo de diversidad se parece más a las obtenidas previamente por Pineda-García et al. (2007), Martínez-Cruz et al. (2013) y a los de otras localidades del país estudiadas por Trejo (2005) (e. g., La Burrera, Baja California; Cerro Zináparo, Michoacán; Jesús María, Nayarit; Calipam, Puebla). Al compararlos con otros sitios localizados en América, los valores de los índices de diversidad (Cuadro 4) siguen tendencias similares a las descritas para el número de especies.
Conclusiones. Los resultados del presente estudio permiten afirmar que la composición, estructura y diversidad del BTC en Tziritzícuaro son comparables con lo detectado para este tipo de vegetación en otras localidades de México y del continente Americano. Estos atributos comunitarios podrían ser mejor entendidos si se analizará la influencia de factores ambientales críticos como la topografía, diferentes tipos de suelo o el efecto del disturbio por actividades agropastoriles (Robert y Marie-Agnes, 2003; Lebrija-Trejos et al., 2010; Eisenlohr et al., 2013). También puede ser pertinente evaluar la variación de atributos funcionales de las especies a lo largo de gradientes ambientales de disponibilidad de humedad, un enfoque de investigación relativamente reciente y promisorio para entender los patrones de estructuración y mantenimiento de la biodiversidad en el BTC (McGill et al., 2006; Li et al., 2011; Pavoine y Bonsall, 2011). El establecimiento de parcelas permanentes, que incluso puedan reflejar diferentes tiempos de disturbio (e. g., Lebrija-Trejos et al., 2010, 2011), serían especialmente valiosas para el desarrollo de este tipo de investigaciones, lo que contribuiría en la conservación del BTC de la Depresión del Balsas, una región prioritaria al respecto a una escala global (Olson y Dinerstein, 2002).
El presente estudio forma parte de la investigación doctoral del primer autor y constituye un requisito para la obtención del grado de Doctor en Ciencias del Posgrado en Ciencias Biológicas de la Universidad Nacional Autónoma de México. El primer autor agradece al Conacyt por la beca para desarrollar sus estudios de doctorado. Esta investigación fue apoyada por el Programa de Apoyo a Proyectos de Investigación e Innovación Tecnológica (PAPIIT) de la UNAM, como parte del proyecto IN207512 (Fenología de especies arbóreas del bosque tropical caducifolio en la Depresión del Balsas, Michoacán). Se agradece a Patricio y Jesús Rosas, habitantes de la localidad de Tziritzícuaro, por la asistencia en el trabajo de campo realizado en el presente estudio. A la Ing. Atzimba López-Maldonado, al Ing. Alberto Valencia-García y al MTI. Heberto Ferreira-Medina, por apoyar diversos aspectos técnicos del trabajo de cómputo. La ayuda de la M. en C. Guadalupe Cornejo-Tenorio fue invaluable en la identificación de las plantas censadas y en la elaboración final de las figuras. Los comentarios realizados al documento por 3 árbitros anónimos y por el Dr. Ramón Cuevas-Guzmán contribuyeron a mejorar sustancialmente una versión previa del trabajo.
Lista de especies y valores de importancia relativa (VIR) de los árboles registrados en 36 unidades de muestreo de 100m2 (0.36 ha) establecidas en el bosque tropical caducifolio de Tziritzícuaro, Michoacán. Abreviaturas: AB, área basal; AT, altura total; D, densidad; ind., individuos; FR, frecuencia.
| Especie | AT (m) | D (ind.) | AB (m2) | FR | VIR (%) |
|---|---|---|---|---|---|
| Cordia elaeagnoides DC. | 5.6 | 803 | 1.2411 | 26 | 33.45 |
| Randia nelsonii Greenm. | 3.4 | 1 351 | 0.2682 | 22 | 23.22 |
| Euphorbia schlechtendalii Boiss. | 4.0 | 922 | 0.1643 | 18 | 16.34 |
| Apoplanesia paniculata C. Presl | 5.6 | 417 | 0.4494 | 19 | 15.85 |
| Lysiloma microphylla (Jacq.) J. F. Macbr. | 7.8 | 408 | 0.5235 | 12 | 15.01 |
| Acacia picachensis Brandegee | 5.4 | 714 | 0.2656 | 8 | 13.12 |
| Cyrtocarpa procera Kunth | 6.6 | 15 | 0.5477 | 9 | 12.09 |
| Handroanthus impetiginosus (Mart. ex DC.) Mattos | 3.6 | 645 | 0.1118 | 7 | 9.85 |
| Lippia umbellata Cav. | 2.9 | 466 | 0.0469 | 17 | 9.76 |
| Amphipterygium adstringens (Schltdl.) Standl. | 3.8 | 24 | 0.2461 | 13 | 9.52 |
| Mimosa arenosa (Willd.) Poir. | 6.9 | 21 | 0.233 | 9 | 7.97 |
| Lysiloma tergemina Benth. (ver http://www.theplantlist.org/tpl1.1/record/ild-33622) | 4.4 | 23 | 0.127 | 12 | 7.37 |
| Croton morifolius Willd. | 3.2 | 359 | 0.037 | 11 | 6.95 |
| Bursera coyucensis Bullock | 3.0 | 2 610 | 0.201 | 5 | 6.92 |
| Hintonia latiflora (Sessé y Moc. ex DC.) Bullock | 4.7 | 24 | 0.101 | 11 | 6.82 |
| Heliocarpus occidentalis Rose | 5.7 | 21 | 0.125 | 9 | 6.35 |
| Bursera grandifolia (Schltdl.) Engl. | 4.7 | 15 | 0.127 | 9 | 5.79 |
| Cochlospermum vitifolium (Willd.) Spreng. | 11.3 | 2 | 0.281 | 2 | 4.95 |
| Lonchocarpus longipedunculatus M. Sousa y J. C. Soto | 5.6 | 11 | 0.093 | 8 | 4.62 |
| Bursera crenata Paul G. Wilson | 5.9 | 9 | 0.190 | 3 | 4.54 |
| Plumeria rubra L. | 4.6 | 7 | 0.154 | 5 | 4.33 |
| Bursera fagaroides (Kunth) Engl. | 3.6 | 11 | 0.062 | 8 | 4.15 |
| Lonchocarpus constrictus Pittier | 8.0 | 10 | 0.103 | 4 | 3.60 |
| Brogniartia sp. | 3.7 | 10 | 0.032 | 6 | 3.07 |
| Bursera heteresthes Bullock | 8.8 | 4 | 0.111 | 3 | 2.87 |
| Bursera sp. | 5.9 | 4 | 0.072 | 4 | 2.54 |
| Acacia coulteri Benth. | 4.8 | 7 | 0.013 | 6 | 2.49 |
| Bunchosia palmeri S. Watson | 4.4 | 6 | 0.019 | 6 | 2.48 |
| Bursera trimera Bullock | 3.4 | 8 | 0.018 | 5 | 2.40 |
| Manihot tomatophylla Standl. | 4.1 | 5 | 0.053 | 4 | 2.35 |
| Guettarda elliptica Sw. | 3.0 | 6 | 0.007 | 6 | 2.30 |
| Erythroxylum mexicanum Kunth | 3.5 | 5 | 0.025 | 5 | 2.20 |
| Spondias purpurea L. | 4.9 | 6 | 0.018 | 5 | 2.19 |
| Diphysa floribunda Peyr. | 3.4 | 8 | 0.017 | 4 | 2.11 |
| Bauhinia divaricata L. | 5.0 | 6 | 0.018 | 4 | 1.93 |
| Stenocereus queretaroensis (F.A.C. Weber) Buxb. | 4.7 | 2 | 0.078 | 2 | 1.90 |
| Bursera copallifera (DC.) Bullock | 3.9 | 5 | 0.031 | 3 | 1.76 |
| Mimosa rosei B. L. Rob. | 2.8 | 6 | 0.003 | 4 | 1.70 |
| Cnidoscolus multilobus (Pax) I. M. Johnst. | 4.4 | 11 | 0.019 | 1 | 1.64 |
| Genipa americana L. | 4.4 | 3 | 0.036 | 3 | 1.63 |
| Malpighia mexicana A. Juss. | 4.7 | 4 | 0.029 | 3 | 1.63 |
| Ceiba aesculifolia (Kunth) Britten y Baker f. | 6.8 | 3 | 0.052 | 2 | 1.61 |
| Erythroxylum rotundifolium Lunan | 3.7 | 5 | 0.016 | 3 | 1.54 |
| Jacaratia mexicana A. DC. | 6.3 | 3 | 0.029 | 3 | 1.53 |
| Randia aculeata L. | 3.1 | 9 | 0.006 | 2 | 1.51 |
| Ruprechtia fusca Fernald | 3.0 | 7 | 0.004 | 2 | 1.28 |
| Pouzolzia occidentalis (Liebm.) Wedd. | 2.0 | 4 | 0.002 | 3 | 1.23 |
| Colubrina triflora Brongn. ex Sweet | 4.0 | 5 | 0.013 | 2 | 1.21 |
| Caesalpinia platyloba S. Watson | 4.0 | 2 | 0.030 | 2 | 1.19 |
| Haematoxylum brasiletto H. Karst. | 3.9 | 3 | 0.003 | 3 | 1.14 |
| Pterocarpus orbiculatus DC. | 10.0 | 1 | 0.046 | 1 | 1.05 |
| Lonchocarpus balsensis M. Sousa y J. C. Soto | 4.2 | 2 | 0.020 | 2 | 1.04 |
| Bursera infernidialis Guevara y Rzed. | 3.4 | 3 | 0.025 | 1 | 0.94 |
| Mimosa benthamii J. F. Macbr. | 3.7 | 3 | 0.007 | 2 | 0.93 |
| Coccoloba acapulcensis Standl. | 5.7 | 4 | 0.016 | 1 | 0.91 |
| Acacia cochliacantha Humb. y Bonpl. ex Willd. | 4.0 | 2 | 0.004 | 2 | 0.78 |
| Cordia morelosana Standl. | 2.9 | 2 | 0.001 | 2 | 0.74 |
| Boraginaceae sp. 2 | 6.9 | 1 | 0.025 | 1 | 0.74 |
| Cordia alliodora (Ruiz y Pav.) Oken | 4.8 | 2 | 0.016 | 1 | 0.70 |
| Malvaceae | 3.0 | 3 | 0.004 | 1 | 0.62 |
| Bursera denticulata McVaugh y Rzed. | 5.0 | 1 | 0.011 | 1 | 0.52 |
| Boraginaceae sp. 3 | 4.9 | 1 | 0.010 | 1 | 0.51 |
| Caesalpinia eriostachys Benth. | 7.7 | 1 | 0.009 | 1 | 0.51 |
| Acacia macilenta Rose | 4.2 | 2 | 0.002 | 1 | 0.50 |
| Capparis indica (L.) Druce | 4.5 | 2 | 0.002 | 1 | 0.49 |
| Coursetia glandulosa A. Gray | 6.0 | 1 | 0.006 | 1 | 0.46 |
| Karwinskia latifolia Standl. | 3.7 | 1 | 0.004 | 1 | 0.43 |
| Sideroxylon celastrinum (Kunth) T. D. Penn. | 6.4 | 1 | 0.003 | 1 | 0.41 |
| Boraginaceae sp. 1 | 6.6 | 1 | 0.002 | 1 | 0.40 |
| Gyrocarpus jatrophifolius Domin | 2.6 | 1 | 0.001 | 1 | 0.38 |
| Pithecellobium dulce (Roxb.) Benth. | 1.7 | 1 | 0.001 | 1 | 0.38 |
| Cordia nelsonii I.M. Johnst. | 1.6 | 1 | 0.001 | 1 | 0.37 |
| Piscidia piscipula (L.) Sarg. | 1.5 | 1 | 0.0004 | 1 | 0.37 |
| Mimosa sp. | 5.0 | 1 | 0.0004 | 1 | 0.37 |
| Randia echinocarpa Moc. y Sessé ex DC. | 2.7 | 1 | 0.0004 | 1 | 0.37 |
| Adelia oaxacana (Müll. Arg.) Hemsl. | 2.0 | 1 | 0.0003 | 1 | 0.37 |
| Especie no determinada | 1.7 | 1 | 0.0003 | 1 | 0.37 |
| Morisonia americana L. | 1.8 | 1 | 0.0001 | 1 | 0.37 |