Se analizaron los patrones de variación espacial y temporal de las comunidades bentónicas submareales de una bahía arenosa semiexpuesta en relación con las condiciones ambientales. Se seleccionaron 4 estaciones de muestreo con diferentes condiciones como tamaño de sedimento, exposición al oleaje y proximidad de descargas de agua continental, y se realizó un muestreo mensual utilizando una bomba de succión durante un ciclo anual. Se tomaron muestras de sedimento para su análisis granulométrico y su contenido en materia orgánica. Para los análisis estadísticos los datos fueron agrupados en 2 periodos hidroclimáticos: verano e invierno. La parte norte de la bahía presentó sedimento más fino como limos y arcillas, mayor porcentaje de materia orgánica, es decir, más del doble que la parte sur durante el verano, mayores densidades de individuos, con dominancia de escafópodos y poliquetos (88% de la abundancia), así como bajos niveles de diversidad y equitatividad, sobre todo, en el verano. La parte sur presentó arena fina con menor contenido en materia orgánica, menores densidades y mucha mayor diversidad y equitatividad sin grandes diferencias entre invierno y verano. Se observó una correlación muy elevada entre la composición de las comunidades bentónicas y el tamaño de sedimento y la cantidad de materia orgánica (Spearman rs=0.94).
Spatial and seasonal patterns of benthic assemblages in a semiexposed sandy bay were analyzed in relation to sedimentary variables and organic load. Four sampling stations with different environmental conditions; sediment size, wave exposure and proxmity of freshwater runoff; were selected along the bay. Monthly samplings were carried out during a year using a suction sampler. Sediment samples were also taken to analyze granulometry and organic load. For analysis purposes data were pooled according to climatic periods present in the area, dry season-winter and rainy season-summer. The north part of the bay showed fine sediment, silt and clay, with higher organic matter percentage, doubling the south percentages during summer, higher density of macrofauna, with a clear dominance of scaphopods and polychaetes; 88% of total abundance; and lower diversity and evenness. Scaphopods showed densities up to 9 788 ind•m−2. The south part of the bay showed coarser sediment; mainly fine sand; with lower organic matter content, lower macrofaunal density and higher diversity and evenness. Scaphopod densities were much lower in this area. High significant correlation was found between macrofaunal assemblages and the percentage of silt and organic matter (Spearman rs=0.94).
Las áreas costeras son consideradas hábitats de cría para numerosas especies de organismos marinos. Tradicionalmente, los hábitats de cría han sido definidos como áreas donde los ejemplares juveniles se encuentran en elevadas densidades, evitan la depredación con más éxito o crecen más rápido (Gillanders et al., 2003). El paradigma de Gunter (1967) establece que los ambientes estuarinos representan a las áreas de cría por definición debido a la gran dependencia de este hábitat por parte de numerosas especies de peces en el sureste de Estados Unidos de América. Sin embargo, con el conocimiento de las historias de vida de peces de otras regiones, se encontró que donde la distribución de ambientes estuarinos es muy reducida, las zonas costeras someras y protegidas constituían verdaderas áreas de cría, y los macroinvertebrados bentónicos, el grupo trófico más crítico, al que se denominó “especies forraje” (Blaber, 1997) y que son la fuente de alimento de numerosas especies de peces. Las zonas someras de la costa de Jalisco fungen como zonas de alimentación y cría para muchas especies de peces de interés comercial, siendo la macrofauna bentónica de gran importancia en su dieta (Saucedo-Lozano et al., 1999; Saucedo-Lozano y Chiappa-Carrara, 2000; Pérez-España et al., 2005; Raymundo-Huizar y Saucedo-Lozano, 2008; Flores-Ortega et al., 2010, 2011; Aguilar-Palomino y González-Sansón, 2010).
Las zonas costeras están sujetas a alteraciones por descargas de ríos y por desechos domésticos, que propician cambios súbitos en salinidad, sedimentos, concentración de materia orgánica, así como de otros contaminantes (Ambrogi et al., 1990; Pagola-Carte y Saiz-Salinas, 2002; Salen-Picard y Arlhac, 2002). La macrofauna bentónica responde a la alteración del hábitat y su diversidad se relaciona con la intensidad y frecuencia de estas alteraciones (Weston, 1990; Nickell et al., 2003; Austen y Widdicombe, 2006). Las instalaciones de maricultura también producen un enriquecimiento de materia orgánica que altera los fondos marinos y produce cambios en las comunidades bentónicas (Weston, 1990; Nickell et al., 2003; Sutherland et al., 2007; D'Amours et al., 2008; Tomassetti et al., 2009). En estos casos la fuente de materia orgánica proviene principalmente de restos de alimento suministrado y no ingerido, así como de las heces de los peces enjaulados, cuyo impacto es más evidente en el bentos, sobre todo, debajo de las jaulas y en sus inmediaciones (Sanz-Lázaro y Marín, 2011). Los patrones de diversidad y abundancia de la macrofauna bentónica en ambientes alterados fueron descritos con detalle en el modelo de Pearson y Rosenberg (1978), donde se describen los cambios y sucesiones de las comunidades macrofaunales a lo largo de un gradiente de alteración por enriquecimiento en materia orgánica. En este modelo se indica que cuando hay un aporte importante de materia orgánica se produce un incremento de la abundancia de especies oportunistas y un descenso de la biomasa, la riqueza específica y la biodiversidad, aunque a niveles intermedios de perturbación también se pueden producir incrementos en la riqueza específica y la diversidad (Connell, 1978; Pearson y Rosenberg, 1978).
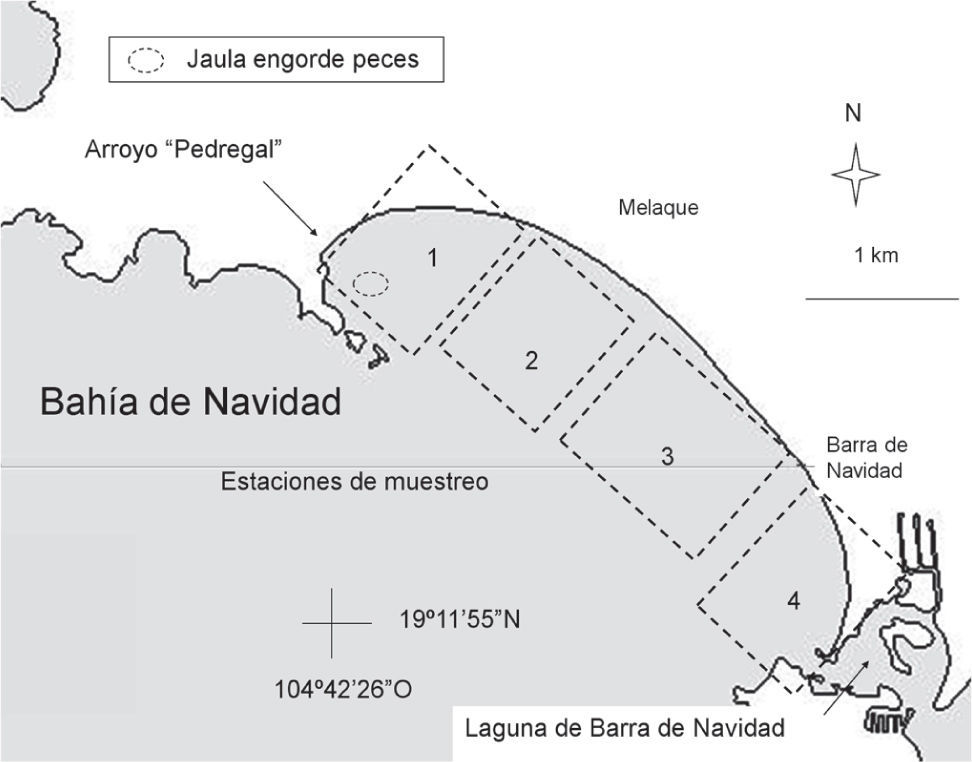
En la bahía de Navidad se encuentran una jaula de engorde de peces, una descarga estacional (arroyo El Pedregal), una laguna costera abierta permanentemente y exposición al oleaje variable según la orientación de las marejadas. Por otra parte, las condiciones hidroclimáticas de la zona presentan un patrón estacional muy claro, con 2 épocas evidentemente diferenciadas. De junio a noviembre prevalecen condiciones tropicales debido a la influencia de la contracorriente norecuatorial (CCNE) y la época lluviosa (Kessler, 2006; Lavín et al., 2006). Durante la estación seca, de diciembre a mayo, prevalecen las condiciones subtropicales debido a la influencia de una rama de la corriente de California con flujo hacia el sur (Kessler, 2006; Lavín et al., 2006) y, sobre todo, a eventos de afloramiento costero entre enero y mayo (López-Sandoval et al., 2009), que producen una notable disminución de la temperatura superficial del agua del mar.
Teniendo en cuenta lo anterior, se plantea la hipótesis de que existen diferencias espaciales y temporales en las comunidades de macrofauna bentónica de la bahía y tienen correlación con las condiciones ambientales, en concreto con los aportes de sedimento y materia orgánica provenientes de las descargas de aguas continentales y la jaula de maricultura. El objetivo de este trabajo es describir y analizar los patrones de variación espacial y temporal de la macrofauna submareal en la bahía de Navidad y determinar su relación con el tamaño del sedimento y su contenido en materia orgánica.
Materiales y métodosÁrea de estudio. El área de estudio se localizó en la bahía de Navidad, situada en el sur de la costa de Jalisco (situada entre los puntos 19°10'30” y 19°14'00” N, 104°45'00” y 104°41'30” O), en el Pacífico tropical mexicano y ha sido descrita con detalle por Flores-Ortega et al. (2010). Se realizó un muestreo mensual de marzo de 2007 a marzo de 2008, salvo en los meses de abril y octubre de 2007 y febrero de 2008, debido a condiciones meteorológicas adversas. Se seleccionaron 4 estaciones de muestreo, para tener representación de secciones de la bahía con diferentes condiciones ambientales (Fig. 1). La estación 1 se ubica en la parte norte, en las inmediaciones de una jaula de engorde de peces (principalmente huachinango, Lutjanus peru) con capacidad para 10 000 ejemplares, y de una descarga del arroyo El Pedregal, que aporta sedimentos y materia orgánica durante la época de lluvias. Con una superficie de 0.49km2, es la más protegida del oleaje y presenta el sedimento más fino. La estación 2 se encuentra inmediata hacia el sur, a 700–1 400m de la descarga y la jaula, con 0.49km2, presenta mayor exposición al oleaje y sedimento fino. La estación 3 es la más extensa y expuesta al oleaje con 0.77km2, presenta el sedimento más grueso y se encuentra entre 1 400-2 800m de la descarga y la jaula, y a 750-2 150m de la desembocadura de la laguna de Barra de Navidad. La estación 4 se encuentra en las inmediaciones de la desembocadura de la laguna de Barra de Navidad, que se mantiene abierta permanentemente, a pesar de que el aporte de agua continental tiene un marcado carácter estacional; con 0.27km2, está más expuesta al oleaje y presenta sedimento grueso. En todas las estaciones de muestreo la profundidad osciló entre 8 y 15m.
Muestreo y procesado de muestras. Cada mes se tomaron 3 réplicas por estación empleando un cuadrado de 50×50cm y se aspiró todo el interior hasta una profundidad de 15cm en el sedimento mediante una bomba de succión operada por buceadores. La bomba de succión consistió en un tubo de PVC (180cm de largo y 7.5cm de diámetro) unido a un difusor de acero inoxidable de 30cm de largo y conectado a un compresor de aire. En el extremo del tubo se acopló una bolsa de 0.5mm de luz de malla. Las muestras se tamizaron a bordo de la embarcación con una malla de 0.5mm. Los organismos fueron separados en el laboratorio in vivo, siempre que fue posible. En caso contrario, las muestras se congelaron a −20°C hasta su separación. Una vez separados, los organismos fueron fijados en una solución de formol al 4% en agua de mar y, posteriormente conservados en etanol al 70%. Los individuos se identificaron hasta el nivel taxonómico más bajo posible. Se formaron 26 grupos taxonómicos funcionales, órdenes, infraórdenes, superfamilias y familias, de acuerdo con su movilidad, alimentación, tamaño, forma y posición en el sedimento (Hewitt et al., 2008), además del criterio taxonómico (Cuadro 3), para describir los patrones de la macrofauna relacionados con factores ambientales como enriquecimiento en materia orgánica o contaminantes (Olsgard et al., 1997, 1998).
Análisis granulométrico y contenido de materia orgánica. Para los análisis de granulometría y del contenido de materia orgánica en el sustrato, de noviembre de 2007 a marzo de 2008, se recolectaron en bolsa 2 muestras de 300g de sedimento en cada estación de muestreo y, posteriormente, una vez descongeladas se realizaron análisis granulométricos de acuerdo con el método descrito por Bale y Kenny (2005), el cual consiste en secar la submuestra de 200g de sedimento a 60°C y, después tamizarla en húmedo a través de una torre de tamices de distinta luz de malla, de 2mm a 0.0625mm, para separar la arena del lodo, esta última fracción fue considerada como la mezcla de limo y arcilla. Las fracciones retenidas en los tamices, grava y arena, fueron secadas en una estufa a 60°C y, posteriormente se determinó su peso en gramos. La fracción de lodo se estimó como la diferencia entre el peso seco total de la muestra y el peso seco de la suma de las fracciones de arena y grava. El tamaño de grano fue expresado como porcentajes de grava, de arena y de lodo según la escala de Udden/Wentworth (Wentworth, 1922). El contenido de materia orgánica en el sedimento fue calculado de acuerdo con el método de oxidación: se colocan 200g de cada muestra en un vaso de precipitados, se agregaron 200ml de peróxido de hidrógeno al 40% y se mantuvo en movimiento continuo hasta la degradación total de la materia orgánica, normalmente 3 días. Se secó la muestra en la estufa a 60°C y se calculó la diferencia de peso, que corresponde al contenido en gramos de materia orgánica. El peso se estandarizó para 100g de sedimento y se expresó como porcentaje de materia orgánica.
Análisis estadísticos. Para realizar los análisis estadísticos se agruparon los datos según los patrones principales hidroclimáticos de la región, que consisten en 2 periodos principales: 1) de junio a noviembre, periodo de influencia de la contracorriente norecuatorial y estación lluviosa, y que denominaremos “verano”; 2) de diciembre a mayo, periodo de influencia de la corriente de California y estación seca, y que denominaremos “invierno”. En este caso, es de destacar la importancia de diferenciar bien los periodos de lluvias y secas, ya que la descarga de aguas continentales es una importante fuente de sedimentos y materia orgánica en el bentos, sobre todo, en zonas cercanas a la costa.
La densidad media mensual (individuos• m−2) de cada grupo taxonómico fue estimada como el promedio de las 3 réplicas en cada estación. Con estas medias mensuales se estimaron las medias para cada periodo hidroclimático. Para comparar la densidad media entre estaciones de muestreo y periodos hidroclimáticos, se llevó a cabo un análisis de varianza (Anova) de 2 vías. Los datos de densidad fueron transformados a su raíz cuarta, debido a la gran cantidad de ceros y pocos valores elevados obtenidos (Quinn y Keough, 2002). Con esta transformación se consiguió una distribución normal de los datos (test de Kolmogorov-Sminrov, p>0.2) y la homogeneidad de varianzas (test de Levene, p>0.29). Posteriormente, se utilizó el test de Duncan para realizar las comparaciones múltiples.
Se llevaron a cabo análisis multivariantes para detectar los patrones en la distribución de las asociaciones de macrofauna. Los métodos de Clarke (1993) y el software PRIMER v. 6 fueron utilizados (Clarke y Gorley, 2006). La abundancia total de cada grupo taxonómico en cada mes de muestreo y estación, suma de las 3 réplicas de los cuadrados, fue utilizada en estos análisis. Se aplicó una transformación a raíz cuadrada a la suma de abundancias, ya que es la que mejores correlaciones obtiene entre matrices de similitud (tanto de variables ambientales como de grupos faunísticos) cuando trabajamos a nivel taxonómico de familia o niveles superiores (Olsgard et al., 1997; Karakassis y Hatziyanni, 2000; Heino, 2008). Para analizar gráficamente el patrón de asociación de grupos taxonómicos de acuerdo con la estación de muestreo y periodo hidroclimático, se utilizó el método de escalamiento multidimensional no métrico (nMDS) y un análisis de clasificación numérica jerárquica aglomerativa, promedio aritmético de grupos de pares no ponderados (UPGMA, por sus siglas en inglés), utilizando el índice de Bray-Curtis como medida de similitud. La significancia en la formación de los grupos de asociaciones en el dendrograma se determinó con la prueba Simprof, la cual realiza una prueba de permutaciones a cada nodo de un dendrograma para identificar patrones de asociación significativos en muestras a priori no estructuradas (Clarke et al., 2008). Se realizó un análisis de similitud de 2 vías (Anosim) para analizar diferencias en las comunidades entre estaciones de muestreo y periodos hidroclimáticos. Por último, se utilizó un análisis de porcentaje de similitud (Simper) para identificar las especies que más contribuyen a la similitud/disimilitud media entre las estaciones de muestreo y periodos hidroclimáticos que presentaban diferencias significativas en el Anosim.
Con fines comparativos entre las distintas estaciones de muestreo y épocas hidroclimáticas, y la comparación con el modelo de Pearson y Rosenberg y la “hipótesis de alteración intermedia” de Connell (1978), se estimaron el índice H' de Shannon-Wiener utilizando logaritmos en base e (Krebs, 1999) como medida de la diversidad, y el índice (J') de Pielou (1966) como medida de la equitatividad. Para cada mes y estación de muestreo se calcularon ambos índices con los grupos taxonómicos determinados previamente acumulados en las 3 réplicas y, posteriormente se estimaron los H' y J' medios para cada estación y época hidroclimática. Para comparar las diferencias de ambos parámetros entre estaciones de muestreo se utilizó un análisis no paramétrico de Kruskal-Wallis seguido de un test de comparaciones múltiples. Para comparar estas diferencias entre periodos hidroclimáticos en cada estación de muestreo se utilizó un análisis no paramétrico U de Mann-Whitney.
Las variables ambientales con granulometría y contenido de materia orgánica fueron analizadas también mediante un MDS, a partir de una matriz de similitud calculada por índices de la distancia euclídea, con datos sin transformar. Para establecer la relación entre estas variables y las comunidades bentónicas se utilizó el procedimiento Bio-Env, incluido en el software PRIMER (Clarke y Warwick, 2001; Clarke et al., 2008). Este procedimiento utiliza una correlación de rangos de Spearman para comparar las matrices de similitud de las variables ambientales y las comunidades de organismos. Para este análisis se agruparon los datos de invierno y verano de las comunidades macrofaunales y se estimó la media anual para la materia orgánica.
ResultadosCondiciones ambientales. El análisis granulométrico confirmó el gradiente ascendente de tamaño de sedimento observado de norte a sur. Las 2 estaciones de muestreo del norte (1 y 2) presentaron un tamaño de grano fino, principalmente compuesto por limo y arcilla (en más de un 95% en la estación 1 y cercano al 90% en la estación 2) (Cuadro 1), mientras que las estaciones de muestreo del sur (3 y 4) presentaron tamaño de grano más grueso, principalmente arenas finas y medias, con un tamaño medio superior en la estación 4 (Cuadro 1).
Datos de granulometría y contenido en materia orgánica del sedimento de las estaciones de muestreo en la bahía de Navidad. Se muestra el porcentaje de cada fracción de sedimento, el diámetro medio y la clasificación según la escala de Udden/Wenworth (Wenworth, 1922). También se muestra el porcentaje medio de materia orgánica para cada período hidroclimático con su desviación típica
| % de cada fracción | Materia orgánica (%) | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Estación muestreo | Arena muy gruesa | Arena gruesa | Arena mediana | Arena fina | Limo grueso | Limo fino + arcilla | Diámetro medio φ (phi) | Clasificación | Verano | DT | Invierno | DT | Total | DT |
| 1 | 0.22 | 0.68 | 0.59 | 2.89 | 56.32 | 39.29 | 4.68 | Limo | 2.66 | 1.11 | 1.50 | 0.22 | 2.19 | 0.94 |
| 2 | 0.08 | 0.50 | 0.71 | 9.94 | 64.97 | 23.80 | 4.26 | Limo | 2.61 | 0.68 | 1.85 | 1.22 | 2.31 | 1.22 |
| 3 | 1.09 | 9.73 | 21.36 | 46.41 | 19.98 | 1.40 | 2.10 | Arena fina | 1.23 | 0.31 | 1.01 | 0.49 | 1.10 | 0.60 |
| 4 | 2.39 | 6.18 | 14.92 | 66.72 | 8.88 | 0.84 | 2.02 | Arena fina | 0.90 | 0.51 | 1.59 | 0.01 | 1.24 | 0.45 |
El contenido en materia orgánica siguió un patrón similar. Las estaciones de muestreo del norte duplicaron el contenido en materia orgánica de las del sur, haciéndose más evidentes las diferencias durante el verano (Cuadro 1). En la parte sur la estación 4 presentó un porcentaje superior a la estación 3 (Cuadro 1).
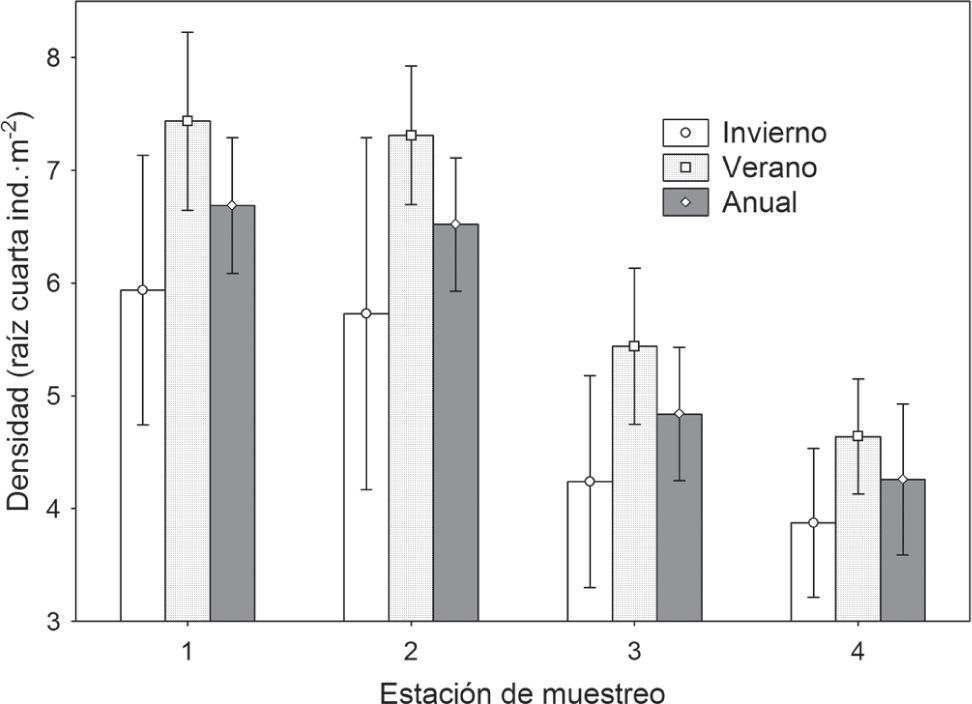
Patrones espaciales y temporales de abundancia. Durante el periodo de muestreo se capturaron un total de 47 985 ejemplares pertenecientes a 61 taxones diferentes, que se agruparon posteriormente en 26. La densidad media total fue de 1 744.9 ind•m−2, obteniéndose grandes variaciones de abundancia entre grupos taxonómicos y periodos hidroclimáticos, con oscilaciones entre 0 y 10 884 ind•m−2. Se encontraron diferencias significativas en la densidad media entre las estaciones de muestreo y entre los 2 periodos hidroclimáticos del año (Anova, p<0.005), pero no su interacción (Anova, p>0.5), por lo que en todas las estaciones de muestreo la densidad media fue significativamente superior en verano (Fig. 2). Las estaciones 1 y 2 presentaron densidades medias significativamente mayores que las demás estaciones (test de Duncan, p<0.005). Entre las estaciones 1 y 2 y las estaciones 3 y 4, no se encontraron diferencias significativas (Fig. 2).
Patrón espacial y temporal de la abundancia de la macrofauna en la bahía de Navidad. Se muestra la densidad media (raíz cuarta del número de individuos•m−2) para cada estación de muestreo y periodo hidroclimático (invierno: corriente de California y secas, y verano: contracorriente norecuatorial y lluvias) con su intervalo de confianza del 95%.
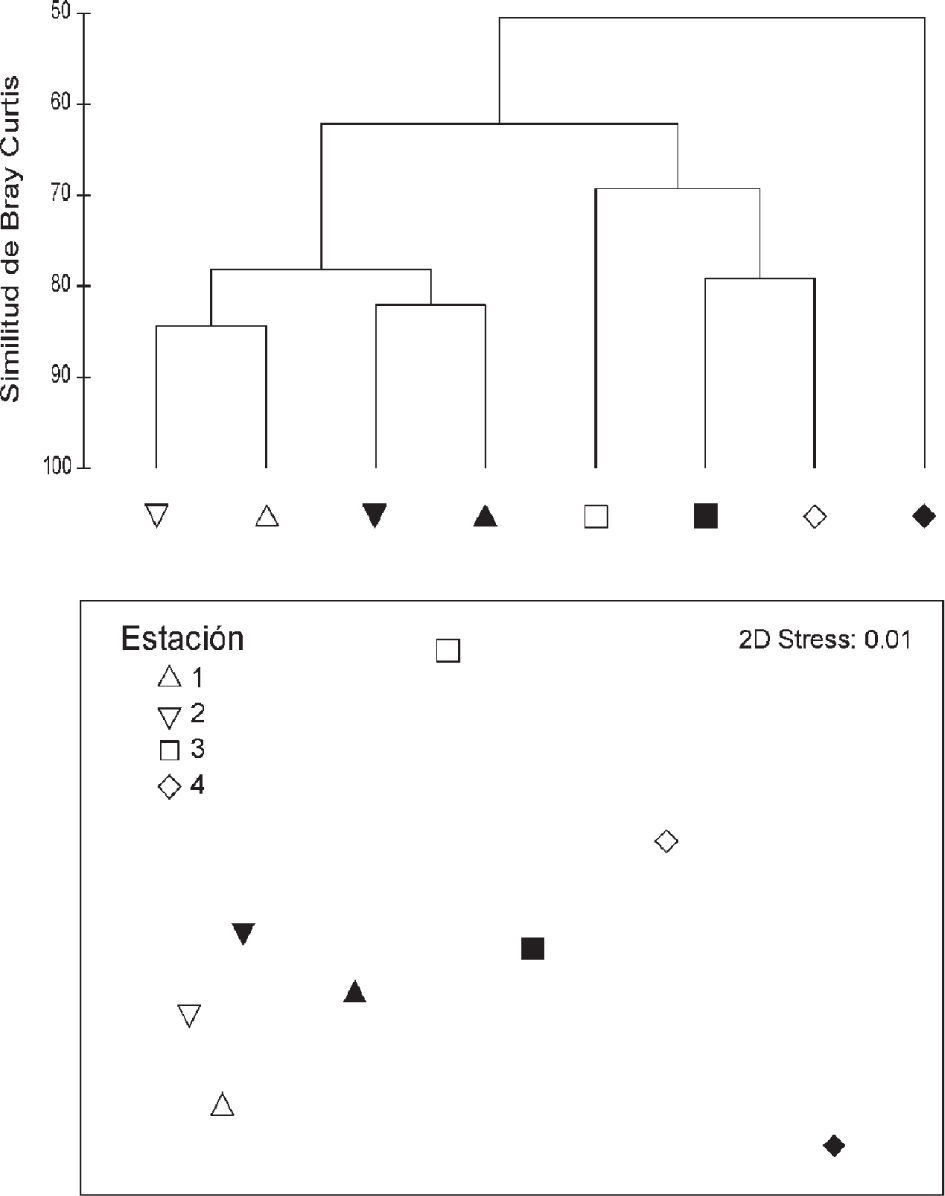
Asociaciones de macrofauna bentónica. Las comunidades bentónicas de las 4 estaciones de muestreo presentaron una similitud bastante elevada, aun así el análisis de clasificación numérico y la prueba Simprof identificaron diferencias significativas entre las de la parte norte y sur de la bahía (Pi=2.65, p<0.01; Fig. 3). Las estaciones 1 y 2 presentaron diferencias significativas entre periodos hidroclimáticos (Pi=1.82, p<0.05), pero no dentro del mismo periodo hidroclimático (Fig. 3). El análisis de similitud (Anosim) reveló diferencias significativas entre estaciones de muestreo, pero no entre periodos hidroclimáticos (Cuadro 2). Las comunidades de las estaciones 1 y 2 no presentaron diferencias significativas, al igual que las estaciones 3 y 4, con lo que existe una clara diferenciación entre las comunidades del norte y sur de la bahía (Cuadro 2). El resto de combinaciones presentó diferencias significativas, especialmente entre las estaciones 1 y 2 con la 4 (Cuadro 2). De los 26 grupos taxonómicos considerados a lo largo de todo el periodo de muestreo para las estaciones del norte, 4 grupos acumularon más del 90% de la abundancia total: escafópodos, poliquetos, bivalvos y anfípodos (Cuadro 2), y tan sólo 2: escafópodos y poliquetos, acumularon el 87.8% en la estación 1, encontrándose elevadas densidades de los primeros (Cuadro 3). En las estaciones del sur no se produjo tanta dominancia y son 9 los grupos necesarios para acumular el 90% de abundancia: anfípodos, poliquetos, cumáceos, misidáceos, isópodos, bivalvos, escafópodos, picnogónidos y gasterópodos (Cuadro 3). Se observa que la abundancia de escafópodos es muy elevada en las estaciones del norte de la bahía, y en las del sur su abundancia muestra un brusco descenso, pasando de una media de 1 290. 1 ind•m−2 en la estación 2 a 29 ind•m−2 en la estación 3 (Cuadro 3).
Resultados del análisis de clasificación numérico y prueba Simprof (arriba) y nMDS (abajo) con la similitud de la composición de comunidades macrobentónicas entre las distintas estaciones de muestreo y periodos hidroclimáticos (invierno
▪= corriente de California, y secas y verano; □= contracorriente norecuatorial y lluvias) del año. Los valores en el dendrograma presentan la significancia en la formación de los grupos. Las muestras que denotan la formación de grupos significativos, con línea discontinua en el dendrograma, se corresponden en el nMDS.
Análisis de similitud de dos vías para evaluar diferencias en las comunidades macrofaunales entre los dos períodos hidroclimáticos (PH, invierno y verano), y entre las cuatro estaciones de muestreo. Un nivel de significancia inferior al 5% indica el rechazo a la hipótesis nula de no diferencias en la composición de la comunidad entre muestras
| R global | R pareadas | Nivel significancia (%) | |
|---|---|---|---|
| PH | 0.038 | 29.20 | |
| Estación muestreo | 0.372 | 0.10 | |
| 1, 2 | −0.052 | 68.70 | |
| 1, 3 | 0.462 | 0.10 | |
| 1, 4 | 0.778 | 0.10 | |
| 2, 3 | 0.434 | 0.20 | |
| 2, 4 | 0.759 | 0.30 | |
| 3, 4 | −0.101 | 79.70 |
Densidad media (ind•m−2) de los principales grupos taxonómicos capturados en cada estación de muestreo de la bahía de Navidad. Se muestra el error estándar (E. E.) de la media, el porcentaje de cada grupo y el porcentaje acumulado
| Estación muestreo | 1 | 2 | ||||||
|---|---|---|---|---|---|---|---|---|
| Grupo taxonómico | ind•m−2 | % | % acumulado | E. E. | ind•m−2 | % | % acumulado | E. E. |
| Escafópodos | 1 831.6 | 78.63 | 78.63 | 433.79 | 1 290.1 | 59.39 | 59.39 | 262.43 |
| Poliquetos | 212.5 | 9.12 | 87.75 | 53.83 | 339.2 | 15.61 | 75.00 | 85.65 |
| Bivalvos | 65.5 | 2.81 | 90.57 | 15.95 | 44.6 | 2.05 | 77.05 | 10.86 |
| Anfípodos | 65.0 | 2.79 | 93.35 | 11.47 | 165.9 | 7.64 | 84.69 | 26.67 |
| Cumáceos | 46.6 | 2.00 | 95.36 | 12.64 | 81.1 | 3.73 | 88.42 | 16.17 |
| Picnogónidos | 45.9 | 1.97 | 97.33 | 13.40 | 13.0 | 0.60 | 89.02 | 4.65 |
| Quetognatos | 15.0 | 0.65 | 97.97 | 12.21 | 154.9 | 7.13 | 96.15 | 91.50 |
| Megalopas | 11.7 | 0.50 | 98.48 | 2.49 | 9.1 | 0.42 | 96.57 | 1.97 |
| Misidáceos | 8.3 | 0.36 | 98.83 | 3.11 | 7.2 | 0.33 | 96.90 | 2.04 |
| Tanaidáceos | 5.9 | 0.25 | 99.09 | 4.06 | 3.9 | 0.18 | 97.08 | 1.78 |
| Ostrácodos | 5.0 | 0.21 | 99.30 | 2.03 | 33.1 | 1.52 | 98.60 | 7.34 |
| Ofiuras | 4.6 | 0.20 | 99.49 | 1.44 | 7.2 | 0.33 | 98.93 | 2.13 |
| Gasterópodos | 3.5 | 0.15 | 99.64 | 0.89 | 4.4 | 0.20 | 99.13 | 0.86 |
| Actinias | 2.2 | 0.09 | 99.74 | 1.18 | 1.2 | 0.06 | 99.19 | 0.45 |
| Camarones | 1.7 | 0.07 | 99.81 | 0.33 | 3.6 | 0.16 | 99.35 | 0.61 |
| Braquiuros | 1.5 | 0.06 | 99.88 | 0.27 | 1.7 | 0.08 | 99.43 | 0.31 |
| Isópodos | 1.2 | 0.05 | 99.93 | 0.69 | 5.8 | 0.27 | 99.70 | 1.62 |
| Estomatópodos | 0.5 | 0.02 | 99.95 | 0.22 | 0.8 | 0.03 | 99.73 | 0.27 |
| Holoturias | 0.4 | 0.02 | 99.97 | 0.23 | 0.1 | 0.01 | 99.74 | 0.14 |
| Peces | 0.3 | 0.01 | 99.98 | 0.10 | 0.3 | 0.01 | 99.75 | 0.09 |
| Estrellas | 0.1 | 0.01 | 99.99 | 0.14 | 0.6 | 0.03 | 99.78 | 0.55 |
| Ascidias | 0.1 | 0.01 | 100.00 | 0.14 | 0.0 | 0.00 | 99.78 | |
| Langostas | 0.1 | 0.00 | 100.00 | 0.08 | 0.1 | 0.00 | 99.78 | 0.06 |
| Copépodos | 0.0 | 0.00 | 100.00 | 4.6 | 0.21 | 99.99 | 4.55 | |
| Ermitaños | 0.0 | 0.00 | 100.00 | 0.1 | 0.01 | 100.00 | 0.14 | |
| Estación muestreo | 3 | 4 | ||||||
| Grupo taxonómico | ind•m−2 | % | % acumulado | E. E. | ind•m−2 | % | % acumulado | E. E. |
| Anfípodos | 194.6 | 34.20 | 34.20 | 54.90 | 88.3 | 27.39 | 27.39 | 23.95 |
| Poliquetos | 90.3 | 15.86 | 50.06 | 44.14 | 46.6 | 14.44 | 41.83 | 9.80 |
| Cumáceos | 77.0 | 13.52 | 63.59 | 33.41 | 28.5 | 8.84 | 50.66 | 8.58 |
| Misidáceos | 33.2 | 5.84 | 69.43 | 9.64 | 2.2 | 0.67 | 51.33 | 0.99 |
| Isópodos | 32.1 | 5.65 | 75.08 | 9.33 | 85.2 | 26.40 | 77.74 | 29.40 |
| Bivalvos | 30.3 | 5.32 | 80.39 | 8.00 | 31.2 | 9.68 | 87.42 | 7.81 |
| Escafópodos | 29.0 | 5.09 | 85.48 | 12.44 | 7.7 | 2.38 | 89.79 | 1.38 |
| Picnogónidos | 24.3 | 4.27 | 89.75 | 11.19 | 1.3 | 0.41 | 90.21 | 0.75 |
| Gasterópodos | 16.3 | 2.86 | 92.61 | 9.10 | 1.8 | 0.57 | 90.78 | 0.61 |
| Quetognatos | 15.6 | 2.74 | 95.34 | 6.42 | 1.7 | 0.52 | 91.29 | 0.76 |
| Megalopas | 5.5 | 0.97 | 96.31 | 2.06 | 11.2 | 3.46 | 94.76 | 3.05 |
| Peces | 4.9 | 0.86 | 97.17 | 3.33 | 0.5 | 0.14 | 94.90 | 0.21 |
| Ostrácodos | 4.4 | 0.78 | 97.95 | 1.94 | 2.5 | 0.78 | 95.67 | 1.42 |
| Ofiuras | 3.9 | 0.68 | 98.62 | 1.86 | 0.2 | 0.05 | 95.73 | 0.17 |
| Camarones | 2.7 | 0.48 | 99.10 | 0.89 | 1.8 | 0.57 | 96.29 | 0.60 |
| Tanaidáceos | 1.4 | 0.24 | 99.35 | 0.98 | 2.2 | 0.67 | 96.97 | 1.25 |
| Ermitaños | 1.2 | 0.21 | 99.55 | 0.51 | 0.2 | 0.05 | 97.02 | 0.12 |
| Ascidias | 1.0 | 0.17 | 99.72 | 0.83 | 6.8 | 2.12 | 99.14 | 4.38 |
| Braquiuros | 0.9 | 0.16 | 99.88 | 0.26 | 0.8 | 0.24 | 99.38 | 0.24 |
| Langostas | 0.6 | 0.10 | 99.98 | 0.25 | 0.8 | 0.26 | 99.64 | 0.29 |
| Copépodos | 0.1 | 0.02 | 100.00 | 0.14 | 0.5 | 0.16 | 99.79 | 0.50 |
| Estomatópodos | 0.0 | 0.00 | 100.00 | 0.0 | 0.00 | 99.79 | ||
| Actinias | 0.0 | 0.00 | 100.00 | 0.5 | 0.16 | 99.95 | 0.37 | |
| Estrellas | 0.0 | 0.00 | 100.00 | 0.0 | 0.00 | 99.95 | ||
| Holoturias | 0.0 | 0.00 | 100.00 | 0.2 | 0.05 | 100.00 | 0.17 |
El análisis Simper indica que los escafópodos son el grupo taxonómico que más contribuye a la disimilitud o diferenciación entre las estaciones de muestreo de las 2 partes de la bahía, entre las que el Anosim detectó diferencias significativas, contribuyendo entre el 30 y el 44% a la disimilitud (Cuadro 4). Los poliquetos son el segundo grupo que más contribuye a la disimilitud, con porcentajes entre el 8.7 y el 14.2, seguidos de los anfípodos, quetognatos, bivalvos, picnogónidos, gasterópodos e isópodos con menores porcentajes (entre el 4 y el 10%; Cuadro 4).
Resultados del análisis SIMPER para las estaciones de muestreo que presentaron diferencias significativas en el análisis de similitud. Se muestra el porcentaje de disimilitud entre estaciones de muestreo, la abundancia (transformada a raíz cuadrada), la disimilitud media y la contribución (en porcentaje) de cada grupo taxonómico
| Grupo taxonómico | Abundancia media (grupo 1) | Abundancia media (grupo 2) | Disimilitud media | Contribución % | |
|---|---|---|---|---|---|
| Estaciones 1 y 3 disimilitud media 36.4% | |||||
| Escafópodos | 77.38 | 9.27 | 15.45 | 42.44 | |
| Poliquetos | 39.23 | 25.35 | 3.15 | 8.67 | |
| Anfípodos | 15.33 | 25.1 | 2.08 | 5.72 | |
| Gasterópodos | 8.63 | 16.96 | 1.89 | 5.19 | |
| Bivalvos | 26.28 | 18.14 | 1.82 | 4.99 | |
| Isópodos | 2.12 | 9.49 | 1.59 | 4.38 | |
| Peces | 3.29 | 10.22 | 1.56 | 4.29 | |
| Cumáceos | 12.84 | 15.53 | 1.36 | 3.73 | |
| Misidáceos | 5.38 | 10.41 | 1.07 | 2.95 | |
| Picnogónidos | 12.87 | 9.05 | 0.93 | 2.54 | |
| Ermitaños | 0 | 2.91 | 0.68 | 1.86 | |
| Quetognatos | 6.82 | 7.5 | 0.64 | 1.76 | |
| Braquiuros | 7.57 | 5.74 | 0.54 | 1.48 | |
| Tanaidáceos | 4.42 | 2.22 | 0.53 | 1.47 | |
| Estaciones 2 y 3 disimilitud media 36.46% | |||||
| Escafópodos | 66.05 | 9.27 | 12.08 | 33.12 | |
| Poliquetos | 49.55 | 25.35 | 5.11 | 14.01 | |
| Quetognatos | 22.57 | 7.5 | 3.3 | 9.05 | |
| Anfípodos | 24.48 | 25.1 | 1.86 | 5.09 | |
| Gasterópodos | 9.73 | 16.96 | 1.61 | 4.41 | |
| Ostrácodos | 10.93 | 3.72 | 1.53 | 4.19 | |
| Peces | 3.16 | 10.22 | 1.5 | 4.11 | |
| Cumáceos | 16.94 | 15.53 | 1.34 | 3.68 | |
| Misidáceos | 5.04 | 10.41 | 1.1 | 3.01 | |
| Bivalvos | 21.41 | 18.14 | 1.07 | 2.92 | |
| Isópodos | 4.53 | 9.49 | 1.06 | 2.92 | |
| Copépodos | 2.87 | 0.5 | 0.64 | 1.76 | |
| Picnogónidos | 6.84 | 9.05 | 0.51 | 1.4 | |
| Braquiuros | 8.24 | 5.74 | 0.5 | 1.38 | |
| Estaciones 1 y 4 disimilitud media 46.94% | |||||
| Escafópodos | 77.38 | 4.77 | 19.56 | 41.66 | |
| Poliquetos | 39.23 | 15.81 | 6.65 | 14.16 | |
| Picnogónidos | 12.87 | 1.98 | 2.99 | 6.37 | |
| Bivalvos | 26.28 | 16.03 | 2.86 | 6.08 | |
| Isópodos | 2.12 | 12.46 | 2.62 | 5.57 | |
| Quetognatos | 6.82 | 2 | 1.42 | 3.03 | |
| Gasterópodos | 8.63 | 5.22 | 1 | 2.14 | |
| Cumáceos | 12.84 | 9.24 | 0.96 | 2.06 | |
| Ascidias | 0.5 | 3.2 | 0.96 | 2.04 | |
| Ofiuras | 3.91 | 0.5 | 0.93 | 1.99 | |
| Braquiuros | 7.57 | 4.78 | 0.88 | 1.88 | |
| Misidáceos | 5.38 | 2.5 | 0.83 | 1.78 | |
| Camarones | 5.6 | 4.65 | 0.69 | 1.47 | |
| Estaciones 2 y 4 disimilitud media 50.24% | |||||
| Escafópodos | 66.05 | 4.77 | 15.27 | 30.4 | |
| Poliquetos | 49.55 | 15.81 | 8.63 | 17.17 | |
| Quetognatos | 22.57 | 2 | 5.33 | 10.62 | |
| Isópodos | 4.53 | 12.46 | 2.37 | 4.72 | |
| Anfípodos | 24.48 | 16.17 | 2.17 | 4.31 | |
| Ostrácodos | 10.93 | 2.74 | 2.09 | 4.15 | |
| Bivalvos | 21.41 | 16.03 | 1.96 | 3.89 | |
| Cumáceos | 16.94 | 9.24 | 1.92 | 3.82 | |
| Picnogónidos | 6.84 | 1.98 | 1.22 | 2.43 | |
| Gasterópodos | 9.73 | 5.22 | 1.18 | 2.35 | |
| Ofiuras | 4.55 | 0.5 | 1 | 1.99 | |
| Braquiuros | 8.24 | 4.78 | 0.91 | 1.8 | |
| Camarones | 8.02 | 4.65 | 0.9 | 1.78 | |
| Ascidias | 0 | 3.2 | 0.88 | 1.74 | |
Diversidad. El índice de diversidad de Shannon-Wiener (H') y la equitatividad (J') presentaron prácticamente el mismo patrón espacial y temporal. La diversidad presentó valores bajos y similares entre las estaciones 1 y 2, y valores más elevados y similares entre las estaciones 3 y 4 (Cuadro 5). Considerando todo el periodo de muestreo, la estación 3 presentó un índice H' significativamente mayor a todas las demás (Kruskal-Wallis, p<0.01; Cuadro 5), en invierno no se encontraron diferencias significativas entre las 4 estaciones y en verano la estación 4 presentó el H' más elevado (Kruskal-Wallis, p<0.01). Salvo en la estación 4, en todas las demás la diversidad media durante el verano fue inferior a la del invierno, sobre todo, en la estación 1, donde la diferencia es mayor (1.0 vs. 1.6), aunque estas diferencias no fueron significativas (U Mann-Whitney, p>0.05 en todos los casos).
Índices de diversidad de Shannon-Wiener (H') y Equitatividad de Pielou (J') medios (con error estándar, E.E.) obtenidos por estación de muestreo y época hidroclimática. También se muestran los valores obtenidos para todo el período de muestreo
| Estación muestreo | H' | J' | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Invierno | E. E. | Verano | E. E. | Total | E. E. | Invierno | E. E. | Verano | E. E. | Total | E. E. | |
| 1 | 1.61 | 0.25 | 1.00 | 0.19 | 1.24 | 0.17 | 0.60 | 0.18 | 0.37 | 0.16 | 0.46 | 0.06 |
| 2 | 1.42 | 0.08 | 1.36 | 0.11 | 1.38 | 0.07 | 0.56 | 0.09 | 0.48 | 0.09 | 0.51 | 0.03 |
| 3 | 1.96 | 0.10 | 1.72 | 0.17 | 1.81 | 0.11 | 0.79 | 0.07 | 0.66 | 0.16 | 0.72 | 0.05 |
| 4 | 1.76 | 0.27 | 1.78 | 0.06 | 1.77 | 0.06 | 0.67 | 0.09 | 0.71 | 0.05 | 0.70 | 0.02 |
Considerando todo el periodo de muestreo, los valores de equitatividad en las estaciones 3 y 4 fueron significativamente mayores que en las estaciones 1 y 2 (Kruskal-Wallis, p<0.01; Cuadro 5). No se encontraron diferencias significativas entre estaciones en los valores de invierno (Kruskal-Wallis, p>0.05), pero sí en verano, donde las estaciones 3 y 4 presentaron valores más elevados que las estaciones 1 y 2 (Kruskal-Wallis, p<0.01). No hubo diferencias significativas entre los valores de equitatividad de invierno y verano en cada estación (U Mann-Whitney, p>0.05), aunque en la estación 1 el valor medio de invierno es casi el doble que en verano y la diferencia está cerca de ser significativa (p=0.08).
Relación entre variables ambientales y comunidades de macrofauna. Se encontró una relación significativa muy alta entre las comunidades de macrofauna y la granulometría y la cantidad de materia orgánica. Se obtuvo un coeficiente de correlación de Spearman rs=0.94 para el porcentaje de arena fina, al igual que para el porcentaje de limo grueso, ambos característicos de las estaciones del norte y del sur. Asimismo, se obtuvo el mismo nivel de correlación para las combinaciones % arena muy gruesa + % materia orgánica, o % arena muy gruesa + % arena fina, entre otras.
DiscusiónLa bahía de Navidad presentó 2 zonas bien diferenciadas en cuanto a las condiciones ambientales del fondo marino y a las comunidades de macrofauna que lo habitan. La mitad norte, más protegida del oleaje, se caracteriza por un sedimento fino y rico en materia orgánica; y la parte sur, más expuesta al oleaje, por un sedimento más grueso y menor contenido en materia orgánica. Aunque no se observa que los aportes de materia orgánica y sedimento fino afecten a la parte sur de la bahía, tanto el arroyo Pedregal como la laguna de Barra de Navidad, que está permanentemente comunicada con el mar, son fuentes cercanas de estos materiales. Estudios previos indican poca variación de salinidad y turbidez en las inmediaciones de la boca de la laguna en todo el ciclo anual (Sandoval-Rojo et al., 1988), por lo que el efecto del agua continental y la sedimentación afecta, sobre todo, al interior de la laguna, que junto con el manglar deben actuar como filtro de materia orgánica y sedimentos. La diferenciación sedimentaria entre las partes norte y sur de la bahía podría explicarse por el patrón de corrientes de la bahía. Un estudio de corrientes reciente (datos no publicados) indica que las corrientes dominantes en la estación 1 son de dirección predominante SE-NO, y las de la estación 2 son de dirección S-N, lo que impediría la dispersión de grandes cantidades de materia orgánica y sedimento hacia la parte sur de la bahía, que está mucho más expuesta al oleaje y lavaría gran parte de la materia orgánica y el sedimento más fino.
Existe la posibilidad de que las instalaciones de maricultura situadas en las inmediaciones de la estación 1 también fueran causantes de un enriquecimiento en materia orgánica, como se ha demostrado en otros estudios (Weston, 1990; Nickell et al., 2003; Sutherland et al., 2007; D'Amours et al., 2008; Tomassetti et al., 2009). La actividad máxima de la jaula de engorde se registró entre marzo y abril, cuando los ejemplares alcanzaron mayor tamaño y fueron cosechados. Sin embargo, la cantidad de materia orgánica fue muy superior durante la época de lluvias. También es posible que haya otros focos de contaminación no identificados en el área, pero en estos casos es muy difícil separar los efectos antrópicos de los naturales (Pires-Vanin et al., 2013). Las diferencias estacionales observadas entre periodos hidroclimáticos indican que la influencia de la descarga del río es más importante que otras posibles fuentes de enriquecimiento por materia orgánica.
El patrón estacional de abundancia encontrado en el presente trabajo ha sido observado en otras comunidades macrobentónicas en el Pacífico central mexicano (Ahumada-Sempoal et al., 2002) y en otras zonas del golfo de México (Hernández-Arana et al., 2003), donde la proliferación de ejemplares se debe a que el gran aporte de materia orgánica por parte de las descargas de los ríos en la época de lluvias produce un incremento en la biomasa (Escobar-Briones y Soto, 1997; Hernández-Arana et al., 2003; Rodríguez-Valencia, 2004), aunque en algunos casos la hipoxia causada por grandes descargas de los ríos (Gastón, 1985) o la acumulación masiva de sedimento tras una tormenta (Rodríguez-Valencia, 2004) pueden producir una reducción importante de la densidad del macrobentos.
De acuerdo con la hipótesis de alteración intermedia de Connell (1978), la máxima diversidad se produce a niveles moderados de alteración. Atendiendo a los índices de diversidad obtenidos en el presente trabajo y teniendo esto en cuenta, el orden de las estaciones de muestreo por grado de alteración sería 1>2>3>4. En este caso, la estación 3 es la que presenta el índice de diversidad medio más elevado para todo el periodo de muestreo, y la materia orgánica que recibe, en este caso, provocaría efectos positivos (un aporte de materia orgánica moderado, pero continuo puede producir un incremento en la diversidad o la abundancia de la fauna, Nickell et al., 2003). Por su parte, la estación 4 sería la menos alterada de todas si consideramos todo el año, ya que su índice de diversidad es superior a las estaciones 1 y 2.
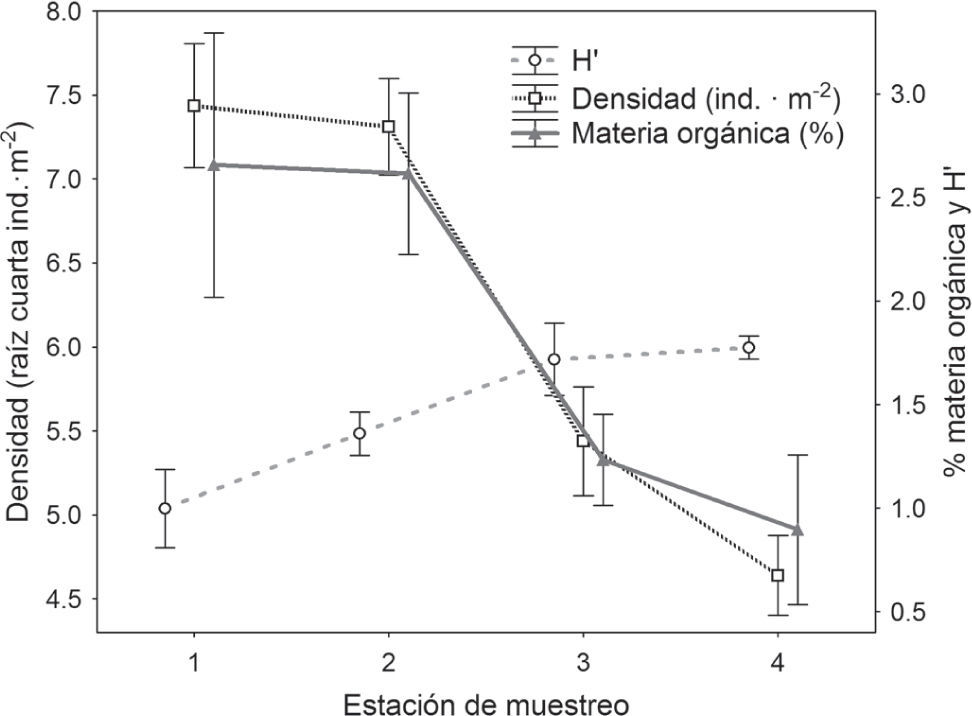
Los patrones de variación espacial de la abundancia, la diversidad y el contenido en materia orgánica observados en el presente estudio concuerdan claramente con el gradiente de contaminación por materia orgánica descrita en el modelo de Pearson y Rosenberg (1978), y que ha sido documentado en numerosos casos de alteración por enriquecimiento en materia orgánica (Weston, 1990; Nickell et al., 2003; Kutti et al., 2007; D'Amours et al., 2008; Tomassetti et al., 2009) (Fig. 4). En este modelo se describen 4 estados de sucesión bentónica: normal, transitoria, contaminada y fuertemente contaminada, dependiendo del nivel de materia orgánica en el sedimento. En este gradiente la diversidad decrece cuando aumenta el contenido en materia orgánica, hasta que la fauna desaparece, cuando la contaminación es muy severa. La abundancia también se incrementa con la cantidad de materia orgánica (Fig. 4) y se produce una simplificación de la estructura trófica de la comunidad, que pasa a ser dominada por unas pocas especies oportunistas como los poliquetos o los anfípodos. Estos son de pequeño tamaño y detritívoros, presentan reproducción continua o semicontinua y están adaptados para colonizar rápidamente (Lenihan y Micheli, 2001; Rosa y Bemvenuti, 2006) y son competidores exitosos cuando la disponibilidad de materia orgánica es alta, pero pobres competidores cuando el alimento y el espacio es escaso, por lo que rápidamente son desplazados por otras especies cuando las condiciones ambientales se restablecen (Lenihan y Micheli, 2001).
Representación de la densidad (ind•m−2, transformada a raíz cuarta), el índice de diversidad de Shannon-Wiener (H') y el % de materia orgánica medios (todos los valores ± el error estándar de la media) a lo largo de las estaciones de muestreo de la bahía de Navidad, de norte a sur durante la temporada de verano.
Numerosos estudios acerca de la respuesta de las comunidades bentónicas ante un enriquecimiento de materia orgánica coindicen en destacar que los poliquetos, sobre todo, capitélidos y espiónidos son los oportunistas más abundantes en condiciones de mayor enriquecimiento (Pearson y Rosenberg, 1978; Bigot et al., 2006; Vivan et al., 2009; entre otros), aunque los anfípodos (Lenihan y Micheli, 2001; Brooks et al., 2003; Bigot et al., 2006; Vivan et al., 2009), isópodos y cumáceos (Lenihan y Micheli, 2001; Vivan et al., 2009) y algunos bivalvos (Brooks et al., 2003; Kutti et al., 2007; Vivan et al., 2009) también forman parte de esta fauna oportunista. En el presente estudio la parte de la bahía enriquecida con materia orgánica presentó elevada abundancia de poliquetos, pero una alta dominancia de escafópodos del género Dentalium. En la estación 1 representan casi el 80% de las capturas, con una densidad media de 1 831 ind•m−2, y llegando a un máximo de 9 788 ind•m−2. En ninguno de los estudios citados anteriormente se encontraron escafópodos entre la fauna de zonas enriquecidas con materia orgánica, ya sea debido a cultivos marinos o a actividad antrópica. Ríos-Jara et al. (2003) destacan la escasa literatura existente sobre escafópodos en las costas del Pacífico mexicano e indican que aparecen ocasionalmente en las muestras de sedimento marino. Los datos obtenidos en trabajos tanto del Pacífico como del Atlántico indican que son organismos poco abundantes (10–220 ind•m−2) en la plataforma de Jalisco y Colima (Ríos-Jara et al., 2003) y todavía menos abundantes (4–34 ind•m−2) en la plataforma de Yucatán (Hernández-Arana et al., 2003) y se encuentran principalmente en zonas profundas, entre 72–75m de profundidad, aunque algunos se capturaron a 23m) en Jalisco y Colima, y 80–140m en Yucatán, por lo que las elevadas densidades obtenidas en el presente trabajo indican que se trata de un fenómeno excepcional. La biología de los escafópodos es aún hoy en día la menos entendida de los moluscos (Reynolds, 2002). Se sabe que son organismos excavadores semisésiles de pequeño tamaño, viven enterrados en el sedimento y son más abundantes en sedimentos finos, fangosos y fango-arcillosos. Son carnívoros que se alimentan principalmente de foraminíferos y otros microorganismos (Reynolds, 2002), aunque algunas especies no son especialistas y se alimentan de cualquier cosa que puedan capturar (Shimek, 1990). Las densidades obtenidas en el presente estudio son muy superiores a las registradas hasta el momento, por lo que suponemos que en la parte norte de la bahía de Navidad encuentran el tipo de sedimento y la cantidad de alimento óptimos para soportar estas densidades. Los foraminíferos son indicadores de contaminación (Eichler et al., 2012) o enriquecimiento por materia orgánica (Gómez-Noguera y Hendrickx, 1997), y se han encontrado elevadas densidades en lugares con sedimento fino y contaminados, por materia orgánica u otro tipo de contaminantes, tanto en zona intermareal (Hack et al., 2007) como submareal (Gómez-Noguera y Hendrickx, 1997; Eichler et al., 2012), por lo que la parte norte de la bahía de Navidad podría contener elevadas densidades de estos organismos. La densidad de los escafópodos fue muy inferior en la parte sur de la bahía y son el grupo taxonómico que marca las diferencias entre comunidades del norte y del sur. La parte sur de la bahía no está tan afectada por un gran aporte de materia orgánica y sedimento fino y presentó una fauna más diversa, aunque los grupos más abundantes fueron anfípodos, poliquetos, cumáceos, misidáceos, isópodos y bivalvos, la mayoría de ellos también considerados como oportunistas y encontrados en otras zonas tropicales afectadas moderadamente por enriquecimiento en materia orgánica (Bigot et al., 2006; Vivan et al., 2009; Pires-Vanin et al., 2013), por lo que podemos suponer que el enriquecimiento en materia orgánica afecta a toda la bahía en mayor o menor medida.
Recientes estudios sobre alimentación de peces de arrecife (Aguilar-Palomino y González-Sansón, 2010; Flores-Ortega et al., 2010) y demersales (Flores-Ortega et al., 2011) en el área de estudio indican que las zonas someras de la bahía de Navidad podrían ser una fuente importante de alimento para estas especies, especialmente la parte sur de la bahía (estaciones 3 y 4), ya que los crustáceos: anfípodos, decápodos e isópodos, de pequeño tamaño son una parte muy importante de la dieta de especies como la sarangola, Microlepidotus brevipinnis y el chivo, Mulloidichthys dentatus (Flores-Ortega et al., 2010), o las rayas Urobatis halleri, Urotrygon munda y Urotrygon rogersi, que se alimentan principalmente de decápodos y anfípodos (Flores-Ortega et al., 2011). El 62% de la abundancia de los grupos taxonómicos capturados en la estación 3, y el 69% en el caso de la estación 4, son presas potenciales de estas especies, lo que indicaría el valor de la bahía de Navidad, al menos en su parte sur, como fuente de alimento de peces importantes para la pesquería.