Uruguay cuenta con una densa red hidrográfica, a pesar de ello, el conocimiento de las comunidades de macroinvertebrados acuáticos es insuficiente. Sumado a esto, en las últimas décadas se ha producido un avance en la forestación con especies exóticas, provocando cambios en la vegetación ribereña de algunos ríos. El objetivo de esta investigación fue determinar la composición y estructura trófica de la comunidad de macroinvertebrados así como su relación con algunos parámetros fisicoquímicos en 8 ríos donde el bosque nativo se encuentra bien conservado, y sentar las bases para futuros estudios. Las muestras fueron recolectadas entre diciembre de 2006 a diciembre de 2007. Temperatura, oxígeno disuelto, pH y conductividad se midieron in situ. Se determinaron la composición y la abundancia taxonómicas y se realizaron análisis de componentes principales y de correspondencia canónica con los parámetros fisicoquímicos y biológicos. La diversidad alfa se calculó utilizando los índices de Shannon-Weaver (H'), dominancia de Simpson (D) y equidad de Pielou (J'). Para la determinación de la diversidad beta se empleó índice de similitud de Bray-Curtis. Un total de 1 291 ejemplares pertenecientes a 92 taxones fueron registrados. Los taxa más abundantes fueron Ephemeroptera (36%), Amphipoda (17%) y Coleoptera (12%). Los ríos muestran una gran diversidad y una baja dominancia. Conductividad, pH y temperatura fueron los factores principales en la determinación de la distribución y composición de los macroinvertebrados.
Uruguay has a dense hydrographic network, nevertheless the knowledge of the aquatic macroinvertebrate community is still lacking. In recent decades afforestation with exotic species has increased which has produced changes in riparian vegetation of some rivers. The aim of this research was to determine the composition and trophic structure of macroinvertebrate community and its relationship to some physicochemical parameters in eight streams where the native forest is still well preserved and provide the basis for future studies. Samples were collected from December 2006 to December 2007. Temperature, dissolved oxygen, pH and conductivity were measured in situ. Taxonomic composition and abundance were determined, a principal component analysis and a canonical correspondence analysis were carried out with the physico-chemical and biological parameters. The alpha diversity was calculated using the Shannon-Weaver (H'), dominance of Simpson (D) and Pielou evenness indexes (J'). Beta diversity was determined employing similarity index of Bray-Curtis. A total of 1 291 specimens belonging 92 taxa were recorded. The most abundant taxa were Ephemeroptera (36%), Amphipoda (17%) and Coleoptera (12%). The streams show high diversity and low dominance. Conductivity, pH, and temperature were the main factors in determining the macroinvertebrate distribution and composition.
Debido al aporte de materia orgánica, la vegetación ribereña juega un papel importante en la estructura y complejidad de los ríos (Boothroyd et al., 2004). La vegetación rivereña se encuentra más conectada a la vida que sucede dentro del río que fuera de él, cumpliendo un rol fundamental en la cadena trófica de estos ambientes y en la determinación de la composición de las comunidades que lo habitan, como son los macroinvertebrados (Vannote et al., 1980; Corbacho et al, 2003). Los cambios en el uso del suelo se reflejan en los recursos hídricos, que sufren degradación de su calidad a través de la contaminación agroquímica, incremento de la carga orgánica y aumento de la sedimentación (Meza et al., 2012; Suga y Tanaka, 2013).
En las últimas décadas, los cultivos forestales con especies exóticas se han expandido en Uruguay, llegando en la actualidad a casi 1millón de hectáreas forestadas, compuesta principalmente de eucaliptos. Esto representa, de acuerdo con la Dirección General Forestal (2010), el 56% del total de bosques presentes, siendo según Paruelo et al. (2006) una de las más importantes transformaciones ocurridas en el país. Algunos autores han documentado los cambios que las plantaciones de Eucalyptus globulus y Eucalyptus grandis producen en la vegetación ribereña de los ríos, lo que trae como consecuencia cambios sobre la estructura y composición de las comunidades de macroinvertebrados (Callisto et al., 2002; Guevara-Cardona et al., 2006; Mancilla et al., 2009). Esto se debe tanto al dosel que controla la penetración de la luz y, consecuentemente, afecta la productividad primaria y la temperatura del agua (Boothroyd et al., 2004) como al aporte directo de las hojas que son tóxicas para muchos organismos (Molinero y Pozo, 2003).
A pesar de la densa y muy ramificada red hidrográfica con que cuenta Uruguay, el conocimiento disponible de las comunidades de macroinvertebrados acuáticos es aún insuficiente. Los estudios limnológicos realizados hasta el presente en el país, se han centrado, principalmente en caracterizar las lagunas costeras (Arocena et al., 2000, 2003; Arocena y Prat, 2006; Arocena, 2007) y cursos de agua relacionados con la cuenca del Río de la Plata, con importantes áreas de degradación urbana y suburbana, así como aspectos de contaminación orgánica (Pintos et al., 1992; Chalar, 1994; Arocena, 1998, 1996; Boccardi, 2004; Teixeira de Mello y Clemente., 2001; Chalar et al., 2011). Hasta ahora no se han realizado inventarios de fauna bentónica en cursos de agua naturales donde el bosque nativo aún se encuentra bien conservado. El propósito de esta investigación fue determinar la estructura de la comunidad de macroinvertebrados acuáticos, su estructura trófica y su relación con algunos parámetros fisicoquímicos en 8 ríos donde el bosque nativo aún se encuentra bien conservado, con especial ausencia de vegetación exótica y, así, llenar ese vacío de información con que hoy contamos y sentar las bases para futuros estudios en taxonomía, dinámica poblacional, ecología, biodiversidad y control de la calidad del agua en la zona de estudio.
Materiales y métodosÁrea de estudio. La cuenca del Río Negro se ubica geográficamente en el centro del país, cubriendo una superficie de 52 034km2, articulándose en torno al más importante curso de agua del interior de Uruguay, el Río Negro, con una longitud de 750km, siendo el quinto más grande del mundo. Nace en el Nudo de Santa Tecla, en territorio brasileño, en el estado de Río Grande del Sur, cruzando luego el territorio uruguayo en dirección este-oeste, dividiéndolo en 2 partes y desembocando en el río Uruguay. En esta cuenca están ubicadas 3 represas hidroeléctricas y se caracteriza por la cría intensiva de ganado, el cultivo de soja y arroz, así como por plantaciones forestales en los últimos años (Evia y Gudynas, 2000; Achkar et al., 2004)
El estudio se realizó en 3 áreas en los departamentos de Durazno y Tacuarembó, donde existe una intensa actividad forestal. Se establecieron 16 sitios de muestreo en 8 arroyos de bajo orden (< 3), de aguas someras, de velocidad moderada, de fondos arenosos, con presencia de cantos rodados, abundante hojarasca y ausencia de vegetación exótica (Fig. 1; Cuadro 1). Se realizaron 4 salidas de campo entre diciembre de 2006 y diciembre de 2007, una en cada estación del año.
Localización geográfica de las estaciones de muestreo y parámetros fisicoquímicos promedios; naciente (n), medio (m), desembocadura (d), en arroyos de la cuenca del Río Negro, Uruguay
| Estaciones | Localidad | O2mg/l-1 | pH | T° C | Conduc. μS | |
|---|---|---|---|---|---|---|
| E1 | Cañada de los Argentinos (n) | 32°24'0.05” S,55°32'28.5” O | 4.13 | 7.45 | 24.4 | 238.0 |
| E2 | Cañada del Sauce Amaro (m) | 32°21'42.9” S,55°34'59.6” O | 2.45 | 7.30 | 15.7 | 289.2 |
| E3 | Cañada del Sauce Amaro (d) | 32°21'41.9” S,55°34'58.6” O | 2.20 | 7.60 | 15.4 | 285.9 |
| E4 | Arroyo Malo (n) | 32°21'19.2” S,55°35'1.6” O | 1.84 | 7.47 | 25.7 | 406.3 |
| E5 | Arroyo Malo (m) | 32°22'18.4” S,55°34'6.4” O | 2.21 | 7.40 | 25.4 | 392.3 |
| E6 | Arroyo Malo (d) | 32°23'40.7” S,55°34 36.9” O | 2.13 | 7.30 | 27.7 | 268.4 |
| E7 | Arroyo del Estado (d) | 32°38'57.1” S,55°24'48.8” O | 2.00 | 7.40 | 22.3 | 78.6 |
| E8 | Arroyo del Estado (m) | 32°39'11.8” S,55°27'38.6” O | 3.53 | 7.00 | 20.2 | 40.0 |
| E9 | Arroyo de las Cañas (m) | 32°40'47.18 S,55°42'35.64” O | 1.42 | 7.25 | 23.8 | 346.0 |
| E10 | Arroyo Asperezas (m) | 32°38'20.2” S,55°24'58.6” O | 5.45 | 7.25 | 23.8 | 52.5 |
| E11 | Cañada Tala (d) | 32°41'10.32' S,55°41'28.60” O | 2.33 | 7.30 | 14.2 | 275.5 |
| E12 | Cañada Tala (m) | 32°41'16.51' S,55°40'26.65” O | 2.18 | 7.50 | 13.8 | 270.6 |
| E13 | Cañada Tala (n) | 32°41'42.76' S,55°40'12.70” O | 2.23 | 7.45 | 17.0 | 100.7 |
| E14 | Arroyo Blanquillo (d) | 32°40'13.80' S,55°40'45.03” O | 7.96 | 7.60 | 19.8 | 287.6 |
| E15 | Arroyo Blanquillo (m) | 32°39'42.89' S,55°41'28.27” O | 5.29 | 7.00 | 20.2 | 288.1 |
| E16 | Arroyo Blanquillo (n) | 32°40'17.73' S,55°40'24.78” O | 3.40 | 7.50 | 24.5 | 110.6 |
Parámetros fisicoquímicos. Con el fin de describir el hábitat, en cada sitio se registraron in situ los parámetros de temperatura, oxígeno y conductividad, empleando una sonda multiparámetro portátil (YSI 556) y el pH, mediante un potenciómetro (Hanna Hl 8313).
Parámetros biológicos. La recolección de los macroinvertebrados acuáticos se realizó con red de corriente (Kick net) de 250μm de luz de malla, a lo largo de 100m en intervalos de 10m, con un tiempo estandarizado de colecta de 10 minutos con 3 réplicas para cada punto de muestreo. Se realizaron muestreos en las nacientes, tramos medios y desembocaduras.
Para el muestreo cuantitativo se utilizó una red Surber (0.3m×0.3m; 250μm de abertura de malla), con 3 réplicas para cada punto de muestreo. El material se conservó en etanol al 70%. Los organismos fueron trasladados a la Sección Entomología de la Facultad de Ciencias, donde se separaron y se identificaron hasta género y/o morfotipo, con la ayuda de las claves de Edmunds et al. (1976); Boschi (1981); Rodríguez (1981); Flint (1983); Domínguez et al. (1992); Zolessi y Philippi (1995); Lopretto y Tell (1995); Domínguez y Fernández (2009). De acuerdo con los criterios propuestos por Tomanova et al. (2006); Chará-Serna et al. (2010) y Rodríguez-Barrios et al. (2011), para taxones neotropicales, los macroinvertebrados fueron clasificados en los siguientes grupos tróficos: colectores-filtradores, colectores-recolectores, raspadores, depredadores y fragmentadores.
Para evaluar la estructura de la comunidad se calculó la riqueza taxonómica, la densidad en individuos por m2, la diversidad mediante el índice de Shannon-Wiener (H), la dominancia a través del índice de Simpson (D) y la equidad por medio del índice de Pielou (J'). El número total esperado de taxones en la zona se evaluó utilizando los modelos de estimación de riqueza Chao 2 y Jacknife de primer orden (Jack 1). Para comparar la composición de los diferentes sitos de muestreo se empleó el índice de similitud de Bray-Curtis, utilizando el algoritmo UPGMA (Magurran, 1989; Moreno, 2001). Para tener una visión acerca de la variabilidad ambiental, se realizó un análisis de componentes principales (ACP) (Mangeaud, 2004; Martínez-Bastida et al., 2006). Las asociaciones entre la estructura de la comunidad, excluyendo los taxa con abundancias de 1 ejemplar por muestra, y las variables ambientales se exploraron mediante un análisis de correspondencia canónica (ACC). Para evaluar la significancia estadística del ordenamiento de los ejes canónicos se realizaron las pruebas de permutaciones de Monte Carlo (1 000 permutaciones, p<0.05). Los análisis estadísticos fueron realizados con los programas Past (Hammer et al., 2001), Bio Diversity Pro 2 (McAleece et al., 1997) y EstimateS (Colwell, 2006).
ResultadosParámetros fisicoquímicos. Los valores promedio de los parámetros fisicoquímicos se presentan en el Cuadro 1. La temperatura del agua osciló entre 13.8° C en el sitio E12 en invierno y 27.7° C en el sitio E6 en el verano. La conductividad varió de 40.09μS (E9) a 406.3μS (E4). El pH varió de 7.00 en los sitios E9 y E15 a 7.60 en E3 y E14. La concentración de oxígeno disuelto osciló entre 1.42mg/1-1 (E8) y 7.9 6mg/1-1 (E14).
Análisis cualitativo y cuantitativo de los macroinvertebrados. Un total de 1 291 ejemplares de macroinvertebrados fueron colectados, pertenecientes a 92 taxones distribuidos en 46 familias y 14 órdenes (Cuadro 2). La densidad promedio osciló entre 48 ind/m2 (E8, verano) y 1 488 ind/m2 (E1, primavera) (Cuadro 3).
Lista taxonómica de los macroinvertebrados recolectados y sus abundancias totales en arroyos de la cuenca del Río Negro, Uruguay
| Clase | Orden | Familia | Género | Núm. |
|---|---|---|---|---|
| Insecta | Ephemeroptera | Caenidae | Caenis | 225 |
| Baetidae | Callibaetis | 24 | ||
| Americabaetis | 105 | |||
| Cloeodes | 62 | |||
| Paracloeodes | 3 | |||
| Siphlonuridae | Metamorius | 14 | ||
| Leptohyphidae | Haplohyphes | 13 | ||
| Tricorythodes | 2 | |||
| Leptophlebiidae | Askola | 3 | ||
| Odonata | Libellulidae | Libellula | 22 | |
| Erythrodiplax | 4 | |||
| Perithemis | 2 | |||
| Coenagrionidae | morfo2 | 51 | ||
| Corduliidae | Rialla | 1 | ||
| Protoneuridae | Peristicta | 24 | ||
| Gomphidae | Zoonophora | 1 | ||
| Progomphus | 1 | |||
| Phyllocycla | 1 | |||
| Gompoides | 1 | |||
| Plecoptera | Gripopterygidae | morfo3 | 34 | |
| Claudioperla | 21 | |||
| Hemiptera | Corixidae | Sigara | 46 | |
| morfo4 | 7 | |||
| Gerridae | Halobatopsis | 4 | ||
| Veliidae | Microvelia | 14 | ||
| Euvelia | 19 | |||
| Belostomatidae | Belostoma | 22 | ||
| Hydrometridae | Hydrometra | 1 | ||
| Trichoptera | Hydropsychidae | Smicridea | 11 | |
| Leptoceridae | morfo5 | 1 | ||
| Triplectides | 15 | |||
| Coleoptera | Gyrinidae | Gyrinus | 2 | |
| Gyretes | 3 | |||
| Andogyrus | 4 | |||
| Elmidae | Austrolimnius | 1 | ||
| Mycrocylloepus | 1 | |||
| Xenelmis | 1 | |||
| Hydrophilidae | Derallus | 4 | ||
| Crenitis | 1 | |||
| Anacaena | 4 | |||
| Berosus | 3 | |||
| Phaenonotum | 1 | |||
| Georissus | 17 | |||
| Paracymus | 6 | |||
| Noteridae | Hydrocanthus | 6 | ||
| Suphisellus | 1 | |||
| Dytiscidae | Notaticus | 6 | ||
| Megadytes | 2 | |||
| Laccophilus | 41 | |||
| Liodessus | 3 | |||
| Laccornellus | 8 | |||
| Hemibidessus | 4 | |||
| Celina | 1 | |||
| Limnichidae | morfo6 | 6 | ||
| Dryopidae | Pelonomus | 2 | ||
| Scirtidae | morfo7 | 6 | ||
| morfo8 | 9 | |||
| Haliplidae | Haliplus | 1 | ||
| Hydrochidae | Hydrochus | 3 | ||
| Curculionidae | Hyodites | 1 | ||
| Notiodes | 3 | |||
| Lissorhoptrus | 1 | |||
| Sphaeriusidae | Sphaerius | 1 | ||
| Chrysomelidae | morfo11 | 1 | ||
| Diptera | Chironomidae | morfo12 | 24 | |
| Dixidae | morfo13 | 23 | ||
| Simulidae | morfo14 | 1 | ||
| Sciomyzidae | morfo15 | 1 | ||
| Culicidae | morfo16 | 4 | ||
| Crustacea | Cladocera | morfo18 | 14 | |
| Ostracoda | morfo17 | 52 | ||
| Cyprididae | Cyprella | 13 | ||
| Amphipoda | Hyalellidae | Hyalella | 120 | |
| Decapoda | Trichodactylidae | Trichodactylus | 1 | |
| Palaemonidae | Macrobrachium | 2 | ||
| Aeglidae | Aegla | 13 | ||
| Pelecipoda | Eulamelibranchia | Hyriidae | Diplodon | 8 |
| Gastropoda | Basommatophora | Planorbidae | Biomphalaria | 28 |
| Littoridina | 8 | |||
| Sphaeridae | Pisidium | 2 | ||
| Mesogastropoda | Ampullaridae | Pomacea | 7 | |
| Hydrobiidae | Helobia | 6 | ||
| Hirudinea | morfo19 | 22 | ||
| Nematoda | morfo20 | 6 | ||
| morfo21 | 28 | |||
| 1 291 |
Parámetros comunitarios para cada estación en arroyos de la cuenca del Río Negro, Uruguay. Riqueza (S), número de individuos (Núm.), índice de Simpson (D), índice de Shannon (H), equidad de Pielou (J'), densidad promedio (ind/m2)
| Estaciones | S | Núm. | D | H | J' | ind/m2 |
|---|---|---|---|---|---|---|
| E1 | 19 | 140 | 0.14 | 2.33 | 0.79 | 1 488 |
| E2 | 6 | 83 | 0.31 | 1.27 | 0.71 | 796 |
| E3 | 6 | 27 | 0.37 | 1.27 | 0.70 | 628 |
| E4 | 15 | 86 | 0.49 | 1.33 | 0.50 | 724 |
| E5 | 20 | 80 | 0.17 | 2.33 | 0.77 | 589 |
| E6 | 13 | 96 | 0.17 | 2.00 | 0.78 | 659 |
| E7 | 13 | 42 | 0.16 | 2.12 | 0.82 | 1 088 |
| E8 | 10 | 25 | 0.18 | 2.11 | 0.91 | 48 |
| E9 | 10 | 66 | 0.13 | 1.92 | 0.83 | 272 |
| E10 | 10 | 31 | 0.18 | 1.96 | 0.85 | 109 |
| E11 | 16 | 52 | 0.21 | 2.05 | 0.74 | 190 |
| E12 | 13 | 43 | 0.19 | 2.02 | 0.79 | 185 |
| E13 | 14 | 99 | 0.14 | 2.20 | 0.83 | 210 |
| E14 | 12 | 132 | 0.56 | 1.06 | 0.42 | 288 |
| E15 | 16 | 77 | 0.13 | 2.34 | 0.84 | 688 |
| E16 | 24 | 177 | 0.10 | 2.55 | 0.80 | 784 |
La clase Insecta representó el 76% de la muestra con 961 ejemplares recolectados. Dentro de ésta, el orden Ephemeroptera presentó la mayor abundancia con 456 individuos (47% del total de insectos y 36% del total de la muestra), seguido por el orden Coleoptera con 149 individuos (16% del total de insectos y 12% del total de la muestra). Entre los crustáceos, con 215 ejemplares recolectados (17% del total de la muestra), el orden más abundante fue Amphipoda con 120 ejemplares. El orden más diverso en cuanto al número de familias fue Coleoptera con 13, los demás estuvieron representados por 6 (Crustacea) y 1 (Plecoptera) familias. El taxón que estuvo presente en todos los sitios fue el género Caenis, con 225 ejemplares, alcanzando la mayor densidad en el sitio de muestreo E4 durante el verano, seguido por Hyalella con 120 ejemplares, alcanzando la mayor densidad en el sitio E1 durante la primavera (Cuadro 2).
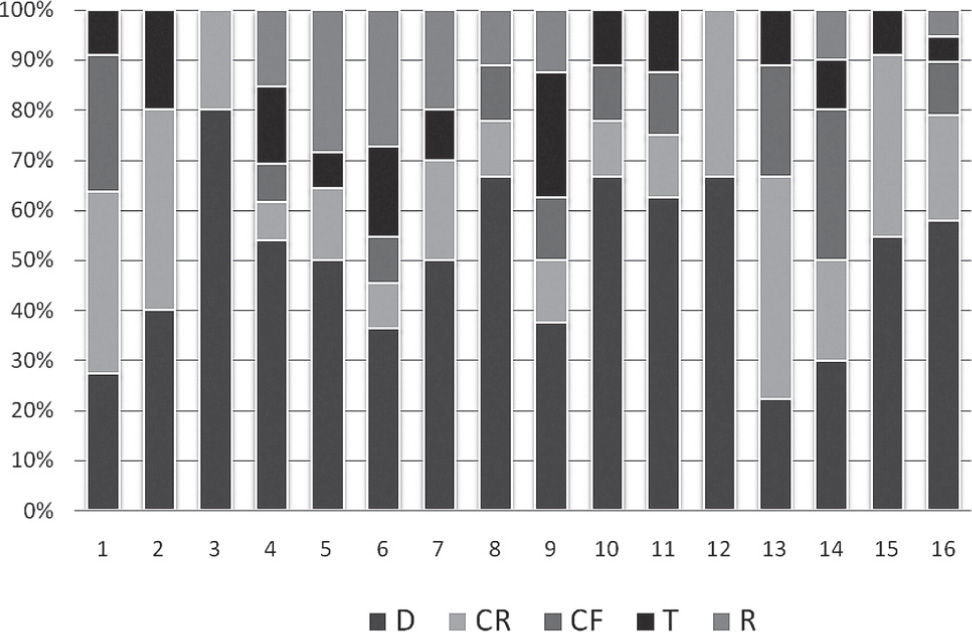
Los grupos tróficos con mayor abundancia fueron los depredadores (51%) y el colector-recolector (20%) presentes en todos los sitios muestreados. Los colectores-filtradores (10%) se encontraron presentes en 13 sitios, los fragmentadores (10%) en 10 y los raspadores (9%) en 8 (Fig. 2).
Los valores de los parámetros de diversidad alfa se presentan en el Cuadro 3. La riqueza varió entre 6 especies en los sitios E2 y E3 en el invierno, a 24 especies en el E16 durante la primavera. El sitio que presentó mayor abundancia de individuos fue el E16 (177, primavera) y el de menor el E9 (25, verano). El índice de diversidad de Shannon Wiener (H) varió entre 1.06 en el sitio E14 a 2.55 en el E16. Se registraron bajos valores de dominancia, menos en los sitios E4 y E14, coincidiendo en ellos con bajos valores de equidad (Cuadro 3).
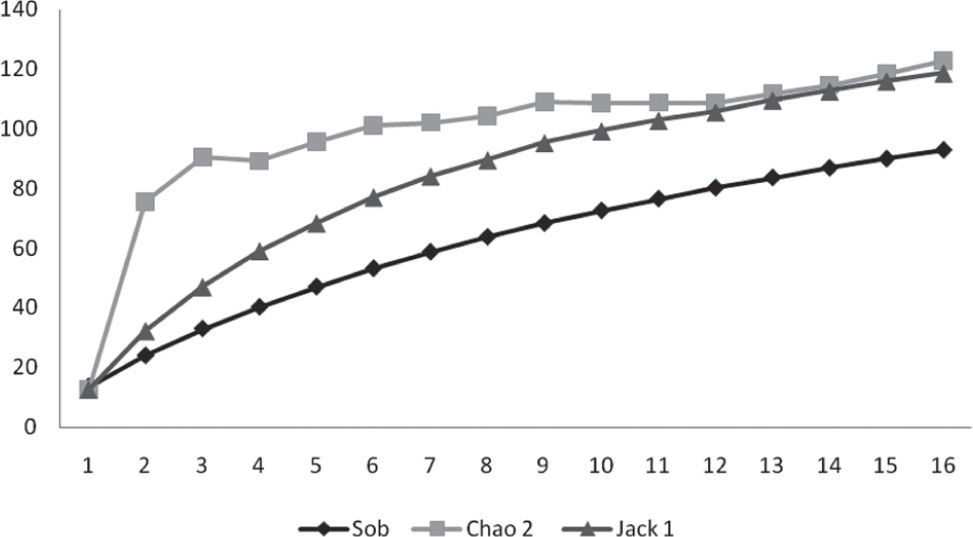
La curva de acumulación de especies observada se aproximó suavemente a la riqueza asintótica, pero siempre por debajo de los estimadores de riqueza. El estimador Chao 2 evidenció que se muestreó el 75% de las especies presentes, mientras que el Jacknife 1, el 77% (Fig. 3).
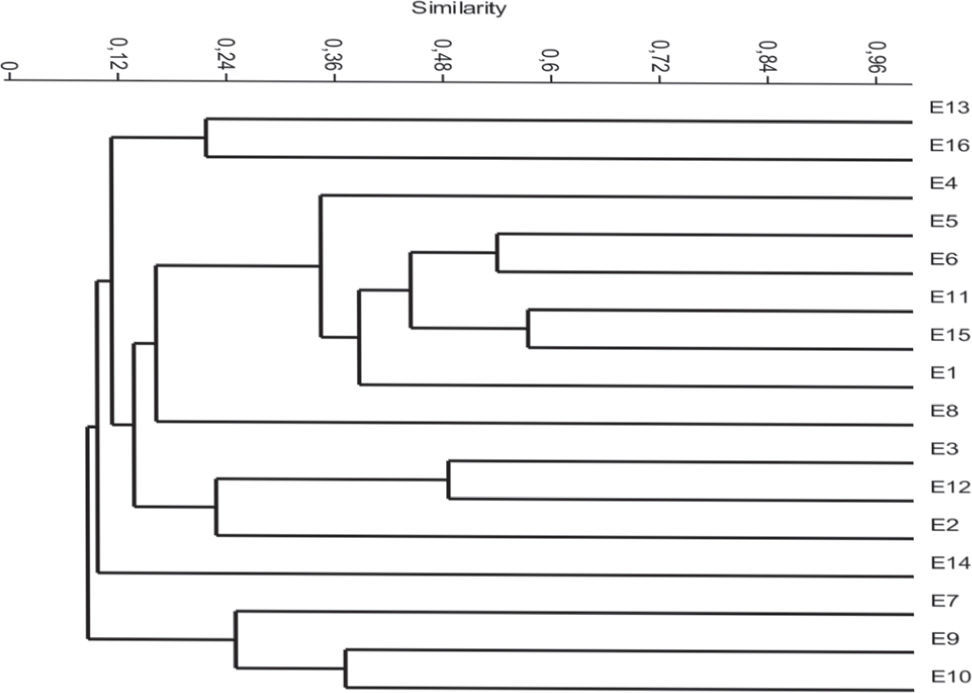
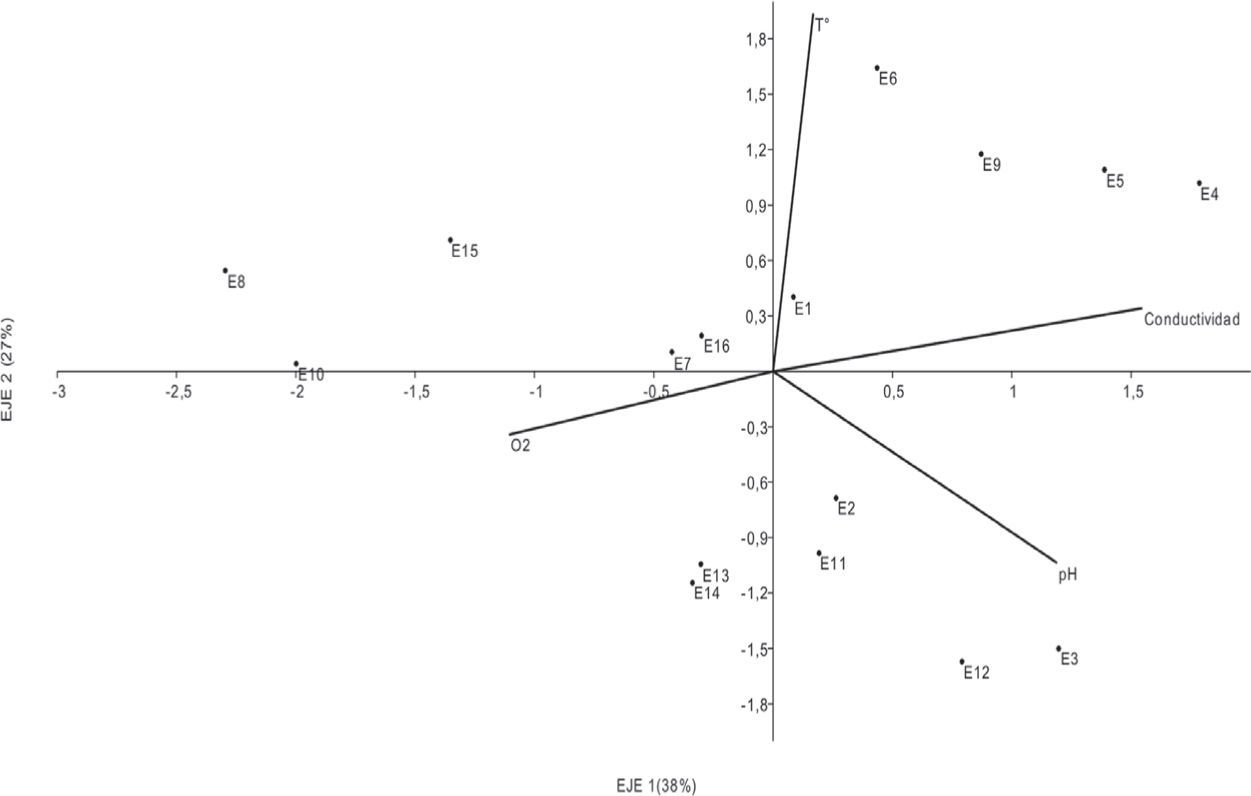
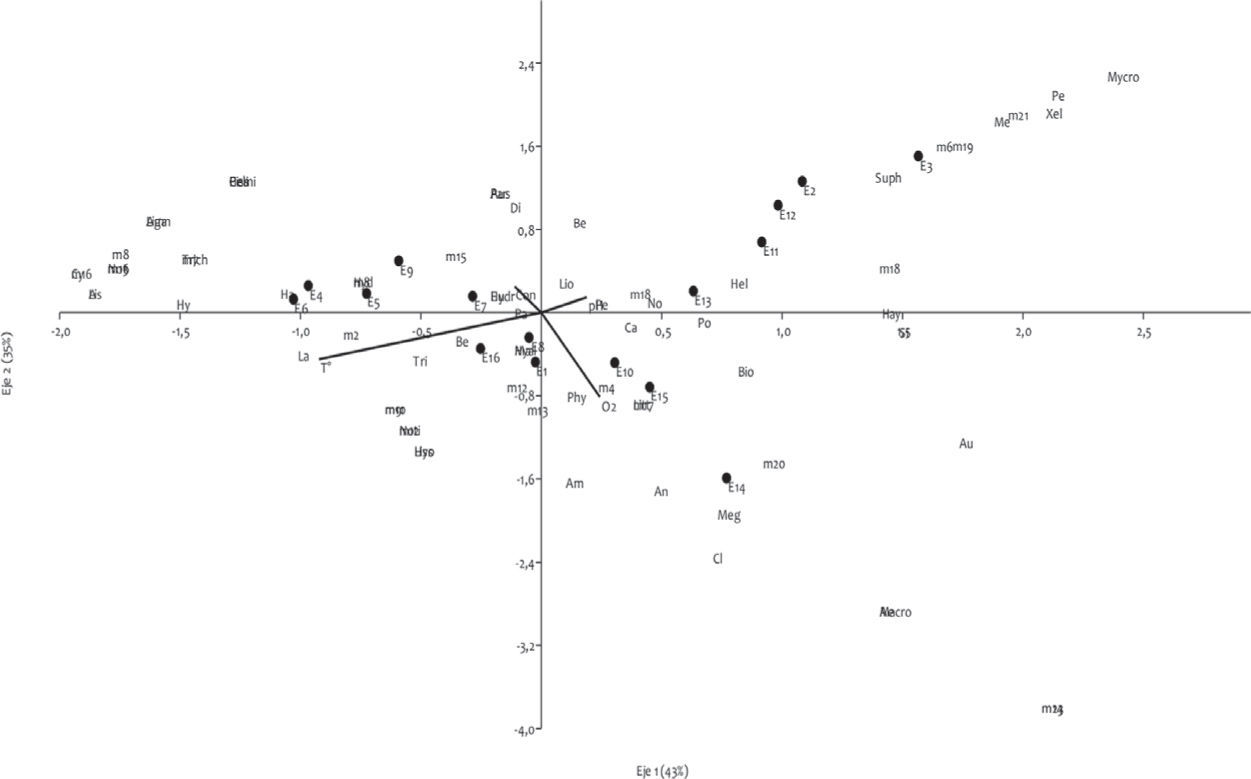
Los valores de similitud se muestran en la figura 4. El análisis reveló similitudes bajas con una tendencia a la agrupación entre estaciones de nacientes, media y desembocadura. La asociación de macroinvertebrados con mayor similitud se dio entre los sitios E15 y E11 (57%), siendo el sitio E14 el más disímil de todos (20%). El ACP (Fig. 5) indica que la relación entre las variables ambientales puede ser explicada por los 2 primeros ejes en un 65%. El eje 1 presentó una correlación positiva con la conductividad (0.78) y el pH (0.60) y negativa con el oxígeno (−0.57). El eje 2 mostró una correlación positiva con la temperatura (0.90). El ACC (Fig. 6) indica que la varianza acumulada de la relación entre las variables fisicoquímicas y biológicas puede ser explicada por los 2 primeros ejes en un 79%. Las pruebas de permutaciones de Montecarlo (1 000) muestran que ambos ejes fueron altamente significativos (p=0.001). Esto confirma que la distribución de los taxones no fue debida al azar, lo que indica que la mayor parte de la variación explicable de los datos fue tomada en cuenta por las variables ambientales medidas.
Los organismos recolectados en este estudio son típicos de sistemas lóticos con poca intervención antrópica (Castellanos y Serrato, 2008). Del mismo modo, es bien sabido que existe una relación directa entre el número de taxones y los tipos y variedad de sustratos (Richards et al., 1993). Por lo general, los ríos con fondos arenosos o arenoso-limosos que albergan pocas especies, con pocos individuos por especie (Pintos et al., 1992; Chalar, 1994; Arocena, 1998; Boccardi, 2004), ya que son sustratos especializados y muy inestables con las corrientes de agua. En contraste, los fondos pedregosos suelen ser más ricos, ya que ofrecen una mayor superficie para el crecimiento de la biopelícula de la cual se alimentan diversos consumidores primarios; los sustratos dominados por hojarasca brindan una mayor disponibilidad de recursos para organismos fragmentadores, lo que además de presentar una alta riqueza de especies permiten sostener una mayor densidad de organismos (Burdet y Watts, 2009; Meza et al., 2012). Esto concuerda con lo observado en el presente estudio, donde los Ephemeroptera (36%), Amphipoda (17%) y Coleoptera (12%) fueron los taxones más representativos. Esto difiere con lo observado para otros ríos de Uruguay (Pintos et al., 1992; Chalar, 1994; Arocena, 1998; Boccardi, 2004) y de Sudamérica (Leiva, 2004; Buckup et al., 2007; Carvacho, 2012) donde predominaron Diptera y Gasteropoda, grupos más afines a los sustratos arenosos-limosos. Asimismo, la composición de taxones registrados, pudo deberse a que estos ríos tienen buenos mecanismos de autolimpieza que permiten la supervivencia de las comunidades (Fierro et al., 2012). Esto se ve reflejado en la estabilidad de los parámetros físicos y químicos, los cuales a pesar de las variaciones estacionales no difieren significativamente (Edokpayi y Osimen, 2001).
Los grupos tróficos que dominaron en la riqueza general de los ríos fueron los depredadores (51%) y colectores-recolectores (20%), presentes en todas los sitios, similar a lo observado por Rodríguez-Barrios et al. (2011). La presencia de varios grupos tróficos en cada sitio de muestreo, estaría relacionada con la existencia de una diversidad de nichos tróficos donde los organismos explotan diferentes hábitats y los recursos disponibles en su entorno, reduciendo los efectos de la competencia (Copatti et al., 2011; Meza et al., 2012).
De acuerdo con Leiva (2004), los altos valores de diversidad se relacionan directamente con un buen balance en las comunidades y con las condiciones del hábitat. Esto concuerda con los parámetros comunitarios analizados en el presente estudio, que indican comunidades estables. El alto valor de dominancia y bajo valor de equidad presentes en los sitios E4 (verano) y E14 (primavera), se debe a la dominancia de los géneros Caenis y Americabaetis, respectivamente. Flowers y De la Rosa (2010) afirman que la tolerancia de Americabaetis a la contaminación se desconoce, pero Caenis puede soportar un amplio rango de condiciones ambientales. En el caso estudiado, la abundancia de estos géneros, debido a la época muestreada, podría corresponder de acuerdo con Hanson et al. (2010) a una futura emergencia masiva.
El análisis de agrupamiento reveló similitudes bajas con una tendencia a la agrupación entre estaciones de nacientes, media y desembocadura, lo que se refleja también en el análisis de correspondencia canónica. Según Montoya (2007, 2008), esto puede ser atribuido a fluctuaciones del caudal y los ciclos de recolonización de biotopos.
Diferentes autores resaltan que los factores fisicoquímicos del medio acuático, como pH, conductividad, oxígeno disuelto y temperatura, son determinantes en la distribución de los macroinvertebrados acuáticos y son, además, los parámetros a los que los organismos son más sensibles (Quinn y Hickey, 1990; Roldán, 1996; Toro et al., 2002; Domínguez y Fernández, 2009; Carvacho, 2012; Meza et al., 2012). Esto concuerda con lo observado en el presente estudio, donde el ACP resaltó la importancia de las variables: conductividad, pH y temperatura, demostrando así su influencia sobre la comunidad estudiada. En otras investigaciones se han documentado resultados similares. Chalar (1994) encontró en el Arroyo Toledo que el oxígeno es la variable con mayor influencia sobre las comunidades de macroinvertebrados, mientras que para el río Santa Lucía lo fueron el oxígeno y la conductividad (Arocena et al., 2008). Distintos autores para otras regiones neotropicales encontraron que la temperatura, el oxígeno, la conductividad y los sólidos disueltos son las variables que mejor explican el funcionamiento de los sistemas lóticos (Mancilla et al., 2009; Carvacho, 2012).
Según esta investigación, los ríos estudiados presentan comunidades diversas y estables, propias de sistemas no alterados por actividades antrópicas. Con base en la perspectiva del avance de la reforestación con especies exóticas, es necesario avanzar en las investigaciones para poder realizar monitoreos físicos, químicos y biológicos periódicos que permitan implementar y aplicar planes de manejo y conservación de la biodiversidad presente en los sistemas lóticos de Uruguay.