Para conocer la distribución, incidencia del daño y especies de plaga de babosas en el cultivo de vainilla; se muestrearon 22 localidades de 9 municipios en 2 estados productores de vainilla en México. Se determinó la incidencia del daño por la plaga en el cultivo y se identificaron las especies presentes. En el 100% de las localidades muestreadas predominó la especie Leidyula moreleti y, en menor proporción se encontró a Sarasinula plebeia (31.8%), ambas mostrando incidencias en el cultivo que oscilan entre el 11 y 89%.
In order to know the distribution, incidence of crop damage and species pest of slugs, 22 locations were sampled in 9 municipalities in 2 vanilla producing states in Mexico. The incidence of damage by the pest in the cultivation was determined and the species were identified. Leidyula moreleti is the main slug found in 100% of the sampled locations and Sarasinula plebeia was found in smaller proportion (31.8%), both showing incidences ranging between 11 and 89%.
La vainilla comercial (Vanilla planifolia Jackson) es una especie originaria de las regiones húmedas tropicales de México y Centroamérica. Es una planta trepadora, hemiepífita o terrestre de la familia de las orquídeas, y para su cultivo necesita esencialmente de materia orgánica y un tutor que proporciona soporte y protección. Es una especie perenne, generalmente los primeros 2 años es de crecimiento vegetativo y a partir del tercero produce frutos anualmente. El fruto cosechado se somete a un proceso de “beneficiado” de 3 a 5 meses, para que se desarrollen los compuestos aromáticos y, posteriormente, se lleva al proceso de industrialización, para la obtención de extracto natural de vainilla como principal producto final (Hernández-Hernández, 2011; Téllez-Velasco, 2011). En México, el principal estado productor de vainilla es Veracruz, que aporta 70% de la producción nacional; en orden de importancia siguen Oaxaca y Puebla, que en conjunto aportan alrededor del 30% de la producción total, otros estados en los que se produce en menor cantidad son San Luis Potosí, Hidalgo, Chiapas y Quintana Roo. En años recientes, México ha ocupado el cuarto lugar a nivel mundial, en cuanto a producción; para el 2010 se tuvo una superficie cultivada de aproximadamente 100 ha, con una producción de 20 ton de vainas verdes (FAO, 2010; Hernández-Hernández, 2011). La vainillina es el saborizante y aromatizante de mayor importancia en el ámbito mundial, con una demanda estimada por especialistas de la industria de saborizantes de alrededor de 14 000 ton para 2012; sin embargo, en el mundo sólo se producen cerca de 100 ton de extracto de vainilla natural, el resto corresponde a sustitutos sintéticos con base en eugenol, coumarina y otros subproductos aromáticos de fermentaciones. La demanda de vainilla beneficiada está dominada por países con nivel de ingreso elevado, tales como Estados Unidos, Francia, Alemania y Japón, en los últimos años se ha observado la demanda de estos países hacia la compra de productos que sean inocuos y de alta calidad, pagando precios del orden de 2 000 pesos mexicanos por kilo de vainas beneficiadas (Lamas-Nolasco, 2013).
Una de las plagas que afectan al cultivo de vainilla son los moluscos conocidos comúnmente como babosas, las cuales causan daños al consumir parte de la enredadera o de las vainas (Curti, 1995; Ester y Geelen, 1996; Glen et al., 2000). En la India, tanto babosas como caracoles ocasionan daño directo en las plantas, debido a que se alimentan de las hojas, raíces, flores y vainas, lo cual causa lesiones que predisponen a la planta a quemaduras por sol y al daño por patógenos como hongos y bacterias (Vanitha et al., 2011). En México hay pocos estudios que indiquen cuáles son las especies de babosas que atacan a este cultivo, se desconoce también la distribución que estas especies guardan y la magnitud de daño que causan en los vainillales. El objetivo del presente trabajo fue identificar las especies de babosas plaga, conocer su distribución y la incidencia de daño por estar en el cultivo de vainilla en la zona productora más importante de México.
Materiales y métodosRecolecta en campo. Durante el periodo de octubre de 2011 a octubre de 2013, se realizaron muestreos trimestrales en un total de 34 vainillales de 22 localidades de 9 municipios de los estados de Puebla y Veracruz; principal zona productora de vainilla en México; el muestreo se realizó en la totalidad del área de cada vainillal. Se recolectaron todos los especímenes de babosas encontrados en cualquier etapa de desarrollo, incluida la de huevo. Los especímenes se localizaron en hendiduras de rocas, debajo de hojarasca, debajo de troncos caídos, debajo de la corteza, en el dosel de los árboles tutores, sobre el follaje de plantas de vainilla y sobre la malla de invernaderos. Todos los especímenes encontrados en cada vainillal se recolectaron de manera directa con ayuda de pinzas o manualmente con guantes de cuero (Neira et al., 2010). Al momento de recolectar los especímenes vivos se tomó una fotografía para tener un mejor registro de su color y apariencia natural (Naranjo-García et al., 2007). Además, en cada localidad muestreada se tomaron los datos de georreferenciación utilizando un geoposicionador Magellan™ modelo Tritón®. Posteriormente, todos los especímenes recolectados se colocaron dentro de frascos de boca ancha con respiradero debidamente etiquetados con los datos más relevantes, se depositaron en una caja de plástico para protegerlas del sol, en donde se transportaron al laboratorio de Nematología Agrícola del Departamento de Parasitología de la Escuela Nacional de Ciencias Biológicas del Instituto Politécnico Nacional para su procesamiento.
Incidencia del daño. En cada vainillal muestreado, con el fin de evaluar la incidencia de daño, se empleó la metodología propuesta por Kranz, 1988; Mora-Aguilera, 1997 y Tovar-Soto et al., 2012, tomando en cuenta el número de plantas con daño por babosas, con relación a las plantas sanas, seleccionando aleatoriamente 2 hileras de plantas de cada vainillal.
Identificación de ejemplares. Para su identificación en el laboratorio, los especímenes se relajaron en 100ml de agua hervida fría a la que se agregó 1g de cristales de mentol en donde se dejaron reposar de 4 a 6h en un sitio fresco, posteriormente, se fijaron en alcohol al 70%, se agregó 0.5g de bórax para evitar la rigidez de los organismos. La disección de los ejemplares se realizó utilizando pinzas entomológicas y tijeras oftalmológicas (Naranjo-García y Gómez-Espinosa, 2004).
La identificación de las especies se llevó a cabo utilizando 10 organismos de cada morfotipo recolectado en el campo. Ésta se basó en la observación y comparación de caracteres morfológicos externos e internos, entre los que destacan el notum, presencia de manchas en el mismo, tegumento, pie, forma del pene, entre otros (Thomé, 1971; Rueda et al., 2002).
ResultadosIdentificación de ejemplares. Características morfológicas más importantes de identificación de las 2 especies estudiadas:
Leidyula moreleti (Fischer, 1871). Noto pardo, con 2 líneas bien definidas, paralelas, longitudinales más oscuras; en adultos muy grandes las líneas longitudinales se presentan en el tercio anterior del dorso (Fig. 1A). El pie es más ancho que los hiponotos, el poro genital femenino es grande localizado a 2/5 de la longitud del cuerpo, a un lado del surco pedioso. El pene se dispone de un soquete cilíndrico y alargado (Fig. 1B). La glándula peneana está constituida por una papila cónica corta, con 35 a 40 túbulos, los internos más cortos y los externos más largos.
A, ejemplar de Leidyula moreleti identificada en la zona de estudio, mostrando las líneas paralelas sobre el notum, característica específica del género; B, disección de un espécimen de L. moreleti, mostrando algunas estructuras internas en donde destaca el pene; C, ejemplar de Sarasinula plebeia; D, S. plebeia alimentándose sobre las hojas de vainilla en el campo; E, S. plebeia localizada sobre malla-sombra en vainilla en día nublado; F, hojas y ápices de vainilla con distintos grados de daño causado por babosas.
Sarasinula plebeia (Fischer, 1868). Noto pardo, con finos puntos negros distribuidos al azar (Fig. 1C). El pie es más delgado que los hiponotos, el poro genital femenino es pequeño localizado a 2/5 de la longitud del cuerpo, en el centro del hiponoto de la derecha. La glándula peneana con una papila cónica puntiaguda, con 4 a 9 túbulos. Con 2 morfologías: 1) tipo cobra, el pene está constituido de un soquete delgado, con los márgenes laterales anchos, está ligeramente cóncavo; algunas veces el glande con la abertura distal bilobulada; 2) tipo lanza, el pene está constituido de un soquete cilíndrico corto, el glande grueso y casi cilíndrico, el ápice delgado y afinado.
Clave para 2 babosas veronicélidas presentes en México.
- 1.
Noto pardo, con líneas longitudinales o puntos negros sin patrón de coloración definido……2
- 2.
Las líneas de coloración longitudinales bien definidas y noto pardo oscuro en ejemplares juveniles; adultos pardo claros, las líneas longitudinales en el tercio anterior, poro genital inmediato al pie……Leidyula moreleti
- 2a.
La coloración del noto es pardo, con puntos negros sin distribución definida, poro genital al centro del hiponoto……Sarasinula plebeia
Se consultaron los ejemplares depositados en la Colección Nacional de Moluscos. Leidyula moreleti (CNMO 642) y Sarasinula plebeia (CNMO 636).
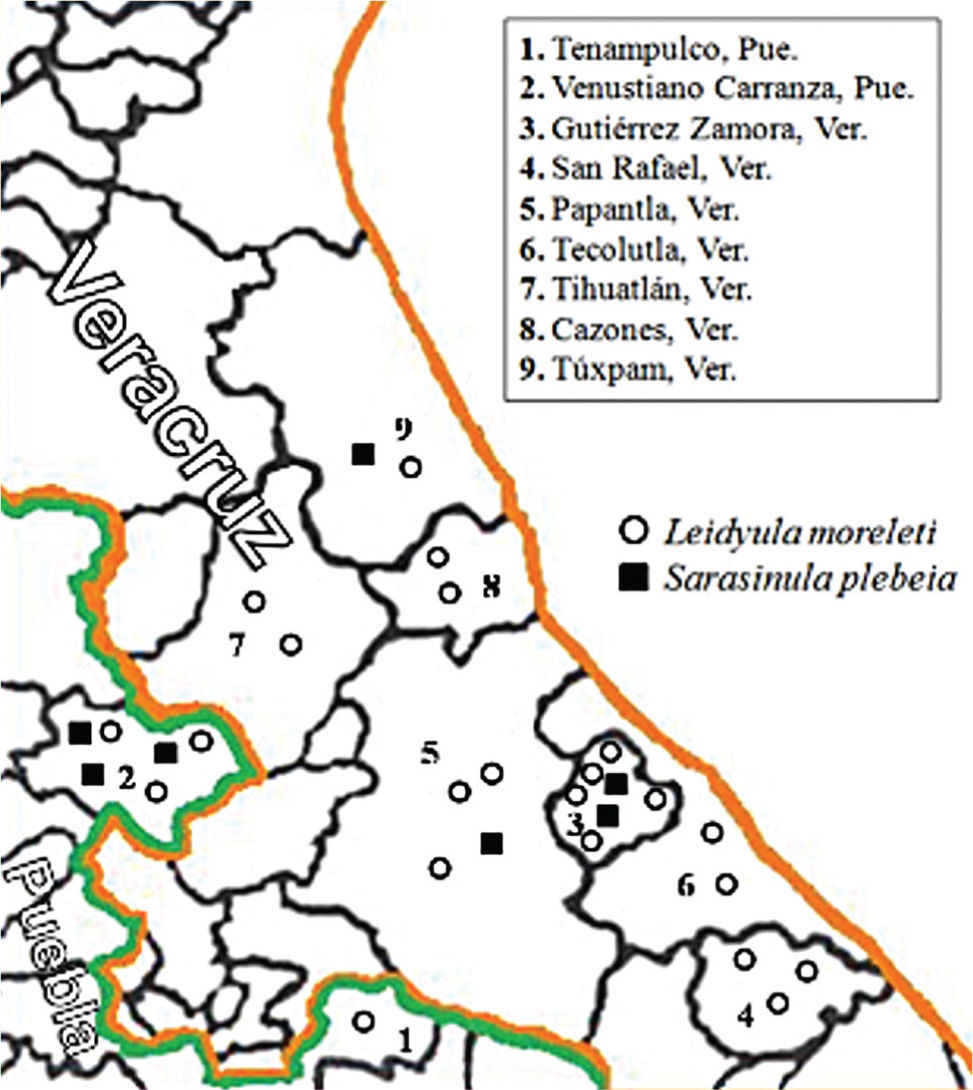
Distribución de especies. Los especímenes de ambas especies fueron localizados en sitios obscuros, húmedos; en días nublados se encontraron alimentándose sobre hojas de plantas de vainilla y sobre la malla-sombra de los vainillales (Figs. 1D, E).
Incidencia del daño. En la zona de estudio el daño causado por estos moluscos, en los 34 diferentes vainillales evaluados, osciló entre el 11 y 89%, observándose los síntomas de daño sobre las hojas y brotes tiernos de las plantas, no así en plantas sanas (Fig. 1F) (Cuadro 1).
Distribución e incidencia del daño por Leidyula moreleti y Sarasinula plebeia encontradas en vainilla en 9 municipios de los estados de Puebla y Veracruz, importante zona productora de vainilla en México
| Localidad | Municipio | Estado | Coordenadas | Altitud (m snm) | Incidencia (%) | Lm | Sp |
|---|---|---|---|---|---|---|---|
| Ejido Tenampulco | Tenampulco | Puebla | 20°20' N, 97°37' O | 236 | 70 | X | |
| Nuevo Cabellal | Venustiano Carranza | Puebla | 20°55' N, 97°74' O | 251 | 45 | X | X |
| San José | Venustiano Carranza | Puebla | 20°57' N, 97°69' O | 135 | 60 | X | X |
| San José | Venustiano Carranza | Puebla | 20°56' N, 97°65' O | 133 | 60 | X | X |
| Mario Hernández Posada | Gutiérrez Zamora | Veracruz | 20°51' N, 97°08' O | 8 | 80 | X | |
| El Ojite-1 | Gutiérrez Zamora | Veracruz | 20°46' N, 97°46' O | 48 | 81 | X | X |
| El Ojite-2 | Gutiérrez Zamora | Veracruz | 20°46' N, 97°11' O | 33 | 11 | X | X |
| Complejo Agroindustrial GAYA 1 | Gutiérrez Zamora | Veracruz | 20°45' N, 97°19' O | 63 | 40 | X | |
| Complejo Agroindustrial GAYA 2 | Gutiérrez Zamora | Veracruz | 20°46' N, 97°13' O | 64 | 67 | X | |
| Calle Grande-1 | San Rafael | Veracruz | 20°87' N, 97°86' O | 17 | 30 | X | |
| Calle Grande-2 | San Rafael | Veracruz | 20°21' N, 97°86' O | 17 | 89 | X | |
| Puntilla Aldama | San Rafael | Veracruz | 20°22' N, 97°86' O | 19 | 58 | X | |
| Solteros de Juan Rosas | Papantla | Veracruz | 20°34' N, 97°20' O | 125 | 59 | X | |
| Francisco I. Madero | Papantla | Veracruz | 20°35' N, 97°21' O | 174 | 45 | X | |
| Montaña de Zaragoza | Papantla | Veracruz | 20°75' N, 97°52' O | 93 | 50 | X | X |
| Paso Real | Tecolutla | Veracruz | 20°39' N, 97°03' O | 26 | 51 | X | |
| Hueytepec | Tecolutla | Veracruz | 20°32' N, 97°01' O | 30 | 70 | X | |
| Paso la Uno-1 | Tihuatlán | Veracruz | 20°47' N, 97°11' O | 39 | 78 | X | |
| Paso la Uno-2 | Tihuatlán | Veracruz | 20°75' N, 97°53' O | 39 | 87 | X | |
| El Torno | Cazones | Veracruz | 20°02' N, 97°24' O | 10 | 85 | X | |
| Felipe Ángeles | Cazones | Veracruz | 20°70' N, 97°24' O | 6 | 81 | X | |
| Nalúa | Túxpam | Veracruz | 20°02' N, 97°51' O | 117 | 72 | X | X |
Símbolos m snm= metros sobre el nivel del mar, Lm= Leidyula moreleti, Sp= Sarasinula plebeia
Leidyula moreleti se encontró asociada al cultivo de vainilla en todas las localidades muestreadas (100%) durante el estudio, mientras que S. plebeia sólo se localizó en el 31.8% de los vainillales muestreados (Cuadro 1) (Fig. 2).
DiscusiónLeidyula moreleti. En la década de los setenta diferentes especies de veronicélidos como Leidyula floridana (Leidyy Binney, 1851), Phyllocaulis gayi (Fischer, 1871) y Sarasinula dubia (Semper, 1885) cobran importancia como plagas para la agricultura (Andrews, 1985, 1987; Andrews y Dundee, 1987; Caballero et al., 1991). Así, L. moreleti, en 1985, es registrada por Deisler y Phelps como plaga en las fincas de café (Coffea arabica L.) y cacao (Theobroma cacao L.) en el estado de Tabasco, en el sureste de México; asimismo, años más tarde, Andrews y Dundee (1987) documentan esta misma especie como causante de problemas en cítricos, en Florida, EUA (Naranjo-García et al., 2007). En el caso particular de este trabajo, se encontró a L. moreleti en 22 localidades tanto en Puebla como en Veracruz.
Sarasinula plebeia. Por su parte, S. plebeia es uno de los gasterópodos polífagos más agresivos registrado en una amplia gama de cultivos, donde destacan: frijol (Phaseolus vulgaris L.), pimiento (Capsicum annuum L.) y tomate de cáscara (Physalis ixocarpa L.) en Panamá; también ha sido documentado en Nicaragua atacando cucurbitáceas. Los daños causados por este molusco son severos, en donde los agricultores han tenido que utilizar la rotación de cultivos con maíz (Zea mays L.) en áreas dañadas para tratar de disminuir las poblaciones (Rueda et al., 2002). En el caso del cultivo de vainilla, estos organismos han causado en los últimos años importantes mermas en la producción, dañando tanto hojas como raíces, flores y vainas de la planta.
El desarrollo de babosas es exitoso en los vainillales debido a que tienen hábitos nocturnos y entran en actividad cuando se dan las condiciones favorables de temperatura y humedad, durante el día se refugian entre las hendiduras de las rocas, debajo de ellas, debajo de la hojarasca o entre ella, bajo troncos caídos, en troncos de árboles, bajo la corteza y en el dosel de los árboles, sólo se exponen al sol cuando la humedad relativa es muy alta; de otra manera podrían desecarse (Coto y Saunders, 1987; Vergara et al., 1993; Naranjo-García, 2003; Imaicela-Ordóñez, 2013). Lo anterior, es parecido a lo que se encontró en este trabajo, ya que ambas especies de babosas cohabitan en ambientes similares a los del cultivo de vainilla en localidades con temperaturas que oscilan entre 22 y 32°C, humedades relativas superiores a 80% y altitudes que van de 0 a 600m snm (Gutiérrez y Dorantes, 2004).
Incidencia del daño. Las condiciones ambientales explican los altos valores de incidencia encontrados en los sitios de muestreo, ya que el desarrollo de una plaga está condicionado por gran número de factores, donde destacan: alimento en abundancia que proporciona el cultivo, factores propios de la plaga, factores abióticos y prácticas agrícolas para el manejo de plagas y enfermedades (Mora-Aguilera, 1997; Zavaleta-Mejía, 1999; Morales et al., 2006).
Mundialmente existen pocos registros que destacan la importancia de moluscos causando daño en el cultivo de vainilla. Vanitha et al. (2011) mencionan a Vaginulus alte, Vaginulus sp. y Mariaella sp. como las especies más agresivas en la India. En cuanto a las especies L. moreleti y S. plebeia identificadas en la zona de estudio, no se tienen informes previos de estas especies causando daño al cultivo de vainilla.
Aunque ya hace tiempo se ha reconocido la importancia de Veronicellidae como plaga en cultivos en México (S. plebeia, Andrews y Dundee, 1987) y en el mundo, son insuficientes los registros serios sobre su importancia económica (Cowie et al., 2009).
Los veronicélidos L. moreleti y S. plebeia ya han sido registrados como causantes de daño en algunos cultivos. La babosa S. plebeia fue la que ocasionó fuertes problemas en cultivos de frijol en Chiapas (1980) y Veracruz (1981) (Andrews y Dundee, 1987). También en Veracruz, en el centro-sur del estado en la región de Los Tuxtlas, Naranjo-García et al. (2007) encontraron que los agricultores se vieron obligados a cambiar el cultivo del frijol por el de árboles, debido a los problemas que les provocaba la babosa S. plebeia. En recolectas del año 2011, en el rancho El Zacatecano, municipio Tlancualpican, Puebla, se encontró que los propietarios de los predios controlan las babosas S. plebeia con píldoras de metaldehído en cultivos de tomillo (CNMO 4934) y de menta (CNMO 4937).
Por su parte, la babosa L. moreleti también ya había sido registrada como plaga del cacao, en Tabasco (Deisler y Stange, 1984), sin que se tenga mayor información como plaga en México.
En México se registra por primera vez la presencia de los veronicélidos L. moreleti y S. plebeia en el cultivo de vainilla; así como la estimación del daño en el cultivo; éstos son aspectos fundamentales que dan a conocer la asociación entre parásitos-plaga y un cultivo de importancia agrícola, lo cual permitirá con la ayuda de más estudios, implementar un programa de manejo integrado de plagas para la vainilla (Zavaleta-Mejía, 1999).
Agradecemos a los Ingenieros Alejandro Ramos y Delia Deveze, así como al Complejo Agroindustrial GAYA por las facilidades brindadas para la realización de los muestreos. A la M. en C. Victoria Araiza por su ayuda en la identificación de las especies. Al Conacyt por los recursos otorgados con una beca al primer autor para realizar estudios doctorales. Asimismo, a la Secretaría de Investigación y Posgrado (Sip) del IPN, quien brindó apoyo por medio de los proyectos SIP 20110658, 20121166 y 20130756. Esta publicación es producto de recursos federales otorgados por la Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación para el Subsistema Nacional de Recursos Genéticos Agrícolas (Sinarefi), coordinado por el Servicio Nacional de Inspección y Certificación de Semillas (SNICS).