Se presenta un análisis de la diversidad alfa y beta de 7 ensambles de Cantharidae asociados a bosque tropical caducifolio (BTC) de la vertiente del Pacífico mexicano, como una primera aproximación a los patrones de diversidad de insectos en ese tipo de vegetación. Se exploran los 2 procesos que originan la diversidad beta (βcc): reemplazamiento de especies (β-3) y diferencia en riqueza de especies (βrich), así como la relación de la diversidad beta con la precipitación, temperatura, estacionalidad, altitud, latitud y distancia geográfica. Se revisaron 4,063 ejemplares, 10 géneros y 70 especies de cantáridos, 59% de las cuales fueron exclusivas de la localidad de recolecta. El género Plectonotum y 11 especies representan nuevos registros en el país y otros 15 son nuevos registros estatales. Se encontró una diversidad beta alta entre los 7 ensambles, con un promedio de 88% de disimilitud total, explicada principalmente por el reemplazamiento de especies. Este componente estuvo correlacionado positivamente con la distancia geográfica y ninguna otra variable influyó en la diversidad de Cantharidae del BTC. No se observó un patrón altitudinal o latitudinal. Se sugiere que la diversidad de cantáridos podría estar determinada por la diversidad florística o la historia biogeográfica de los BTC que habitan.
An analysis of alpha and beta diversity between 7 assemblages of Cantharidae (Coleoptera) associated to the tropical dry forest (TDF) in the Mexican Pacific Slope is presented, as a first approximation to the study of insect diversity patterns in this type of vegetation. We explored beta diversity (βcc) and its 2 components: species replacement (β-3) and species richness differences (βrich). Relationships between beta diversity and different environmental parameters (precipitation, temperature, seasonality, altitude, latitude and geographic distances) were analyzed as well. We examined 4,063 individuals, 10 genera and 70 species of cantharids; 59% of species were exclusive to each locality. The genus Plectonotum and 11 species are new reports for the country, and other 15 are new state reports. We found high beta diversity between the 7 assemblages, with 88% of mean total dissimilarity, mainly explained by the replacement (β-3) component. Species replacement was correlated with geographic distance between assemblages and no other factor seems to influence beta diversity of Cantharidae from the TDF. The latitudinal or altitudinal pattern was not observed. We suggest that Cantharidae diversity could be determined by the floristic diversity or the biogeographic history of the TDF they inhabit.
En México, los bosques tropicales caducifolios (BTC) (Rzedowski, 1978) o selvas bajas caducifolias (Miranda y Hernández-Xolocotzi, 1963) presentan la mayor cobertura vegetal tropical y están más ampliamente distribuidos en la vertiente del Pacífico que en la del Atlántico (Trejo, 2010). Se estima que este tipo de vegetación ha perdido más del 70% de la cobertura que originalmente tenía en el país (Trejo-Vázquez y Dirzo, 2000), debido principalmente a actividades antropogénicas que aceleran el proceso de fragmentación de la selva baja, con la consecuente pérdida de la biodiversidad que se aloja en estas selvas (Miles et al., 2006). Ante esa situación, en las últimas décadas se ha incrementado de forma considerable el interés por estudiar la biodiversidad del BTC mexicano (p. ej., Ceballos et al., 2010; García-Aldrete y Ayala-Barajas, 2004; Noguera, Vega-Rivera, García-Aldrete y Quesada-Avendaño, 2002). La diversidad de especies es el resultado de las interacciones ecológicas entre éstas y de sus relaciones con el medio ambiente, además de la historia evolutiva y biogeográfica de las regiones y la biota que la habita (Halffter y Moreno, 2005; Lobo, 2001). Para comprender la importancia de todos esos elementos es necesario el estudio conjunto de los diferentes niveles de diversidad: alfa, beta y gamma (Halffter y Moreno, 2005).
La diversidad alfa es el componente más estudiado de los 3 (Moreno, Zuria, García-Zenteno y Sánchez-Rojas, 2006) y se define como el número de especies que habitan un lugar específico con cierta homogeneidad (Gaston, 1996; Koleff y Soberón, 2008). Biológicamente, la diversidad α refleja las relaciones ecológicas que se encuentran en un espacio puntual y un tiempo determinado (Halffter y Moreno, 2005).
La diversidad beta originalmente se definió como la variación o recambio en la identidad de las especies entre sitios (Whittaker, 1960). Dicha definición tiene implícitos distintos fenómenos relacionados con la estructura de un ensamble y al respecto, siguiendo la propuesta de Lennon, Koleff, Greenwood y Gaston (2001) y Williams (1996), existen 2 procesos que originan la variación en la composición de especies entre ensambles: las diferencias en riqueza de especies y el reemplazamiento de estas. La diferencia en riqueza se refiere a la diferencia absoluta entre el número de especies de 2 o más ensambles y puede reflejar la diversidad de nichos disponibles en distintas localidades de un mismo gradiente o área de estudio (Legendre, 2014). El reemplazamiento de especies, en cambio, ocurre cuando una especie de un ensamble es sustituida por otra de un ensamble distinto (Carvalho, Cardoso y Gomes, 2012). El reemplazamiento de especies entre ensambles, ya sea por ganancia o pérdida de especies, se debe a factores como la existencia de filtros ambientales, interacciones bióticas, como la competencia, y eventos históricos (Leprieur et al., 2011).
Recientemente, varios autores han intentado ordenar la pluralidad de conceptos existentes en torno a la diversidad beta tomando en cuenta los distintos fenómenos que refleja (p. ej., Anderson et al., 2011; Baselga, 2010, 2012; Carvalho et al., 2012; Carvalho, Cardoso, Borges, Schmera y Podani, 2013; Jurasinski, Retzer y Beierkuhnlein, 2009; Legendre, 2014; Moreno y Rodríguez, 2010, 2011; Podani y Schmera, 2011; Tuomisto, 2010). También han habido avances en cuanto a los métodos adecuados para cuantificar las distintas facetas de la diversidad beta (véase Anderson et al., 2011; Carvalho et al., 2012, 2013). En la presente contribución se utilizó la metodología propuesta por Carvalho et al. (2012, 2013), ya que permite cuantificar la diversidad beta per se y explorar los distintos procesos involucrados en la diversidad beta: diferencias en riqueza y reemplazamiento de especies. Además, los resultados pueden asociarse con facilidad a factores macroecológicos que podrían explicar los patrones de diversidad.
El tercer componente de la diversidad es la diversidad gamma, y está definido por la riqueza de especies de un conjunto de localidades, sitios o comunidades (acervo regional de especies) que integran un paisaje (gamma) (Halffter y Moreno, 2005). Los estudios en el BTC mexicano han permitido identificar una alta diversidad alfa y beta de plantas, así como la presencia de muchas especies endémicas (Trejo, 2010), debido principalmente a la gran heterogeneidad ambiental que caracteriza este tipo de vegetación (Balvanera, Lott, Segura, Siebe e Islas, 2002). Por otro lado, los distintos grupos de vertebrados presentan patrones variados (Ceballos et al., 2010). En mamíferos y aves se han observado altos niveles de endemismo y de diversidad alfa y beta (Ceballos et al., 2010; Vega-Rivera, Arizmendi y Morales-Pérez, 2010), mientras que en anfibios y reptiles se han documentado altos valores de alfa, beta y gamma (García, Solano-Rodríguez y Flores-Villela, 2007).
Los estudios de insectos en el BTC se han enfocado casi exclusivamente en la elaboración de listados faunísticos de algunos grupos, en descripciones de nuevas especies y, en ocasiones, su fenología (p. ej., Deloya, Madora y Covarrubias, 2013; González-Soriano, Noguera, Zaragoza-Caballero y Ramírez-García, 2009; Noguera et al., 2007; Reyes-Novelo y Morón, 2005; Rodríguez-Vélez, Zaragoza-Caballero y Rodríguez, 2009; Zaragoza-Caballero, Noguera, González-Soriano, Ramírez-García y Rodríguez-Palafox, 2010). Por lo general, los estudios se basan en datos obtenidos en muestreos en una sola localidad (García-Aldrete y Ayala-Barajas, 2004) y en muy pocos casos en datos provenientes de regiones extensas (Atkinson, Martínez-Fernández, Saucedo-Céspedes y Burgos-Solorio, 1986; De La Maza, 2010; Deloya et al., 2013). Algunos estudios han reportado una alta diversidad y altos niveles de endemismos en insectos y otros artrópodos asociados al BTC (Noguera et al., 2012; Pescador-Rubio, Rodríguez-Palafox y Noguera, 2002; Rodríguez-Palafox y Corona, 2002); sin embargo, el análisis de los patrones de diversidad en el BTC es incipiente. Así, por ejemplo, algunos trabajos a escala local analizan el efecto de la fragmentación del BTC en la entomofauna, así como la diferencia en riqueza de insectos entre diferentes tipos de vegetación (p. ej., Burgos-Solorio y Anaya-Rosales, 2004; Halffter y Arellano, 2002).
Este trabajo representa un primer acercamiento al estudio de los patrones de diversidad de insectos en el BTC mexicano. Se seleccionó a los escarabajos Cantharidae como objeto de análisis por diversas razones. En primer lugar, es un grupo de coleópteros conspicuo, diurno y relativamente fácil de capturar directamente, con trampas de atracción luminosa o de intercepción (Pelletier y Hebert, 2014; Ramsdale, 2002; Zaragoza-Caballero, 2004). Estos coleópteros están asociados a la vegetación herbácea (Miskimen, 1972), tienen una alta complejidad ecológica, morfológica, evolutiva y sistemática (Crowson, 1972), y son importantes polinizadores (Baskin, Walck, Baskin y Buchele, 2000; Schneider y Buchanan, 1980; Willmer, 2011).
La mayor parte de los trabajos realizados en los escarabajos Cantharidae son de tipo taxonómico (p. ej., Brancucci, 1980; Delkeskamp, 1977; Kazantsev, 2007). Sin embargo, con la idea de intentar reducir la pérdida de especies y, por lo tanto, de las funciones ecológicas que llevan a cabo en el BTC, es necesario generar información desde otras perspectivas. En este sentido, este trabajo representa un primer avance en el estudio de los patrones de diversidad del grupo, así como de los factores relacionados con su diversidad.
En el BTC existe una alta variación en la composición de especies de plantas, resultado de la gran heterogeneidad ambiental y de la distribución en manchones que lo caracteriza (Balvanera et al., 2002; Pennington, Prado y Pendry, 2000). Basado en este patrón, se espera que la diversidad beta de los cantáridos también sea alta. Más específicamente, en este estudio se intenta responder a las siguientes preguntas: ¿qué tan diferente es la entomofauna de cantáridos del BTC entre distintas localidades?; ¿existe un patrón en la distribución espacial de riqueza entre distintas localidades?, y ¿qué factores abióticos están asociados a la diversidad beta de la familia Cantharidae?
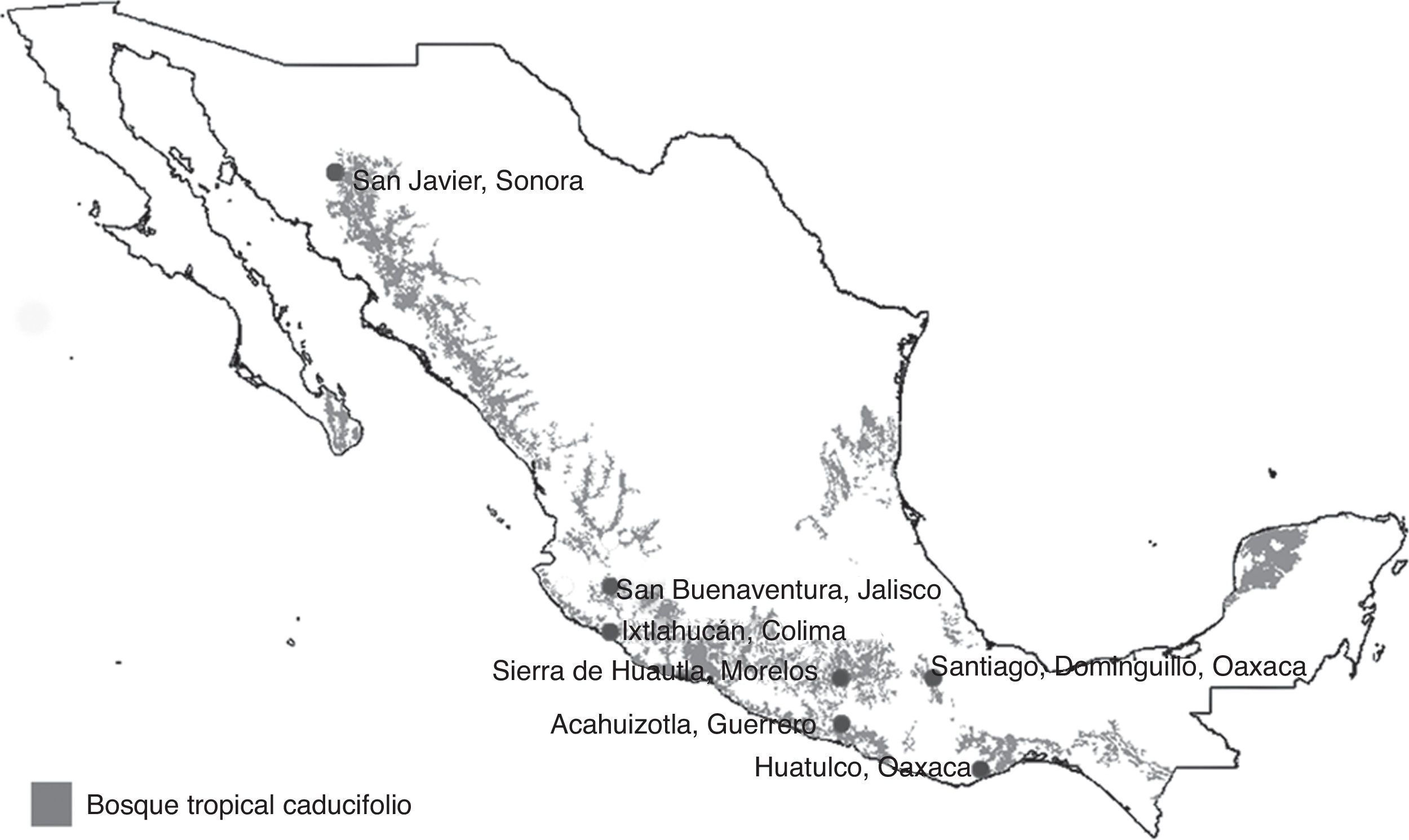
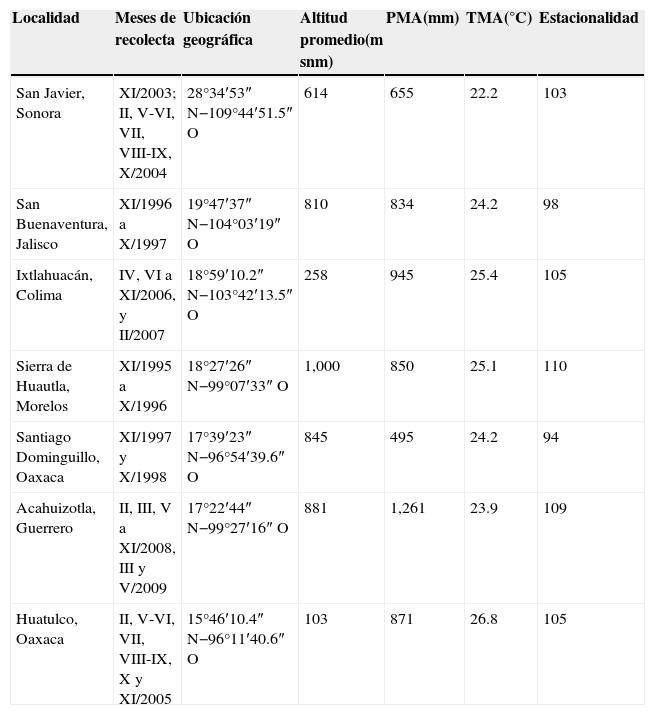
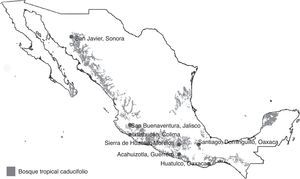
Materiales y métodosLos ejemplares de Cantharidae usados en este estudio fueron recolectados en 7 localidades ubicadas en el BTC, en la vertiente del Pacífico mexicano (fig. 1). Los muestreos entomológicos se llevaron a cabo en distintos años en cada localidad, entre 1995 y 2009, como parte de un proyecto a largo plazo que tenía por objetivo elaborar el inventario de la entomofauna del BTC y analizar sus patrones fenológicos (Linbos, 2014). Las localidades Santiago Dominguillo, sierra de Huautla y San Buenaventura fueron las primeras en ser visitadas y se muestrearon durante 12 meses. Las recolectas en otras localidades duraron entre 7 y 8 meses, debido a que se llevaron a cabo ajustes en función de la estacionalidad de los cantáridos. De cualquier forma, las recolectas en cada localidad fueron continuas e incluyeron las épocas de secas y de lluvias, y todas siguieron el mismo método de muestreo (tabla 1).
Localidades de muestreo de los Cantharidae (Coleoptera) consideradas en este trabajo. Las zonas en gris corresponden a las áreas de distribución del bosque tropical caducifolio obtenidas de Conabio (1999).
Localidades con BTC en la vertiente del Pacífico mexicano que fueron incluidas en el presente estudio. Se ordenaron según su latitud, de norte a sur.
| Localidad | Meses de recolecta | Ubicación geográfica | Altitud promedio(m snm) | PMA(mm) | TMA(°C) | Estacionalidad |
|---|---|---|---|---|---|---|
| San Javier, Sonora | XI/2003; II, V-VI, VII, VIII-IX, X/2004 | 28°34′53″ N−109°44′51.5″ O | 614 | 655 | 22.2 | 103 |
| San Buenaventura, Jalisco | XI/1996 a X/1997 | 19°47′37″ N−104°03′19″ O | 810 | 834 | 24.2 | 98 |
| Ixtlahuacán, Colima | IV, VI a XI/2006, y II/2007 | 18°59′10.2″ N−103°42′13.5″ O | 258 | 945 | 25.4 | 105 |
| Sierra de Huautla, Morelos | XI/1995 a X/1996 | 18°27′26″ N−99°07′33″ O | 1,000 | 850 | 25.1 | 110 |
| Santiago Dominguillo, Oaxaca | XI/1997 y X/1998 | 17°39′23″ N−96°54′39.6″ O | 845 | 495 | 24.2 | 94 |
| Acahuizotla, Guerrero | II, III, V a XI/2008, III y V/2009 | 17°22′44″ N−99°27′16″ O | 881 | 1,261 | 23.9 | 109 |
| Huatulco, Oaxaca | II, V-VI, VII, VIII-IX, X y XI/2005 | 15°46′10.4″ N−96°11′40.6″ O | 103 | 871 | 26.8 | 105 |
Los meses se representan en números romanos, iniciando con enero.
estacionalidad: medida como el coeficiente de variación estacional; PMA: precipitación media anual; TMA: temperatura media anual.
Los métodos de recolecta utilizados fueron: a) redes aéreas y paraguas entomológico, por 2 personas entre las 09:00 y las 15:00h; b) trampas de atracción luminosa tipo Minnesota (Southwood, 1966), que se colocaron en 3 sitios seleccionados de forma aleatoria en cada localidad, y c) trampas de intercepción tipo Malaise basadas en el modelo de Townes (1972). La atracción luminosa se logró con la combinación de 2 fuentes luminosas: una lámpara de vapor de mercurio y 2 bulbos –con y sin filtro– de luz ultravioleta de 15 watts, colocados sobre un contenedor de 20cm de diámetro lleno con alcohol al 70%. Las fuentes luminosas se instalaron contra una sábana blanca de 1.80×1.50 m, colocada en posición vertical, activadas 4h diarias durante 5 días consecutivos cada mes, con el día de luna nueva como tercer día de recolecta. Las trampas tipo Malaise se colocaron en sitios distintos de las trampas de atracción luminosa, pero siempre dentro del área de trabajo, estuvieron activas durante los mismos días y permanecieron abiertas durante 24h. En Acahuizotla, Guerrero, no se colocaron las trampas Malaise. Los detalles de la ubicación de los sitios en los que fueron colocadas las trampas y aquellos en los que se realizó la recolecta directa pueden consultarse en las publicaciones de Noguera et al. (2007, 2012), Rodríguez-Vélez et al. (2009) y Zaragoza-Caballero et al. (2003), Zaragoza-Caballero y Ramírez-García, 2009).
Se analizó la diversidad alfa midiendo el número (riqueza) de especies y la “diversidad verdadera”, que se midió utilizando el exponencial del índice de Shannon (Jost, 2006). La unidad de medida es el número de especies efectivas, que es la diversidad que tendría una comunidad virtual, en la cual todas las especies tuvieran exactamente la misma abundancia (Jost, 2006). Se calculó, además, la máxima diversidad alfa esperada en cada localidad con el estimador no paramétrico ACE (Chao y Lee, 1992), así como la diversidad verdadera esperada con el estimador del índice de Shannon Bias-corrected Shannon Diversity estimator (Chao y Shen, 2003). Todos estos cálculos se realizaron mediante el software SPADE (Chao y Shen, 2010).
La diversidad gamma verdadera utiliza la partición multiplicativa de la diversidad propuesta por Whittaker (1972) y se calculó como el producto del número efectivo de especies de cada unidad de muestreo virtual (alfa verdadera de cada ensamble) por el número efectivo de tales unidades composicionales (beta verdadera de todos los ensambles) (Jost, 2006, 2007). El rango de valores que toma la diversidad beta verdadera en este caso va desde 1, en caso de que todos los ensambles de Cantharidae compartieran a todas sus especies, y un valor máximo de 7, cuando ningún par de localidades compartiera especies.
La diversidad beta y sus 2 componentes se calcularon mediante el software R de acuerdo con las fórmulas de Carvalho et al. (2012, 2013). La diversidad beta absoluta (βcc) o disimilitud en la composición de especies es originada por 2 factores: el reemplazamiento de especies (β-3) y la diferencia en riqueza de especies (βrich), entre 2 o más ensambles. Ambos factores son aditivos, de manera que la fórmula completa es βcc=β-3+βrich. Este método permite el reconocimiento de la variación en la composición de especies entre los 7 ensambles de cantáridos y, además, permite la visualización de la relación del componente beta de la diversidad con los factores espaciales y ambientales.
Para evaluar la relación de beta (βcc, β-3, βrich) con distintas variables ambientales como la precipitación, la temperatura y la estacionalidad, con la distancia geográfica entre localidades y con la altitud y la latitud de cada localidad (tabla 1) se realizaron pruebas de Mantel (Sokal y Rohlf, 1995), mediante el programa R y el paquete Vegan (Oksanen et al., 2011). Se utilizaron los promedios de las variables abióticas de cada localidad que se obtuvieron del Atlas Climático Digital de México (Uniatmos, 2011), de acuerdo con los periodos de recolecta y las coordenadas geográficas de cada localidad (tabla 1). Se construyeron matrices de disimilitud de cada factor examinado. También se realizaron pruebas de correlación entre la diversidad beta y variables ambientales descartando el efecto de la distancia geográfica, y entre la diversidad beta y la distancia geográfica, descartando la influencia de las variables ambientales. Este análisis se realizó mediante pruebas parciales de Mantel (Sokal y Rohlf, 1995). Todas las correlaciones fueron evaluadas mediante 9,999 permutaciones aleatorias. Las pruebas simples y parciales de Mantel permitieron evaluar el nivel de asociación entre la diversidad beta y los distintos factores abióticos, además de que dieron idea de la dirección de la relación.
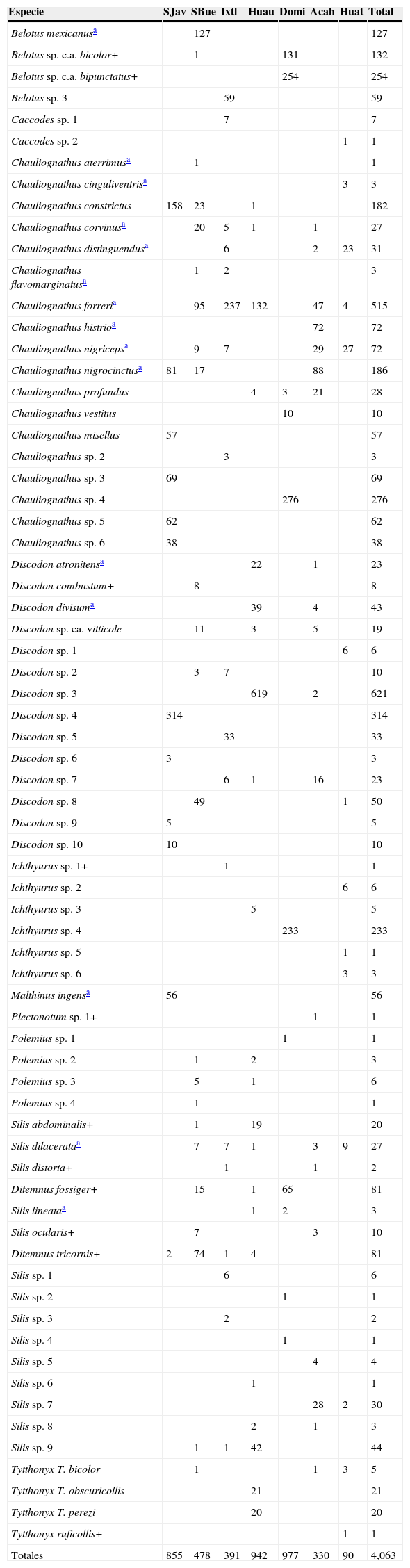
ResultadosSe examinaron 4,063 ejemplares de Cantharidae, que se clasificaron en 10 géneros y 70 especies (tabla 2). Del total, 59% de las especies fueron exclusivas de la localidad en que fueron recolectadas (tabla 3) y ninguna se recolectó en todas las localidades; los porcentajes de exclusividad de especies para cada ensamble van del 15 al 75% (tabla 3). Dos de las 7 localidades estudiadas sobresalen por su riqueza de especies: San Buenaventura (23 especies) y sierra de Huautla 22 (tabla 3). En contraste, la mayor abundancia se encontró en Santiago Dominguillo (977 ejemplares, 24% del total), la localidad con menor riqueza de especies. La menor abundancia correspondió a Huatulco (90 ejemplares, 2.21% del total).
Individuos y especies de Cantharidae asociadas a bosque tropical caducifolio en 7 localidades de la vertiente del Pacífico mexicano.
| Especie | SJav | SBue | Ixtl | Huau | Domi | Acah | Huat | Total |
|---|---|---|---|---|---|---|---|---|
| Belotus mexicanusa | 127 | 127 | ||||||
| Belotus sp. c.a. bicolor+ | 1 | 131 | 132 | |||||
| Belotus sp. c.a. bipunctatus+ | 254 | 254 | ||||||
| Belotus sp. 3 | 59 | 59 | ||||||
| Caccodes sp. 1 | 7 | 7 | ||||||
| Caccodes sp. 2 | 1 | 1 | ||||||
| Chauliognathus aterrimusa | 1 | 1 | ||||||
| Chauliognathus cinguliventrisa | 3 | 3 | ||||||
| Chauliognathus constrictus | 158 | 23 | 1 | 182 | ||||
| Chauliognathus corvinusa | 20 | 5 | 1 | 1 | 27 | |||
| Chauliognathus distinguendusa | 6 | 2 | 23 | 31 | ||||
| Chauliognathus flavomarginatusa | 1 | 2 | 3 | |||||
| Chauliognathus forreria | 95 | 237 | 132 | 47 | 4 | 515 | ||
| Chauliognathus histrioa | 72 | 72 | ||||||
| Chauliognathus nigricepsa | 9 | 7 | 29 | 27 | 72 | |||
| Chauliognathus nigrocinctusa | 81 | 17 | 88 | 186 | ||||
| Chauliognathus profundus | 4 | 3 | 21 | 28 | ||||
| Chauliognathus vestitus | 10 | 10 | ||||||
| Chauliognathus misellus | 57 | 57 | ||||||
| Chauliognathus sp. 2 | 3 | 3 | ||||||
| Chauliognathus sp. 3 | 69 | 69 | ||||||
| Chauliognathus sp. 4 | 276 | 276 | ||||||
| Chauliognathus sp. 5 | 62 | 62 | ||||||
| Chauliognathus sp. 6 | 38 | 38 | ||||||
| Discodon atronitensa | 22 | 1 | 23 | |||||
| Discodon combustum+ | 8 | 8 | ||||||
| Discodon divisuma | 39 | 4 | 43 | |||||
| Discodon sp. ca. vitticole | 11 | 3 | 5 | 19 | ||||
| Discodon sp. 1 | 6 | 6 | ||||||
| Discodon sp. 2 | 3 | 7 | 10 | |||||
| Discodon sp. 3 | 619 | 2 | 621 | |||||
| Discodon sp. 4 | 314 | 314 | ||||||
| Discodon sp. 5 | 33 | 33 | ||||||
| Discodon sp. 6 | 3 | 3 | ||||||
| Discodon sp. 7 | 6 | 1 | 16 | 23 | ||||
| Discodon sp. 8 | 49 | 1 | 50 | |||||
| Discodon sp. 9 | 5 | 5 | ||||||
| Discodon sp. 10 | 10 | 10 | ||||||
| Ichthyurus sp. 1+ | 1 | 1 | ||||||
| Ichthyurus sp. 2 | 6 | 6 | ||||||
| Ichthyurus sp. 3 | 5 | 5 | ||||||
| Ichthyurus sp. 4 | 233 | 233 | ||||||
| Ichthyurus sp. 5 | 1 | 1 | ||||||
| Ichthyurus sp. 6 | 3 | 3 | ||||||
| Malthinus ingensa | 56 | 56 | ||||||
| Plectonotum sp. 1+ | 1 | 1 | ||||||
| Polemius sp. 1 | 1 | 1 | ||||||
| Polemius sp. 2 | 1 | 2 | 3 | |||||
| Polemius sp. 3 | 5 | 1 | 6 | |||||
| Polemius sp. 4 | 1 | 1 | ||||||
| Silis abdominalis+ | 1 | 19 | 20 | |||||
| Silis dilacerataa | 7 | 7 | 1 | 3 | 9 | 27 | ||
| Silis distorta+ | 1 | 1 | 2 | |||||
| Ditemnus fossiger+ | 15 | 1 | 65 | 81 | ||||
| Silis lineataa | 1 | 2 | 3 | |||||
| Silis ocularis+ | 7 | 3 | 10 | |||||
| Ditemnus tricornis+ | 2 | 74 | 1 | 4 | 81 | |||
| Silis sp. 1 | 6 | 6 | ||||||
| Silis sp. 2 | 1 | 1 | ||||||
| Silis sp. 3 | 2 | 2 | ||||||
| Silis sp. 4 | 1 | 1 | ||||||
| Silis sp. 5 | 4 | 4 | ||||||
| Silis sp. 6 | 1 | 1 | ||||||
| Silis sp. 7 | 28 | 2 | 30 | |||||
| Silis sp. 8 | 2 | 1 | 3 | |||||
| Silis sp. 9 | 1 | 1 | 42 | 44 | ||||
| Tytthonyx T. bicolor | 1 | 1 | 3 | 5 | ||||
| Tytthonyx T. obscuricollis | 21 | 21 | ||||||
| Tytthonyx T. perezi | 20 | 20 | ||||||
| Tytthonyx ruficollis+ | 1 | 1 | ||||||
| Totales | 855 | 478 | 391 | 942 | 977 | 330 | 90 | 4,063 |
Acah: Acahuizotla, Guerrero; Huat: Huatulco, Oaxaca; Ixtl: Ixtlahuacán, Colima; SBue: San Buenaventura, Jalisco; SJav: San Javier, Sonora.
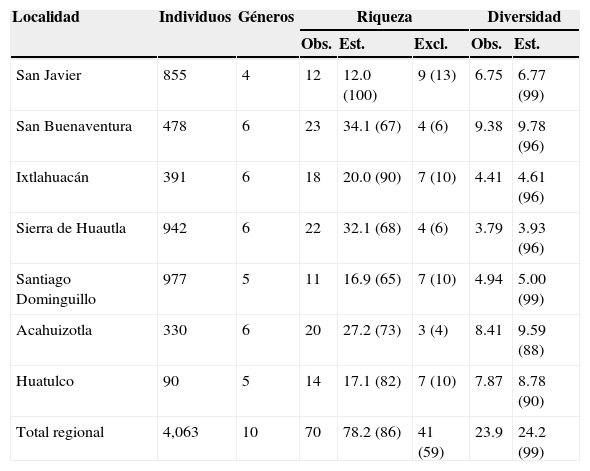
Riqueza y diversidad verdadera de especies de 7 ensambles de Cantharidae (observadas, estimadas y exclusivas), asociados a bosque tropical caducifolio en la vertiente del Pacífico mexicano.
| Localidad | Individuos | Géneros | Riqueza | Diversidad | |||
|---|---|---|---|---|---|---|---|
| Obs. | Est. | Excl. | Obs. | Est. | |||
| San Javier | 855 | 4 | 12 | 12.0 (100) | 9 (13) | 6.75 | 6.77 (99) |
| San Buenaventura | 478 | 6 | 23 | 34.1 (67) | 4 (6) | 9.38 | 9.78 (96) |
| Ixtlahuacán | 391 | 6 | 18 | 20.0 (90) | 7 (10) | 4.41 | 4.61 (96) |
| Sierra de Huautla | 942 | 6 | 22 | 32.1 (68) | 4 (6) | 3.79 | 3.93 (96) |
| Santiago Dominguillo | 977 | 5 | 11 | 16.9 (65) | 7 (10) | 4.94 | 5.00 (99) |
| Acahuizotla | 330 | 6 | 20 | 27.2 (73) | 3 (4) | 8.41 | 9.59 (88) |
| Huatulco | 90 | 5 | 14 | 17.1 (82) | 7 (10) | 7.87 | 8.78 (90) |
| Total regional | 4,063 | 10 | 70 | 78.2 (86) | 41 (59) | 23.9 | 24.2 (99) |
Entre paréntesis el porcentaje de riqueza y diversidad verdadera obtenida en campo respecto al valor estimado.
Los resultados del estimador no paramétrico ACE revelan que las recolectas efectuadas variaron entre el 65 y el 100% de la riqueza esperada. La riqueza de especies que se encontró en Santiago Dominguillo, San Buenaventura y sierra de Huautla correspondieron al 65, el 67 y el 68% de la riqueza de especies esperada, respectivamente; es decir, en estas localidades aún falta por registrar más del 30% de las especies. En San Javier, Sonora, se alcanzó el 100% de la riqueza esperada. Al integrar los datos de recolecta de todas las localidades y analizar la curva de acumulación de especies se encontró que los más de 4 mil registros corresponderían al 86% de la riqueza esperada, es decir, a escala regional faltaría por recolectar el 14% de las especies (tabla 3).
En el BTC cada ensamble presentó 6 o 7 especies del género Chauliognathus, a excepción de en Santiago Dominguillo, donde solamente se capturaron 3 especies. En todos los ensambles se encontraron representantes de este taxon, que suele ser muy conspicuo y de hábitos nectarívoros y florífagos (Miskimen, 1972), y representantes del género Discodon en cantidades similares (representan el 29 y el 40% del total de ejemplares, respectivamente). En los 7 ensambles se recolectaron especies del género Silis, aunque la frecuencia fue bastante menor (8%) que la de Chauliognathus y Discodon. Ichthyurus (6%) y Tytthonyx (1.15%) estuvieron presentes en 4 ensambles, mientras que los géneros Belotus (14%), Caccodes (0.19%) y Polemius (0.27%) se registraron en 3 localidades. Malthinus fue exclusivo de San Javier (2% del total recolectado), mientras que en Acahuizotla se capturó sólo 1 ejemplar de Plectonotum (0.02%).
Diversidad alfa, beta y gamma verdaderasLa mayor diversidad alfa verdadera se obtuvo en San Buenaventura (9.38 especies efectivas) y la menor, en la sierra de Huautla, Morelos (3.79 especies efectivas). La diversidad alfa verdadera observada resultó muy cercana a la esperada en todas las localidades (tabla 3). La diversidad gamma o regional de cantáridos en el BTC fue de 23.04 especies efectivas, con una diversidad alfa promedio de 5.58 especies efectivas y una beta de 4.29 comunidades efectivas. La diversidad beta verdadera resultó alta, considerando que el valor máximo alcanzable era 7.
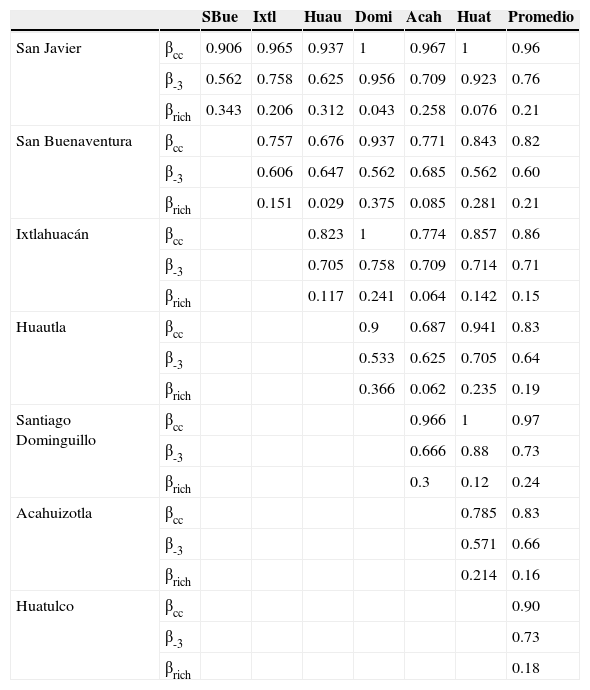
Análisis de la diversidad betaPara la diversidad beta, o βcc, se obtuvieron porcentajes menores al 34% de disimilitud (p. ej., entre sierra de Huautla y San Buenaventura). Los valores promedio de βcc fluctuaron entre 82% (San Buenaventura) y 97% (Santiago Dominguillo). La β-3 varió entre el 60% (San Buenaventura) y el 76% (San Javier); mientras que la βrich explica entre el 15% (Ixtlahuacán) y el 24% (Santiago Dominguillo) de la diversidad beta total (tabla 4). Los ensambles más similares en cuanto a composición de especies fueron San Buenaventura-Huautla y Huautla-Acahuizotla, y los más disímiles fueron San Javier-Santiago Dominguillo y Huatulco, Ixtlahuacán-Santiago Dominguillo y Santiago Dominguillo-Huatulco (tabla 4).
Valores y promedios de la diversidad beta total (βcc), el reemplazo de especies (β-3) y las diferencias en riqueza (βrich) entre 7 ensambles de Cantharidae asociados a bosque tropical caducifolio en la vertiente del Pacífico mexicano.
| SBue | Ixtl | Huau | Domi | Acah | Huat | Promedio | ||
|---|---|---|---|---|---|---|---|---|
| San Javier | βcc | 0.906 | 0.965 | 0.937 | 1 | 0.967 | 1 | 0.96 |
| β-3 | 0.562 | 0.758 | 0.625 | 0.956 | 0.709 | 0.923 | 0.76 | |
| βrich | 0.343 | 0.206 | 0.312 | 0.043 | 0.258 | 0.076 | 0.21 | |
| San Buenaventura | βcc | 0.757 | 0.676 | 0.937 | 0.771 | 0.843 | 0.82 | |
| β-3 | 0.606 | 0.647 | 0.562 | 0.685 | 0.562 | 0.60 | ||
| βrich | 0.151 | 0.029 | 0.375 | 0.085 | 0.281 | 0.21 | ||
| Ixtlahuacán | βcc | 0.823 | 1 | 0.774 | 0.857 | 0.86 | ||
| β-3 | 0.705 | 0.758 | 0.709 | 0.714 | 0.71 | |||
| βrich | 0.117 | 0.241 | 0.064 | 0.142 | 0.15 | |||
| Huautla | βcc | 0.9 | 0.687 | 0.941 | 0.83 | |||
| β-3 | 0.533 | 0.625 | 0.705 | 0.64 | ||||
| βrich | 0.366 | 0.062 | 0.235 | 0.19 | ||||
| Santiago Dominguillo | βcc | 0.966 | 1 | 0.97 | ||||
| β-3 | 0.666 | 0.88 | 0.73 | |||||
| βrich | 0.3 | 0.12 | 0.24 | |||||
| Acahuizotla | βcc | 0.785 | 0.83 | |||||
| β-3 | 0.571 | 0.66 | ||||||
| βrich | 0.214 | 0.16 | ||||||
| Huatulco | βcc | 0.90 | ||||||
| β-3 | 0.73 | |||||||
| βrich | 0.18 |
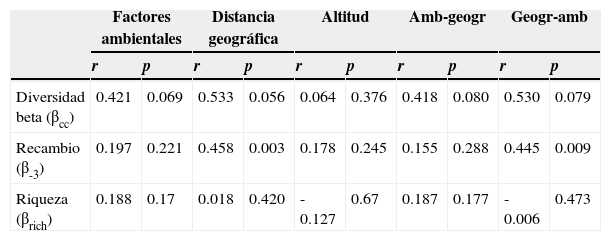
Las pruebas simples y parciales de Mantel dieron como resultado una correlación positiva y moderada entre la disimilitud debida al recambio de especies (β-3) y la distancia geográfica (r=0.458; p<0.01). La correlación se mantuvo, aun cuando se eliminó el efecto de los factores climáticos considerados (r=0.445; p<0.01) (tabla 5). El resto de las correlaciones no fueron significativas.
Correlación de la diversidad beta (sensuCarvalho et al., 2012) de 7 ensambles de Cantharidae (Coleoptera) con distancias geográficas, precipitación, temperatura, estacionalidad y altitud de cada localidad (a partir de pruebas de Mantel); entre la diversidad beta y los factores ambientales, cuando se elimina el efecto de la distancia geográfica (Amb-geogr), y entre la diversidad beta y la distancia geográfica, si se elimina el efecto de las variables ambientales (Geogr-amb) (pruebas parciales de Mantel).
| Factores ambientales | Distancia geográfica | Altitud | Amb-geogr | Geogr-amb | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| r | p | r | p | r | p | r | p | r | p | |
| Diversidad beta (βcc) | 0.421 | 0.069 | 0.533 | 0.056 | 0.064 | 0.376 | 0.418 | 0.080 | 0.530 | 0.079 |
| Recambio (β-3) | 0.197 | 0.221 | 0.458 | 0.003 | 0.178 | 0.245 | 0.155 | 0.288 | 0.445 | 0.009 |
| Riqueza (βrich) | 0.188 | 0.17 | 0.018 | 0.420 | -0.127 | 0.67 | 0.187 | 0.177 | -0.006 | 0.473 |
Las 70 especies de Cantharidae halladas en las 7 localidades con BTC en la vertiente del Pacífico mexicano representan el 31% del total de especies reportado para México (Zaragoza-Caballero y Pérez-Hernández, 2014). El número de Cantharidae que se conocía para el BTC se incrementó un 34% (Zaragoza-Caballero y Mendoza, 1996; Zaragoza-Caballero et al., 2003; Zaragoza-Caballero, 2004; Zaragoza-Caballero y Ramírez-García, 2009). En este trabajo, el género Pletonotum y 11 especies se anotan como nuevos registros para el país, y otras 15 representan nuevos registros estatales.
Ensambles de Cantharidae como los de San Buenaventura y sierra de Huautla presentaron una riqueza comparable con la de otras regiones del mundo, con distinto tipo de vegetación y capturados con distinto método de muestreo (p. ej., Diéguez-Fernández et al., 2006). Otros ensambles como los de San Javier, Santiago Dominguillo y Huatulco mostraron una riqueza muy baja, pero importante para la fauna nacional de cantáridos, ya que más del 50% de las especies son endémicas de México (tabla 2).
La diversidad alfa de Cantharidae del BTC mostró grandes diferencias entre los ensambles. Ensambles tan ricos en especies como Ixtlahuacán y sierra de Huautla tuvieron valores de diversidad más bajos que otros con menor riqueza, como Santiago Dominguillo, debido principalmente a la presencia de especies muy dominantes en los primeros y a un mejor reparto en la abundancia de especies en los segundos (tabla 3). El mejor ejemplo para el primer caso fue el de sierra de Huautla, donde el 66% del total de los individuos de Cantharidae recolectados correspondieron a 1 sola especie de Discodon, con el consecuente valor de diversidad bajo. La mayoría de los ensambles se encontraron conformados de manera similar al de sierra de Huautla.
En cuanto a las estimaciones de riqueza obtenidas con ACE, las localidades en las que el muestreo resultó ser el más incompleto fueron aquellas en las que el esfuerzo de muestreo fue mayor: San Buenaventura, sierra de Huautla y Santiago Dominguillo, localidades en las que se efectuaron 12 muestreos. Estos resultados indican que aún falta por descubrirse entre el 15 y el 25% de la fauna de Cantharidae, lo que concuerda con otros estudios (Zaragoza-Caballero y Pérez-Hernández, 2014). Un muestreo más extensivo e intensivo en ambientes tan heterogéneos como el BTC podría incrementar de forma considerable la riqueza de especies de cantáridos registrada hasta ahora. Es de esperarse que en estos muestreos se capturen muchas especies endémicas y raras, pues a excepción de Chauliognathus, Discodon y Silis, la mayoría de las especies son exclusivas y presentaron frecuencias bajas (p. ej., Caccodes, Plectonotum y Polemius).
La gran diferencia en la composición de especies entre pares de ensambles (altos valores de βcc), resultaron estar modeladas básicamente por uno solo de los componentes de beta: el reemplazamiento de especies (β-3), que a su vez es un reflejo del número de especies exclusivas de cada localidad. La disimilitud debida a las diferencias en cantidad de especies de cada ensamble fue mucho menos importante. El reemplazamiento de especies refleja la ganancia o pérdida de especies que resulta de las diferencias en las condiciones ambientales, la competencia entre especies y los eventos históricos propios de la localidad de estudio (Leprieur et al., 2011). En el caso de los ensambles de Cantharidae del BTC, este estudio sugiere que las condiciones ambientales no tienen mucha influencia sobre ellos, y la competencia entre especies de cantáridos no ha sido evaluada con suficiente detalle. Sin embargo, la compleja historia geomorfológica y evolutiva del BTC ha dado lugar a que este tipo de vegetación presente una distribución en forma de manchones aislados (Prado y Gibbs, 1993; Trejo, 2005), lo que ha favorecido la especiación alopátrica en taxones como plantas y lepidópteros (De la Maza, 2010; Pennington et al., 2000). Los manchones del BTC podrían estar actuando como una barrera biogeográfica importante para taxones como Cantharidae, que presentan escasa vagilidad y una fuerte relación con sus plantas huéspedes (Gambardella y Vaio, 1978; Miskimen, 1972), lo que generaría un alto nivel de endemismos en los ensambles.
La alta exclusividad de especies de coleópteros en el BTC no es una novedad, pues ya había sido notada en la familia Cerambycidae (Coleoptera) de 5 localidades con BTC (Noguera et al., 2012; Zaragoza-Caballero et al., 2010). Entre los cerambícidos se registran altos porcentajes de endemismo (29 a 65%) y de exclusividad (6 a 40%), pero también altos porcentajes de especies compartidas (27 a 54%). En cambio, para ensambles de Odonata de las mismas localidades, se ha propuesto un patrón distinto del observado aquí, con valores de disimilitud menores al 50% y una cantidad de especies exclusivas baja (González-Soriano et al., 2009; Venegas-Suárez-Peredo, 2011).
Por otro lado, las pruebas simples y parciales de Mantel sugieren que el reemplazamiento de especies (β-3) está modelado fundamentalmente por las distancias geográficas, lo que no sucede con la diferencia en la riqueza de especies (βrich) (tabla 4). Este resultado ya se había reportado para Coleoptera del BTC mexicano (p. ej., Mora-Aguilar y Montes de Oca, 2007; Trevilla-Rebollar, Deloya y Padilla-Ramírez, 2010) y, en general, la correlación positiva entre beta y la distancia geográfica es un patrón frecuente en una gran variedad de taxones (Nekola y White, 1999).
La diversidad de cantáridos del BTC no presenta el clásico patrón altitudinal o latitudinal de la diversidad, en el que esta aumenta de latitudes y altitudes mayores a menores (Gaston, 2000). En este caso, los mayores valores de riqueza y diversidad se encontraron en latitudes intermedias del rango latitudinal, en las localidades del Eje Neovolcánico Transversal (San Buenaventura, sierra de Huautla y Santiago Dominguillo). Esta región corresponde a la ecorregión bosques secos del Balsas, reconocida como una zona de alta diversidad de distintos grupos y de altas concentraciones y endemismos de plantas (Dinerstein et al., 1995; Rzedowski, 1991). El patrón de diversidad de los cantáridos es similar al de los escarabajos necrófilos (Trevilla-Rebollar et al., 2010). La ausencia de un patrón latitudinal o altitudinal en Coleoptera del BTC también se había notado en Cerambycidae (Noguera et al., 2012), con la salvedad de que la diversidad más alta se presentó en la costa del Pacífico.
No se encontró una correlación significativa entre los factores macroclimáticos y la diversidad beta de cantáridos que señale la influencia de estos factores sobre la distribución de los escarabajos en el BTC. Sin embargo, es importante señalar que la marcada estacionalidad del BTC determina los ciclos de vida de muchas especies de insectos. Por ejemplo, la mayor abundancia y riqueza de especies en estado adulto ocurre en los meses de mayor precipitación (Pescador-Rubio et al., 2002) y los ciclos de vida de los Cantharidae están asociados estrechamente al reverdecimiento de las plantas del BTC (Zaragoza-Caballero y Mendoza, 1996; Zaragoza-Caballero et al., 2003; Zaragoza-Caballero, 2004; Zaragoza-Caballero y Ramírez-García, 2009). Estos elementos sugieren la necesidad de explorar fenómenos en escalas más locales que consideren la heterogeneidad propia del BTC (Balvanera et al., 2002).
La influencia de factores bióticos, particularmente de la flora presente en cada ensamble, también debería analizarse en profundidad, pues la relación cantárido-planta (p. ej., Crowson, 1972; Miskimen, 1972) no se ha explorado de forma adecuada. Una explicación podría ser que se trata de un grupo con una diversidad ecológica alta, conformado por especies difíciles de identificar (Crowson, 1972; Ramsdale, 2002). La alta diversidad beta de la flora de los BTC mexicanos (Trejo, 2005, 2010) podría influir de forma considerable en los insectos asociados a ella. En el caso de los Cantharidae, sería importante analizar su distribución en relación con las plantas Asteraceae, con las que se han asociado recurrentemente (p. ej.., Dickinson y McKone, 1992).
Los factores históricos constituyen otro aspecto muy importante en la conformación de los ensambles, otro elemento que debe considerarse en futuros trabajos en los que se analicen los patrones de insectos en el BTC. Para ello, es necesario tomar en cuenta que la historia biogeográfica y la actual distribución de ese tipo de vegetación en México actúan como un factor de especiación en distintos taxones (De la Maza, 2010; Pennington et al., 2000). En el caso de los Cantharidae, también podría ser la causa de la alta exclusividad de especies hallada, que se refleja en un alto reemplazo de especies entre los ensambles, más que en una diversidad alfa alta, como se mencionó en párrafos anteriores.
La familia Cantharidae es una de las más conspicuas y diversas del orden Coleoptera, y se distribuye principalmente en zonas tropicales (Zaragoza-Caballero, 2004). Sin embargo, no se ha explorado de forma adecuada en términos de sus patrones de diversidad, ni tampoco en lo que respecta a su historia natural. Con estos resultados podría considerarse que en el BTC habita casi el 50% del total de la fauna mexicana de cantáridos. Muchas de esas especies seguramente son todavía desconocidas para la ciencia, y otro tanto supondrán nuevos registros para el país.
Los autores desean agradecer a Felipe A. Noguera-Martínez, Enrique Ramírez-García y Enrique González-Soriano por su apoyo en el trabajo de campo. Además, agradecemos a este último, a Claudia E. Moreno-Ortega, Pilar Rodríguez-Moreno y a 2 revisores anónimos por sus comentarios y sugerencias que mejoraron sustancialmente el manuscrito. Este trabajo fue financiado parcialmente por Conacyt (4751N y 993555), Conabio y DGAPA-PAPIIT (IN228707-3). Además, la primera autora agradece al Posgrado en Ciencias Biológicas de la Universidad Nacional Autónoma de México.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.