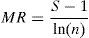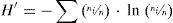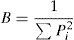Para el análisis del grado de traslape trófico, se consideraron 2 especies de carácidos neotropicales: Hemibrycon brevispini y Bryconamericus caucanus. En ambas especies se ha identificado una dieta insectívora con tendencias al consumo de efemerópteros, himenópteros y dípteros. Se encontró que estos peces comparten el 65% de los ítems alimenticios, lo que se refleja en el elevado traslape trófico (QS=0.620) y, además, no existe diferencia entre las abundancias de las presas consumidas. Los valores de amplitud trófica, diversidad, equidad y riqueza fueron mayores en B. caucanus al comparar con H. brevispini, lo cual explica la flexibilidad ecológica que exhibe B. caucanus en su amplio intervalo de distribución geográfica en relación con H. brevispini. En estos taxones, la sintopía responde principalmente a la gran abundancia de recursos disponibles en el transcurso del año.
To analyze the degree of trophic overlap, 2 species of Neotropical characins were considered: Hemibrycon brevispini and Bryconamericus caucanus. Both species have been identified as having an insectivorous diet with a tendency to consume mayflies, hymenopterans, and dipterans. It was found that these fish share 65% of food items, which is reflected in their high trophic overlap (QS=0.620). There is also no difference between the abundances of prey consumed. The values of trophic breadth, diversity, evenness, and richness were higher in B. caucanus than in H. brevispini, which explains the ecological flexibility exhibited by B. caucanus throughout its wide range of geographical distribution compared to H. brevispini. In these taxa, syntopy is mainly due to the high abundance of resources available during the year
La comunidad se considera como un ensamble de diferentes especies que coexisten e interactúan en tiempo y espacio (Gotelli y Colwell, 2001) bajo relaciones de competencia, depredación, parasitismo, comensalismo y mutualismo, entre otras (Allan, 1995). En la naturaleza, la competencia representa una limitante en la distribución de las especies, sobre todo entre las que utilizan el mismo tipo de recurso alimenticio y comparten hábitats. Como resultado de lo anterior, se plantea que 2 especies sintópicas (sensuRivas, 1964) no ocupan, en ningún caso nichos idénticos, por lo cual se excluyen mutuamente en forma tal que cada una aprovecha (explota) alimentos y modos de vida divergentes y específicos (Cody, 1974; Krebs, 1985; Krebs, 1999; MacArthur, 1972; Pianka, 1982; Zug, Vitt y Caldwell, 2001), con consecuencias ecológicas (Alatalo, 1981) y evolutivas (Diamond, 1978) evidentes.
Entre los aspectos más importantes del nicho se encuentra la dimensión trófica, pues la repartición del recurso alimenticio es fundamental para los organismos, y su división entre especies resulta útil para entender las interacciones derivadas de su coexistencia (Gerking, 1994; Schoener, 1974; Taper y Marquet, 1996). La partición del recurso trófico puede variar con respecto a los cambios en las abundancias de presas (Goszcynski, 1986), hábitat (Clode y MacDonald, 1995) o sitios geográficos, y son modelados bajo la teoría del forrajeo óptimo, que predice el aumento en la amplitud de nicho con respecto al decremento en la disponibilidad de recursos, pues en estas condiciones se promueve el consumo de un amplio rango de presas subóptimas y la pérdida de especificidad trófica (Krebs y Davies, 1981; MacArthur y Pianka, 1966; Svärdson, 1949).
Las definiciones de simpatría y sintopía varían entre diversos autores y suelen usarse indistintamente como sinónimos. Según Funk (1993) la distinción entre estos 2 términos depende únicamente de las características físicas derivadas de la coexistencia; es decir, especies sintópicas ocupan un espacio físico cercano, pero diferentes zonas de vida (microhábitats). Bussing (1998) señala como sintópicas a 2 o más poblaciones que ocupan el mismo hábitat y simpátricas únicamente cuando 2 o más poblaciones están en la misma zona, como peces en la misma cuenca hidrográfica. En este sentido, la diferencia radica únicamente en la escala: la simpatría se da a escala geográfica y la sintopía hace referencia específica al hábitat. Rivas (1964) asume que el término sintópico debe ser usado también en especies que tienen la potencialidad geográfica para reproducirse entre sí (por su distribución espacial), pero en ictiología sintópico significa que las especies han sido colectadas juntas.
En el presente trabajo se analiza el aspecto trófico, que permite explicar la coexistencia de Hemibrycon brevispini, una especie con notable grado de endemismo geográfico en las quebradas La Venada y Quebradanegra, Río Quindío, Alto Cauca (Román-Valencia y Arcila-Mesa, 2009; Román-Valencia, Arcila-Mesa y García, 2009), y Bryconamericus caucanus, abundante y de amplia distribución en las cuencas de los ríos Ranchería y Cauca-Magdalena, ambas en Colombia (Román-Valencia, Vanegas-Ríos y García, 2009).
Materiales y métodosSe capturaron 53 individuos de B. caucanus y 116 de H. brevispini con red de arrastre de 2×0.5m y ojo de 0.5cm. Con el objetivo de retrasar la degradación enzimática del contenido estomacal, los peces se preservaron in situ en una caja de icopor que contenía hielo y se transportaron, el mismo día de la captura, al laboratorio del ictiología de la Universidad del Quindío, Armenia, Colombia (IUQ), donde se realizaron, de igual manera, disecciones uroventrales para la extracción del tracto digestivo (estómago, ciegos pilóricos e intestino). Las muestras de peces se recolectaron mensualmente entre julio de 2011 y enero de 2014, solo en la quebrada La Venada (4°26′47.4” N; 75°40′44.3” O; 1,307-1,661msnm), afluente quebrada Quebradanegra, Río Santo Domingo, Alto Cauca, Calarcá, Quindío, Colombia. Los muestreos cubrieron, para el sitio del estudio, los periodos secos (junio-agosto y enero-marzo) y de lluvias (septiembre-diciembre y abril-mayo). Se analizaron los porcentajes volumétricos (%V) (descritos en Capitoli, [1992] y Pedley y Jones [1978]), numéricos (%N) y las frecuencias observadas (%FO) (detallados en Hynes [1950] y Hyslop [1980]) de cada categoría de presas, y se siguieron tal y como se aplican por Román-Palacios, Román-Valencia, y Taphorn (2014).
Se generó una matriz de presas a partir de las muestras examinadas de B. caucanus y de H. brevispini. La estandarización de los ítems de la dieta para insectos se realizó mediante la categoría orden, y otros grupos taxonómicos se agruparon en orden o artificial. En cada categoría taxonómica se calculó el valor porcentual del índice de importancia relativa (%IRI) propuesto por Cortés (1997) para permitir comparaciones entre especies, así como entre ítems de acuerdo con su importancia relativa (IRI), y se expresa como:
donde IRIi es el valor de IRI para la presa i, y n el número total de categorías tróficas consideradas. %Foi, %Noi y %Voi son los porcentajes de frecuencia, número y volumen observado para la presa i, respectivamente.Se consideró el índice de dominancia (D) expresado como D=1-índice de Simpson (λ; Harper, 1999; Simpson, 1949), que presenta un rango entre 0 (en donde todas las presas están igualmente representadas) y 1 (con un único ítem dominante en la dieta de la especie):
donde ni es el número de individuos de la presa i.La riqueza trófica se calculó con el índice de Margalef (Margalef, 1958) expresado como:
donde S y n son el número de presas y la abundancia de cada una, respectivamente. Este índice es poco sensible al tamaño de la muestra, ya que presenta características de crecimiento del tipo función radical con respecto al aumento del número de taxones y un crecimiento logarítmico del tamaño de la muestra; es decir, dependiente de las abundancias relativas (Hammer y Harper, 2006).Se realizaron curvas de rango-abundancia para el contenido trófico de B. caucanus y H. brevispini con base en la contribución de la abundancia relativa de cada presa en la dieta. Estas curvas permiten una comparación gráfica de la riqueza trófica (número de puntos), sus abundancias relativas, la forma de las curvas (equitatividad) y, además, conservan la identidad de las presas que componen el espectro trófico de las especies (Feinsinger, 2004). El cálculo de la diversidad trófica se realizó a partir del índice de Shannon-Wiener (H’; Krebs, 1999; Shannon y Weaver, 1949), que comprende el número de individuos (equitatividad) y número de taxones (riqueza), calculado como:
donde ni es el número de individuos de la presa i, y n es el número de presas consumidas por la especie. Este índice varía entre 0, para comunidades con un solo taxón, y valores elevados en comunidades con muchos taxones, cada uno con pocos individuos. El dato indica, por lo tanto, la dificultad de predecir la categoría del próximo ítem encontrado (Hammer y Harper, 2006). Los análisis de diversidad, riqueza y equitatividad fueron realizados en Past 2.17 (Hammer, Harper y Ryan, 2001).La amplitud del nicho es un parámetro que pretende cuantificar qué tan especializada es una especie dentro de un ambiente determinado (Krebs, 1999). Un especialista se alimenta de 1 o 2 recursos alimenticios y tiene, por lo tanto, una amplitud de nicho menor que el de un generalista. Para esto, se aplicó el índice de Levins (1968), que cuantifica la uniformidad en los recursos consumidos por cada especie, expresados como:
donde pi es la proporción de individuos encontrados usando el recurso i. El índice de Levins (Krebs, 1999) estandarizado (Best=(B–1)/n–1) se utilizó para expresar la amplitud de nicho en una escala que va desde 0 (nicho angosto) hasta 1 (nicho amplio). Así, cuando los valores son menores de 0.60, el organismo se considera especialista, lo que indica que utiliza un número bajo de recursos y presenta una preferencia por ciertos alimentos (Krebs, 1999). Para estimar el grado de similitud de la dieta entre las especies, se utilizaron 2 índices que miden el nivel en que 2 especies usan un conjunto de recursos en particular y manifiestan el grado de repartición de recursos entre pares de especies, dentro de una comunidad.Por un lado, se utilizó el índice de sobre posición de dieta simplificado de Morisita (Cλ; Horn, 1966), expresado como:
donde nji es el número de individuos de la presa i en la especie j y Nj corresponde al número de individuos en la especie j. Este índice no presenta mayor sensibilidad a la riqueza trófica ni al tamaño de muestra como otros índices (Magurran, 2004).Además, se utilizó el índice de Czekanowski, conocido también como Sorensen cuantitativo (QS):
donde a y b son el número de presas en las especie 1 y 2, respectivamente, y c es el número de especies compartidas entre las especies 1 y 2. Este índice enfatiza sobre los taxones compartidos entre especies. Los exámenes de traslape trófico se llevaron a cabo con EcosimR (Gotelli y Ellison, 2013) y R software (R Core Team, 2013).Se realizó también un análisis de componentes principales (ACP) a partir de la matriz de abundancias transformada (Y¿= log [x+1]) para verificar patrones subyacentes en el espacio multivariado de los ítems alimenticios entre B. caucanus y H. brevispini. Este análisis se basa en la abundancia numérica, por ser informativa de acuerdo con el procedimiento de alimentación, e indica características de la estrategia trófica de las especies, más que la importancia nutricional de cada presa (Cailliet, 1977; MacDonald y Green, 1983).
Un análisis de similitud (ANOSIM) se usó para comparar las dietas entre B. caucanus y H. brevispini (Clarke, 1993). La matriz de similaridad se obtuvo a partir de las abundancias transformadas (Y¿) y se utilizó el índice de Bray Curtis por presentar un significado biológico (Clarke y Warwick, 1994a). La similaridad de Curtis y las relaciones observadas se compararon con una expectativa aleatoria basada en 9,999 permutaciones. Este análisis permite definir si existen diferencias significativas entre las especies en términos de abundancias de presas. ANOSIM genera un valor de r que varía entre –1 y +1, con un dato de 0 que indica la no selección de dieta (Montaña y Winemiller, 2013). Se realizó un análisis del porcentaje de similaridad (Simper), para determinar los ítems tróficos responsables de las diferencias entre las especies, que calcula el promedio de diferencias entre las especies de peces y registra la contribución de cada categoría a esta desigualdad (Clarke y Warwick, 1994b).
ResultadosEn el %IRI, B. caucanus y H. brevispini presentaron registros superiores al 20% para los ítems Ephemeroptera, Diptera e Hymenoptera (tabla 1). Esto indica que existe un aprovechamiento mayoritario por parte de ambas especies hacia presas de estos 3 grupos de insectos. Además, estas especies comparten el 65% de los ítems presentes en la totalidad del espectro trófico con el 10% únicas para B. caucanus y el 40% para H. brevispini.
Valores porcentuales de importancia relativa para las categorías de presas consideradas en el análisis del nicho trófico en 2 especies sintópicas, B. caucanus y H. brevispini, en la quebrada La Venada, Alto Cauca, Colombia.
| Presa | B. caucanus | H. brevispini |
|---|---|---|
| Hymenoptera | 23.81 | 32.14 |
| Diptera | 27.37 | 36.49 |
| Ephemeroptera | 27.71 | 22.97 |
| Hemiptera | 0.00 | 0.16 |
| Coleoptera | 0.53 | 2.74 |
| Odonata | 0.88 | 0.24 |
| Trichoptera | 8.24 | 4.35 |
| Lepidoptera | 0.00 | 0.06 |
| Miriapoda | 0.07 | 0.05 |
| Crustacea | 0.03 | 0.03 |
| Arachnida | 0.02 | 0.003 |
| Nematoda | 8.86 | 0.19 |
| Gastropoda | 0.10 | 0.003 |
| Plantae | 2.05 | 0.48 |
| Pluma | 0 | 0.02 |
| Oocitos | 0 | 0.01 |
| Escama | 0.08 | 0.00078 |
| Dyctioptera | 0 | 0.00078 |
| Psocoptera | 0.02 | 0 |
| Annelida | 0.03 | 0 |
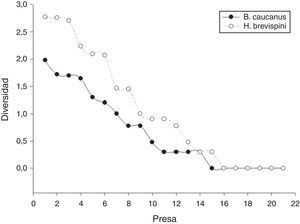
Se encontró un índice de amplitud trófica de Levins mayor en B. caucanus (B= 6.552, BEST= 0.427) con respecto a H. brevispini (B= 5.252, BEST= 0.303); es decir, H. brevispini presenta una mayor especialización en el consumo de efemerópteros, dípteros e himenópteros. Estos índices son también sensibles a la homogeneidad en la distribución de abundancias y entre el número de categorías de presas prestablecidas. Al analizar los valores de diversidad de Shannon-Wiener, B. caucanus, con H¿= 1.927, presenta mayor diversidad que H. brevispini, con H¿= 1.765, generada por una alta equitabilidad en las abundancias de presas en la primera especie; es decir, una menor dominancia de un taxón sobre los demás (D= 0.1873 y D= 0.2113, respectivamente). La riqueza interpretada a partir del índice de Margalef presentó también un valor mayor en B. caucanus (MR= 2.285) y menor en H. brevispini (MR= 1.824). La curva de rango-abundancia (fig. 1) apoya los datos encontrados con el índice de Margalef e indica un mayor número de presas consumidas por H. brevispini, pero presenta una distribución más heterogénea con respecto a las abundancias relativas de estas, lo que genera un menor registro de diversidad para esta especie, en comparación con B. caucanus.
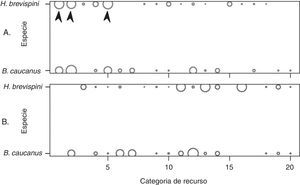
La visualización de ítems (fig. 2A) indica que ambas especies consumen Hymenoptera, Diptera y Ephemeroptera, presas que presentan un consumo importante por parte de ambas especies de peces y contribuyen a la mayoría del traslape trófico. Esta afirmación se obtiene al comparar las abundancias observadas con el uso esperado para una población predictiva a partir de un modelo de comunidad nula (fig. 2B). Los índices de traslape trófico apoyan lo encontrado en la comparación resultante entre la visualización observada y esperada (fig. 2), pues ambos presentaron concordancia en los valores de traslape elevados entre las especies (Cλ= 0.844 y QS= 0.620).
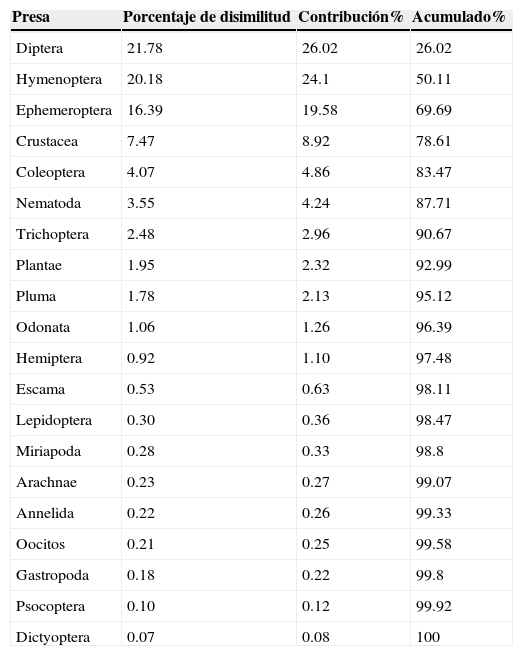
Por otro lado, el análisis de similitud (Anosim) indicó la formación de 2 grupos con respecto a la matriz de abundancias, pero estos grupos no se corresponden con los hábitos alimentarios de cada especie. Las especies no se diferencian de forma significativa en cuanto a las características tróficas, pues el consumo de dípteros, himenópteros y efemerópteros es abundante en ambas (r= 0.33; p< 0.05). Estos grupos insinuados por el Anosim se establecen, como indica el Simper, por diferencias en el consumo de Diptera, Hymenoptera y Ephemeroptera (tabla 2). Existe variación intraespecífica en ambas especies, consecuencia de la captura diferencial de estos 3 ítems que contribuye a la distancia entre grupos.
Datos de disimilitud generados a partir de Simper para la matriz de abundancias transformada de B. caucaus y H. brevispini.
| Presa | Porcentaje de disimilitud | Contribución% | Acumulado% |
|---|---|---|---|
| Diptera | 21.78 | 26.02 | 26.02 |
| Hymenoptera | 20.18 | 24.1 | 50.11 |
| Ephemeroptera | 16.39 | 19.58 | 69.69 |
| Crustacea | 7.47 | 8.92 | 78.61 |
| Coleoptera | 4.07 | 4.86 | 83.47 |
| Nematoda | 3.55 | 4.24 | 87.71 |
| Trichoptera | 2.48 | 2.96 | 90.67 |
| Plantae | 1.95 | 2.32 | 92.99 |
| Pluma | 1.78 | 2.13 | 95.12 |
| Odonata | 1.06 | 1.26 | 96.39 |
| Hemiptera | 0.92 | 1.10 | 97.48 |
| Escama | 0.53 | 0.63 | 98.11 |
| Lepidoptera | 0.30 | 0.36 | 98.47 |
| Miriapoda | 0.28 | 0.33 | 98.8 |
| Arachnae | 0.23 | 0.27 | 99.07 |
| Annelida | 0.22 | 0.26 | 99.33 |
| Oocitos | 0.21 | 0.25 | 99.58 |
| Gastropoda | 0.18 | 0.22 | 99.8 |
| Psocoptera | 0.10 | 0.12 | 99.92 |
| Dictyoptera | 0.07 | 0.08 | 100 |
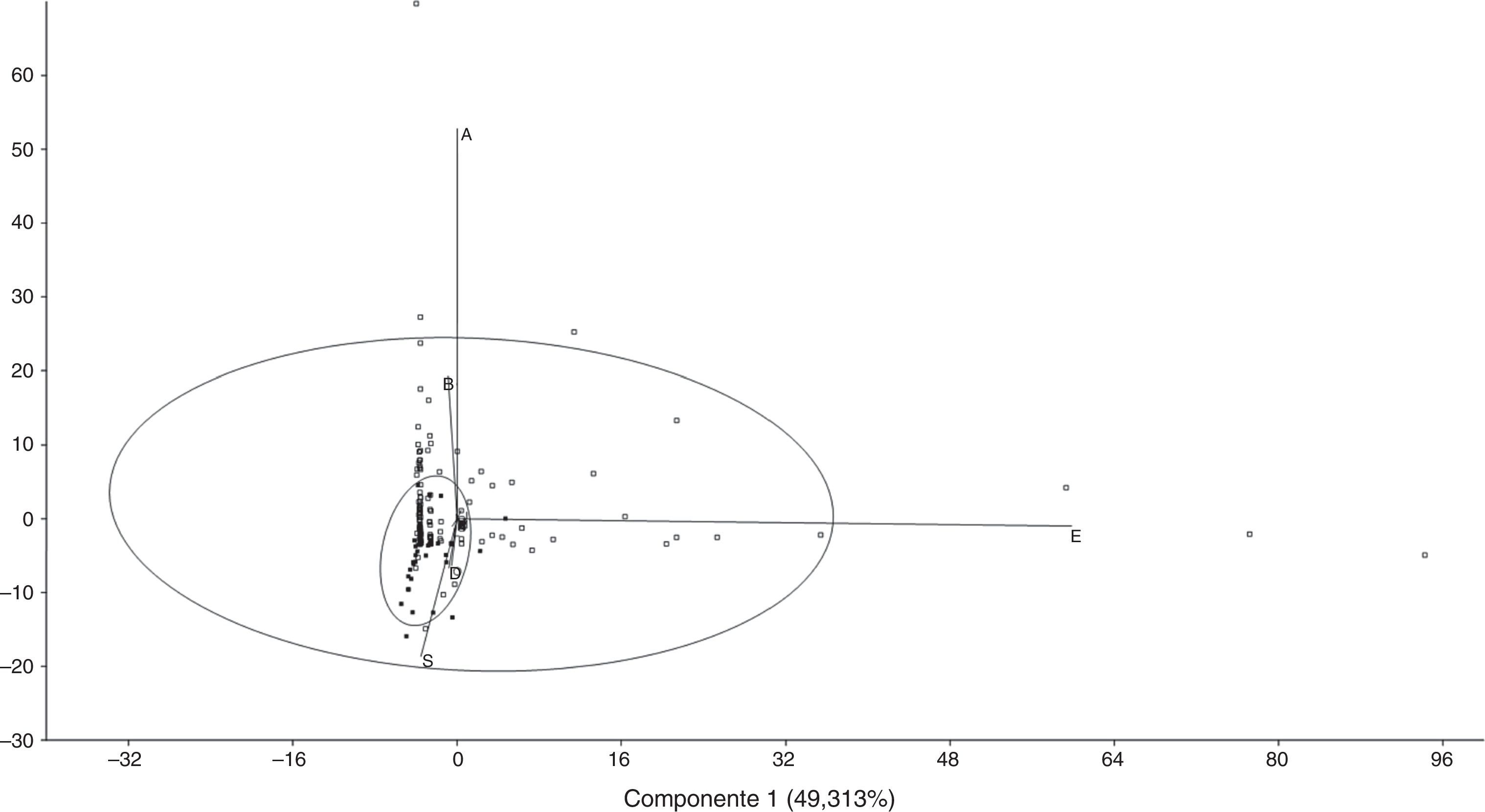
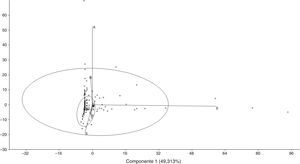
En los análisis de componentes principales (ACP) se seleccionaron los componentes 1 (PC1= 49.31%) y 2 (PC2= 23.15%) que explican un 72.46% de la varianza del espacio multivariado de presas consumidas por B. caucanus y H. brevispini (fig. 3). El PC1 está dominado en el eje positivo por Hymenoptera (Eigenvalue= 0.801) y Diptera (Eigenvalue= 0.529), y en el negativo por Ephemeroptera (Eigenvalue= -0.179). En el PC2 predomina Ephemeroptera en el eje positivo (Eigenvalue= 0.975) y Lepidoptera (Eigenvalue= -0.0282) y Plantae (Eigenvalue= -0.029) en el negativo. Hemibrycon brevispini presenta tendencias más extremas en el consumo de himenópteros, dípteros y efemerópteros, y además registra la mayor abundancia relativa de lepidópteros y material de origen vegetal en su estómago. Por otro lado, B. caucanus presenta una ingesta más homogénea en las abundancias de los ítems constituyentes del espectro trófico, y por lo tanto, la mayor parte de los individuos analizados se presentan como una dispersión cerca del origen de los ejes.
DiscusiónCon base en los resultados de este trabajo y a la luz de las agrupaciones a escala taxonómica suprafamiliar, estas especies coinciden en la utilización de los recursos alimenticios. Sin embargo, los ensambles de peces son excelentes modelos para evaluar conceptos teóricos sobre repartición de recursos (Aranha, Takeuti y Yoshimura, 1998; Motta y Uieda, 2004), amplitud de nicho (Casatti, 2002) y traslape de nicho (Douglas y Matthews, 1992; Douglas, Marsh y Minckley, 1994; Novakowski, Hahn y Fugi, 2008). Estos ensambles presentan particularidades relacionadas con las características intrínsecas al nicho específico como estrategias para reducir el traslape y optimizar la amplitud del nicho. En el caso de los ecosistemas dulceacuícolas neotropicales, la alta diversidad local refleja problemas de coexistencia entre especies que, según la teoría del nicho (Gerking, 1994; Hutchinson, 1957), se basan en la repartición de recursos (Schoener, 1985). Pianka (1969) indica que las especies comparten 3 tipos de recursos: alimento, espacio y tiempo, pero de todas formas la separación trófica se considera como el mecanismo de repartición de recursos más importante en ensambles de peces (Ross, 1986).
La abundancia de recursos puede tener como consecuencia el aumento en el traslape entre 2 especies sintópicas. Cuando la abundancia de recursos alimenticios decrece, el traslape trófico esperado disminuye (Cody, 1974; Lack, 1947; Pianka, 1982; Schoener, 1982; Svärdson, 1949; Wiens, 1989). Aun así, si la restricción en la cantidad de alimento persiste, el nicho trófico volverá a solaparse (Bell y Ford, 1990; Wiens, 1989). Es claro que el traslape trófico de especies coexistentes puede llevar a la competencia interespecífica por la repartición del recurso alimenticio, pero se ha sugerido que en peces dulceacuícolas de aguas lóticas, que consumen gran variedad de ítems alimenticios disponibles en su ambiente, la competencia no parece tener lugar ni forma parte de las interacciones preponderantes entre especies. La especialización trófica (Vojtech et al., 2002) o la repartición diferencial de recursos (Hynes, 2001; Ross, 1986; Schoener, 1974) son responsables de la falta de competencia en los ensambles de peces neotropicales y generan, así, una potencialidad mayor en el número de especies coexistentes. Se indica también que la plasticidad trófica permite coexistir al explorar diferentes fuentes de alimento (Balassa, Fugi, Hahn y Galina, 2004).
Por otro lado, aunque no ha sido desarrollado un fundamento estadístico para establecer la significación de los estimadores de traslape en el nicho trófico (Cailliet y Barry, 1979), como los aplicados en el presente trabajo; se ha designado por consenso que registros superiores a 0.6 indican un elevado traslape en el eje trófico del hipervolumen de nicho (Cortés, 1997). Las especies objeto de este estudio (B. caucanus y H. brevispini) exhiben un alto traslape trófico, ya que los índices presentan datos entre 0.62 y 0.84, consecuencia de la tendencia hacia la insectivoría marcada en los taxones. Bryconamericus caucanus, a diferencia de H. brevispini, aprovecha con mayor equitatibilidad el espectro trófico que consume, por lo que se considera que hay una gran abundancia de alimento para ambas especies, siendo H. brevispini un poco más selectiva que B. caucanus, la cual come lo que ve.
Bryconamericus caucanus se localizó cerca de la orilla o zona litoral, en refugios bajo vegetación ribereña, mientras H. brevispini se observó únicamente en aguas abiertas cerca de la superficie en la columna de agua en los charcos o remansos de su hábitat, con tendencia hacia una mayor reófila en áreas amplias observadas sin vegetación. En este sentido, aunque es necesario un nuevo examen de la repartición espacial en ambas especies, en general se reconoce que la repartición de recursos y las tácticas exploratorias para la minimización del traslape de nicho representan alternativas a la competencia en estos ambientes con gran diversidad de ítems alimenticios. Asimismo, el traslape de nichos puede ser reducido a partir de las características intrínsecas de las especies como la elevada diversidad de adaptaciones morfológicas y la explotación de diferentes microhábitats y periodos de actividad (Chase y Leibold, 2003; Hurlbert, 1978).
Hemibrycon brevispini y B. caucanus presentan una notoria similitud en cuanto a los ítems consumidos en su espectro trófico. Se ha demostrado que un recurso trófico puede ser consumido por muchas especies de peces en una comunidad sin generar relaciones antagónicas entre estas (Novakowski et al., 2008; Pouilly, Lino, Bretenoux y Rosales, 2003; Pouilly, Yunoki, Rosales y Torres, 2004; Pouilly, Barrera y Rosales, 2006). Creemos que los ítems Ephemeroptera, Hymenoptera y Diptera aportan un alto valor nutricional evidente en la contribución volumétrica de la dieta de cada especie y, por lo tanto, son depredados con intensidad similar por ambas especies estudiadas. Sin embargo, hay que tener en cuenta que el alto consumo puede ser una consecuencia de la abundancia y tal vez no en el valor nutricional (Rezende, Caramaschi, Lobón-Cerviá y Mazzoni, 2013).
Este trabajo se benefició de la lectura crítica y sugerencias de Carlos A. García, Carmen Montaña, Douglas Rodríguez-Olarte, Donald C. Taphorn, K. W. Winemiller, D. Moraga y 2 revisores anónimos. Algunos estudiantes de la carrera de Biología de la Universidad del Quindío (curso: Biología Animal 2011–2013) participaron en los muestreos realizados.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.