La sierra Fría de Aguascalientes está cubierta por bosques templados que sostienen comunidades de encino, encino-pino y pino-encino. En esta sierra, los pinos son afectados por el insecto descortezador mexicano menor Dendroctonus mexicanus en simbiosis con hongos Ophiostomatoides manchadores de madera que en áreas productoras de este recurso, pueden reducir el valor comercial entre un 10 a 50%. Este trabajo se realizó con el objetivo de identificar a los hongos Ophiostomatoides que causan el manchado de la madera de los pinos en la sierra Fría de Aguascalientes. Se obtuvieron muestras de madera de pinos infestados por D. mexicanus para aislar, purificar e identificar las especies de hongos. Se describieron las características de cultivo de los aislamientos representativos de estos hongos y se realizaron estudios morfométricos de las estructuras reproductivas de anomorfos y teleomorfos de los mismos. Los hongos Ophiostoma sp., Ophiostoma pulvinisporum, O. pluriannulatum, Ceratocystiopsis fasciata y Leptographium sp. fueron identificados en Pinus teocote y P. leiophylla, siendo Ophiostoma sp. y Leptographium sp. los más frecuentes. Este es el primer trabajo en el que se registran estos hongos en los pinos de la sierra Fría de Aguascalientes.
The Sierra Fría of Aguascalientes is covered with temperate forests, sustaining oak, oak-pine, and pine-oak communities. In this sierra, pines are affected by the smaller mexican pine beetle, Dendroctonus mexicanus, in symbiosis with wood-staining Ophiostomatoid fungi that, in timber production areas, may reduce timber value from 10 to 50%. The objective of this research was to identify Ophiostomatoid fungi species that cause wood-stain in pine species in the Sierra Fría of Aguascalientes. Wood samples were taken from pine trees infested by D. mexicanus, to isolate, purify and identify fungi species. Growing characteristics of these fungi were described and morphometric studies of the reproductive structures of anamorphs and telemorphs were conducted. The fungi Ophiostoma sp., O. pulvinisporum, O. pluriannulatum, Ceratocystiopsis fasciata and Leptographium sp., were identified on Pinus teocote and P. leiophylla, being Ophiostoma sp. and Leptographium sp. the most frequent. This is the first document that reports Ophiostomatoid fungi on pine trees of the Sierra Fría of Aguascalientes.
La sierra Fría, localizada en la parte meridional de la sierra Madre Occidental y declarada área natural protegida por el gobierno del estado de Aguascalientes en 1994, es una de las regiones de nuestro país cubierta por bosques templados que está dominada por bosques de encino y pino-encino. Se estima que la superficie de los bosques de pino, encino-pino y pino-encino en la sierra Fría es de 2,939 ha (Chapa, Sosa y Alba, 2008). Los bosques templados abarcan 29% de la superficie del estado de Aguascalientes. En este estado se localizan la sierra Fría y la sierra del Laurel, que son los macizos montañosos de la entidad, los cuales llegan a alcanzar hasta 3,000 m snm. Se tienen registradas 8 especies de Pinus sp. en Aguascalientes: P. cembroides Zucc., P. chihuahuana (Engelmann) G. R. Shaw, P. durangensis Martínez, P. durangensis f. quinquefoliata Martínez, P. leiophylla Schl. y Cham., P. lumholtzii Robins y Ferns, P. michoacana var. cornuta Martínez, y P. teocote Schiede ex Schltdl. (Siqueiros, 1989). Las especies más abundantes son P. teocote y P. leiophylla, las cuales, por lo general, se encuentran en las mesetas altas y/o en pendientes con exposición norte. En contraste, las especies más escasas son P. michoacana var. cornuta y P. durangensis que están representadas por individuos aislados o en pequeñas poblaciones, en barrancas húmedas o mesetas, formando bosques de encino-pino en las partes más altas de la sierra entre los 2,450 a 2,800 m snm (Siqueiros, 1989).
Los pinos pueden ser afectados por diversas plagas y enfermedades. Respecto a esto último, Sánchez (2004) después de realizar un diagnóstico fitosanitario de los bosques de pino, pino-encino y encino-pino, señaló que durante el año 2001 la sierra Fría de Aguascalientes sufrió fuertes infestaciones de escarabajos descortezadores, principalmente D. mexicanus Hopkins. Por dicha razón, hubo una mortalidad alta de P. teocote y P. leiophylla. En ese año se derribaron alrededor de 10,000 árboles infestados, como parte de un programa de saneamiento. Dendroctonus mexicanus es un pequeño escarabajo de 2.3 a 4.5 mm de longitud, de color café oscuro y cuerpo cilíndrico. En la sierra Fría D. mexicanus ataca a P. leiophylla y P. teocote, las 2 especies dominantes en dicha área (Sánchez, 2004). Desde el punto de vista evolutivo, se ha establecido una de las relaciones simbióticas más frecuentes e importantes entre pinos-insectos descortezadores-hongos. Los insectos descortezadores de los géneros Dendroctonus e Ips (Coleoptera: Scolytidae) se consideran las plagas más importantes de los bosques de pino por matar a los árboles. Los microorganismos más frecuentemente asociados a los insectos descortezadores son los hongos del Phylum Ascomycota, orden Microascales de los géneros Ceratocystiopsis Upadhyay y Kendr., Ceratocystis Ellis y Halst. y Ophiostoma Syd. y P. Syd., aunque otros hongos (Penicillum, Cladosporium, Thrichoderma, Botrytis, entre otros) y bacterias (Pseuodomonas, Serratia, Rahnella y Burkholderia, entre otras) también están asociados a las especies de los insectos anteriormente señalados (Marmolejo, 1991; Sánchez, 1994; Six y Klepzig, 2004). En esta asociación los insectos se benefician alimentándose del hongo, mientras que el hongo es beneficiado al ser transportado a otros árboles por el insecto. Se señala que la interacción y coevolución entre plantas e insectos se inició hace 280 millones de años, en la era Mesozoica. Esto se conoce con base en las galerías que se han encontrado de estos insectos en madera de árboles petrificados (Sánchez, 1994). De igual manera, se estima que la relación planta-insecto-hongo es tan antigua como la de planta-insecto. La coevolución que han tenido insecto y hongos ha sido tan estrecha y antigua que los escarabajos han desarrollado estructuras portadoras de esporas y/o micelio de los hongos que se llaman micangios. Estas estructuras pueden tener forma de sacos, cavidades o poros en las partes esclerotizadas de la cabeza, tórax y los élitros. Las células de los micangios secretan sustancias grasosas y cerosas que aparentemente ayudan a las esporas para una mejor adhesión, desecación y/o germinación prematura (Sánchez, 1994; Six y Klepzig, 2004).
Los hongos Ophiostomatoides, entre otros, causan el manchado azul de la madera. En fitopatología forestal se llama manchado azul, en la albura de la madera, a la presencia de una coloración azul, azul oscuro a gris oscura ocasionada por diferentes especies de hongos. Aunque normalmente los hongos manchadores no causan destrucción de la madera, ésta sí puede perder entre un 10 a 50% de su precio por la pérdida de la calidad por estar manchada (Gibbs, 1999; Marmolejo, 1991; Sánchez, 2004). Las especies de Ophiostoma tienen diferentes rasgos morfológicos y han sido encontrados en muchos sitios ecológicos. A este grupo de hongos, desde que fueron descubiertos, se les ha clasificado de muchas formas. Recientemente, Zipfel, De Beer, Jacobs, Wingfield y Wingfield (2006), utilizaron datos de secuencias de ADN parcialmente combinados con LSU nucleares y genes β-tubulina para conocer las relaciones filogenéticas de 50 especies de Ophiostoma, mismas que representan todos los grupos morfológicos mayores en este género. Ellos encontraron que hay 3 líneas monofiléticas bien soportadas en Ophiostoma. Las especies que tienen el anomorfo Leptographium fueron agrupadas en el género teleomorfo Grosmannia. Otra línea incluye a especies que son sensibles a la cycloheximida, que tienen cuellos periteciales cortos y ascosporas falcadas, siendo su anomorfo Hyalorhinocladiella. Para estas últimas especies se asignó el género Ceratocystiopsis. Un tercer grupo de especies con los anomorfos Sporothrix y Pesotum son asignadas al género-teleomorfo Ophiostoma.
En México se han realizado varios trabajos de investigación sobre las especies de hongos Ophiostomatoides en el género Pinus sp. Al respecto, Marmolejo (1989) identificó a Ophiostoma conicolum asociado a P. cembroides y transmitido por el insecto Conophthorus cembroides. Marmolejo (1990) investigó los hongos que manchan la madera aserrada de 8 distintas especies de árboles en los bosques de Nuevo León. Él aisló y describió 25 especies de hongos encontrando que Ophiostoma piliferum fue el hongo más frecuente e importante de la madera aserrada. Con menos frecuencia identificó a O. ips, O. minus, O. piceae y O. pluriannulatum.
Marmolejo y Butin (1990) documentaron la presencia de nuevas especies de hongos Ophiostomatoides en México. Describieron la presencia de Ophiostoma abietinum en Abies vejari atacadas por Pseudohylesinus; también a O. conicolum en conos de P. cembroides infestados con C. cembroides y aCeratocystiopsis collifera obtenido de corteza de P. teocote atacado por Dendroctonus valens. En otro trabajo, Marmolejo y Garza (1993) documentaron la presencia de O. minus aislado a partir de Pinus arizonica y de O. piliferum a partir de P. hartwegii. Zhou, De Beer, Cibrián, Wingfield y Wingfield (2004) encontraron 6 especies de hongos Ophiostomatoides relacionados a D. mexicanus afectando a Pinus pseudostrobus. Estas especies fueron Ceratocystiopsis minuta, una especie similar a Ophiostoma galeiformis que finalmente identificaron como O. pluriannulatum, una especie de Hyalorhinocladiella y 2 de Sporothrix. Tres especies de hongos Ophiostomatoides fueron relacionadas a Ips calligraphus afectando a Pinus maximinoi. Estas especies fueron O. pluriannulatum, una especie de Sporothrix y una de Hyalorhinocladiella. Recientemente, Pérez et al. (2009) identificaron la presencia de O. ips y su anamorfo Graphilbum sp., en las galerías que realiza el insecto descortezador D. adjunctus en el “pino de las alturas“ (Pinus hartwegii Lindl) en el estado de Puebla. La identificación la realizaron morfológicamente y aplicando la técnica de PCR. Es importante conocer los hongos Ophiosomatoides que causan el manchado de la madera de los pinos en la sierra Fría de Aguascalientes, ya que esto nos permitirá un mejor manejo de los hongos. Con ello se podrá evitar, principalmente, la pérdida, hasta un 50% de su valor, de calidad de la madera por el manchado que ocasionan los hongos. El objetivo de este trabajo fue el de identificar a los hongos Ophiostomatoides causantes del manchado de la madera de los pinos en la sierra Fría de Aguascalientes.
Materiales y métodosEn este trabajo, se realizaron 13 viajes de estudio a diferentes localidades de la sierra Fría de Aguascalientes, mismos que fueron referenciados geográficamente (tabla 1). Se tomaron muestras de madera de pinos con síntomas de daños por D. mexicanus y con la mancha azul causada por hongos. Las muestras fueron trasladadas al laboratorio del Departamento de Microbiología, Centro de Ciencias Básicas de la Universidad Autónoma de Aguascalientes, para su análisis.
Ophiostomatoides causantes del manchado azul en 2 especies de Pinus en la sierra Fría de Aguascalientes, México.
| Localidad | Fecha dd-mm-año | Latitud | Longitud | Árboles de Pinus sp. muestreados | Fitopatógeno identificado |
|---|---|---|---|---|---|
| 1. Laguna Seca, San José de Gracia, Ags. | 09-02-12 | 22°11’01“ | 102°38’28“ | 2 Pinus teocote | Ninguno |
| 2.1. Laguna Seca, San José de Gracia, Ags. | 01-03-12 | 22°11’01“ | 102°38’28“ | 1 P. teocote | Ophiostoma sp. |
| 2 P. teocote | Leptographium sp. | ||||
| 2.2. Rancho El Huapango, San José de Gracia, Ags. | 01-03-12 | 22°11’44“ | 102°38’07“ | 2 P. tecote | Leptographium sp. |
| 1 P. leiophylla | Leptographium sp. | ||||
| 3. Cruce de los caminos a Mesa El Águila y El Aserradero, San José de Gracia, Ags. | 22-03-12 | 22°11’37“ | 102°35’34“ | 1P. leiophylla | Ophiostoma sp. |
| 1 P. leiophylla | Leptographium sp. | ||||
| 4. La Sauda, Jesús María, Ags. | 04-04-12 | 21°58’30“ | 102°32’0.4“ | 1 P. teocote | Ophiostoma spp |
| 1 P. teocote | No | ||||
| 5. Barranca de Juan Francisco, San José de Gracia, Ags. | 02-05-12 | 22°11’32“ | 102°35’43“ | 1 P. leiophylla | No |
| 2 P. leiophylla | Leptographium sp. | ||||
| 6. Cruce de los caminos a Mesa El Águila y El Aserradero, San José de Gracia, Ags. | 14-08-12 | 22°11’37“ | 102°35’34“ | 2 P. leiophylla | Leptographium sp. |
| 7. Barranca de Juan Francisco, San José de Gracia, Ags. | 19-09-12 | 22°11’32“ | 102°35’43“ | 1 P. leiophylla | Hyalorhincladiella sp. |
| 1 P. leiophylla | Leptographium sp. | ||||
| 1 P. teocote | Leptographium sp. y Sporothrix sp. | ||||
| 8.1. Laguna Seca, San José de Gracia, Ags. | 02-10-12 | 22°11’01“ | 102°38’28“ | 1 P. teocote | Ophiostoma sp. |
| O. pluriannulatuum | |||||
| 8.2. El Huapango, San José de Gracia, Ags. | 02-10-12 | 22°11’44“ | 102°38’07“ | 1 P. leiophylla | Ophiostoma sp. |
| 9. El Huapango, San José de Gracia, Ags. | 19-10-12 | 22°11’44“ | 102°38’07“ | 1 P. leiophylla | Ophiostoma sp. |
| 1 P. leiophylla | O. pulvinisporum | ||||
| C. fasciata | |||||
| 10. El Huapango, San José de Gracia, Ags. | 13-11-12 | 22°11’44“ | 102°38’07“ | 1 P. teocote | Ophiostoma sp. |
| 1 P. teocote | Ophiostoma sp. | ||||
| Leptographium sp. | |||||
| 1 P. teocote | Ophiostoma sp. | ||||
| O. pluriannulatuum | |||||
| Leptographium | |||||
| 11. 2km al O de Laguna Seca, San José de Gracia, Ags. | 11-04-13 | 22°10’24“ | 102°39’16“ | 2 P. teocote | Ophiostoma sp. |
| 12. 2km al O de Laguna seca, San José de Gracia, Ags. | 18-04-13 | 22°10’24“ | 102°39’16“ | 2 P. teocote | Ophiostoma sp. |
| O. pluriannulatuum | |||||
| C. fasciata | |||||
| 13. El Huapango, San José de Gracia, Ags. | 16-05-13 | 22°11’44“ | 102°38’07“ | 2 P. teocote | Ophiostoma sp. |
| O. pluriannulatuum | |||||
| Leptographium sp. |
Aislamiento de los hongos. Se cortaron secciones de madera, de 2×2 mm, a partir del límite del avance del manchado. Las secciones se desinfectaron en hipoclorito de sodio al 1% durante 1 min y luego fueron enjuagadas 2 veces en agua destilada estéril, secadas en papel estéril y sembradas (4 a 5 secciones) en cajas Petri con extracto de malta agar (EMA: 20 g de extracto de malta, 20 g de agar y 1,000 ml de agua destilada) al que se le añadió 400 mg/l de estreptomicina o de cloranfenicol. Los cultivos se incubaron a 22 °C por 2 a 3 semanas (Agrios, 2005). Posteriormente, los hongos fueron purificados, transfiriendo puntas de hifa a tubos con EMA y se preservaron en refrigeración a 5 °C y en aceite mineral. Los hongos aislados también se cultivaron en EMA, al que se le adicionó 400 mg/l de cycloheximida para observar si se desarrollaban o no, lo que por sí mismo es una prueba para diferenciar los géneros de hongos Ophiostomatoides (Harrington, 1981). Además, se realizó la inducción de la formación de anomorfos y teleomorfos de los hongos colocando las muestras de madera (10×10×2 cm) en cámaras de humedad, por 1 a 8 semanas, en condiciones de oscuridad, con luz negra cercana a la luz ultravioleta (Jacobs y Wingfield, 2001; Pérez, 2009; Zhou, 2002). Después de la inducción de las estructuras fúngicas se realizó el aislamiento directo de los hongos. Las muestras se observaron con la ayuda de un microscopio estereoscópico, luego, usando una aguja de insulina estéril se tomó una masa de esporas acumuladas en las puntas de los peritecios y de los conidióforos y se transfirieron a EMA. Los cultivos se incubaron a 25 °C, en oscuridad y se purificaron transfiriendo puntas de hifas al medio de cultivo EMA sin antibióticos (Jacobs y Wingfield, 2001; Zhou, 2002).
Identificación de los hongos mediante estudios morfométricosPara los anomorfos de los hongos Ophiostomatoides se realizaron preparaciones de microcultivos, con la finalidad de observar cómo son formados los conidióforos y conidios. Además, se realizaron preparaciones de anomorfos y teleomorfos, estructuras asexuales y sexuales, colocándolas entre porta y cubreobjetos con azul de algodón lactofenol y se midieron con una reglilla micrométrica colocada en el ocular de un microscopio compuesto Carl Zeiss. Se realizó la medición de 50 conidióforos, conidios, peritecios y ascosporas. Se obtuvo el promedio y los rangos de variación de cada una de las mediciones de las estructuras fungosas. Para la identificación se utilizó la bibliografía especializada en este grupo taxonómico (Barnet y Hunter, 1999; Cibrián, Alvarado y García, 2007; esmp Hunt, 1956; Jacobs y Wingfield, 2001; Upadhyay, 1981; Wingfield, Seifert y Webber, 1993; Zhou, 2002; Zhou et al., 2004; Zipfel et al., 2006).
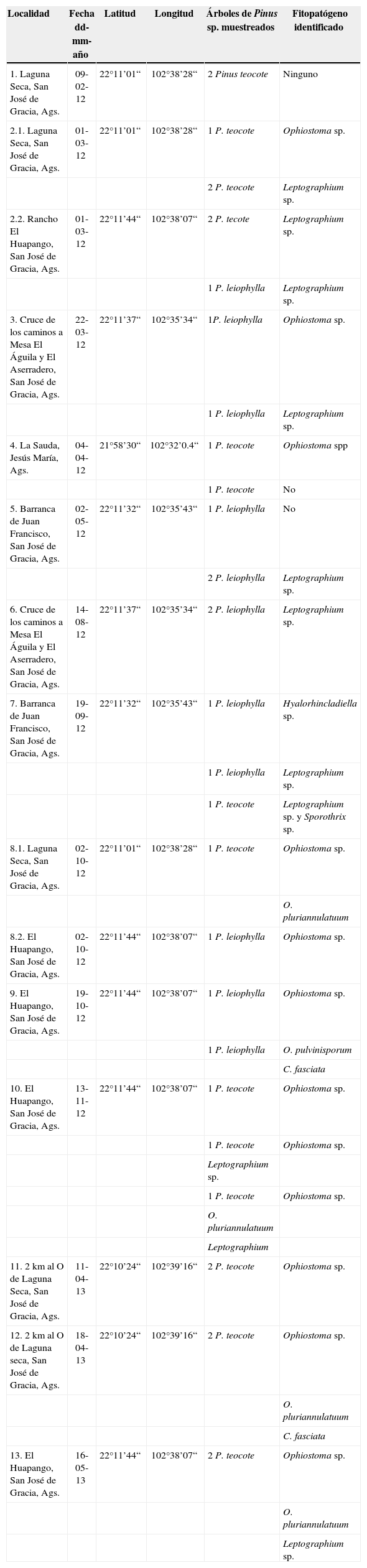
ResultadosSíntomas que causan D. mexicanus y los hongos OphiostomatoidesLos árboles de pino dañados por D. mexicanus y hongos Ophiostomatoides presentan las hojas de color verde si el ataque de los insectos descortezadores es inicial; de color amarillo, cuando el ataque ya es avanzado; y de color rojizo cuando el árbol ya está muerto (fig. 1A). En el tallo de los árboles se observan claramente los daños que causan los insectos, ya que por los orificios de entrada escurre resina (fig. 1B). Al quitar la corteza del tallo se pueden observar las galerías (figs. 1C, D) de los insectos y el manchado de la madera causado por los hongos Ophiostomatoides (figs. 1E, F). El crecimiento, desarrollo y pudrición que causa el hongo se incrementa conforme pasan las semanas. La acción de insectos y la invasión de haces vasculares por parte de los hongos bloquea el paso de los nutrientes de xilema y floema, lo que ocasiona que el árbol se marchite y muera en 3 a 4 meses después de la colonización del árbol por los insectos. Los hongos Ophiostomatoides son organismos parásitos facultativos, lo cual les permite seguir desarrollándose y creciendo, a pesar de que el árbol ya esté muerto. Inclusive, el crecimiento del hongo puede continuar si la madera es industrializada (Cibrián et al., 2007).
Pinos dañados por Dendroctonus mexicanus y hongos Ophiostomatoides. A, árboles de Pinus leiophilla muertos; B, tronco de P. teocote con la resinación típica que causa D. mexicanus (flechas); C, corteza de P. leiophilla con galerías de D. mexicanus; D, galería con 3 insectos adultos; E, tronco de Pinus leiophylla, sin corteza, en la que se observa el manchado de la madera; F, sección transversal de un tronco mostrando el manchado de la madera en forma radial.
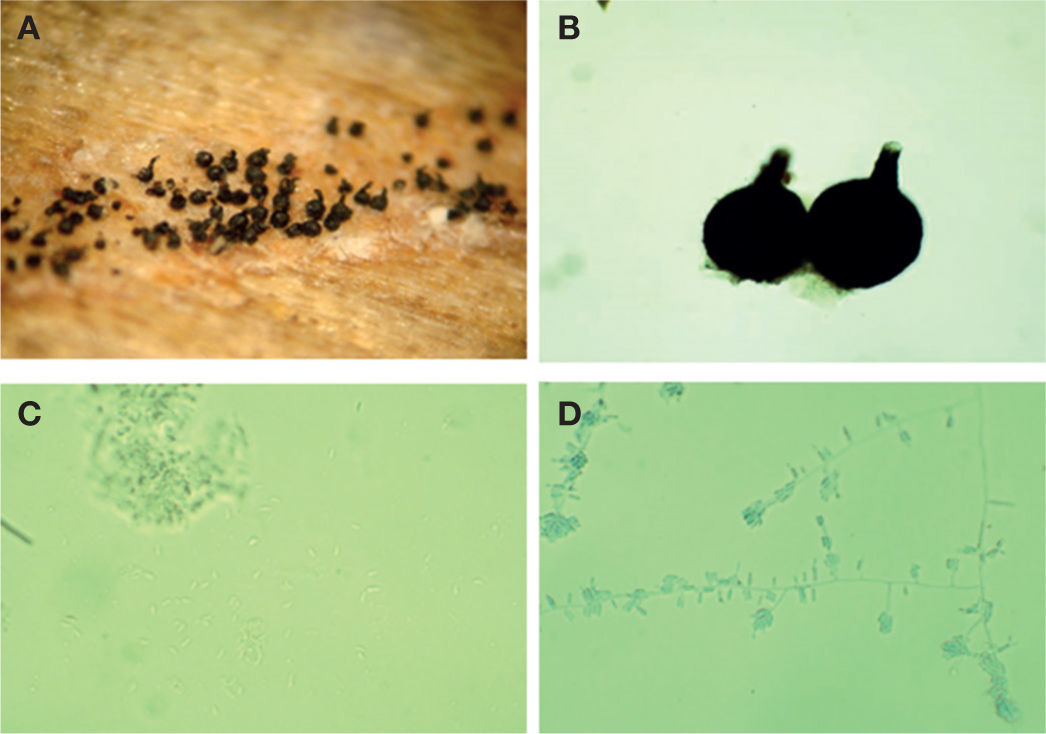
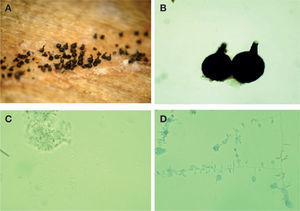
Este hongo forma peritecios oscuros (figs. 2A, B) con base bulbosa lisa con un diámetro de 160-290 μ (×= 209 μm) y una longitud del peritecio de 230-380 μm (×= 289 μm). El cuello mide de 40-110 (×= 77) μm × 30-50 μm (×= 38 μm). Las ascas son evanescentes y las ascosporas son unicelulares, hialinas, de 2.5-7.5 (×= 4.7 μm) de longitud y de forma alantoide (fig. 2C). A partir de cultivos monoascospóricos se aisló a su fase asexual Sporothrix sp. (fig. 2D). Este hongo se desarrolló bien en EMA más Cicloheximida y formó colonias de color blanquecino, de 8 cm de diámetro a las 4 semanas de desarrollo. El reverso de las cajas de Petri el color del micelio es hialino. Sporothrix forma conidióforos simples, unicelulares o septados, hialinos, formando un grupo de conidios en el ápice. Los conidios son hialinos, unicelulares, globosos a ovoides, formados en dentículos cortos y prominentes. Todas estas características concuerdan con las del género Ophiostoma sp. (Cibrián et al., 2007; Upadhyay, 1981; Wingfield et al., 1993; Zipfel et al., 2006).
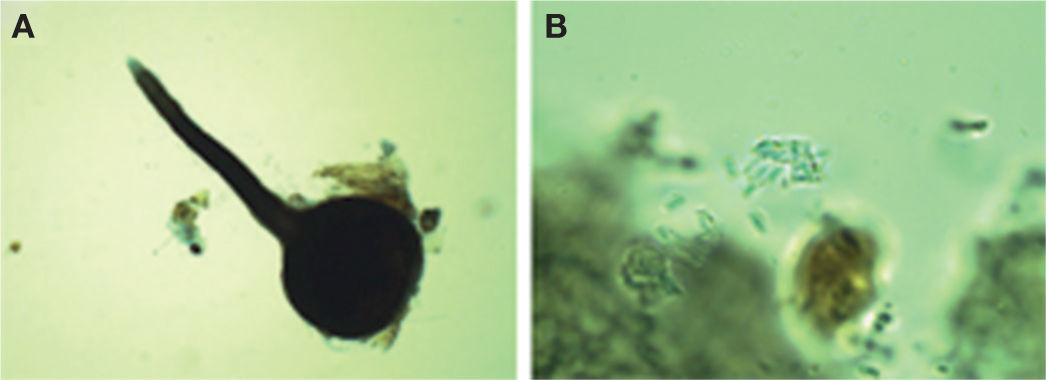
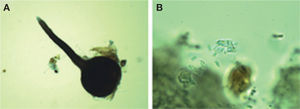
Ophiostoma pulvinisporum (X. D. Zhou y M. J. Wingfield)Este hongo forma peritecios oscuros (figs. 3A, B) con base bulbosa lisa con un diámetro de 200-360 μm (×= 286 μm) y una longitud total del peritecio de 600-1000 (×= 703 μm). Los cuellos miden de 270-510 (×= 408 μm) × 5-8 μ (×= 7 μm). Las ascosporas son en forma de cojín o almohada, unicelulares y miden 4.0-6.5 μm (×= 5.0 μm) × 2.0-3.0 μm (×= 2.6 μm). Las descripciones anteriores concuerdan con O. pulvinisporum descrito por Zhou et al. (2004).
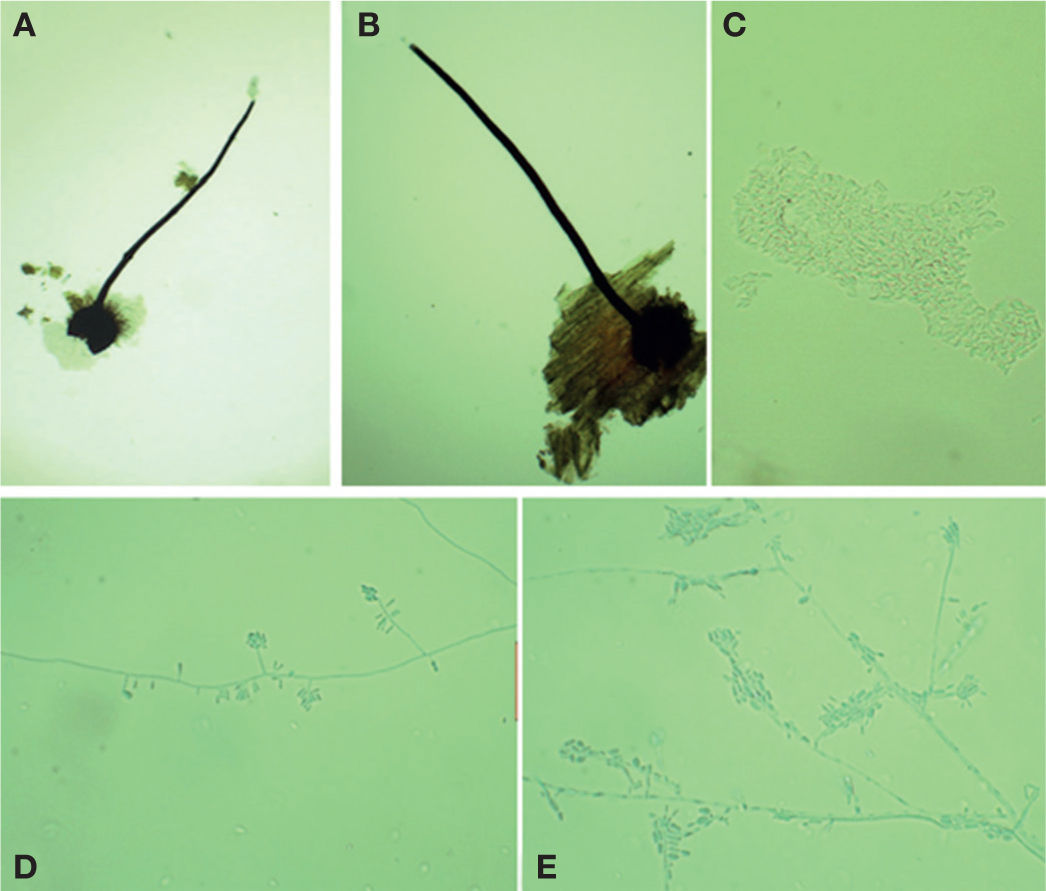
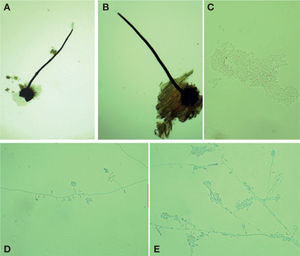
Ophiostoma pluriannulatum (Hedgc.) Syd. y P. Syd.Este hongo forma peritecios oscuros (figs. 4A, B) con base bulbosa lisa con un diámetro de 100-200 μm (×= 151 μm) y una longitud total del peritecio de 560-1150 μm (×= 906 μm). El cuello mide de 400-970 (×= 771 μm) × 20-30 μ (×= 30 μm). Las hifas ostiolares son hialinas, septadas, de 22-63×1.5-2 μm; las ascas son evanescentes y las ascosporas son unicelulares, hialinas, de 3-5 μm (×= 4) x 0.8-1 μm (×= 0.9 μm) y de forma alantoide (fig. 4C). A partir de un cultivo de ascospora simple se aisló la fase asexual Hyalodendron sp. (figs. 4C, D). En EMA a 27 °C, este hongo forma colonias que crecen 45 mm de diámetro en 10 días, son lanosas, blanquecinas. El reverso de la caja de Petri es color hialino. El micelio superficial está compuesto por hifas hialinas, de paredes delgadas de 1-2.5 μm de diámetro. Los conidióforos son hialinos, no ramificados, de 22-58×2-4 μm. Los conidios son producidos en dentículos hialinos, unicelulares, elipsoides a claviformes, algunas veces curvos, de 4-11×1-3 μm. Esta especie se caracteriza por presentar proliferación, anillos múltiples, en sus cuellos (fig. 4A). Las descripciones anteriores concuerdan con las descritas para O. pluriannulatum por varios investigadores (Cibrián et al., 2007; Upadhyay, 1981; Wingfield et al., 1993; Zipfel et al., 2006).
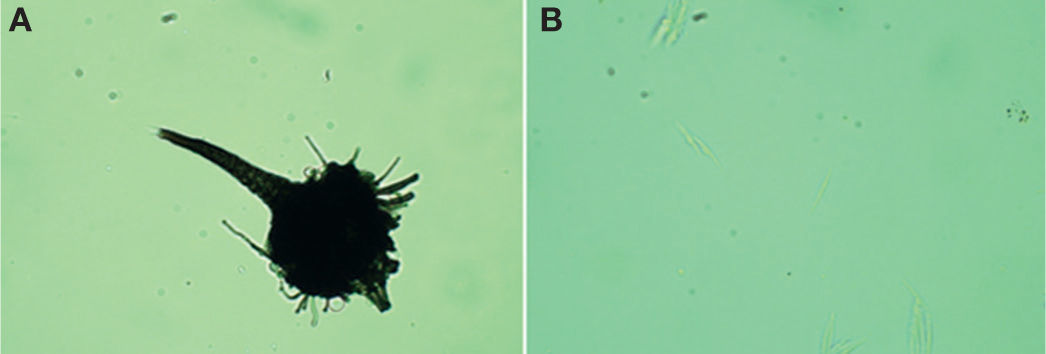
Ceratocystiopsis fasciata (Olchow. y J. Reid) H. P. UpadhyayEste hongo se caracteriza por formar ascocarpos hialinos a negros, los peritecios con base globosa a subglobosa. Los cuellos son relativamente cortos que se estrechan hacia el ápice. Los ápices tienen hifas ostiolares convergentes, cónicamente arregladas o algunas veces divergentes. Las ascas tienen 8 ascosporas, son evanescentes, fusiformes, clavadas o raramente subglobosas, hialinas. Las ascosporas son hialinas, aseptadas, elongadas, falcadas, rodeadas por una vaina gelatinosa hialina. Los conidios son holoblásticos o enteroblásticos. Todas estas características concuerdan con Ceratocystiopsis (Cibrián et al., 2007; Upadhyay, 1981; Wingfield et al., 1993; Zipfel et al., 2006). Además, los peritecios son oscuros (fig. 5A) con el cuerpo principal ornamentado con hifas no diferenciadas, con un diámetro de 50-117 μm (×= 67 μm) y una longitud total del peritecio de 105-152 μm (×= 106 μm). El cuello mide de 25-82 (×= 42 μm) × 10-17 μm (×= 11 μm). Las hifas que forman el cuello le dan una apariencia como si tuviera bandas. Las ascas son evanescentes y las ascosporas son unicelulares, hialinas, de 9.5-14×1-1.5 μm de longitud y de forma falcada (fig. 5B). Los cuellos son fasciados, se estrechan y truncan hacia su ápice. Las hifas ostiolares miden 3-6.5 μm de longitud, estas características concuerdan para C. fasciata documentado por varios autores (Cibrián et al., 2007; Upadhyay, 1981; Wingfield et al., 1993; Zipfel et al., 2006).
Leptographium sp.Cuando crece en madera este hongo forma conidióforos rectos, que dan lugar a una o más series de ramas (metulae) que terminan en células conidiogénicas que forman cabezas en forma de brocha, con la parte inferior oscura y las ramas superiores hialinas (figs. 6A, B, C). Las células conidiogénicas producen conidios unicelulares hialinas o finamente pigmentadas, formadas enteroblásticamente y con proliferación holobalística. Los conidios se acumulan formando una masa mucilaginosa en el ápice de los conidióforos, por lo cual son fácilmente transportados por insectos vectores. La descripción anteriormente señalada es consistente con las hechas para el género Leptographium por otros autores (Barnet y Hunter, 1999; Cibrián et al., 2007; Jacobs y Wingfield, 2001).
Localidades visitadas, coordenadas y fitopatógenos identificadosLas salidas de campo a diferentes localidades de la sierra Fría, fechas, coordenadas, especies de pino de las que se tomaron muestras de madera y los hongos Ophiostomatoides aislados e identificados en este estudio, se observan en la tabla 1. En esta tabla podemos apreciar que se realizaron 13 salidas de campo, se tomaron muestras de 20 árboles de P. teocote y 13 de P. leiophilla. En la primera localidad, Laguna Seca, no se logró inducir la esporulación ni se aisló ninguno de ellos. En el resto de las localidades visitadas se identificó a Ophiostoma sp., O. pulvinisporum, O. pluriannulatum, C. fasciata y a las fases asexuales Sporothrix sp. y Leptographium sp., Ophiostoma sp. y Leptographium sp. fueron los hongos Ophiostomatoides que se encontraron con mayor frecuencia. Para el estado de Aguascalientes, ésta es la primera vez que se registran a los hongos Ophiostomatoides afectando a pinos.
DiscusiónRespecto a Ophiostoma sp., a este hongo fitopatógeno lo encontramos en las muestras de P. teocote y P. leiophilla, en 7 de las 9 localidades de la sierra Fría visitadas (tabla 1). Después de haberlo sometido a las claves disponibles, no se encontraron coincidencias con ninguna de las especies descritas hasta el momento. Por esta última razón, una cepa de este hongo fue enviada al Dr. Pedro W. Crous (KNAW-CBS Fungal Biodiversity Centre, Utrecht, Holanda) para su identificación molecular. La patogenicidad de las especie de Ophiostoma ha sido confirmada en diferentes árboles forestales tanto por investigadores extranjeros como por mexicanos (Christiansen, Waring y Berryman, 1987; Kim, Plattner, Lim y Breuil, 2008; Pérez, 2009; Pérez, Alvarado, Cibrián, Equihua y Cárdenas, 2011; Yamaoka, Hiratsuka y Maruyama, 1995). Algunas especies de Ophiostoma son muy importantes como fitopatógenos. Uno de los ejemplos extremos es O. ulmi que causa la bien conocida enfermedad del olmo holandés, el cual ha matado a miles de árboles en Norteamérica y Europa (Agrios, 2005; Zhou, 2002). En el presente estudio, este hongo, al igual que Leptographium sp. se encontró en 13 de los 33 árboles muestreados, siendo los más frecuentes en incidencia (tabla 1).
Ophiostoma pulvinisporum no se pudo aislar en su fase asexual porque solo fue encontrado en las muestras de madera de P. leiophylla en la localidad conocida como El Huapango, San José de Gracia, Aguascalientes. Sin embargo, Zhou et al. (2004) señalan que esta especie tiene 3 fases de anomorfos que corresponden a los géneros Hyalorhinocladiella, Pesotum y Leptographium. Ellos describieron como una nueva especie a O. pulvinisporum, señalando que es la especie que comúnmente se ha descrito como Ophiostoma ips en México y que O. ips es de latitudes más altas. Estos autores aislaron a este hongo a partir de D. mexicanus e Ips calligraphus, encontrados en P. pseudostrobus y P. maximinoi, respectivamente, en Chiapas. Además, señalan que O. pulvinisporum es morfológicamente similar a O. adjuncti, O. ips y a O. montium. Ophiostoma pulvinisporum y O. ips pueden ser distinguidos de las otras especies basado en sus diferentes grados de crecimiento y secuencias de ITS rDNA. Ophiostoma pulvinisporum se desarrolla de forma óptima a 30 °C, mientras que O. ips a 25 °C y O. adjuncti a 20 °C. Por otra parte, Kim et al. (2008) documentaron que O. montium no es capaz de crecer a 35 °C, mientras que O. pulvinisporum y O. ips crecen bien a esa temperatura. Además, ellos encontraron que O. pulvinisporum es heterotálico, mientras que O. ips es homotálico. En el presente estudio, este hongo solo fue encontrado en las muestras de un árbol de P. leiophylla (tabla 1).
Ophiostoma pluriannulatum fue encontrado en las muestras de madera de P. teocote, en las localidades de laguna Seca y El Huapango, San José de Gracia, Aguascalientes y fue encontrado en las muestras de 3 árboles de 29 estudiados (tabla 1). Esta especie ya se encuentra registrada para México por Marmolejo y Garza (1993), quienes la encontraron presente en Quercus affinis y en P. pseudostrobus en Nuevo León. También, fue documentada por Zhou et al. (2004) asociada a D. mexicanus e I. calligraphus en P. maximinoi en Chiapas. Ophiostoma pluriannulatum fue descrito por primera vez por Hedgcock, en 1906, quien lo aisló de Quercus borealis en Estados Unidos de América. Este hongo causa manchado azul de la madera de árboles de madera dura y se encuentra asociado a muchos insectos en el Hemisferio Norte, incluyendo a México, como ya se señaló. En el Hemisferio Sur este hongo ha sido encontrado en Nueva Zelanda y Sudáfrica (Zhou et al., 2004).
Ceratocystiopsis fasciata tampoco pudo ser aislado en medios de cultivo, a pesar de realizar muchos intentos utilizando diversas técnicas de aislamiento, directo y a partir del límite de avance de las lesiones, y los medios de cultivo: EMA, papa dextrosa agar, harina de maíz agar y agar con ramitas de pino; recomendados por los especialistas en este grupo (Jacobs y Wingfield, 2001; Upadhyay, 1981; Zhou, 2002). Sin embargo, Upadhyay (1981) señala que esta especie se caracteriza por formar colonias de 35-40 mm de diámetro en EMA, a 27 °C, floculosas, blanquecinas. Los conidióforos son macronematosos, simples o verticiladamente ramificados, septados, hialinos. Los conidios están arreglados formando cabezuelas mucilaginosas, holobalísticos, son hialinos, unicelulares, cilíndricos a elipsoidales clavados a obovados de 2-5×1-2 μm. Esta fase anomórfica corresponde al género Hyalorhinocladiella (Upadhyay, 1981). En México esta especie ha sido descrita por Marmolejo (1989) y Marmolejo y Garza (1993) en P. pseudostrobus afectados por D. mexicanus, en bosques de Nuevo León. En el presente estudio, este hongo se encontró solo en 3 (2 P. teocote y 1 P. leiophylla) de los 33 árboles muestreados (tabla 1).
Respecto a Leptographium sp., se ha confirmado que este hongo tiene como teleomorfo al género Ophiostoma. Recientemente, Zipfel et al. (2006) propusieron que las especies que tienen como anomorfo a Leptographium sean incluidas en el género (teleomorfo) Grosmannia. Este hongo tiene resistencia al antibiótico cicloheximida y presenta celulosa, ramnosa y quitina en su pared celular. Al igual que otros hongos Ophiostomatoides, este género tiene muchas especies que causa manchado azul de la madera y enfermedades importantes tanto en árboles forestales como en otras plantas (Jacobs y Wingfield, 2001). Leptographium ha sido registrado como causante de manchado de la madera en pinos de Michoacán (Sánchez y Gallegos, 1988). En el Estado de México, en la Estación Forestal Experimental Zoquiapan de la UACh, se identificó a Leptographium guttulatum (Pérez et al., 2011) presente en Pinus hartwegii. En este estudio, Leptographium fue, al igual que Ophiostoma sp., el género más frecuentemente encontrado en las muestras de madera de pinos (tabla 1).
A la Universidad Autónoma de Aguascalientes por el apoyo otorgado a este trabajo, mediante el proyecto PIB12-1. A la Asociación Sierra Fría de Aguascalientes, A. C., por permitirnos el acceso y toma de muestras en las diferentes propiedades que tienen sus asociados. A la Secretaría de Medio Ambiente del Estado de Aguascalientes por las facilidades otorgadas para la realización de este trabajo. Al Sr. Francisco Juárez Reyes, guardabosques de la Secretaría de Medio Ambiente del Estado de Aguascalientes, por su apoyo, interés y entusiasmo demostrados durante el trabajo de campo.