Las poblaciones de Chirostoma humboldtianum habitan en ambientes lénticos a lo largo de la cuenca del río Lerma-Santiago, desde el Estado de México hasta Nayarit. El objetivo de este estudio fue describir y analizar mediante morfometría geométrica la figura de 6 poblaciones de esta especie aisladas geográficamente (n=147). La figura mostró diferencias significativas (p<0.001) entre las poblaciones analizadas; la altura del cuerpo y la cercanía o separación de las aletas dorsales fueron las variables de mayor peso en la diferenciación. Se observó que las poblaciones de San Pedro Lagunillas (Nayarit) y Tepuxtepec (Michoacán) fueron las más divergentes, mientras que las de Tiacaque (Edo. de México) y Zacapu (Michoacán) fueron las más semejantes. Adicionalmente, se observa la existencia de un gradiente de este a oeste en el tamaño centroide. Las diferencias morfológicas y el tamaño centroide de los organismos resultaron estar relacionados con la altitud de cada localidad. Así, las variaciones morfológicas de las poblaciones de C. humboldtianum sugieren la presencia de al menos 5 morfotipos o fenotipos derivados del aislamiento geográfico desde su diversificación hace al menos 0.52 millones de años. Este trabajo aporta nueva información sobre la variación morfológica dentro de poblaciones de C. humboldtianum, lo cual puede explicar en parte la diversificación de este género en México.
Populations of Chirostoma humboldtianum inhabit lentic environments along the Lerma-Santiago River basin, from the State of Mexico to Nayarit. The objective of the present study was to describe and analyze with geometric morphometric, the shape of 6 geographically isolated populations of this species (n=147). The shape showed significant differences (p<.001) among the studied populations; the body height and proximity or separation of dorsal fins are the most important variables in this differentiation. Likewise, it was observed that populations from San Pedro Lagunillas and Tepuxtepec were the most divergent, while those from Tiacaque and Zacapu were the most similar. In addition, the existence of an east-west gradient in centroid size is observed. Morphological differences and the size of the centroid of the organisms are related to the altitude of each site. Thus, morphological variations of the populations of C. humboldtianum suggest the presence of at least 5 morphotypes or phenotypes derived from geographic isolation from its diversification at least 0.52 million of years ago. This work provides new information on the intra-population morphological variation of C. humboldtianum, which may explain in part the diversification of this genus in Mexico.
El género Chirostoma, perteneciente a la familia Atherinopsidae (Dyer y Chernoff, 1996; Dyer, 2006; Nelson, Grande y Wilson, 2016), es endémico de la Mesa Central de México y está conformado por 18 especies y 6 subespecies (Barbour, 1973a; Echelle y Echelle, 1984), algunas de ellas dentro de la lista de especies amenazadas (Semarnat, 2010). La reducción y la fragmentación de su hábitat, así como otras afectaciones antropogénicas reflejan una disminución en la longitud de los individuos y en el tamaño poblacional (Hernández-Rubio, Figueroa-Lucero, Barriga-Sosa, Arredondo-Figueroa y Castro-Barrera, 2006) incluso llegando a la extirpación poblacional de Chirostoma humboldtianum (Valenciennes, 1835) en la cuenca de México, en los canales de Xochimilco (Álvarez y Navarro, 1957). El pez blanco C. humboldtianum, conocido también como charal de Xochimilco, es una de las especies que conserva el patrón de distribución más antiguo (Barbour, 1973a) y habita en los sistemas lénticos desde el Estado de México hasta Nayarit, siendo su distribución actual discontinua a lo largo de la cuenca del Río Lerma-Santiago (Hernández-Rubio et al., 2006).
Los estudios del género Chirostoma son extensos particularmente en la evaluación de los caracteres merísticos y morfométricos tradicionales (Álvarez, 1950, 1970, 1972; Álvarez y Cortés, 1962; Barbour, 1973a; Barriga-Sosa, Eguiarte y Arredondo-Figueroa, 2004; Barriga-Sosa, Ibáñez-Aguirre y Arredondo-Figueroa, 2002; Soria-Barreto y Paulo-Maya, 2005). Sin embargo, los análisis morfológicos dirigidos a la determinación taxonómica son poco concluyentes debido al traslape de caracteres merísticos en algunas especies, impidiendo una identificación certera (Barbour, 1973a; Barbour y Chernoff, 1984; Barriga-Sosa, Pérez-Ramírez, Soto-Aguirre, Castillo-Rivera y Arredondo-Figueroa, 2005). Por lo anterior, se han analizado también caracteres genéticos y moleculares (Barriga-Sosa et al., 2004, 2005) con los cuales se corrobora la identidad taxonómica y las relaciones filogenéticas (Bloom, Weir, Piller y Lovejoy, 2013).
Sin embargo, los estudios sobre las diferencias fenotípicas entre poblaciones de C. humboldtianum que puedan presentarse por alopatría son incipientes. En este sentido, la morfometría geométrica (MG) ha sido una herramienta útil para evaluar las diferencias fenotípicas entre grupos o poblaciones, cuantificando la variación morfológica desde un punto de vista estadístico (Klingenberg, Barluenga y Meyer, 2002). El estudio de la forma sensu stricto distingue los datos de la forma que se obtienen al eliminar solo los efectos de rotación y traslación, de los datos de forma pura —en adelante figura— en donde además se contempla la eliminación del efecto del tamaño (Bookstein, 1986; Rohlf, 1990; Klingenberg et al., 2002; Zelditch, Swiderski, Sheets y Fink, 2004). Considerando que C. humboldtianum tiene una edad mínima de aparición de 0.520 millones de años (Bloom et al., 2013) y que se encuentra aislada en diferentes cuerpos de agua que presumiblemente mantenían una continuidad en el pasado (Barbour, 1973b), se establece la hipótesis de que actualmente sus poblaciones tienen diferencias morfológicas entre ellas. El objetivo fue analizar la figura corporal de C. humboldtianum mediante el uso de la MG y describir las diferencias fenotípicas existentes en 6 poblaciones aisladas geográficamente.
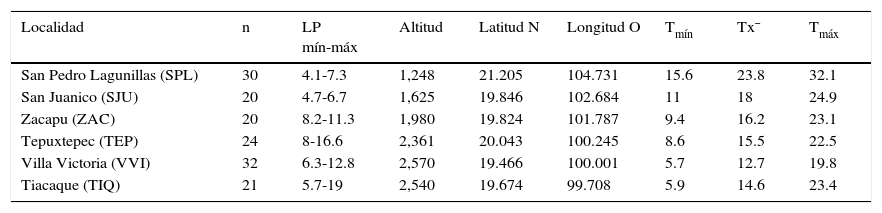
Materiales y métodosSe analizaron ejemplares adultos de C. humboldtianum de acuerdo con García-Martínez, Mejía-Guerrero, García-de León y Barriga-Sosa (2015) —los cuales fueron capturados con un chinchorro charalero de 0.5mm de luz y longitud 50m con 1.5m de caída; se procuró tener el mismo esfuerzo de captura en todos los casos— provenientes de 6 sistemas lénticos distribuidos discontinuamente a lo largo del sistema Lerma-Santiago: a) Tiacaque (TIQ) y Villa Victoria (VVI) en el Estado de México, dentro del curso del alto Lerma; b) Tepuxtepec (TEP), Zacapu (ZAC) y San Juanico (SJU) en Michoacán, en el curso del medio Lerma; c) San Pedro Lagunillas (SPL) en Nayarit, perteneciente al curso del bajo Lerma (fig. 1). Los ejemplares analizados para cada localidad se seleccionaron al azar de los lotes existentes y en cantidades proporcionales a su disponibilidad. La ubicación para cada localidad se definió con un geográfico central para cada sistema, expresando en grados con decimales. La temperatura media anual (° C) y la altitud de cada cuerpo de agua se obtuvieron de acuerdo con la Conagua (2015) (tabla 1).
Localidades de procedencia de los organismos analizados de Chirostoma humboldtianum: Tiacaque, Villa Victoria, Tepuxtepec, Zacapu, San Juanico y San Pedro Lagunillas (modificado de Barbour, 1973a).
Localidades, número de organismos analizados (n), longitud patrón mínima y máxima (LP mín-máx), altitud, latitud, longitud, temperatura mínima (Tmín), temperatura promedio (Tx¯) y temperatura máxima (Tmáx) de cada localidad.
| Localidad | n | LP mín-máx | Altitud | Latitud N | Longitud O | Tmín | Tx¯ | Tmáx |
|---|---|---|---|---|---|---|---|---|
| San Pedro Lagunillas (SPL) | 30 | 4.1-7.3 | 1,248 | 21.205 | 104.731 | 15.6 | 23.8 | 32.1 |
| San Juanico (SJU) | 20 | 4.7-6.7 | 1,625 | 19.846 | 102.684 | 11 | 18 | 24.9 |
| Zacapu (ZAC) | 20 | 8.2-11.3 | 1,980 | 19.824 | 101.787 | 9.4 | 16.2 | 23.1 |
| Tepuxtepec (TEP) | 24 | 8-16.6 | 2,361 | 20.043 | 100.245 | 8.6 | 15.5 | 22.5 |
| Villa Victoria (VVI) | 32 | 6.3-12.8 | 2,570 | 19.466 | 100.001 | 5.7 | 12.7 | 19.8 |
| Tiacaque (TIQ) | 21 | 5.7-19 | 2,540 | 19.674 | 99.708 | 5.9 | 14.6 | 23.4 |
Se tomaron fotografías digitales del lado izquierdo de cada pez con una cámara Canon RebelT3i (16 mpx). Se colocaron 10 marcas anatómicas y homólogas de referencia a lo largo del cuerpo de acuerdo con la configuración propuesta por O’Reilly y Horn (2004) y con el programa TPSdig (fig. 2) (Bookstein, 1986; Rohlf, 2003; Zelditch et al., 2004). Las coordenadas se alinearon usando el método generalizado de superposición de procrustes por mínimos cuadrados, procedimiento mediante el cual se elimina la información de tamaño, posición y rotación de las coordenadas (Rohlf, 1990; Rohlf y Slice, 1990). Las deformaciones parciales se obtuvieron con los programas de la serie Integrate Morphometrics Package (Sheets, 2004), con los cuales se uniformiza la figura de las 6 poblaciones para describir las diferencias en la figura por cada localidad (Zelditch et al., 2004).
Disposición de las marcas en los ejemplares de C. humboldtianum: 1, región distal del premaxilar; 2, término de la región cefálica en la parte dorsal; 3, inicio de la primera aleta dorsal; 4, inicio de la segunda aleta dorsal; 5, región media del pedúnculo caudal en la base de la aleta caudal; 6, inicio de la aleta anal; 7, inicio de la aleta ventral; 8, inicio de la aleta pectoral; 9, centro del ojo; 10, región distal del maxilar.
Se evaluó la significación estadística de las diferencias morfológicas entre las poblaciones con un análisis de variantes canónicas (AVC) y para describir las diferencias en la figura de cada población se obtuvieron las mallas de deformación con los vectores derivados de estos análisis. Posteriormente se realizaron comparaciones múltiples entre pares de localidades —usando todas las deformaciones parciales más los componentes uniformes— mediante la prueba de Hotelling con una corrección de Bonferroni. Para conocer el grado de similitud entre las poblaciones se utilizó la distancia de Mahalanobis (Mahalanobis, 1936). Se determinó la influencia del tamaño sobre la figura por medio de una regresión entre la figura y el logaritmo natural del tamaño centroide (LogTC) usando las distancias procrustes obtenidas a partir del programa Regress (Integrate Morphometrics Package) como descriptor univariado de la figura. Finalmente, por medio del análisis de correlación de Spearman se evaluó la probable asociación de los datos geográficos y de temperatura con los datos de figura, LogTC y de las variantes canónicas 1 y 2 (VC) derivadas del AVC. Se usó el programa STATISTICA 7 (Hilbe, 2012) para los análisis de correlación y el programa PAST (Hammer, Harper y Ryan, 2001) para la edición de los gráficos.
ResultadosLos resultados del AVC mostraron diferencias significativas entre las 6 poblaciones en los 5 ejes derivados (p's<0.001) y con valores de lambda de Wilks muy bajos para los 2 primeros ejes (λ1=0.0171, λ2=0.0814), los cuales mostraron una varianza acumulada del 75.01%. El morfoespacio entre estos 2 ejes (fig. 3) muestra que en la parte superior se segregan claramente de izquierda a derecha las localidades de SPL, SJU y TEP, las cuales son las más separadas entre sí. Por su parte, las poblaciones de ZAC, VVI y TIQ se mantienen en la parte inferior con menor separación entre sí.
En las mallas de deformación obtenidas a partir de los primeros 2 ejes del AVC (fig. 4) se muestran los cambios principales en la figura en las 6 poblaciones. Así, las mallas de deformación derivadas de estos 2 ejes muestran cómo el alto del cuerpo aumenta, que las aletas dorsales tienden a juntarse (VC1) o separarse (VC2) y que las aletas ventrales y anal se separan con una orientación hacia adelante; estos cambios se dan de acuerdo a un gradiente de variación de izquierda a derecha o de negativo a positivo para la VC1 (fig. 3), denotando que los organismos de SPL presentan la menor altura, con las aletas dorsales más separadas y con las aletas ventral y anal más juntas, mientras que los organismos de TEP presentan la mayor altura, con las aletas dorsales más juntas y con las aletas ventral y anal más separadas. En el resto de las localidades presentan cambios en menor magnitud y se mantienen dentro del espectro de variación de estas 2 poblaciones. También se observaron otras variaciones con menor grado de importancia asociadas a la región cefálica.
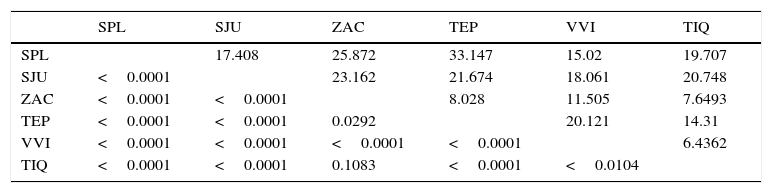
Las comparaciones pareadas por medio de la prueba de Hotelling mostraron diferencias significativas entre todas las localidades con excepción de ZAC y TIQ (tabla 2). En relación con la similitud de acuerdo con las distancias de Mahalanobis (Mahalanobis, 1936), se observó que en general SPL y SJU mostraron mayores diferencias con ZAC y TEP, mientras que las localidades con mayores similitudes fueron las de TIQ, VIV y ZAC (tabla 2). La regresión de la figura con respecto al logaritmo del tamaño centroide (LogTC) mostró una R2=0.078 (fig. 5), observándose además que los ejemplares de SPL son los más pequeños y los de TIQ son los de mayor tamaño, mientras que el resto de los organismos se distribuyen entre estas 2poblaciones.
Matriz de valores de significación (p-Bonferroni) de las comparaciones pareadas de acuerdo con la prueba de Hotelling (por abajo de la diagonal). Distancias de Mahalanobis entre cada una de las poblaciones (por arriba de la diagonal). Nomenclatura de las localidades de acuerdo con la tabla 1.
| SPL | SJU | ZAC | TEP | VVI | TIQ | |
|---|---|---|---|---|---|---|
| SPL | 17.408 | 25.872 | 33.147 | 15.02 | 19.707 | |
| SJU | <0.0001 | 23.162 | 21.674 | 18.061 | 20.748 | |
| ZAC | <0.0001 | <0.0001 | 8.028 | 11.505 | 7.6493 | |
| TEP | <0.0001 | <0.0001 | 0.0292 | 20.121 | 14.31 | |
| VVI | <0.0001 | <0.0001 | <0.0001 | <0.0001 | 6.4362 | |
| TIQ | <0.0001 | <0.0001 | 0.1083 | <0.0001 | <0.0104 |
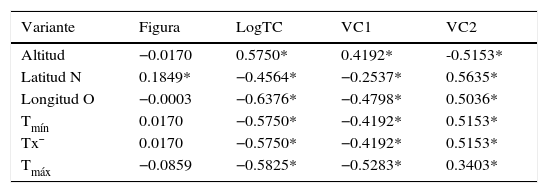
Los valores de las correlaciones de Spearman (tabla 3) mostraron asociaciones significativas entre las características relevantes de los sistemas y los 2 primeros ejes derivados del AVC y el LogTC. Sin embargo, la figura se correlacionó de manera importante y de forma positiva solo con el gradiente latitudinal. También es evidente que tanto la VC1 como el LogTC presentan una correlación positiva (0.5750) con la altitud, la VC2 también se correlaciona con la altitud aunque negativamente, denotando como la figura de las poblaciones presenta una alta correlación con la altitud en ambas VC.
Valores de correlación de Spearman de los datos de figura, LogTC, variable canónica 1 (VC1) y variable canónica 2 (VC2), con los datos de altitud, latitud, longitud y temperatura. Los valores significativos se señalan con asterisco (p<0.05).
| Variante | Figura | LogTC | VC1 | VC2 |
|---|---|---|---|---|
| Altitud | −0.0170 | 0.5750* | 0.4192* | -0.5153* |
| Latitud N | 0.1849* | −0.4564* | −0.2537* | 0.5635* |
| Longitud O | −0.0003 | −0.6376* | −0.4798* | 0.5036* |
| Tmín | 0.0170 | −0.5750* | −0.4192* | 0.5153* |
| Tx¯ | 0.0170 | −0.5750* | −0.4192* | 0.5153* |
| Tmáx | −0.0859 | −0.5825* | −0.5283* | 0.3403* |
La diversidad morfológica, de acuerdo con Foote (1997), es la estimación cuantitativa de la distribución empírica de los taxones en un espacio multidimensional o morfoespacio dentro de ejes que representan las medidas morfológicas. Bajo esta premisa, los datos morfológicos obtenidos a partir de la MG permiten evaluar las diferencias fenotípicas de distintos grupos o poblaciones incluso de una misma especie (Cavalcanti, Monteiro y Lopes, 1999; Collyer, Stockwell, Adams y Hildegard-Reiser, 2007; Elmer, Kusche, Lehtonen y Meyer, 2010; Kassam, Adams y Yamaoka, 2004; Kassam, Mizoiri y Yamaoka, 2004; Scott y Johnson, 2010; Trapani, 2003).
En el presente estudio, el AVC mostró que existen diferencias significativas entre los organismos de las 6 poblaciones analizadas. Lo anterior puede estar asociado con los altos valores de diversidad haplotípica y nucleotídica reportados para estas mismas poblaciones (García-Martínez et al., 2015).
De acuerdo con las mallas de deformación, las diferencias encontradas en la figura se relacionan con la variación en la altura de los peces, la distancia entre las aletas dorsales y la variación en la posición del aparato mandibular, siendo estas 3 características morfológicas las más importantes en la diferenciación de las poblaciones. Similarmente, las mallas de deformación de 4 poblaciones de Atherinops affinis de las costas del Pacífico (O’Reilly y Horn, 2004) mostraron que la región cefálica, el alto del cuerpo y las aletas dorsales y anal fueron las regiones corporales más importantes en el cambio de su figura.
Por otra parte, la variación cefálica presente en las mallas de deformación permite observar cambios sutiles en la región del premaxilar. Así, se ha observado que la plasticidad fenotípica en esta región en etapas tempranas del desarrollo de Odontesthes hatcheri puede ser inducida de manera mecánica (Crichigno, Battini y Cussac, 2012), por lo que es posible que dicha variación encontrada esté fuertemente asociada con aspectos alimentarios. La plasticidad observada en las diferencias corporales en distintas poblaciones de peces está relacionada con las variaciones en el hábitat y los hábitos alimentarios (Cavalcanti et al., 1999); en este sentido, dentro del género Chirostoma existe variación osteológica en la región mandibular asociada con una segregación trófica principalmente en poblaciones en simpatría (Soria-Barreto y Paulo-Maya, 2005).
También se ha documentado variación morfológica en 2 poblaciones de Chirostoma grandocule del lago de Pátzcuaro, Michoacán, basada en morfometría tradicional, donde se describe que la principal variación morfológica se encuentra en la posición de la segunda aleta dorsal, el pedúnculo caudal y la órbita del ojo, cambios asociados con diferencias en la alimentación, en la variación ambiental y en las diferencias geofisicogeográficas presentes en la parte norte y sur del lago (Barriga-Sosa et al., 2004).
De acuerdo con las comparaciones pareadas al usar la prueba de Hotelling, solo las localidades de Tiacaque y Zacapu no presentan diferencias significativas, resultado consistente con la asociación de estas localidades como un solo grupo y el resto de las localidades como grupos independientes.
En relación con las distancias de Mahalanobis, las poblaciones de Zacapu, Tiacaque y Villa Victoria son las más similares entre sí (y las más cercanas geográficamente), mientras que las mayores distancias las presentaron los organismos de Tepuxtepec con los de San Pedro Lagunillas y San Juanico (estas últimas relativamente similares entre sí). Tales distancias también concuerdan con el grado de alejamiento geográfico que existe entre estas localidades. El patrón de estas distancias presenta un comportamiento similar a los resultados de análisis moleculares encontrados por García-Martínez et al. (2015), donde las redes de haplotipos muestran que Tepuxtepec y San Pedro Lagunillas son las poblaciones más distantes y aunque las localidades comparten haplotipos, estos estudios permiten separarlos con valores estimados de diversificación de entre 2.62 y 0.72 MA.
El valor de R2 resultado de la regresión de la figura contra el LogTC refleja poca influencia en los cambios de la figura por la disminución de tamaño que se observa de este a oeste. Asimismo, se ve que la población de Tepuxtepec tiene amplia dispersión con respecto a los valores de figura, aspecto que la diferencia del resto de las poblaciones.
Es evidente que el tamaño centroide de los ejemplares de C. humboldtianum de la población de Tiacaque es muy grande en comparación con el de los organismos de San Pedro Lagunillas, mientras que el tamaño centroide del resto se dispersa dentro de estas 2 poblaciones. Este comportamiento parece presentar un gradiente que obedece a una dirección este a oeste, lo cual puede estar en relación a su vez con la altitud y consecuentemente con la temperatura de cada localidad. Este gradiente concuerda con la probable distribución del ancestro de C. humboldtianum que comienza en la cuenca de México y se dirige hacia el oeste en los estados de Jalisco y Nayarit y hacia el sur en Michoacán (Barbour, 1973b).
Los resultados de las correlaciones simples muestran asociaciones significativas entre LogTC con las características de cada sistema (latitud, longitud, altitud y temperatura) y que la figura solo se relaciona con la latitud en sentido norte. Geográficamente, la localidad de San Pedro Lagunillas se encuentra más al oeste dentro de la distribución de C. humboldtianum con una altitud de 1,248m snm, consecuentemente, la temperatura (Tx¯ = 23.8°C) en esta región es mayor que en Tiacaque a 2,540m snm (Tx¯ = 14.6°C). Estos datos concuerdan con otros estudios centrados en la variación de los peces continentales, asociada con gradientes altitudinales y con las variaciones ambientales de cada cuerpo de agua (Barbour, 1973b; Pardo, Scott y Vila, 2005).
También se ha comprobado que los peces de una misma especie que habitan en ambientes lénticos y lóticos sufren modificaciones, no solo genéticas, también morfológicas como es el caso de Goodea atripinnis (Goodeidae) y Chirostoma jordani (Atherinopsidae), los cuales poseen un cuerpo más alto en hábitats lénticos y un cuerpo más fusiforme en ambientes lóticos (Foster, Bower y Piller, 2015)
Las modificaciones morfológicas corporales, como la posición de las aletas, están asociadas al efecto de la depredación resultando en formas más ágiles para escapar o con tendencias a incrementar la altura del cuerpo en su parte anterior, como sucede en los géneros Gambusia y Poecilia (Burns, di Nardo y Rodd, 2009; Langerhans y Makowicz, 2009; Langerhans, Gifford y Joseph, 2007; O'Steen, Cullum y Bennett, 2002). Sin embargo, los adultos de C. humboldtianum son piscívoros, por lo tanto, considerar la depredación como factor de cambio fenotípico deberá evaluarse de otra manera antes de ser descartado o relacionado con esta especie.
Parte de la explicación de las diferencias en las poblaciones de C. humboldtianum puede estar asociada con eventos de preadaptación que presentan los aterinópsidos; dado que derivan de un ancestro marino, presentan una alta variación intraespecífica (Bamber y Henderson, 1988), ya que los organismos que colonizan estuarios pueden adentrarse en aguas dulces continentales y diversificarse, como se observa en este género.
Los cambios de la figura encontrados son altamente significativos en por lo menos 5 de las 6 localidades, considerando que la diversificación de esta especie tiene alrededor de 0.52 millones de años (Bloom et al., 2013). Las poblaciones de San Pedro Lagunillas y Tepuxtepec son las de la variación fenotípica más importante y con mayor separación espacial. Para las mismas 6 localidades, los datos moleculares sugieren que la estructura genética de C. humboldtianum puede relacionarse con fenómenos geológicos y climáticos del Plio-Pleistoceno (García-Martínez et al., 2015).
Los resultados morfológicos presentados en este trabajo corroboran que las diferencias en las poblaciones de C. humboldtianum se correlacionan con aspectos geneticomoleculares, que en conjunto pueden apoyar la teoría de una dispersión íctica colonizadora en un sentido longitudinal de este a oeste de organismos que provenían del río Bravo al norte de la República Mexicana. Esta hipótesis fue propuesta por Miller (1966), Miller y Chernoff (1980) y Miller y Smith (1986) —en conjunto la más aceptada y respaldada— la cual sugiere que entre el Plioceno y el Pleistoceno, o aun antes durante el Mioceno, una especie relacionada con el actual género Menidia (muy probablemente un aterinópsido pequeño semejante a las actuales Chirostoma arge y Chirostoma jordani) penetró al territorio mexicano a través del río Bravo desde la costa del Atlántico, que se encontraba conectado con la Mesa Central a través de un río que posiblemente se dirigía hacia el sur (Bloom et al., 2013). Dicha especie ancestral quedó atrapada en aguas continentales (Barbour, 1973b) y sus poblaciones probablemente se dispersaron para posteriormente presentar eventos de especiación en ambientes relativamente aislados que pudieron dar origen a las actuales especies del género Chirostoma (Bloom et al., 2013), incluyendo aquellas que en la actualidad son de mayor tamaño como C. humboldtianum.
Esta hipótesis concuerda con los estudios geológicos históricos de la formación de los grandes lagos de la Mesa Central y del sistema del Lerma-Santiago, que se encuentran dentro de las provincias morfotectónicas denominadas Mesa Central y Faja Volcánica Trasmexicana (Ferrusquía-Villafranca, 1998). La formación de estos lagos fue de este a oeste y comenzó en el Terciario medio (hace más de los 30 MA) con el emplazamiento de cuerpos volcánicos, seguido en el Plio-Cuaternario (hace 5 MA) por la formación de mesetas sierras y picos, dando lugar a la formación de fosas en donde se formaron lagos (Ferrusquía-Villafranca, 1998). La secuencia de estos eventos coincide con la reconstrucción del clado filogenético con tiempo calibrado para el género Chirostoma (Bloom et al., 2013), así como también con lo observado en la familia Goodeidae, distribuida en las cuencas y ríos de la Mesa Central mexicana, la cual se originó en el Mioceno (Doadrio y Domı¿nguez, 2004; Estrada, Alcántara y Monroy, 2001) y es durante el Plioceno que se da la diversificación de esta familia (5 MA.) (Doadrio y Domı¿nguez, 2004).
En conclusión, las diferencias en el alto del cuerpo y la posición de las aletas dorsales y anal entre poblaciones aisladas geográficamente en la actualidad permiten inferir la presencia de al menos 5 fenotipos de C. humboldtianum; de estos últimos, los organismos de Tepuxtepec y San Pedro Lagunillas son las poblaciones con una figura más diferenciada. Además, la figura no se ve influenciada por el tamaño de los organismos, pero sí presenta una relación positiva con la altitud y puede estar relacionada inversamente con la temperatura; aspectos que en conjunto son congruentes con un patrón de dispersión de la especie de este a oeste.
El presente trabajo forma parte del proyecto doctoral de Iván Alarcón Durán en Ciencias Biológicas y de la Salud, UAM, contando con beca Conacyt 359096. Además contó con el apoyo de los proyectos Conacyt-CB-2009-1-130220 otorgado a IDLAB y PROMEP-UAM-I-130 otorgado a GFL. Se agradece a los laboratorios de Genética Molecular y de Biología del Desarrollo, ambos de la UAM-I proporcionar los ejemplares para la realización de este estudio. Asimismo, al Laboratorio de Arqueozoología «M. en C. Ticul Álvarez Solórzano» de la SLAA- INAH su permiso para usar el equipo necesario y proporcionar el espacio para los análisis de MG.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.