La sociabilidad en los carnívoros parece haber evolucionado como una estrategia para depredar sobre otros mamíferos de gran tamaño y mejorar las ventajas de competencia intragremial. En cánidos, la relación entre altos niveles de sociabilidad e hipercarnivoría ha sido ampliamente discutida, pero son escasos los intentos de ponerla a prueba en un contexto filogenético. Debido a esto, aún existen dudas sobre la relación entre dieta y sociabilidad, particularmente si la variación en este último rasgo se asocia con presiones tróficas. En este trabajo buscamos identificar si el comportamiento social y las preferencias alimentarias están asociados en los cánidos actuales, y establecer cómo es esa relación en términos de la variabilidad de ambos rasgos y sus tendencias de cambio. Se obtuvo información sobre dieta y sociabilidad a partir de la revisión de literatura y probamos su relación mediante métodos de filogenética comparada. Aproximaciones cladísticas y probabilísticas indican que existe una relación directa entre una mayor tendencia a la carnivoría y mayor sociabilidad. Nuestros resultados también indican que el comportamiento social tiende a evolucionar primero y que en un contexto evolutivo social las probabilidades de adoptar preferencias carnívoras se incrementan.
Sociality in carnivorans seems to have evolved as a strategy for preying on big mammals and enhancing intraguild competition. In canids, the relationship between high sociality levels and hypercarnivory has been widely discussed, but there are few attempts for testing it in a phylogenetic context. As a result, there are still doubts regarding the relationship between diet and sociality; particularly if variation in the latter is associated with trophic pressures. Here, we test if social behavior and feeding preferences are associated in extant canids, and establish how this relationship is in terms of the variability of both traits and their transition tendencies. We obtained information about diet and sociality after literature review, and tested their association with phylogenetic comparative methods. Cladistic and probabilistic approaches indicate a direct relationship between higher carnivory and higher sociality. Our results also indicate that social behavior tends to evolve first, and that carnivorous preferences are more likely to evolve under social evolutionary contexts.
A través de su historia evolutiva, los cánidos han exhibido una variedad dietaria considerable; hay especies con tendencias a la omnivoría (v. g., Urocyon cinereoargenteus), frugivoría (v. g., Cynarctus crucidens), insectivoría (v. g., Otocyon megalotis), carnivoría (v. g., Vulpes lagopus), hipercarnivoría (v. g., Cuon alpinus) y durofagia (v. g., Borophagus diversidens). Referido este último hábito alimenticio al consumo de materiales duros, como en el caso de los mamíferos que trituran huesos (Hall y Dalquest, 1962; Muñoz-Durán, 2010; Nowak, 1999; Slater, Dumont y Van Valkenburgh, 2009; Van Valkenburgh, 1991; Van Valkenburgh y Koepfli, 1993; Van Valkenburgh, Sacco y Wang, 2003; Wang, Tedford y Taylor, 1999). No obstante, la tendencia general de este grupo ha sido la omnivoría y, dentalmente, son los más cercanos al diseño ancestral de los carnívoros, especialmente por su fórmula dental poco reducida y molares tribosfénicos relativamente inmodificados, a excepción de los carnasiales (Wang y Tedford, 2007; Wayne et al., 1997). Resulta sorprendente que un linaje poco especializado como el de los cánidos exhiba preferencias hipercarnívoras en su dieta. Más aún, la comparación de cánidos recientes con grupos extintos deja ver que los primeros parecen estar menos equipados para los hábitos hipercarnívoros (Andersson, 2003).
Los félidos, por ejemplo, cuentan con extremidades superiores fuertes y flexibles que se pueden supinar y, además, están equipados con garras retráctiles, afiladas y curvas (Van Valkenburgh et al., 2003). Gracias a estos rasgos, los félidos pueden incursionar con facilidad en hábitos arbóreos, son eficientes en la cacería por emboscada y se aferran fuertemente a sus presas (Wang, 1993). La principal excepción es el guepardo (Acinonyx jubatus), único entre los félidos por sus adaptaciones altamente cursoriales, reflejadas en cuerpos gráciles y extremidades con limitada capacidad de supinación (Martín-Serra, Figueirido y Palmqvist 2014; Van Valkenburgh, 2007). Pero aun cuando los guepardos no se aferren a sus presas como otros felinos, utilizan un espolón para desestabilizarlas después de una carrera corta de alta aceleración y posteriormente las sofocan (Martín-Serra, Figueirido, Pérez-Claros y Palmqvist, 2015; Meachen-Samuels y Van Valkenburgh, 2009). A pesar de estas diferencias poscraneales asociadas a la locomoción, los félidos en general cuentan con cráneos cortos y caninos redondeados que les confieren ventajas biomecánicas para someter a sus presas con una sola mordida (Van Valkenburgh et al., 2003), lo cual está bien ejemplificado en el jaguar (Panthera onca).
A diferencia del patrón general para félidos, los cánidos exhiben cuerpos gráciles, no pueden supinar las extremidades y presentan garras romas, derechas y no retráctiles (Wang, 1993; Wang y Tedford, 2007). En este sentido, el esqueleto poscraneal de los cánidos se asemeja más al del guepardo, pero, a diferencia de este último, los cánidos no cuentan en sus extremidades con ninguna estructura especial que facilite la captura de las presas (Gonyea y Ashworth, 1975). Las principales estructuras involucradas en capturar, sujetar y matar presas en los cánidos son las mandíbulas (Bekoff, Daniels y Gittleman, 1984; Van Valkenburgh et al., 2003). Aun así, las cabezas alargadas de los cánidos carecen de las ventajas biomecánicas propias de cráneos más cortos; aunado a esto, sus caninos son angostos y comprimidos y, por lo tanto, sus mordidas son más débiles que las de otros depredadores (Van Valkenburgh y Koepfli, 1993).
Pero aun sin estas especializadas adaptaciones morfológicas, los cánidos son depredadores exitosos y puedan derribar presas tan grandes como las que llegan a capturar algunos félidos. Se sabe que los cánidos tienen una amplia variación tanto en la dieta como en el tamaño corporal (Bekoff et al., 1984; Macdonald, Creel y Mills, 2004). En particular, este último rasgo ha sido postulado para explicar la hipercarnivoría en el linaje, si se toma en cuenta que en las 3 subfamilias de cánidos se detecta un patrón creciente de carnivoría y tamaño corporal a lo largo del tiempo, donde las formas hipocarnívoras suelen ser de tamaños pequeños y medianos (Wang, Tedford, Van Valkenburgh y Wayne, 2004). No obstante, este aparente patrón tiene varios puntos débiles, dado que existen cánidos medianos y pequeños cuya dieta consiste mayoritariamente en el consumo de carne (tabla 1), como Vulpes lagopus, V. macrotis, Speothos venaticus y varias especies de la subfamilia Hesperocyoninae (Wang et al., 2004a,b). Más aún, existen cánidos grandes que son menos carnívoros de lo que se esperaría para un animal de su tamaño, como Chrysocyon brachyurus, Canis latrans, C. mesomelas y C. aureus (Van Valkenburgh y Koepfli, 1993; Wang et al., 2004a,b). Curiosamente Canis lupus, quizá el cánido más grande entre las especies actuales, tiene hábitos alimentarios más flexibles que otras especies hipercarnívoras como Speothos venaticus, que suele ser omitido en estas comparaciones debido al poco conocimiento que hay de su historia natural (Van Valkenburgh y Koepfli, 1993).
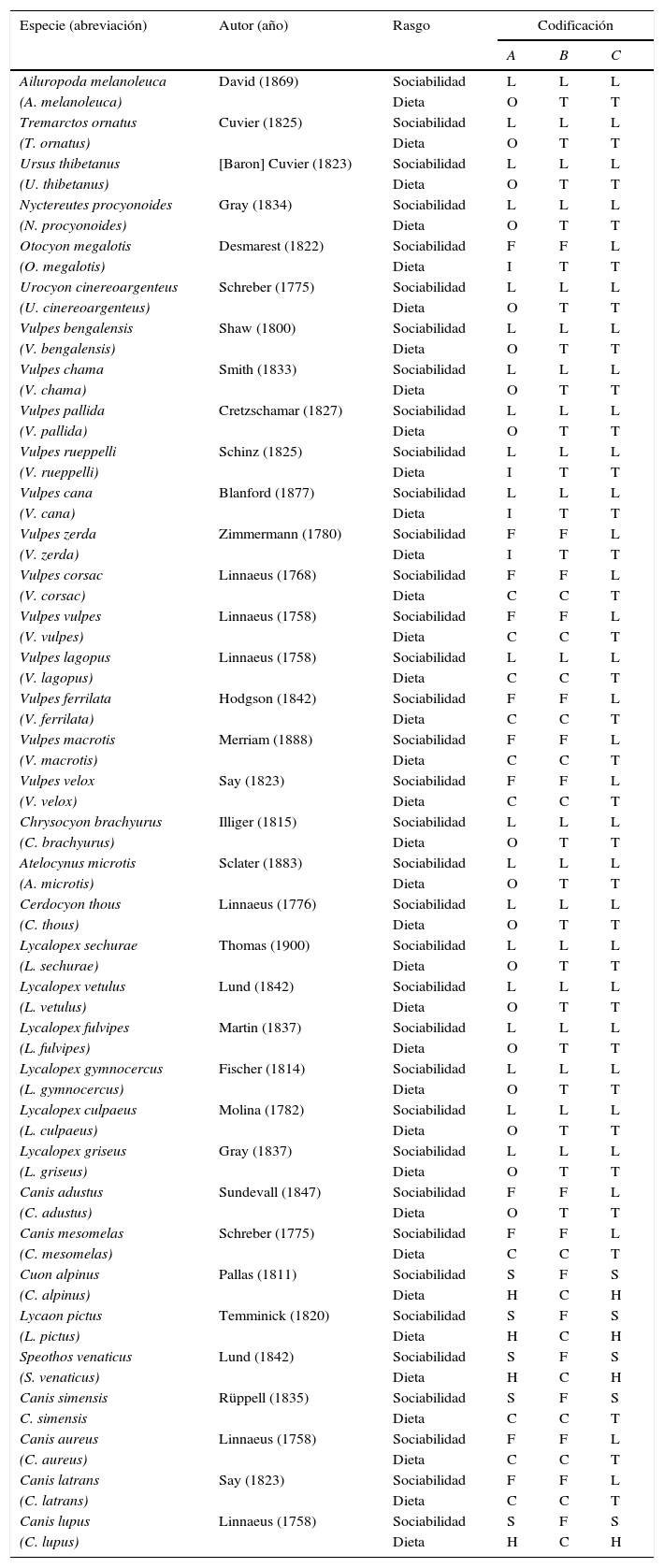
Especies de cánidos y úrsidos vivientes incluidas en este estudio.
| Especie (abreviación) | Autor (año) | Rasgo | Codificación | ||
|---|---|---|---|---|---|
| A | B | C | |||
| Ailuropoda melanoleuca | David (1869) | Sociabilidad | L | L | L |
| (A. melanoleuca) | Dieta | O | T | T | |
| Tremarctos ornatus | Cuvier (1825) | Sociabilidad | L | L | L |
| (T. ornatus) | Dieta | O | T | T | |
| Ursus thibetanus | [Baron] Cuvier (1823) | Sociabilidad | L | L | L |
| (U. thibetanus) | Dieta | O | T | T | |
| Nyctereutes procyonoides | Gray (1834) | Sociabilidad | L | L | L |
| (N. procyonoides) | Dieta | O | T | T | |
| Otocyon megalotis | Desmarest (1822) | Sociabilidad | F | F | L |
| (O. megalotis) | Dieta | I | T | T | |
| Urocyon cinereoargenteus | Schreber (1775) | Sociabilidad | L | L | L |
| (U. cinereoargenteus) | Dieta | O | T | T | |
| Vulpes bengalensis | Shaw (1800) | Sociabilidad | L | L | L |
| (V. bengalensis) | Dieta | O | T | T | |
| Vulpes chama | Smith (1833) | Sociabilidad | L | L | L |
| (V. chama) | Dieta | O | T | T | |
| Vulpes pallida | Cretzschamar (1827) | Sociabilidad | L | L | L |
| (V. pallida) | Dieta | O | T | T | |
| Vulpes rueppelli | Schinz (1825) | Sociabilidad | L | L | L |
| (V. rueppelli) | Dieta | I | T | T | |
| Vulpes cana | Blanford (1877) | Sociabilidad | L | L | L |
| (V. cana) | Dieta | I | T | T | |
| Vulpes zerda | Zimmermann (1780) | Sociabilidad | F | F | L |
| (V. zerda) | Dieta | I | T | T | |
| Vulpes corsac | Linnaeus (1768) | Sociabilidad | F | F | L |
| (V. corsac) | Dieta | C | C | T | |
| Vulpes vulpes | Linnaeus (1758) | Sociabilidad | F | F | L |
| (V. vulpes) | Dieta | C | C | T | |
| Vulpes lagopus | Linnaeus (1758) | Sociabilidad | L | L | L |
| (V. lagopus) | Dieta | C | C | T | |
| Vulpes ferrilata | Hodgson (1842) | Sociabilidad | F | F | L |
| (V. ferrilata) | Dieta | C | C | T | |
| Vulpes macrotis | Merriam (1888) | Sociabilidad | F | F | L |
| (V. macrotis) | Dieta | C | C | T | |
| Vulpes velox | Say (1823) | Sociabilidad | F | F | L |
| (V. velox) | Dieta | C | C | T | |
| Chrysocyon brachyurus | Illiger (1815) | Sociabilidad | L | L | L |
| (C. brachyurus) | Dieta | O | T | T | |
| Atelocynus microtis | Sclater (1883) | Sociabilidad | L | L | L |
| (A. microtis) | Dieta | O | T | T | |
| Cerdocyon thous | Linnaeus (1776) | Sociabilidad | L | L | L |
| (C. thous) | Dieta | O | T | T | |
| Lycalopex sechurae | Thomas (1900) | Sociabilidad | L | L | L |
| (L. sechurae) | Dieta | O | T | T | |
| Lycalopex vetulus | Lund (1842) | Sociabilidad | L | L | L |
| (L. vetulus) | Dieta | O | T | T | |
| Lycalopex fulvipes | Martin (1837) | Sociabilidad | L | L | L |
| (L. fulvipes) | Dieta | O | T | T | |
| Lycalopex gymnocercus | Fischer (1814) | Sociabilidad | L | L | L |
| (L. gymnocercus) | Dieta | O | T | T | |
| Lycalopex culpaeus | Molina (1782) | Sociabilidad | L | L | L |
| (L. culpaeus) | Dieta | O | T | T | |
| Lycalopex griseus | Gray (1837) | Sociabilidad | L | L | L |
| (L. griseus) | Dieta | O | T | T | |
| Canis adustus | Sundevall (1847) | Sociabilidad | F | F | L |
| (C. adustus) | Dieta | O | T | T | |
| Canis mesomelas | Schreber (1775) | Sociabilidad | F | F | L |
| (C. mesomelas) | Dieta | C | C | T | |
| Cuon alpinus | Pallas (1811) | Sociabilidad | S | F | S |
| (C. alpinus) | Dieta | H | C | H | |
| Lycaon pictus | Temminick (1820) | Sociabilidad | S | F | S |
| (L. pictus) | Dieta | H | C | H | |
| Speothos venaticus | Lund (1842) | Sociabilidad | S | F | S |
| (S. venaticus) | Dieta | H | C | H | |
| Canis simensis | Rüppell (1835) | Sociabilidad | S | F | S |
| C. simensis | Dieta | C | C | T | |
| Canis aureus | Linnaeus (1758) | Sociabilidad | F | F | L |
| (C. aureus) | Dieta | C | C | T | |
| Canis latrans | Say (1823) | Sociabilidad | F | F | L |
| (C. latrans) | Dieta | C | C | T | |
| Canis lupus | Linnaeus (1758) | Sociabilidad | S | F | S |
| (C. lupus) | Dieta | H | C | H | |
Se muestran nombres científicos con abreviaciones, autoría con año de descripción y codificación para comportamiento social y preferencias alimentarias a partir de revisión bibliográfica (material suplementario 1). Se distinguen 3 estrategias de codificación: A) codificación multiestado, con 3 estados de carácter para la sociabilidad (L=solitario, F=familiar, S=social) y 4 para la dieta (O=omnívoro, I=insectívoro, C=carnívoro, H=hipercarnívoro); B) codificación binaria flexible que distingue a las especies solitarias (L=solitario, F=familiar) y carnívoras (C=carnívoro, T=otro); C) codificación binaria estricta que distingue a las especies sociales (L=solitario, S=social) e hipercarnívoras (H=hipercarnívoro, O=otro).
Una hipótesis más sólida para explicar las preferencias alimentarias de los cánidos podría estar asociada con el comportamiento social (Muñoz-Durán, 2002; Van Valkenburgh y Koepfli, 1993; Van Valkenburgh et al., 2003; Wang y Tedford, 2007). Debido a sus hábitos cursoriales y a unos cráneos relativamente débiles, los cánidos no confieren una única mordida mortal a sus presas sino múltiples mordidas desgarrantes durante persecuciones prolongadas, estrategia que resulta más efectiva con el trabajo coordinado de un grupo que coopera; así, el grupo completo fatiga a la presa durante la persecución, mientras algunos individuos la sostienen y otros la hieren (Bekoff et al., 1984; Maier, 2001; Van Valkenburgh y Koepfli, 1993; Van Valkenburgh et al., 2003; Wang y Tedford, 2007). Además, la cooperación incrementa el espectro potencial de presas y el trabajo en equipo permite a los cánidos competir con adversarios tan fuertes como las hienas y los felinos (Fanshawe y Fitzgibbon, 1993).
Con base en lo anterior, son más abundantes los argumentos para justificar la relación entre preferencia alimentaria y comportamiento social que los intentos por ponerla a prueba. Más aún, dado que los cánidos actuales que cazan solos rara vez toman presas más grandes que ellos y que los cráneos más robustos son presentados por las especies altamente sociales, se ha asumido que los ejemplares fósiles que muestran morfologías similares tuvieron que haber sido cazadores grupales hipercarnívoros (Van Valkenburgh y Koepfli, 1993). Sin embargo, esta generalización tiene varios problemas. En primer lugar, los carnívoros no son análogos morfológicos, como lo muestran las diversas adaptaciones que exhiben para responder a presiones tróficas similares (Muñoz-Durán y Fuentes, 2012; Radinsky, 1981); por ejemplo, los leones son sociales, aun exhibiendo las características típicas de los hipercarnívoros solitarios grandes (Muñoz-Durán, 2010). En segundo lugar, al asociar rasgos entre especies diferentes sin incorporar una corrección filogenética, se asume que los datos son independientes, ignorando la dependencia debida a la ancestría común que tienen los taxones involucrados en un análisis comparado (Felsenstein, 1985). Debido a esto, se hace relevante establecer la relación evolutiva potencial entre preferencias alimentarias y comportamiento social en los cánidos actuales mediante una aproximación filogenética.
Aproximaciones más recientes con un contexto filogenético indican que la carnivoría y la sociabilidad se encuentran relacionadas en los cánidos (Muñoz-Durán, 2011), pero no es claro si las variantes alimentarias se asocian a formas particulares de conformar grupos. Más aún, tradicionalmente se ha considerado que la ayuda para cazar, matar y defender presas ha sido una presión selectiva que ha favorecido la vida en grupo (Andersson, 1984; Fanshawe y Fitzgibbon, 1993; Macdonald, 1983; Martin, 1989; Muñoz-Durán, 2002). Sin embargo, esta presión selectiva no explica por qué algunas especies viven en grupo pero suelen cazar individualmente, como ocurre con Vulpes vulpes, V. macrotis y V. ferrilata (Macdonald, 1983; Schaller y Ginsberg, 2004). En este trabajo se propone determinar analíticamente si la dieta y la sociabilidad se encuentran asociadas en los cánidos actuales y establecer cómo es esa relación. En particular, buscamos identificar cómo la variabilidad en preferencias alimentarias se asocia a los niveles de sociabilidad en cánidos y si este último rasgo realmente aparece como una respuesta a presiones tróficas en dicho grupo de carnívoros.
Materiales y métodosSe trató el comportamiento social y las preferencias alimentarias como caracteres discretos, compilados mediante revisión de la literatura. Para dar cuenta de la variación interespecífica que ambos rasgos exhiben en los Caninae, se inició considerando una codificación multiestado (codificación A, tabla 1) basada en los criterios propuestos por Muñoz-Durán (2002). Exceptuando a C. rufus y Urocyon littoralis, se evaluaron todas las especies vivientes de cánidos y se asignaron a un comportamiento social de 3 condiciones posibles (solitarios, familiares, sociales) y a una preferencia alimentaria de 4 condiciones posibles (omnívoros, insectívoros, carnívoros, hipercarnívoros). Asimismo, se incluyeron las siguientes 3 especies de osos: Ailuropoda melanoleuca, Tremarctos ornatus y Ursus thibetanus, para propósitos de polarización.
Para poder explorar más a fondo la variación en niveles de sociabilidad y carnivoría, se usaron otros 2 esquemas alternativos de codificación para cada rasgo (tabla 1). En cuanto a la sociabilidad, se reunió en un esquema (codificación B) a todas las especies con tendencias grupales, i. e., familiares y sociales, dejando a las solitarias en otro estado de carácter; mientras que en otro esquema (codificación C) se separó a las especies con tendencias eusociales del resto, i. e., solitarias y familiares. En cuanto a la dieta, quedaron agrupadas en un esquema (codificación B) las especies carnívoras e hipercarnívoras, dejando a las demás (omnívoras e insectívoras) en otro estado de carácter. En otro esquema (codificación C) se separó a las especies hipercarnívoras del resto (omnívoras, insectívoras y carnívoras). De esta manera, la codificación B permitió explorar la relación entre carnivoría y sociabilidad bajo una perspectiva flexible, mientras que la codificación C permitió explorar la misma relación pero de manera más estricta. Estas alternativas de codificación también facilitaron el uso de métodos comparados que solo funcionan con caracteres binarios.
Se siguió la filogenia presentada por Fuentes y Muñoz-Durán (2012), quienes condujeron un análisis de congruencia de caracteres bajo parsimonia usando datos morfológicos, moleculares, cariológicos y de historia de vida. La topología resultante (un consenso estricto que solo colapsa un nodo entre Vulpes chama y V. pallida) reúne a los 3 cánidos poseedores de talón cortante (en m1) en un grupo monofilético. Este arreglo filogenético no corrobora la evolución convergente que ha sido propuesta para esta estructura en algunos trabajos previos (Bardeleben, Moore y Wayne, 2005; Tedford, Taylor y Wang, 1995; Wayne et al., 1997; Zrzavý y Řičánková, 2004), lo que podría impactar los análisis comparados entre dieta y sociabilidad de manera particular. Para evitar que los resultados quedaran condicionados a esta topología, reanalizamos la matriz de Fuentes y Muñoz-Durán (2012) bajo inferencia bayesiana (material suplementario 2). La topología resultante recupera la hipótesis de evolución convergente sobre el talón cortante y ofrece un buen escenario alternativo para determinar qué tan consistente es el patrón de evolución correlacionada entre dieta y sociabilidad en cánidos. Se usaron estas filogenias para los análisis de evolución de caracteres siguiendo la estructura de Fuentes y Muñoz-Durán (2012), asignando los datos de Ailuropoda melanoleuca al primer grupo externo (GE1), Tremarctos ornatus al segundo (GE2) y Ursus thibetanus al tercero (GE3).
Evolución de caracteres bajo parsimoniaSe exploraron las tasas evolutivas a través de gráficas de cambio y estasis, en las que primero se reconstruye la historia evolutiva del carácter y luego se extraen las frecuencias de cada tipo de cambio. Cuando se presentaron ambigüedades en la reconstrucción, se recurrió a la opción de «mínimo y máximo» con el objeto de examinar todas las reconstrucciones más parsimoniosas de evolución de caracteres.
Se realizó la estimación de estados ancestrales usando las reconstrucciones más parsimoniosas del mapeo de caracteres. Se seleccionaron las aproximaciones exactas para la estimación de estados ancestrales en vista de que la codificación de los 2 rasgos trazados no incluyó polimorfismos.
Para probar la asociación entre las estrategias alimentarias y el comportamiento social, se utilizó la prueba de cambios concentrados PCC (Maddison, 1990). Inicialmente se trazó la dieta sobre la filogenia como variable independiente y, posteriormente, se estimó la probabilidad de que las ganancias y pérdidas observadas en la sociabilidad (el carácter dependiente) ocurrieran en áreas distinguidas de las topologías bajo la hipótesis nula de aleatoriedad. Se aplicó la prueba sobre el internodo más basal, para explorar la concentración de cambios sobre toda la filogenia. Las áreas distinguidas estuvieron caracterizadas por el estado apomórfico de las preferencias alimentarias. En la medida de lo posible, se usaron conteos exactos para el cálculo de las probabilidades; no obstante, cuando el problema generaba sobreflujo computacional o disminuía considerablemente las labores de cálculo, se usaron simulaciones con 1,000 iteraciones partiendo de cualquier estado como ancestral en la sociabilidad. En estos casos se dejó el valor de compensación en cero, debido a que la matriz tiene un buen número de especies y difícilmente habrá un número de cambios superior a la cuarta parte de la cantidad de taxones (Maddison y Maddison, 2005). Para las simulaciones, se recurrió a las reconstrucciones derivadas tanto por el algoritmo de Minstate como por el algoritmo de Maxstate, con el objeto de evadir el sesgo que pueden introducir las reconstrucciones en la prueba.
Dado que estos métodos funcionan sobre árboles completamente resueltos, se utilizaron los 2 árboles más parsimoniosos, no el consenso. Se trataron los rasgos como no ordenados. Para la reconstrucción de estados ancestrales y los gráficos de cambio y estasis, se usó la estrategia de codificación multiestado (codificación A); sin embargo, se aplicaron las 2 estrategias alternativas de codificación (codificaciones B y C) sobre PCC, dado que este método está concebido para caracteres binarios. Se implementaron estos métodos con el programa MacClade (Maddison y Maddison, 2005).
Evolución de caracteres bajo modelos markovianos continuos en el tiempoEsta aproximación permite a un rasgo cambiar en cualquier momento de un estado a otro, en intervalos de tiempo infinitesimalmente pequeños (Pagel, 1994). A diferencia de las aproximaciones recién expuestas para parsimonia, el modelo markoviano continuo en el tiempo (MMCT) permite usar longitudes de ramas en los análisis de evolución de caracteres. Estas longitudes de ramas se estimaron con base en los caracteres estándar de Fuentes y Muñoz-Durán (2012) utilizando el modelo Mkv (Lewis, 2001). Se llevó a cabo este procedimiento con MrBayes (Huelsenbeck y Ronquist, 2001; Ronquist y Huelsenbeck, 2003) mediante congelamiento de topologías y estimación de longitudes de ramas a partir de las propuestas derivadas del parámetro multiplicador. Se usó una corrida con 3 cadenas calientes por 1,000,000 de generaciones y muestreando cada 100; se mantuvo una proporción 100:1 con respecto al número de generaciones totales para descartar las longitudes de ramas de las primeras generaciones de búsqueda (material suplementario 3).
Se implementó la versión bayesiana del MMCT en BayesTraits (Pagel y Meade, 2007). Este método trabaja sobre caracteres binarios, así que solo se usaron las codificaciones B y C. Para determinar los parámetros de las distribuciones previas, se usaron hiperprevios exponenciales o γ con saltos reversibles (Pagel, Meade y Barker, 2004), que fueron alimentados a través de distribuciones uniformes. Para especificar los intervalos de estas distribuciones nos servimos de análisis exploratorios, que también fueron útiles para configurar las optimizaciones markovianas (material suplementario 4). Se efectuó el contraste de modelos tras las corridas markovianas comparando las probabilidades marginales mediante factores bayesianos (FB). Esta verosimilitud marginal es difícil de estimar en la práctica, pero puede ser aproximada a través de la media armónica de las verosimilitudes cuando la cadena de Markov corre por suficiente tiempo (Pagel y Meade, 2007). La media armónica puede tener un comportamiento inestable, por lo que procuramos dejar correr las cadenas por un buen número de generaciones y se compararon los resultados de estos contrastes con inferencias alternativas (Pagel y Meade, 2007). Como regla de decisión para los FB utilizamos los criterios de Kass y Raftery (1995).
Debido al interés en las tasas evolutivas de las codificaciones multiestado, no se reportaron estos resultados bajo MMCT. Se estimaron estados ancestrales sobre nodos específicos bajo esta aproximación por medio del cómputo de probabilidades marginales (Pagel, 1999). Se seleccionaron los nodos a partir de los estados ancestrales reconstruidos por parsimonia; específicamente se evaluaron nodos equívocos y aquellos en los que se planteaban cambios. Se efectuaron las reconstrucciones con el método de ancestro común más reciente ACMR (Pagel et al., 2004) y se contrastaron los estados de carácter fosilizando nodos y haciendo pruebas de hipótesis sobre ellos (usando FB). Para las estimaciones, se usaron 10,000,000 de generaciones tomando muestras cada 300 y descartando las primeras 100,000. La distribución posterior permitió examinar la estimación bayesiana de cada estado en los nodos de interés; esta evaluación se realizó en el programa Tracer (Rambaut y Drummond, 2007).
Para las pruebas de evolución correlacionada se usaron búsquedas con 101,000,000 de generaciones tomando muestras cada 300 y descartando las primeras 1,000,000. En la versión bayesiana de esta prueba se puede probar la evolución correlacionada de los rasgos mediante FB, pero, además, se evaluó la distribución posterior del modelo de saltos reversibles para identificar, no solo si los caracteres estaban evolucionando independientemente, sino también cuántos parámetros bastaban para describir las transiciones evolutivas entre dieta y sociabilidad (Pagel y Meade, 2006). Cuando el modelo dependiente fue seleccionado, se compararon la media posterior y las desviaciones estándar de los coeficientes de tasas; también se evaluaron hipótesis concretas de cambio de caracteres. Para lograr esto, se contrastaron los coeficientes de interés evaluando la probabilidad posterior (pp) de que uno fuese mayor que el otro.
Evolución de caracteres bajo mapeo estocástico de caracteresEsta aproximación (Huelsenbeck, Nielsen y Bollback, 2003) permite el uso de rasgos codificados como multiestado (por lo que se omitieron las variantes binarias bajo este método) y se implementaron a través de SIMMAP versión 1.5 y el programa utilitario Nex2Xml (Bollback, 2006). En la estimación de las longitudes de ramas se utilizó SIMMAP para reescalar el árbol, generando una tasa aleatoria con forma y escala predeterminadas, mediante una distribución uniforme. Los modelos estándar se configuraron para cada carácter (preferencias alimentarias y comportamiento social) a partir del modelo Mk (Lewis, 2001), que también fue utilizado para la estimación de longitudes de ramas. Como los caracteres estudiados siempre fueron multiestado, se hizo una selección previa empíricamente para configurar los parámetros de sesgo. Los previos de distribución γ se configuraron para los parámetros de tasas mediante un procedimiento bayesiano (Schultz y Churchill, 1999). Este procedimiento consistió en correr una cadena de Markov utilizando previos predeterminados por el programa (α=1.25; β=0.25; k=90) sobre los caracteres de interés con 100,000 generaciones, muestreando cada 200 y descartando las primeras 10,000. Se utilizaron los resultados de estas corridas para estimar los mejores ajustes de la distribución γ a partir de la distribución posterior de los parámetros (material suplementario 5), haciendo uso de los paquetes MASS (Venables y Ripley, 2002) y TeachingDemos (Snow, 2009) del programa R (R Development Core Team, 2016), así como ejecutando el protocolo elaborado por Bollback (2006) que se encuentra disponible en el sitio web del programa (http://www.simmap.com/). Consideramos los caracteres como no ordenados tanto en la estimación de los mejores previos como en los análisis propiamente dichos.
Se usaron las tendencias de cambio y el tiempo promedio que permanecen los caracteres en estados particulares para explorar las tasas evolutivas de dieta y sociabilidad. Para muestrear los mapas mutacionales en la estimación de tasas evolutivas, utilizamos 1,000 réplicas sobre cada árbol y cada carácter, con 10 trazas previas.
Para los estados ancestrales, el mapeo estocástico mutacional emplea un muestreo sobre la distribución conjunta, lo que permite obtener información acerca del cronometraje de diferentes cambios y la duración de diferentes estados. No obstante, la estimación de estados ancestrales bajo mapeo estocástico de caracteres (MEC) no derivó del mapa mutacional, sino que fue calculada directamente como la probabilidad posterior marginal de cada estado de carácter posible sobre todos los nodos (Huelsenbeck et al., 2003).
Para evaluar la evolución correlacionada se usaron los estadísticos D y MIC (Bollback, 2006). El primero (D) se establece a partir de la presencia de estados sobre la filogenia, mientras que el segundo (MIC) evalúa la correlación entre historias de caracteres y sus estados a lo largo de la filogenia. Para muestrear los mapas mutacionales en las pruebas de evolución correlacionada, se utilizaron 1,000 réplicas sobre cada árbol y cada carácter, con 10 trazas previas y 10 muestras predictivas. Además de trabajar con caracteres multiestado, MEC permite detectar correlaciones entre estados de carácter tras encontrar una asociación significativa entre los 2 rasgos estudiados (Huelsenbeck et al., 2003).
ResultadosLas gráficas de cambio y estasis permitieron reconocer que tanto las estrategias alimentarias como el comportamiento social muestran mayor frecuencia de estasis que de cambio, especialmente para omnivoría y carnivoría en el primer caso, así como para los estados solitario y familiar en el segundo (fig. 1). Las frecuencias de ganancias y pérdidas varían levemente entre topologías, lo cual es apropiado para conducir las pruebas de evolución correlacionada bajo escenarios evolutivos diferentes. Estos resultados son consistentes con las tasas estimadas bajo MEC (material suplementario 6).
Burbujas que indican la frecuencia relativa de cambio para las preferencias alimentarias (arriba: 0=omnívoro, 1=insectívoro, 2=carnívoro, 3=hipercarnívoro) y el comportamiento social (abajo: 0=solitario, 1=familiar, 2=social) derivadas de las topologías de análisis de parsimonia (MP) e inferencia bayesiana (IB); las topologías propiamente dichas se muestran en las figuras 2 y 3, para parsimonia e inferencia bayesiana, respectivamente. Las burbujas indican la frecuencia mínima (oscuro) y la frecuencia máxima (claro) de eventos.
En términos de estrategias alimentarias, las reconstrucciones parsimoniosas muestran que la omnivoría es la condición plesiomórfica para los cánidos vivientes y que la condición solitaria se corresponde para el comportamiento social (figs. 2 y 3). Estos resultados son consistentes con MMCT (media posterior > 0.99 en ambos casos) y MEC (media posterior > 0.8 en ambos casos). La historia de las condiciones apomórficas varía entre topologías, especialmente porque el árbol bayesiano separa a los cánidos con talón cortante (generando más ganancias en la historia de la hipercarnivoría y la sociabilidad) y los árboles parsimoniosos separan a las especies holárticas de las especies afrotropicales e indomalayas del género Vulpes (generando menos ganancias en la historia de la insectivoría).
Topología parsimoniosa con mapeos de preferencias alimentarias (izquierda: blanco=omnivoría, gris claro=insectivoría, gris oscuro=carnivoría, negro=hipercarnivoría) y comportamiento social (derecha: blanco=solitario, gris=familiar, negro=social). Ramas con varios colores representan reconstrucciones equívocas. La politomía del árbol original no afecta a la reconstrucción ancestral, así que solo mostramos uno de los árboles más parsimoniosos (con V. chama como más basal). Abreviaturas como en la tabla 1. En términos generales estos resultados son consistentes con las reconstrucciones probabilísticas (material suplementario 7).
Topología bayesiana con preferencias alimentarias y comportamiento social mapeados. Especificaciones como en la figura 2.
En términos generales, hay 2 ganancias de carnivoría, una dentro del clado de los lobos y otra dentro de los zorros holárticos del género Vulpes (figs. 2 y 3). En el árbol bayesiano, la reconstrucción parsimoniosa es ambigua para la codificación multiestado de la dieta al inicio del clado de los lobos, lo que involucra cambios entre la omnivoría, la carnivoría y la hipercarnivoría a lo largo de la historia del linaje. El MEC favorece un escenario de convergencias en el que la omnivoría se mantiene solo en la especie C. adustus, mientras que la carnivoría y la hipercarnivoría aparecen en el resto de los integrantes del clado (material suplementario 7).
Todo indica que V. lagopus y V. rueppelli (en el caso del árbol probabilístico) son solitarios tras haber perdido la condición familiar (figs. 2 y 3). Para el árbol cladístico la reconstrucción más parsimoniosa es ambigua, pero MMCT favorece la opción de la pérdida, tanto por el método de ACMR como por el contraste de modelos (material suplementario 7).
Hay mucha incertidumbre en la reconstrucción del comportamiento social para el clado de los lobos (figs. 2 y 3), en el que MMCT favorece la evolución convergente de la sociabilidad en C. lupus, C. simensis y los cánidos con talón cortante, mientras que MEC favorece un escenario en el que la sociabilidad aparece en los cánidos con talón cortante y en las especies recientes del género Canis, pero luego se pierde en este último y evoluciona de nuevo en la rama terminal que conduce a C. lupus (material suplementario 7). A pesar de estas diferencias, los resultados indican que la condición familiar antecede a la sociabilidad propiamente dicha de manera consistente.
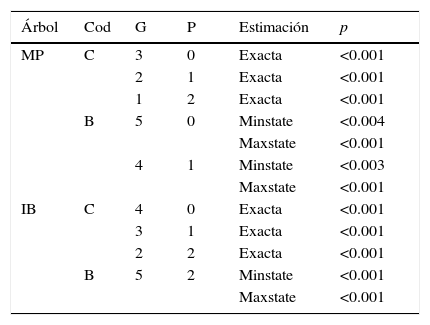
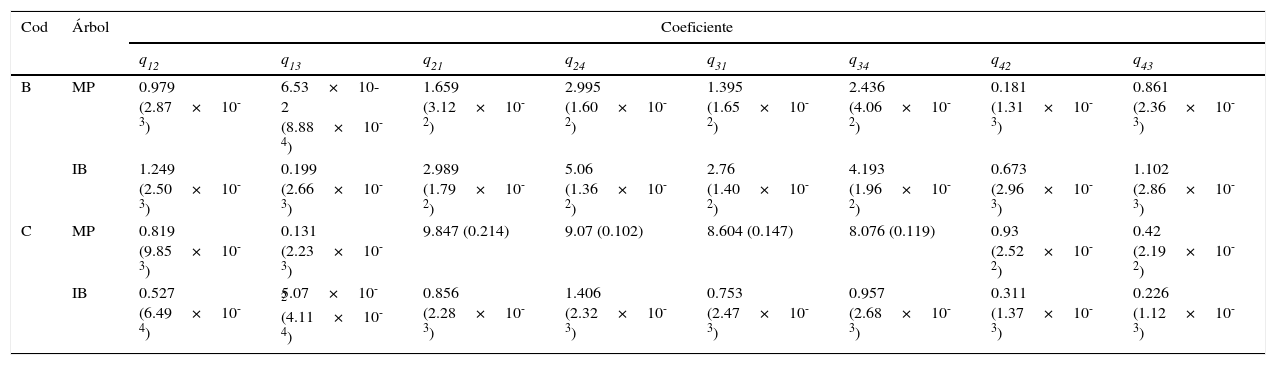
Se encontró una correlación significativa entre dieta y sociabilidad con PCC sobre todos los escenarios evolutivos analizados (tabla 2). Estas asociaciones fueron confirmadas con MMCT (tabla 3) y la comparación entre coeficientes de tasas permitió identificar algunas tendencias de cambio entre caracteres (tabla 4). En particular, la codificación estricta (codificación C) en función del árbol parsimonioso señala que la ruta más probable para ganar las condiciones apomórficas (social-hipercarnívoro) desde las condiciones plesiomórficas (solitario-omnívoro) es mediada por un cambio inicial en la sociabilidad y que las pérdidas son improbables una vez que las condiciones apomórficas han evolucionado (tabla 4). Efectivamente, contrastes específicos mostraron que: a) la sociabilidad tiende a evolucionar primero (pp: q12>q13=0.7415, iguales=0.2397); b) es más probable que la hipercarnivoría evolucione en presencia de la sociabilidad (pp: q24>q13=0.877, iguales=0.0686); c) es más probable que la hipercarnivoría sufra reversiones en presencia de comportamientos solitarios (pp: q31>q42=0.615, iguales=0.2375) y d) es más probable que la sociabilidad sufra reversiones bajo un sistema omnívoro (pp: q21>q43=0.6646, iguales=0.228); sin embargo, los contrastes enfocados en pérdidas (c y d) involucran más incertidumbre. El árbol bayesiano confirmó estas tendencias de cambio (tabla 4), pero los contrastes fueron más consistentes en términos de las ganancias, con resultados similares para a (pp: q12>q13=0.8415, iguales=0.1473) y b (pp: q24>q13=0.9504, iguales=0.0328); en cuanto a las pérdidas, solo d fue confirmado con incertidumbre (pp: q21>q43=0.6035, iguales=0.2837).
Resultados de PCC.
| Árbol | Cod | G | P | Estimación | p |
|---|---|---|---|---|---|
| MP | C | 3 | 0 | Exacta | <0.001 |
| 2 | 1 | Exacta | <0.001 | ||
| 1 | 2 | Exacta | <0.001 | ||
| B | 5 | 0 | Minstate | <0.004 | |
| Maxstate | <0.001 | ||||
| 4 | 1 | Minstate | <0.003 | ||
| Maxstate | <0.001 | ||||
| IB | C | 4 | 0 | Exacta | <0.001 |
| 3 | 1 | Exacta | <0.001 | ||
| 2 | 2 | Exacta | <0.001 | ||
| B | 5 | 2 | Minstate | <0.001 | |
| Maxstate | <0.001 |
Dado que el comportamiento social contó con múltiples reconstrucciones igualmente parsimoniosas (figuras no mostradas), se aplicó PCC sobre cada una de ellas para evaluar su asociación con las estrategias alimentarias. El número de ganancias y pérdidas para sociabilidad en cada reconstrucción parsimoniosa es indicado en la tabla y se parte de cualquiera de sus estados de carácter como ancestral en todas las pruebas. Se muestran los resultados para las 2 hipótesis filogenéticas (MP; IB). Se utilizaron las 2 estrategias de codificación binaria para estas pruebas (codificaciones B y C, tabla 1).
Cod: codificación; Estimación: método utilizado para el cálculo de probabilidades; G: ganancias; IF: inferencia bayesiana; MP: parsimonia; P: pérdidas.
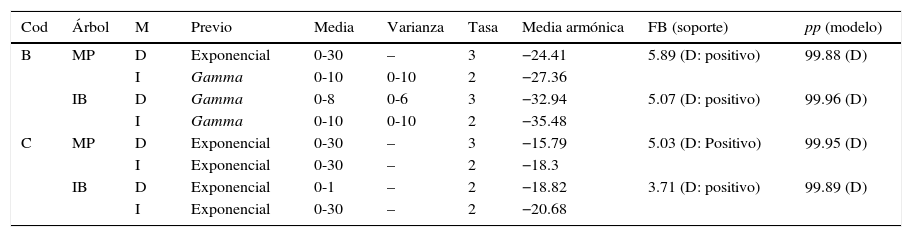
Condiciones de búsqueda y probabilidades marginales para los modelos dependientes e independientes de las estrategias alimentarias y el comportamiento social según las codificaciones binarias (codificaciones B y C, tabla 1) en función de las topologías derivadas de parsimonia e inferencia bayesiana.
| Cod | Árbol | M | Previo | Media | Varianza | Tasa | Media armónica | FB (soporte) | pp (modelo) |
|---|---|---|---|---|---|---|---|---|---|
| B | MP | D | Exponencial | 0-30 | – | 3 | −24.41 | 5.89 (D: positivo) | 99.88 (D) |
| I | Gamma | 0-10 | 0-10 | 2 | −27.36 | ||||
| IB | D | Gamma | 0-8 | 0-6 | 3 | −32.94 | 5.07 (D: positivo) | 99.96 (D) | |
| I | Gamma | 0-10 | 0-10 | 2 | −35.48 | ||||
| C | MP | D | Exponencial | 0-30 | – | 3 | −15.79 | 5.03 (D: Positivo) | 99.95 (D) |
| I | Exponencial | 0-30 | – | 2 | −18.3 | ||||
| IB | D | Exponencial | 0-1 | – | 2 | −18.82 | 3.71 (D: positivo) | 99.89 (D) | |
| I | Exponencial | 0-30 | – | 2 | −20.68 |
Se muestran los factores bayesianos con el modelo soportado entre paréntesis, así como con el nivel de soporte. La probabilidad posterior del modelo de saltos reversibles se muestra en la última columna, con el modelo favorecido entre paréntesis. El modelo de saltos reversibles indicó que los 8 parámetros del modelo dependiente no fueron necesarios en ninguna de las 4 comparaciones para explicar los datos con alta credibilidad (material suplementario 8).
D: dependientes; I: independientes; IB: inferencia bayesiana; M: modelos; MP: topologías derivadas de parsimonia; pp: probabilidad posterior.
Medias posteriores (con desviaciones estándar entre paréntesis) para los coeficientes de tasas.
| Cod | Árbol | Coeficiente | |||||||
|---|---|---|---|---|---|---|---|---|---|
| q12 | q13 | q21 | q24 | q31 | q34 | q42 | q43 | ||
| B | MP | 0.979 (2.87×10-3) | 6.53×10-2 (8.88×10-4) | 1.659 (3.12×10-2) | 2.995 (1.60×10-2) | 1.395 (1.65×10-2) | 2.436 (4.06×10-2) | 0.181 (1.31×10-3) | 0.861 (2.36×10-3) |
| IB | 1.249 (2.50×10-3) | 0.199 (2.66×10-3) | 2.989 (1.79×10-2) | 5.06 (1.36×10-2) | 2.76 (1.40×10-2) | 4.193 (1.96×10-2) | 0.673 (2.96×10-3) | 1.102 (2.86×10-3) | |
| C | MP | 0.819 (9.85×10-3) | 0.131 (2.23×10-3) | 9.847 (0.214) | 9.07 (0.102) | 8.604 (0.147) | 8.076 (0.119) | 0.93 (2.52×10-2) | 0.42 (2.19×10-2) |
| IB | 0.527 (6.49×10-4) | 5.07×10-2 (4.11×10-4) | 0.856 (2.28×10-3) | 1.406 (2.32×10-3) | 0.753 (2.47×10-3) | 0.957 (2.68×10-3) | 0.311 (1.37×10-3) | 0.226 (1.12×10-3) | |
Se muestran los resultados para las 2 hipótesis filogenéticas (MP=parsimonia, IB=bayesiana) y las 2 estrategias de codificación binaria utilizadas (codificaciones B y C, tabla 1).
Los coeficientes de tasas corresponden a la parametrización propuesta por Pagel (1994).
La codificación flexible (codificación B) corroboró estos resultados, pero abrió un escenario de reversiones facilitado por el comportamiento social (tabla 4). Los contrastes específicos mostraron que: I) las tendencias familiares tienden a evolucionar primero (pp: q12>q13=0.9077, iguales=0.0901); II) es más probable que la carnivoría evolucione en presencia del comportamiento familiar (pp: q24>q13=0.9631, iguales=0.0323) y III) las tendencias familiares tienden a hacer reversiones primero (pp: q43>q42=0.731, iguales=0.2521); una vez más, los contrastes en términos de las pérdidas fueron más inciertos. El árbol bayesiano confirmó estos resultados para las ganancias, con contrastes similares para I (pp: q12>q13=0.8105, iguales=0.1785) y II (pp: q24>q13=0.9293, iguales=0.0451); pero el resultado para III no fue confirmado (pp: q43>q42=0.3979, iguales=0.5181).
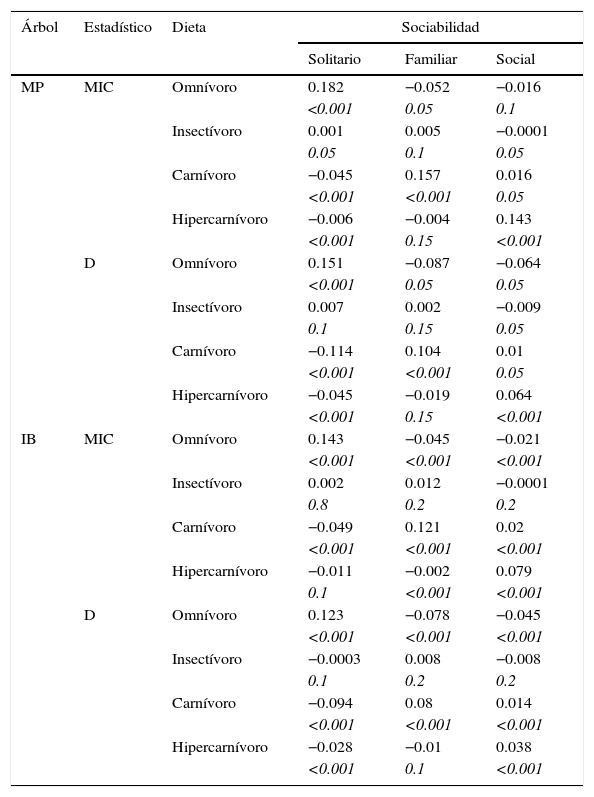
La evolución correlacionada fue corroborada bajo MEC usando la codificación multiestado (codificación A, tabla 1). Las estrategias alimentarias y el comportamiento social presentaron una asociación significativa bajo los 2 estadísticos evaluados sobre los árboles más parsimoniosos (MIC=0.391067, p<0.01; D=0.696597, p<0.01) y el consenso bayesiano (MIC=0.249985, p<0.01; D=0.550149, p<0.01). Las comparaciones por pares permitieron dilucidar relaciones más específicas entre estados de carácter (tabla 5). El patrón más consistente de todas las comparaciones es la correlación positiva de los estados: omnívoro-solitario, carnívoro-familiar e hipercarnívoro-social. Una correlación positiva entre preferencias carnívoras y tendencias sociales solo fue detectada bajo el árbol bayesiano. Las correlaciones negativas no fueron muy consistentes, pero en términos generales puede verse que el comportamiento solitario difícilmente evoluciona junto con las preferencias carnívoras (árbol parsimonioso: MIC y D, árbol bayesiano: D) o hipercarnívoras (árbol parsimonioso: MIC y D); que el comportamiento familiar difícilmente evoluciona junto con las preferencias omnívoras (árbol bayesiano: MIC y D) o hipercarnívoras (árbol bayesiano: MIC); así como que el comportamiento social no se correlaciona con las preferencias omnívoras (árbol bayesiano: MIC y D). La insectivoría no reveló ningún patrón particular de cambio con el comportamiento social, i. e., parecería que este hábito alimentario es no informativo y, por lo tanto, no se correlacionaría necesariamente con ningún comportamiento social entre los cánidos estudiados.
Resultados de la asociación entre estados de carácter de las estrategias alimentarias y el comportamiento social para los árboles más parsimoniosos (MP) y el consenso bayesiano (IB) según los estadísticos D y MIC.
| Árbol | Estadístico | Dieta | Sociabilidad | ||
|---|---|---|---|---|---|
| Solitario | Familiar | Social | |||
| MP | MIC | Omnívoro | 0.182 | −0.052 | −0.016 |
| <0.001 | 0.05 | 0.1 | |||
| Insectívoro | 0.001 | 0.005 | −0.0001 | ||
| 0.05 | 0.1 | 0.05 | |||
| Carnívoro | −0.045 | 0.157 | 0.016 | ||
| <0.001 | <0.001 | 0.05 | |||
| Hipercarnívoro | −0.006 | −0.004 | 0.143 | ||
| <0.001 | 0.15 | <0.001 | |||
| D | Omnívoro | 0.151 | −0.087 | −0.064 | |
| <0.001 | 0.05 | 0.05 | |||
| Insectívoro | 0.007 | 0.002 | −0.009 | ||
| 0.1 | 0.15 | 0.05 | |||
| Carnívoro | −0.114 | 0.104 | 0.01 | ||
| <0.001 | <0.001 | 0.05 | |||
| Hipercarnívoro | −0.045 | −0.019 | 0.064 | ||
| <0.001 | 0.15 | <0.001 | |||
| IB | MIC | Omnívoro | 0.143 | −0.045 | −0.021 |
| <0.001 | <0.001 | <0.001 | |||
| Insectívoro | 0.002 | 0.012 | −0.0001 | ||
| 0.8 | 0.2 | 0.2 | |||
| Carnívoro | −0.049 | 0.121 | 0.02 | ||
| <0.001 | <0.001 | <0.001 | |||
| Hipercarnívoro | −0.011 | −0.002 | 0.079 | ||
| 0.1 | <0.001 | <0.001 | |||
| D | Omnívoro | 0.123 | −0.078 | −0.045 | |
| <0.001 | <0.001 | <0.001 | |||
| Insectívoro | −0.0003 | 0.008 | −0.008 | ||
| 0.1 | 0.2 | 0.2 | |||
| Carnívoro | −0.094 | 0.08 | 0.014 | ||
| <0.001 | <0.001 | <0.001 | |||
| Hipercarnívoro | −0.028 | −0.01 | 0.038 | ||
| <0.001 | 0.1 | <0.001 | |||
En cada caso se muestra el valor del estadístico (arriba) y la probabilidad predictiva de que una asociación tan extrema como la observada pueda aparecer simplemente por azar (abajo, cursiva).
Todas las estimaciones indicaron de forma consistente que muy probablemente la forma a partir de la cual se diferenciaron los cánidos vivientes tuvo un hábito alimentario omnívoro, lo cual es consistente con la idea de que a través de su historia evolutiva los cánidos han partido de formas generalizadas desde las cuales han evolucionado en direcciones tanto hipocarnívoras como hipercarnívoras (Wang y Tedford, 2007). Los resultados indicaron que los cánidos vivientes suelen presentar hábitos alimentarios hacia la omnivoría y carnivoría, y que estos estados de carácter, a su vez, son los que presentan tasas de cambio más altas (en términos tanto de ganancias como de pérdidas). Esta tendencia de conservar hábitos alimentarios generalistas facilita la versatilidad evolutiva que caracteriza al grupo (Wang y Tedford, 2007). Aunque la hipercarnivoría ha aparecido por múltiples vías en la historia evolutiva de los cánidos, este grupo ha conservado características plesiomórficas comúnmente asociadas a la dieta omnívora, como la retención de pequeños talónidos y molares poscarnasiales (Van Valkenburgh, 1991). Esto concuerda con las bajas tasas de cambio hacia la hipercarnivoría y su aparición tardía en las reconstrucciones de estados ancestrales.
Por otra parte, la forma ancestral de los cánidos vivientes fue reconstruida como solitaria, mientras que la tendencia a evolucionar en comportamientos altamente sociales fue baja. En sí, la sociabilidad puede resultar costosa para los individuos que cooperan. Los cánidos son inusuales entre los mamíferos por presentar características como monogamia, monoestro, falso embarazo en hembras que no conciben, supresión reproductiva de los subordinados, producción de crías altriciales y cuidado aloparental, incluso por parte de los machos (Asa, 1997). Muchas de estas características mantienen la unidad social y son ventajosas pues permiten incrementar la eficiencia en el acceso al alimento, el éxito reproductivo y la supervivencia (Macdonald et al., 2004). No obstante, algunas de esas características también pueden reducir los tamaños poblacionales efectivos que, sumados a fenómenos como el efecto Allee, la actividad migratoria y la competición intragrupal, pueden hacer que las especies sociales sean particularmente vulnerables a procesos de extinción (Asa, 1997; Macdonald, 1983; Macdonald et al., 2004; Maier, 2001; Muñoz-Durán, 2002, 2010).
En cuanto a la relación del hábito alimentario y el comportamiento social, todos los métodos utilizados sobre las diferentes hipótesis filogenéticas mostraron evidencias a favor de una evolución correlacionada entre ellos. Estos resultados corroboran la hipótesis de que la cooperación ha jugado un papel importante en la evolución de la cacería de los cánidos actuales (Muñoz-Durán, 2002; Van Valkenburgh et al., 2003). Tanto PCC como MMCT mostraron evidencias a favor de la relación entre las dietas carnívoras con las tendencias grupales y, específicamente, las dietas hipercarnívoras con los comportamientos altamente sociales. MEC corroboró estas asociaciones indicando que es más probable ver hábitos omnívoros en cánidos solitarios, pero no en aquellos con tendencias sociales, mientras que las dietas carnívoras no suelen acompañarse de comportamientos solitarios. De esta manera, parecería entonces que con el aumento en la sociabilidad se tienden a incrementar las preferencias carnívoras.
En términos de las tasas de cambio de los caracteres evaluados, la probabilidad de cambio fue más alta para el comportamiento social que para las estrategias alimentarias, pero, además, MMCT permitió determinar ciertos patrones en la predisposición de cambios entre dieta y sociabilidad. Por una parte, el comportamiento social tiende a evolucionar antes que las estrategias carnívoras en los cánidos actuales y es en este contexto evolutivo en el que las preferencias carnívoras tienen más probabilidades de aparición. Esto indica que la sociabilidad pudo aparecer primero promovida por múltiples causas ajenas a la carnivoría, con lo que la caza cooperativa y, particularmente, los rasgos craneodentales asociados a este tipo de dieta (v. g., áreas de maceración relativamente reducidas en la dentición, superficies de corte acentuadas en los carnasiales, caninos e incisivos grandes, hocicos y occipitales anchos, mandíbulas profundas, mayor ventaja mecánica de los músculos temporal y masetero, crestas sagitales desarrolladas, cráneos firmes, acinéticos y robustos) vendrían siendo una consecuencia de la vida en grupo, más que su causa evolutiva (Fanshawe y Fitzgibbon, 1993).
La hipótesis dispersión y disponibilidad de recursos es un buen ejemplo de cómo el surgimiento de la sociabilidad en los carnívoros puede explicarse sin recurrir a la caza cooperativa (Bekoff et al., 1984; Geffen et al., 1996; Macdonald, 1983; Macdonald et al., 2004; Moehlman y Hofer, 1997). Las especies de carnívoros que viven en áreas con poca disponibilidad de alimento tienen camadas pequeñas y viven en parejas o grupos reducidos, mientras que las especies que habitan en áreas donde la comida es abundante tienen camadas más grandes y viven en grupos más numerosos (Geffen et al., 1996). El origen de diferentes estrategias sociales en los cánidos puede subyacer en patrones de distribución de recursos que disminuyeron la necesidad de dispersarse y permitió que los lazos familiares persistieran hasta la adultez (Macdonald, 1983).
El establecimiento de grupos posibilita la aparición de nuevos candidatos de selección, ahora más ligados a la sociabilidad propiamente dicha. Por ejemplo, en mamíferos se ha encontrado que la vida en grupo puede reducir las tendencias neofóbicas de sus integrantes, donde la probabilidad de consumir alimentos nuevos aumenta en presencia de conespecíficos (Maier, 2001). Esto ofrece un escenario para entender por qué algunos cánidos con tendencias familiares presentan preferencias carnívoras, aun cuando no dependen de la cacería cooperativa para obtener sus presas. En el caso de los cánidos hipercarnívoros, la sociabilidad les otorgaría una solución alternativa para someter presas que no estarían disponibles si las cazaran individualmente, a diferencia de lo que sí pueden hacer otros carnívoros altamente especializados hacia la carnivoría, como los félidos (Muñoz-Durán, 2002). Esta falta de especialización trófica puede llevar a pensar en los cánidos recientes como análogos pobres de sus parientes fósiles, tanto en términos morfológicos como en comportamiento (Andersson, 2003). No obstante, esta falta de especialización pudo haber incrementado la plasticidad ecológica al permitirles retener habilidades para explotar recursos limitados en épocas de escasez, y evolucionar en comportamientos alimentarios tanto omnívoros como carnívoros (Maier, 2001; Van Valkenburgh, 1991).
El comportamiento social podría ser una pieza clave en la conservación de dicha plasticidad ecológica. La codificación binaria estricta no mostró un escenario claro de reversiones una vez que se habían alcanzado tanto la hipercarnivoría como conductas altamente sociales. Pero aunque no fue consistente, un escenario de reversiones mediado por el comportamiento social se presentó bajo la codificación flexible: vale decir, al incluir cánidos con hábitos sociales y carnívoros menos elaborados. Así, el comportamiento social podría mediar las tendencias de cambio que permiten a los cánidos retornar a hábitos más generalistas, reduciendo las restricciones asociadas a la especialización trófica. Por ejemplo, las familias Felidae y Nimravidae exhibieron una reducción y una pérdida de molares poscarnasiales tempranas en su historia, lo cual les permitió adquirir dietas altamente carnívoras que incrementan la fuerza de mordida en los caninos, pero que apenas sufrieron reversiones (Van Valkenburgh, 1991). Este diseño probablemente garantizó el éxito ecológico de sus portadores en ambientes estables; sin embargo, serían particularmente vulnerables ante alteraciones del ecosistema y, por lo tanto, a su potencial extinción, tal como ocurrió con los hipercarnívoros de gran tamaño a finales del Pleistoceno (Wang et al., 2004a,b). Tal es el caso del león americano Panthera leo atrox, con un peso estimado alrededor de los 300kg (Lange, 2002).
Canis lupus es un buen ejemplo de esta flexibilidad fenotípica, pues aunque vive en manadas numerosas y exhibe estrategias coordinadas de cacería para derribar ungulados de gran tamaño, puede ser encontrado en grupos pequeños o incluso cazando en solitario (Asa, 1997). Al parecer, el tamaño de la camada en esta especie está relacionado con la disponibilidad de presas, consistente con la hipótesis de dispersión y disponibilidad de recursos (Schmidt y Mech, 1997). Incluso Lycaon pictus, que parece ser un cazador cooperativo más obligado que el mismo C. lupus, regularmente caza gacelas de forma solitaria, lo que ha llevado a pensar que la cacería cooperativa es más probable cuando el éxito individual es bajo (Asa, 1997; Fanshawe y Fitzgibbon, 1993).
Similar a C. lupus, el reclutamiento y tamaño grupal en C. latrans puede estar relacionado con la disponibilidad de presas (Moehlman y Hofer, 1997; Schmidt y Mech, 1997). No obstante, las especies sociales de mayor tamaño tienden a ser dominantes al competir con otros carnívoros simpátricos (Muñoz-Durán, 2010). La competencia intensa genera mayor saturación de hábitat, lo que a su vez puede afectar la estructura social de las especies que presentan vida en grupo, especialmente las menos dominantes (Bekoff et al., 1984; Moehlman y Hofer, 1997). De esta manera, C. latrans pudo haber estado restringido históricamente para adoptar hábitos más hipercarnívoros por efectos de la competencia con especies más dominantes como C. lupus.
A diferencia de C. lupus y L. pictus, cuyas presas son abundantes y grandes, las presas de C. simensis son abundantes pero pequeñas (Macdonald et al., 2004). Esta última especie de depredador se encuentra confinada a las tierras altas de Etiopía, donde se alimenta fundamentalmente de roedores (Moehlman y Hofer, 1997). En este caso, la abundancia de presas pudo haber generado la disponibilidad de recursos que promovió el surgimiento de la sociabilidad (Bekoff et al., 1984; Macdonald et al., 2004), lo que facilitó, a su vez, la aparición de preferencias carnívoras. Pero como el tamaño de estos roedores no constituye una presión selectiva que dé lugar a la hipercarnivoría, esta especie ha retenido características morfológicas generalistas sin que esto afecte sus preferencias tróficas ni la vida en grupo (Muñoz-Durán y Fuentes, 2012).
Comparada con una especie adaptada para la hipercarnívora, C. simensis tendría mayores probabilidades de retornar a hábitos solitarios y adoptar una dieta más omnívora en caso de una perturbación ambiental. Aunque este es un escenario hipotético para C. simensis, podría describir parcialmente el contexto en el que evolucionó Vulpes lagopus. Las estimaciones de estados ancestrales favorecieron un escenario evolutivo en que las especies holárticas del género Vulpes ganaron las tendencias grupales tempranamente en su historia evolutiva, pero se fueron perdiendo en el linaje que conduce a V. lagopus. Este zorro solitario presenta tamaños de camada mucho más grandes que los esperados, con promedios comparables a los de L. pictus, un cánido altamente social. V. lagopus vive en la tundra ártica y alpina de Eurasia, donde depende fuertemente de las marcadas fluctuaciones poblacionales que presentan los roedores de los cuales se alimenta principalmente (Macdonald et al., 2004; Moehlman y Hofer, 1997). Esto implica que en repetidas ocasiones esta especie haya contado con territorios muy pequeños para sus necesidades metabólicas grupales, dado que la riqueza y heterogeneidad de los parches disponibles no es constante (Macdonald et al., 2004). A través del tiempo, un escenario como este podría explicar la reversión de la sociabilidad, pero al mismo tiempo la retención de camadas numerosas y hábitos carnívoros que suelen caracterizar a zorros familiares como V. macrotis y V. vulpes (Macdonald et al., 2004).
A diferencia de V. lagopus, C. brachyurus no presentó antecedentes de carnivoría o sociabilidad mediante la estimación de estados ancestrales. Como es un cánido grande, las predicciones a partir del tamaño indican que debería vivir en grupos, producir camadas numerosas y presentar cuidado aloparental, pero tales predicciones no se cumplen en esta especie (Moehlman y Hofer, 1997). A diferencia de C. lupus y L. pictus, C. brachyurus vive en un ambiente donde no hay disponibilidad de presas grandes. Este es un cánido omnívoro que se alimenta fundamentalmente de roedores y frutas (Moehlman y Hofer, 1997). Pero a diferencia de C. simensis, las presas de C. brachyurus no están disponibles a una biomasa alta, lo que, además de limitar su tamaño de grupo, puede hacer que el costo de conseguir alimento resulte tan alto que las posibilidades de alimentar una camada se reduzcan (Asa, 1997; Bekoff et al., 1984; Macdonald et al., 2004; Moehlman y Hofer, 1997). Así, la sociabilidad no ha marcado la historia evolutiva reciente de esta especie, la cual morfológicamente parecería ligada a la vida en grupo y a las preferencias carnívoras. Este efecto evolutivo sí lo encontramos en Speothos venaticus, un cánido de tamaño mediano que podría predecirse como solitario cuando en realidad es social e hipercarnívoro (Beisiegel y Zuercher, 2005).
Esta asociación entre comportamiento social y preferencias alimentarias en los cánidos actuales y, a su vez, la estrecha relación que existe entre este último rasgo con su anatomía craneodental (Bekoff et al., 1984; Muñoz-Durán y Fuentes, 2012; Van Valkenburgh et al., 2003), resalta la relevancia de otras interrogantes relacionadas con la historia evolutiva de esta familia de carnívoros. Por un lado, conduce a considerar cómo la morfología se relaciona con la sociabilidad, en tanto que la dieta se encuentra asociada con ambas. Por otro lado, la morfología, un rasgo susceptible de ser estudiado en el registro fósil, abriría las puertas para abordar preguntas acerca del comportamiento en linajes extintos, asociadas a caracteres que no suelen preservarse. Incrementos en las preferencias carnívoras asociados con características anatómicas particulares podrían indicar niveles de sociabilidad altos en cánidos extintos. No obstante, nuestros resultados indican que algunos linajes sociales no podrán ser identificados bajo esta estrategia puesto que la sociabilidad puede evolucionar antes que las preferencias carnívoras y, por ende, en ausencia de los rasgos morfológicos que caracterizan a este tipo de dieta. Es importante tener esto en cuenta para abordar el problema de la sociabilidad en un contexto filogenético más amplio, con el objeto de determinar qué especies de la familia Canidae fueron sociales, así como cuándo, dónde y bajo qué contexto ecológico evolucionaron.
A Paul Lewis por sus valiosos comentarios y recomendaciones en la implementación de métodos probabilísticos para estimación filogenética y evolución de caracteres. A Carlos Sarmiento por sus sugerencias y las discusiones sobre versiones preliminares de este manuscrito. Al grupo de Ecología Evolutiva de la Universidad Nacional de Colombia, en especial a Jimmy Quintero, Carlos Morantes y Ludwig Jiménez, por su ayuda en la revisión de la literatura relacionada con rasgos ecológicos y de comportamiento. Dos evaluadores anónimos aportaron valiosos comentarios que mejoraron el artículo. Este trabajo fue posible gracias al apoyo económico de la División de Investigación Bogotá (DIB, proyecto 8373), Colciencias (proyecto 192-2007) y de la Facultad de Ciencias de la Universidad Nacional de Colombia.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.