La riqueza y abundancia de briofitas en espacios urbanos puede ser un indicador de calidad del ambiente. En México los estudios sobre la diversidad briológica de áreas urbanas y su uso en el monitoreo ambiental son escasos. En este estudio se identificó la riqueza de musgos epifitos de la zona metropolitana del valle de Toluca (ZMVT) a partir de la recolecta de todas las especies. Adicionalmente, las colonias de musgos se muestrearon por el método en parcela, para determinar las variaciones de su diversidad en 16 zonas verdes. Se encontró una riqueza de 41 especies y variedades incluidas en 16 familias: la familia Pottiaceae fue la más numerosa y frecuente. El 65% de las especies tienen una distribución geográfica amplia. Los estimadores Jacknife 1 y bootstrap indican que el inventario presenta entre el 71 y 85% de los taxones esperados. Las colonias de musgos epifitos tienden a ser diversas (H=2.3) y están representadas en orden de importancia por Syntrichia amphidiacea, Leskea angustata, Syntrichia fragilis, Syntrichia pagorum y Fabronia ciliaris, que fueron las especies con mayor peso ecológico. Las zonas verdes analizadas presentan baja similitud promedio (ISj=0.30) asociada potencialmente a las condiciones microclimáticas y a su cercanía a los centros urbanos.
The richness and abundance of bryophytes in urban areas may be an indicator of environmental quality. In Mexico studies about moss diversity in urban areas and their use in environmental monitoring are scarce. This study identified the richness of epiphytic mosses of the metropolitan area of the Toluca Valley from the collection of all species present. Additionally, colonies of mosses were sampled plot method to determine the variations of their diversity in 16 parks. Floristic richness comprised 41 species and varieties included in 16 families among wich the Pottiaceae was the most numerous and frequent family. Sixty-five percent of the species have a wide geographic distribution. The Jacknife 1 and bootstrap estimators indicate that the inventory has between 71 and 85% of expected taxa. The epiphytic moss colonies tend to be diverse (H=2.3) and are represented, in order of importance by Syntrichia amphidiacea, Leskea angustata, S. fragilis, S. pagorum and F. ciliaris that were those with high ecological weight. The green areas analyzed have low average similarity (ISj=0.30) potentially associated with their microclimatic conditions and their proximity to urban centers.
Como un tipo especial de ecosistema, las ciudades albergan una riqueza biológica significativa aunque, generalmente poco conocida (Kowarik, 2011). En las áreas verdes urbanas es posible encontrar numerosas plantas, incluyendo briofitas (Anthocerophyta, Marchantiophyta y Bryophyta), las cuales típicamente han recibido poca atención en los estudios de diversidad debido a su naturaleza críptica y tamaño pequeño (Suzanne y Macdonald, 2004). Sin embargo, algunas especies de estas pequeñas plantas pueden ser muy comunes en ciertos microambientes urbanos y dado que algunas son sensibles a los disturbios antropogénicos (Suzanne y Macdonald, 2004; Sabovljevic y Grdovic, 2009), en diferentes partes del mundo han servido para determinar la calidad de los biótopos y el impacto de las actividades humanas, en particular el grado de urbanización y la presencia de áreas con problemas de contaminación (Rao, 1982; Bako y Afolabi, 2008; Ron et al., 2008).
Las comparaciones sobre la composición de especies de briofitas de diferentes espacios urbanos y suburbanos alrededor del mundo, indican como tendencia general que el crecimiento, reproducción, abundancia y diversidad de las briofitas, específicamente de los musgos (Bryophyta), se encuentran disminuidos en zonas con alta influencia y contaminación antrópica (Giordano et al., 2004; Zvereva y Kozlov, 2011), en contraste con áreas suburbanas y rurales, en las que tienden a aumentar por la presencia de un mayor número de hábitats potenciales. Las actividades humanas habitualmente conducen a la pérdida y fragmentación del hábitat, así como al establecimiento de filtros de selección y dispersión de especies (Kowarik, 2011); las briofitas que se mantienen en áreas urbanas suelen ser tolerantes al estrés causado por perturbaciones naturales o antropogénicas (Longton, 1997) y muestran tanto en su ciclo de vida como a través de su reproducción asexual, niveles de tolerancia y especialización funcional y morfológica que les permiten responder a disturbios estacionales, colonizar con rapidez diversos espacios (Glime, 2007) y mantenerse en condiciones desfavorables para después reverdecer. Es por esto que la composición de las colonias de briofitas y, en especial, la sensibilidad o resistencia que exhiben algunos musgos a la contaminación del aire, han mostrado ser buenos indicadores en programas de monitoreo y calidad ambiental (Rao, 1982; Bako y Afolabi, 2008; Zvereva y Kozlov, 2011).
En México los musgos son el grupo de las briofitas más conocido: actualmente se registran 984 especies y variedades (Delgadillo, 2012) gracias a los numerosos trabajos florísticos, fitogeográficos y taxonómicos que durante más de 4 décadas se han realizado en diferentes partes del territorio mexicano. No obstante, la información sobre la riqueza y abundancia de musgos de centros urbanos es escasa. En el país la zona metropolitana más conocida y ampliamente estudiada desde el punto de vista briológico, es la ciudad de México (Cárdenas, 1988); en ella se ha reconocido la presencia de 87 especies y variedades de musgos (Delgadillo y Cárdenas, 2000). Desafortunadamente, la intensa contaminación de esta gran metrópoli ha provocado un decremento en la frecuencia, biomasa y número de especies de musgos (Durán et al., 1992), y como en otros países (Schulze et al., 2004; Nöske et al., 2008), el cambio de uso de suelo prácticamente ha eliminado su hábitat natural y resulta ser la causa principal de la extinción de varias de ellas (Delgadillo y Cárdenas, 2000). Un fenómeno similar se ha determinado en la ciudad de Morelia, Michoacán, donde la diversidad, cobertura, frecuencias y vitalidad de las poblaciones de musgos (Prado, 2009) y líquenes epifitos se han visto afectadas negativamente por el deterioro de la vegetación y las diferentes emisiones de contaminantes (Alvarado y Gómez, 2010).
A partir de la década de los 60, la zona metropolitana del valle de Toluca (ZMVT) se convirtió en un polo de desarrollo económico con fuertes problemas demográficos y de contaminación. Actualmente, se considera la segunda concentración poblacional más importante del Estado de México y la quinta del país (Gobierno del Estado de México, 2011). Los problemas ambientales de esta zona y la necesidad de plantear alternativas para su solución, demandan el conocimiento de su diversidad, particularmente de aquellos organismos que pueden ser indicadores de la calidad del ambiente, como es el caso de los musgos. Al formar parte del Eje Neovolcánico y particularmente del Corredor Florístico Toluca, la ZMVT potencialmente conserva una riqueza de musgos alta, como lo proyectan de forma general las investigaciones previas (Delgadillo, 2009, 2012; Cuevas, 2010). Sin embargo, en las áreas verdes de la ciudad se desconoce la abundancia y tamaño de las colonias de musgos, así como su distribución local. En este sentido, el presente trabajo propone registrar las especies de musgos epifitos y determinar las variaciones de su diversidad en zonas urbanas y suburbanas del valle de Toluca. Considerando que la riqueza de especies y las diferencias en la distribución local de musgos pueden reflejar la calidad de los ambientes, la información generada puede aportar criterios y establecer las bases para implementar programas de evaluación y monitoreo del ambiente.
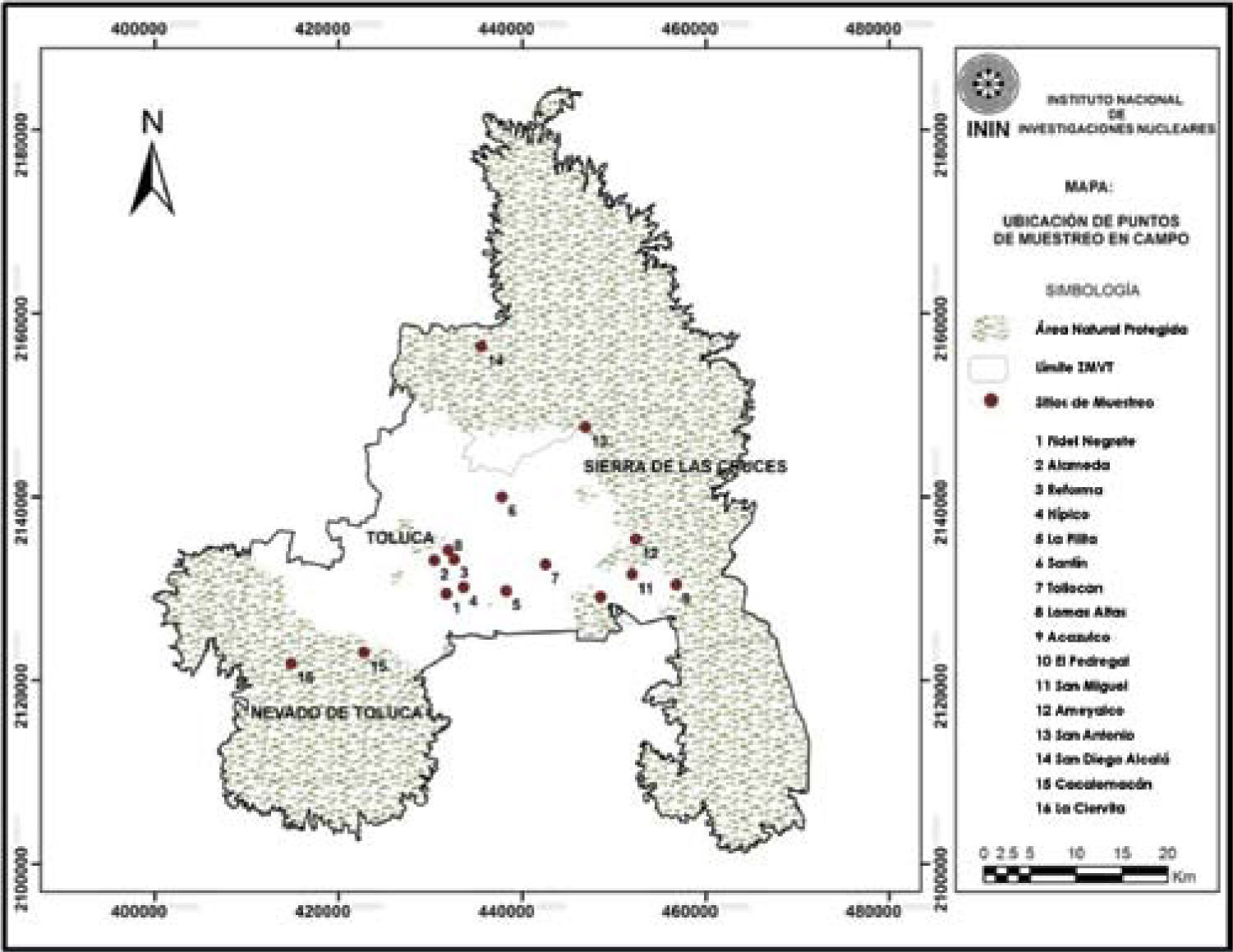
Materiales y métodosZona de estudioLa zona metropolitana del valle de Toluca (ZMVT) se localiza en la parte central del Estado de México, entre los 19°27’46” y 19°03’52” de latitud norte y 99°54’15” y 99°19’06” de longitud oeste. Se extiende sobre una superficie de 1 208.55 km2 con altitud promedio de 2 660 m snm. La mayor parte del valle presenta clima templado subhúmedo con lluvias en verano (C(w2)(w)b(i)g), temperatura media anual de 12° C y precipitación media anual de 800 a 1 200 mm (Gobierno del Estado de México, 2011). En las partes altas el clima es frío o semifrío subhúmedo con temperaturas anuales promedio de -2 a 5° C (Gobierno del Estado de México, 2011).
En la ZMVT se seleccionaron dieciséis zonas verdes, 8 correspondieron a parques urbanos dominados por árboles ornamentales y 8 zonas más, a espacios rurales con remanentes de vegetación natural (Fig. 1). Se recolectaron ejemplares de musgos epifitos de cada área de muestreo para elaborar una lista general de especies para la ZMVT. Los organismos se preservaron y manejaron siguiendo las técnicas recomendadas por Delgadillo y Cárdenas (1990). La determinación de los ejemplares se realizó mediante la Flora de musgos de México (Sharp et al., 1994), el Manual de musgos del valle de México (Cárdenas y Delgadillo, 2009) y revisiones taxonómicas recientes. La nomenclatura utilizada y la consulta sobre la distribución geográfica de los taxones de musgos se basaron en Cárdenas y Delgadillo (1992), Delgadillo (2000a, b) y en la versión digital actualizada de LATMOSS (2010), donde se definen los patrones de distribución geográfica y sus respectivas referencias bibliográficas.
Las colonias de musgos epifitos se evaluaron en 10 árboles de la(s) especie(s) más abundantes de cada zona verde. La evaluación se hizo por el método de muestreo en parcela (Brower et al., 1997) y a 3 diferentes niveles del tronco: de 50 cm hasta 1 m de altura, de 1 m hasta 1.5 m y de 1.5 m hasta los 2 m. Sobre los troncos y a cada nivel, se colocó una banda horizontal de polietileno de 30 cm de alto, cuya longitud varió según la circunferencia del tronco y permitió calcular el área total muestreada. Para estimar la cobertura de cada especie de musgo epifito, todas las colonias cubiertas por la banda de polietileno se mapearon sobre la misma y se rotularon según la especie. Los muestreos se hicieron en octubre de 2010.
Análisis de datosRiqueza y valor de importancia. La riqueza de musgos epifitos de la ZMVT se definió como el número de especies registradas en todas las zonas verdes. Para explicar la presencia o ausencia de algunos musgos en cada zona verde, se realizó un análisis de la contribución de especies por familia y otro de la distribución geográfica de los taxones reportados. Para determinar el grado de completitud del inventario se crearon curvas de acumulación de taxones infragenéricos, especies y variedades, empleando 2 estimadores no paramétricos: bootstrap y Jacknife 1. Se usaron estos estimadores porque Jacknife 1 no asume homogeneidad ambiental en la muestra y bootstrap arroja resultados más precisos al estimar la riqueza de ensamblajes con gran cantidad de especies raras (Magurran, 2004, Colwell, 2008). Los valores se obtuvieron con el programa EstimateS versión8 (Colwell 2008), empleando 1 000 iteraciones con reemplazo en las muestras. Las comparaciones de las curvas de acumulación de especies están dadas con base en los intervalos de confianza del 95% generado por el programa EstimateS.
Los mapas de las colonias de musgos epifitos realizados en campo se escanearon con una medida de referencia y con ayuda del software SigmaScanPro versión 5 (SPSS, 1999) se calculó el área (cm2) de cada colonia de musgo. Con esta información se determinó el valor de importancia (VI) de las especies de cada zona verde y se calculó, de acuerdo con Brower et al. (1997): 1) la densidad relativa (Dr=número total de colonias de la especie i/número total de colonias de todas las especies); 2) la cobertura relativa (Cr=suma total del área en centímetros cuadrados cubierta por la especie i/suma total del área en centímetros cuadrados de todas las especies); 3) la frecuencia (F=número de bandas en la cual la especie i ocurrió/número total de bandas realizadas); 4) la frecuencia relativa (Fr=frecuencia de la especie i/suma de frecuencias de todas las especies) y 5) el valor de importancia (VI=suma de los valores relativos de densidad, cobertura y frecuencia). Los VI de las especies de cada zona verde se usaron para determinar grupos de musgos con mayor peso ecológico: para ellos se aplicó un análisis de clasificación con el método Ward, varianza mínima, con medidas de distancia euclidiana en el programa Statistica 7 (StatSoft, 2004). De esta forma se obtuvieron conjuntos de especies según su importancia proporcional calculada en función de los valores relativos de densidad, cobertura y frecuencia de cada especie.
Diversidad alfaLa diversidad de musgos epifitos total y de cada zona verde se calculó mediante los índices de diversidad de Shannon (H´) y el inverso del índice de Simpson (Zar, 1999) en el programa PAST 1.90 (Hammer et al., 2001). Los valores obtenidos para cada zona verde se compararon por medio de una prueba de t-Student modificada (Zar, 1999) para establecer diferencias significativas. Adicionalmente y como complemento de los índices de diversidad, se calculó el índice de uniformidad de Pielou (J’) para determinar la equidad en la abundancia de las especies de musgos para toda la ZMVT y de cada zona verde. El valor del índice de Simpson se usó para determinar la dominancia de especies (Moreno, 2001) a los mismos niveles. Para comparar la composición, abundancia y uniformidad de especies entre las zonas verdes se realizaron gráficas de intervalo-abundancia y intervalo-cobertura.
Diversidad betaPara comparar el grado de similitud o asociación de especies entre las zonas verdes, se ejecutó en el programa PAST 1.90 (Hammer et al., 2001) un análisis de clasificación, utilizando la estrategia aglomerativa de la media aritmética sin ponderación (UPGMA, Unweighted Pair Group Method using Arithmetic Averages) como medida de agrupamiento y el índice de similitud de Jaccard como medida de proximidad. Los valores del índice de Jaccard van de 0 (cuando un par de sitios son diferentes) a 1 cuando son idénticos (Moreno, 2001). Adicionalmente, se evaluó la complementariedad (1-Jaccard) como el grado de disimilitud en la composición de musgos epifitos entre pares de zonas verdes (Colwell y Coddington, 1994). El valor del índice de complementariedad varía de 0 cuando 2 sitios son idénticos en su composición, a 1 cuando son totalmente diferentes, es decir, el valor obtenido tiene un significado inverso a la similitud, indicando la tasa de recambio entre pares de sitios o diversidad beta (Moreno, 2001; Magurran, 2004).
ResultadosRiquezaEn la zona metropolitana del valle de Toluca se encontraron 39 especies de musgos epifitos, entre las cuales hay 4 variedades (Cuadro 1). El 60% de las especies fueron acrocárpicas y el resto pleurocárpicas. Todo el conjunto se agrupó en 16 familias, la familia Pottiaceae presentó el mayor número de especies (11), seguida de Bryaceae y Orthotrichaceae con 5 e Hypnaceae con 4; el resto presentó 1 o 2 especies.
Lista de especies de musgos epifitos y su área de distribución geográfica. AD: amplia distribución, CAR: Caribe, END: endémico, MES: mesoamericano, NOR: norteamericano
| Familia y especies | Distribución |
| Brachytheciaceae | |
| Brachythecium ruderale (Brid.) W. R. Buck | AD |
| Bryaceae | |
| Brachymenium sp. | |
| Brachymenium systylium (Müll. Hal.) A. Jaeger | AD |
| Bryum argenteum Hedw. | AD |
| Bryum billarderi Schwägr. | AD |
| *Bryum procerum Schimp. | MES |
| Cryphaeaceae | |
| Cryphaea patens Hornsch. | CAR |
| Dicranaceae | |
| Campylopus pilifer Brid. | AD |
| Symblepharis vaginata (Hook.) Wijk & Margad. | AD |
| Entodontaceae | |
| Entodon abbreviatus (Schimp.) A. Jaeger | END |
| Fabroniaceae | |
| Fabronia ciliaris (Brid.) Brid. | AD |
| Fissidentaceae | |
| *Fissidens angustelimbatus Mitt. | AD |
| Grimmiaceae | |
| Grimmia trichophylla Grev. | AD |
| Hedwigiaceae | |
| Hedwigidium integrifolium (P. Beauv.) Dixon | AD |
| Hypnaceae | |
| *Homomallium mexicanum Cardot | NOR |
| *Hypnum cupressiforme Hedw. var cupressiforme | AD |
| Platygyriella pringlei (Cardot) W. R. Buck | MES |
| Pylaisia falcata Schimp. | AD |
| Leskeaceae | |
| Leskea angustata Taylor | MES |
| *Rozea andrieuxii (Müll. Hal.) Besch. | MES |
| Leucodontaceae | |
| Leucodon sp. | |
| Neckeraceae | |
| Neckera sp. | |
| Orthotrichaceae | |
| *Orthotrichum aequatoreum Mitt. | AD |
| *Orthotrichum diaphanum Schrad. ex Brid. | AD |
| Orthotrichum pycnophyllum Schimp. ex Müll. Hal. | MES |
| Orthotrichum sp. | |
| *Zygodon obtusifolius Hook. | AD |
| Pottiaceae | |
| Bryoerythrophyllum jamesonii (Taylor) H. A. Crum | AD |
| Didymodon australasiae (Hook. & Grev.) R. H. Zander | AD |
| Didymodon rigidulus Hedw. var. gracilis (Schleich. ex Hook.Grev.) R.H. Zander | AD |
| Didymodon rigidulus Hedw. var. icmadophilus (Schimp. ex Müll. Hal.) R. H. Zander | AD |
| Didymodon rigidulus var. rigidilus Hedw. | AD |
| Leptodontium flexifolium (Dicks. ex With.) Hampe | AD |
| Leptodontium viticulosoides (P. Beauv.) Wijk & Margad. | AD |
| Rhexophyllum subnigrum (Mitt.) Hilp. | MES |
| Syntrichia amphidiacea (Müll. Hal.) R. H. Zander | MES |
| Syntrichia fragilis (Taylor) Ochyra | AD |
| *Syntrichia pagorum (Milde) Amann | AD |
| Sematophyllaceae | |
| Sematophyllum subpinnatum (Brid.) E. Britton | AD |
| *Sematophyllum subsimplex (Hedw.) Mitt. | AD |
| Thuidiaceae | |
| Thuidium delicatulum (Hedw.) Schimp. | AD |
Especies que se adicionan a la lista del Corredor florístico de Toluca citada por Delgadillo (2009).
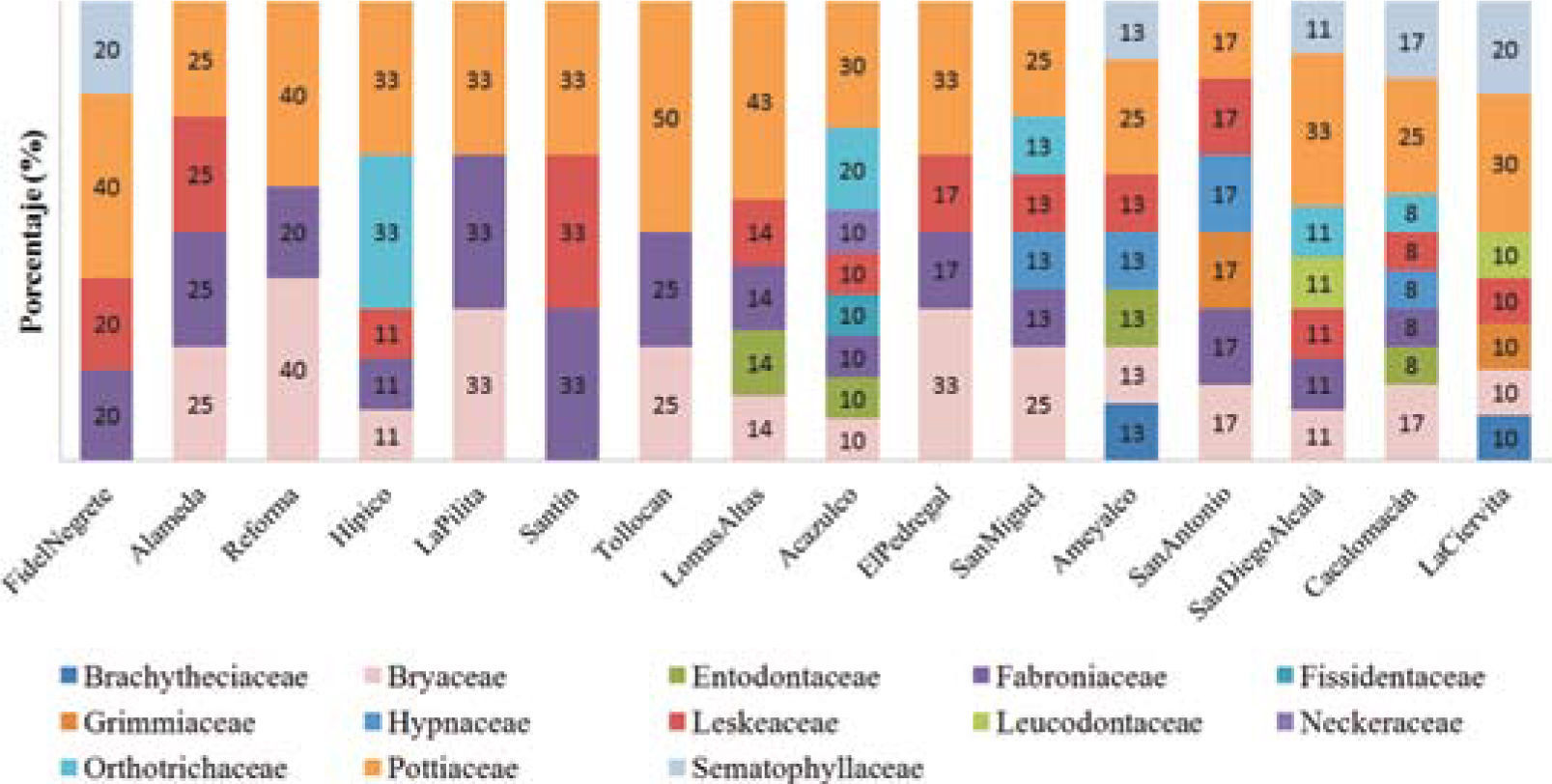
Al analizar la contribución de especies por familia en cada zona verde se encontró que la familia Pottiaceae fue la más diversa (de 17 a 50%) y ampliamente distribuida dentro de las zonas verdes. En segundo lugar se ubica la familia Bryaceae (de 10 a 40%), mientras que las familias restantes mostraron una desigualdad en las proporciones (Fig. 2).
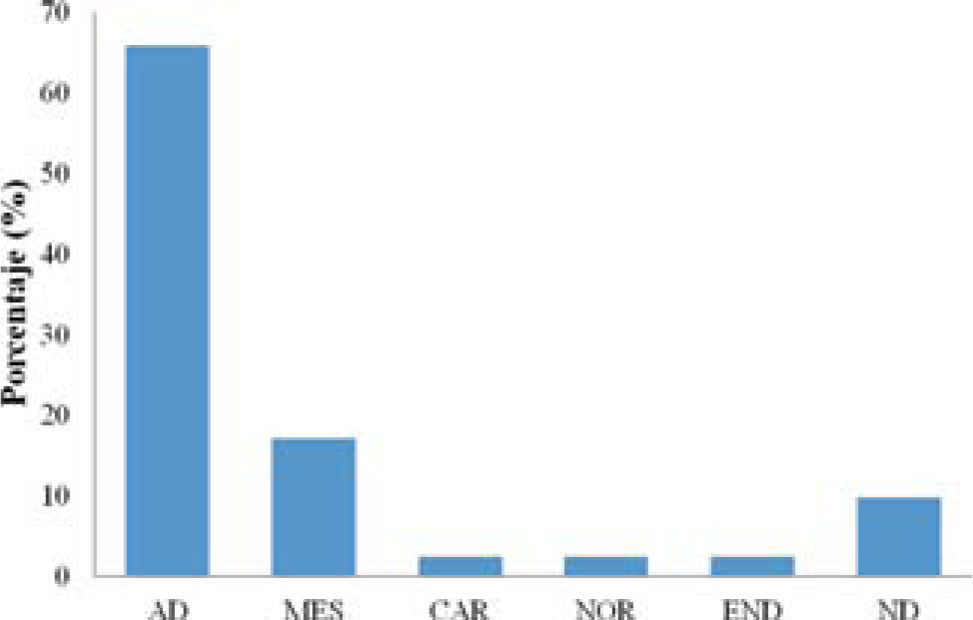
El análisis de la distribución mundial de la flora de musgos epifitos de la ZMVT muestra que 65% de las especies son de amplia distribución, dentro de este grupo se encuentra una especie cosmopolita (Bryum argenteum) y 3 especies bicontinentales (Symblepharis vaginata, Fissidens angustelimbatus y Orthotrichum aequatoreum). Los organismos que se distribuyen únicamente en el continente americano corresponden a especies mesoamericanas (17%), norteamericanas (2%) y un elemento endémico de México (Entodon abbreviatus). De otras regiones sólo se registra una especie con distribución caribeña (Cuadro 1; Fig. 3).
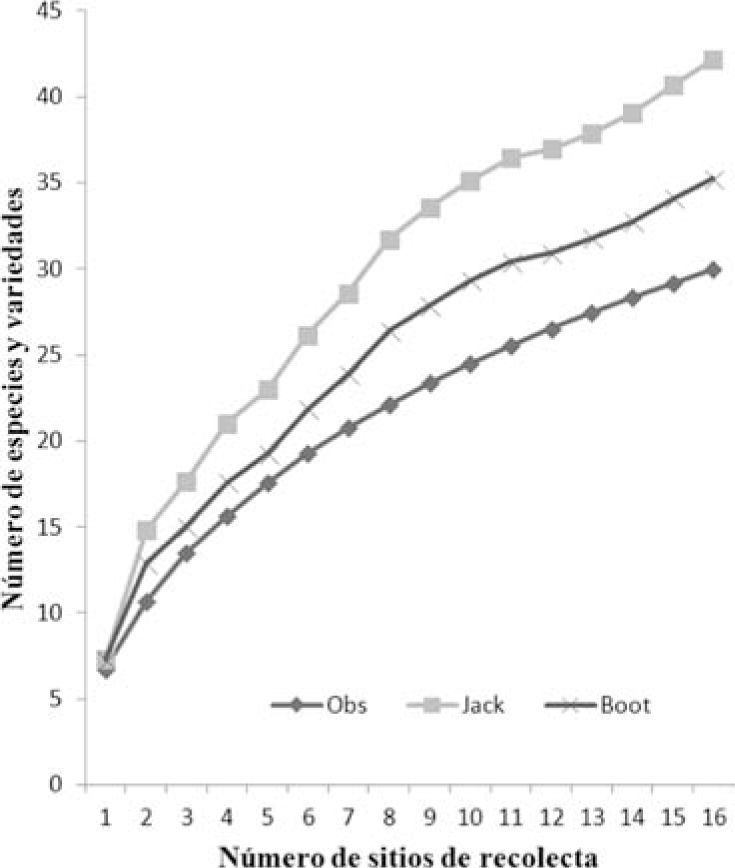
Considerando los datos obtenidos del muestreo en parcela se obtuvo que en promedio el número de especies por zona verde fue de 7. El número más bajo se presentó en las zonas de La Pilita y Santín, mientras que el número más alto (12) se encontró en Cacalomacán. El análisis de la riqueza de especies de musgos epifitos y la comparación entre la riqueza observada y esperada indican que aún se requieren muestreos y colectas para tener un inventario completo de la ZMVT. Los estimadores de riqueza (Cuadro 2; Fig. 4) indican que el inventario fluctuó entre 71% (Jacknife) y 85% (bootstrap).
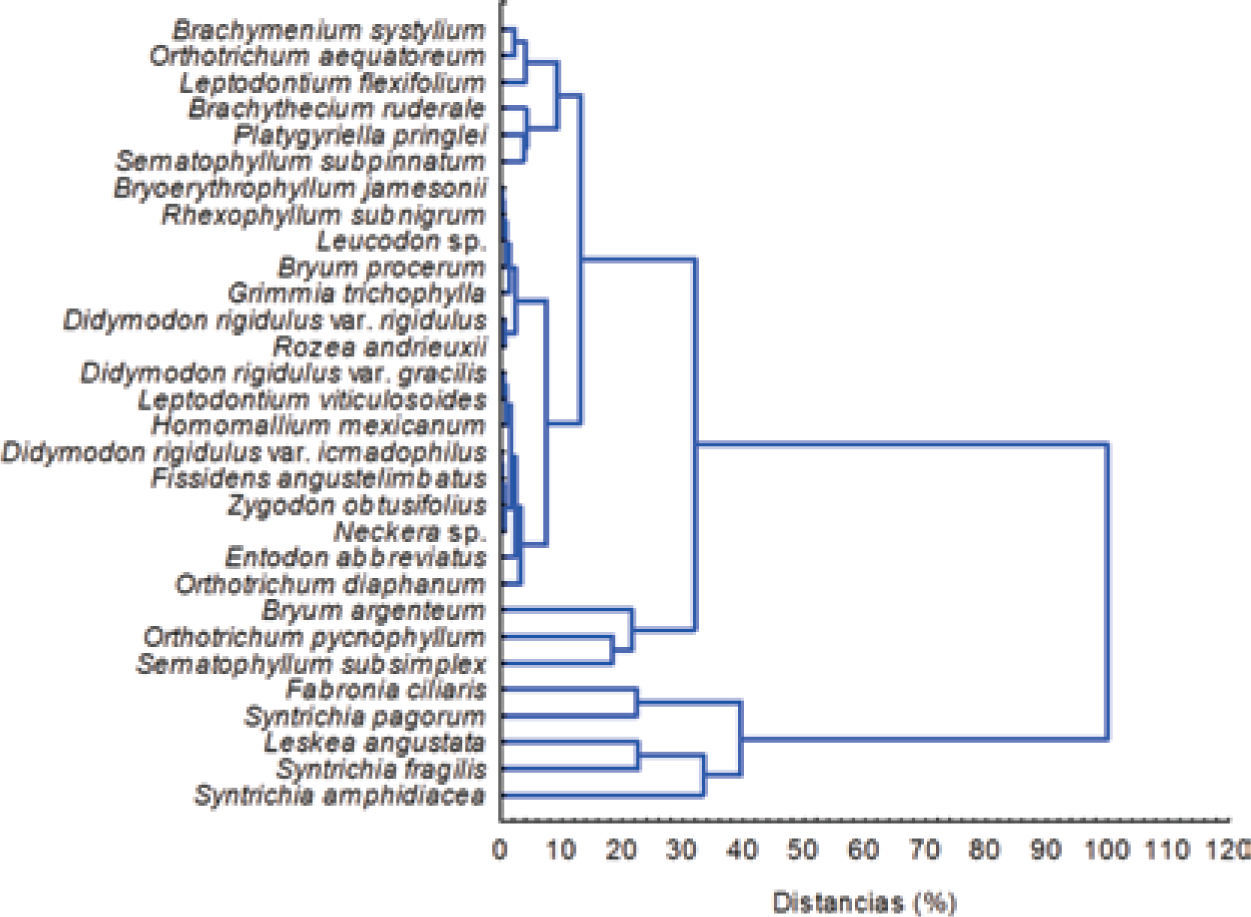
Los VI permiten comparar el peso ecológico de las especies de musgos epifitos, ya que combinan los valores relativos de abundancia, cobertura y frecuencia de cada especie. El dendrograma que asocia a las especies recolectadas en las 16 zonas verdes (Fig. 5) permite diferenciar a una distancia relativa de 90% 2 grupos de especies, y con una distancia de 38% como umbral de corte es posible distinguir 3 grupos bien definidos. El primero está formado por S. amphidiacea, L. angustata y S. fragilis, las 2 primeras especies presentaron los VI promedio más altos y se ubican como las especies con mayor peso ecológico en la ZMVT. El segundo grupo está conformado por S. pagorum y F. ciliaris, cuyos VI promedio superaron la unidad. El tercer conjunto incluye 25 especies, las cuales pueden agruparse a su vez en especies con VI promedio > 0.5 y < 1.0, especies con VI promedio > 0.1 y < 0.5 y especies con VI promedio < 0.1 (Fig. 5), revelando que su peso ecológico en la ZMVT es muy bajo.
La distribución de las especies en cada zona verde es variable (Cuadro 3): S. amphidiacea fue la especie con mayor VI en Tollocan, Ameyalco, San Diego Alcalá, Acazulco, La Pilita y Lomas Altas, mientras que L. angustata lo fue para San Antonio, San Miguel y el Pedregal. Fabronia ciliaris fue la especie más relevante en El Hípico y Alameda, a pesar de ser la epifita más ampliamente distribuida (88% de 16 sitios; Cuadro 3). Las zonas de Reforma, Fidel Negrete, Santín, Cacalomacán y La Ciervita presentaron una especie diferente de musgo con VI alto (S. pagorum, S. fragilis, B. argenteum, Orthotrichum pycnophyllum y Sematophyllum subsimplex, respectivamente), por lo que el peso ecológico de cada una difiere entre sitios.
Valores de importancia y porcentaje de ocurrencia de las especies de musgos epifitos en la ZMVT. En negritas se indica el VI más alto para cada zona
| Fidel Negrete | Alameda | Reforma | Hípico | La Pilita | Santín | Tollocan | Lomas Altas | Acazulco | El Pedregal | San Miguel | Ameyalco | San Antonio | San Diego Alcalá | Cacalomacán | La Ciervita | Promedio | Ocurrencia % | |
| Brachymenium | 0.068 | 0.088 | 0.017 | 0.195 | 0.164 | 0.096 | 38 | |||||||||||
| systylium | ||||||||||||||||||
| Brachythecium | 0.345 | 0.355 | 0.350 | 13 | ||||||||||||||
| ruderale | ||||||||||||||||||
| Bryoerythrophyllum | 0.120 | 0.120 | 6 | |||||||||||||||
| jamesonii | ||||||||||||||||||
| Bryum argenteum | 0.060 | 0.143 | 1.625 | 0.064 | 0.147 | 0.050 | 0.162 | 0.152 | 0.064 | 0.087 | 0.114 | 0.242 | 69 | |||||
| Bryum procerum | 0.080 | 0.080 | 6 | |||||||||||||||
| Didymodon | 0.018 | 0.018 | 6 | |||||||||||||||
| rigidulus var. | ||||||||||||||||||
| gracilis | ||||||||||||||||||
| Didymodon | 0.050 | 0.050 | 6 | |||||||||||||||
| rigidulus var. | ||||||||||||||||||
| icmadophilus. | ||||||||||||||||||
| Didymodon | 0.248 | 0.248 | 6 | |||||||||||||||
| rigidulus var. | ||||||||||||||||||
| rigidulus | ||||||||||||||||||
| Entodon | 0.049 | 0.068 | 0.131 | 0.071 | 0.080 | 25 | ||||||||||||
| abbreviatus | ||||||||||||||||||
| Fabronia ciliaris | 0.217 | 1.147 | 1.205 | 0.915 | 0.472 | 0.961 | 1.326 | 0.882 | 0.059 | 0.087 | 0.579 | 0.196 | 0.562 | 0.165 | 0.627 | 88 | ||
| Fissidens | 0.050 | 0.050 | 6 | |||||||||||||||
| angustelimbatus | ||||||||||||||||||
| Grimmia | 0.095 | 0.123 | 0.109 | 13 | ||||||||||||||
| trichophylla | ||||||||||||||||||
| Homomallium | 0.096 | 0.096 | 6 | |||||||||||||||
| mexicanum | ||||||||||||||||||
| Leptodontium | 0.141 | 0.145 | 0.051 | 0.200 | 0.253 | 0.158 | 31 | |||||||||||
| flexifolium | ||||||||||||||||||
| Leptodontium | 0.045 | 0.045 | 6 | |||||||||||||||
| viticulosoides | ||||||||||||||||||
| Leskea angustata | 1.077 | 0.811 | 0.556 | 1.233 | 0.625 | 1.280 | 1.237 | 0.670 | 0.398 | 1.476 | 0.427 | 0.411 | 0.850 | 75 | ||||
| Leucodon sp. | 0.022 | 0.142 | 0.082 | 13 | ||||||||||||||
| Neckera sp. | 0.085 | 0.085 | 6 | |||||||||||||||
| Orthotrichum | 0.099 | 0.202 | 0.319 | 0.207 | 19 | |||||||||||||
| aequatoreum | ||||||||||||||||||
| Orthotrichum | 0.203 | 0.203 | 6 | |||||||||||||||
| diaphanum | ||||||||||||||||||
| Orthotrichum | 0.216 | 1.099 | 0.658 | 13 | ||||||||||||||
| pycnophyllum | ||||||||||||||||||
| Platygyriella | 0.143 | 0.474 | 0.146 | 0.254 | 19 | |||||||||||||
| pringlei | ||||||||||||||||||
| Rhexophyllum | 0.139 | 0.139 | 6 | |||||||||||||||
| subnigrum | ||||||||||||||||||
| Rozea andrieuxii | 0.052 | 0.218 | 0.135 | 6 | ||||||||||||||
| Sematophyllum | 0.318 | 0.139 | 0.222 | 0.082 | 0.190 | 25 | ||||||||||||
| subpinnatum | ||||||||||||||||||
| Sematophyllum | 0.084 | 0.047 | 1.494 | 0.542 | 19 | |||||||||||||
| subsimplex | ||||||||||||||||||
| Syntrichia | 0.427 | 1.295 | 0.414 | 1.465 | 1.145 | 1.201 | 0.855 | 0.658 | 0.860 | 1.149 | 0.477 | 0.904 | 69 | |||||
| amphidiacea | ||||||||||||||||||
| Syntrichia fragilis | 1.561 | 0.298 | 0.102 | 0.122 | 0.640 | 0.401 | 0.411 | 1.000 | 0.567 | 50 | ||||||||
| Syntrichia pagorum | 0.060 | 0.974 | 1.506 | 0.145 | 0.671 | 25 | ||||||||||||
| Zygodon | 0.036 | 0.036 | 6 | |||||||||||||||
| obtusifolius |
De acuerdo con el índice de Shannon la diversidad de musgos epifitos de toda la ZMVT es relativamente alta (H=2.3), aunque no llega a la máxima esperada (Hmax=3.4) por el número de especies registradas. El valor total del índice de equidad de Pielou (J’=0.68) indica que la distribución de las colonias tiende a ser homogénea (Cuadro 4).
Valores de los índices de diversidad por zona verde. Los valores en negritas son máximos y los subrayados son mínimos. D. E.=desviación estándar y C. V.=coeficiente de variación. *=urbano, **=suburbano
| Número de taxa | Dominancia (D) | Shannon (H’) | Pielou (J’) | Valor máximo (Hmax) | Simpson (1/D) | |
| Fidel Negrete* | 5 | 0.47 | 0.94 | 0.58 | 1.61 | 2.15 |
| Alameda * | 4 | 0.33 | 1.16 | 0.84 | 1.39 | 3.07 |
| Reforma * | 5 | 0.54 | 0.87 | 0.54 | 1.61 | 1.84 |
| Hípico * | 9 | 0.16 | 1.92 | 0.87 | 2.20 | 6.08 |
| La Pilita * | 3 | 0.50 | 0.86 | 0.78 | 1.10 | 1.98 |
| Santín * | 3 | 0.39 | 1.01 | 0.92 | 1.10 | 2.58 |
| Tollocan * | 4 | 0.43 | 0.97 | 0.70 | 1.39 | 2.33 |
| Lomas Altas * | 7 | 0.42 | 1.04 | 0.53 | 1.95 | 2.37 |
| Acazulco ** | 10 | 0.37 | 1.29 | 0.56 | 2.30 | 2.73 |
| El Pedregal ** | 6 | 0.31 | 1.29 | 0.72 | 1.79 | 3.20 |
| San Miguel ** | 8 | 0.17 | 1.87 | 0.90 | 2.08 | 5.73 |
| Ameyalco ** | 8 | 0.19 | 1.81 | 0.87 | 2.08 | 5.35 |
| San Antonio ** | 6 | 0.36 | 1.23 | 0.69 | 1.79 | 2.76 |
| San Diego Alcalá** | 9 | 0.26 | 1.64 | 0.75 | 2.20 | 3.91 |
| Cacalomacán ** | 12 | 0.17 | 1.98 | 0.83 | 2.40 | 5.89 |
| La Ciervita ** | 10 | 0.16 | 2.05 | 0.89 | 2.30 | 6.32 |
| Total | 30 | 0.15 | 2.34 | 0.69 | 3.40 | 6.82 |
| Promedio | 7 | 0.33 | 1.37 | 0.75 | 1.83 | 3.64 |
| D. E. | 3 | 0.13 | 0.43 | 0.14 | 0.43 | 1.64 |
| C. V. | 39 | 39.57 | 31.68 | 18.17 | 23.36 | 44.99 |
De acuerdo con el inverso de Simpson, las colonias de musgos epifitos de la ZMVT como un conjunto son diversas (S1/D=6.8) y tiene un valor de dominancia total bajo (0.15), lo que sugiere que la distribución del abundancia de todas las especies tiende a ser equitativa (Cuadro 4).
Diversidad alfa por zona verdeLa diversidad entre pares de zonas varió significativamente (p≤ 0.05): el valor promedio del índice de Shannon fue de 1.38, mientras que el inverso de Simpson fue de 3.6. El mayor coeficiente de variación se presentó en el inverso de Simpson y la dominancia, mientras que los otros índices presentaron una variación baja (< 35%; Cuadro 4).
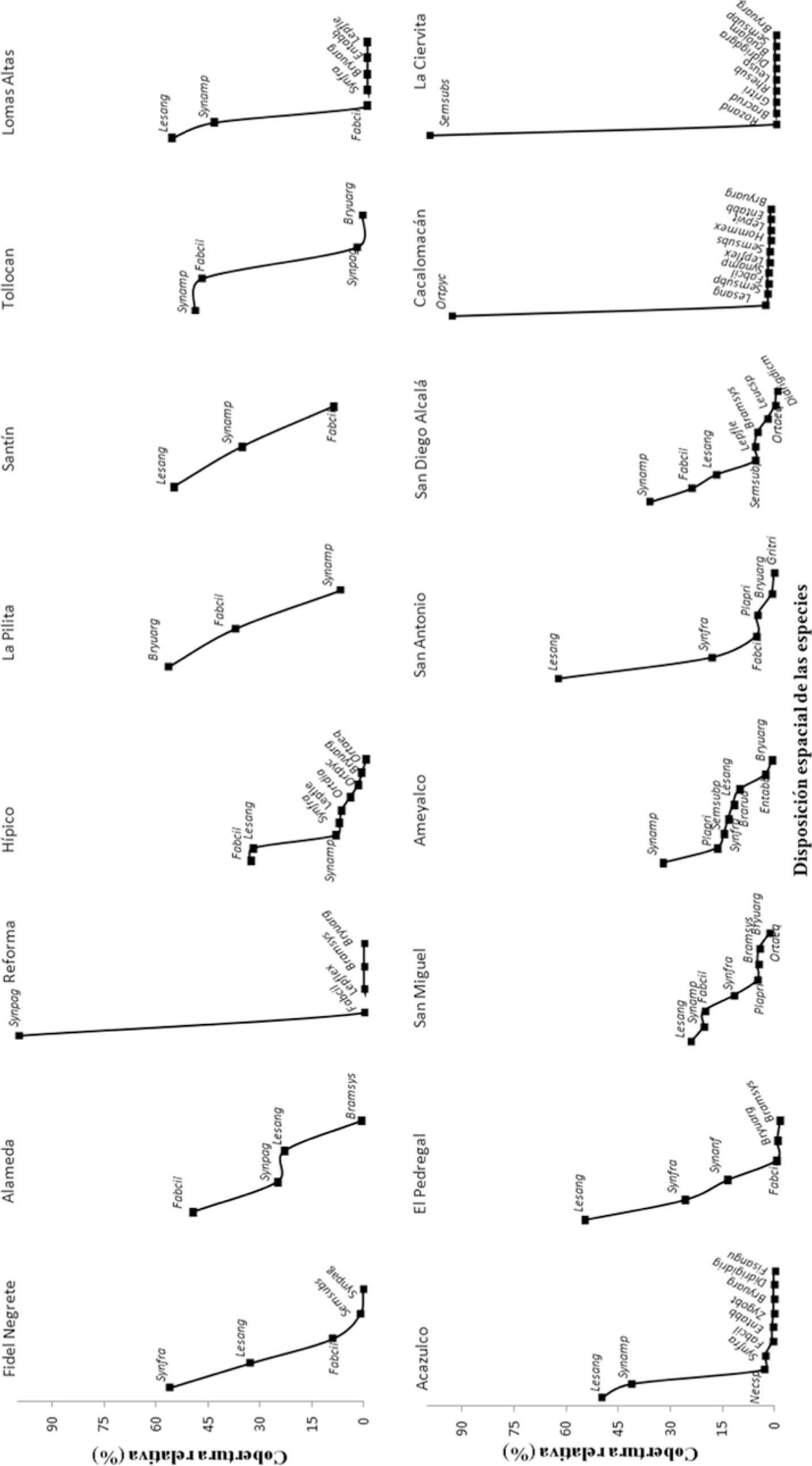
Tanto el índice de Shannon como el inverso de Simpson convergen al indicar que las zonas con menor diversidad fueron La Pilita y Reforma, mientras que Cacalomacán y La Ciervita presentaron los valores más altos (Cuadro 4). En las zonas de menor diversidad los porcentajes de abundancia relativa de las especies mostraron valores extremos, algunos superiores al 60% como se observa en las curvas de intervalo-abundancia (Fig. 6), lo que se traduce en una dominancia alta (Cuadro 4). Las zonas de mayor diversidad destacan por ser las que se ubican a mayor altitud de todas las áreas muestreadas y donde la vegetación presenta remanentes de bosque natural: en ellas los porcentajes de abundancia relativa de las especies mostraron valores inferiores al 30% (Fig. 6) y por lo tanto, se ubican como las zonas con la menor dominancia (Cuadro 4) y con tendencia a poseer colonias de musgos epifitos más homogéneas.
Cinco especies se presentaron en más del 50% de las zonas de muestreo (Cuadro 3) y en algunos casos coincidieron en ser las especies con colonias numerosas y extensas. Los gráficos de intervalo-abundancia muestran que en cada zona verde abunda una especie particular de musgo epifito, siendo S. amphidiacea la especies más abundante en el 50% de los sitios muestreados (Fig. 6), F. ciliaris lo fue en Alameda, Reforma e Hípico; L. angustata en San Antonio, B. argenteum en La Pilita, S. fragilis en Fidel Negrete y S. subsimplex en La Ciervita.
Por otro lado, las curvas de intervalo-cobertura indican que en 56% de las zonas analizadas la especie más numerosa también presentó las colonias más extensas (Fig. 6 y 7). En el resto de las zonas verdes aquellas especies que tienen numerosas colonias no necesariamente presentaron la mayor cobertura: tal es el caso de S. amphidiacea, que fue la especies más abundante en 8 zonas verdes, pero sólo en Ameyalco, San Diego Alcalá y Tollocan fue la que presentó colonias más extensas. En el caso opuesto está L. angustata que sólo fue abundante en San Antonio, pero presentó extensas colonias en Lomas Altas, Acazulco, El Pedregal, San Miguel, Santín y San Antonio (Fig. 6 y 7). Diversidad beta. El análisis de las especies de musgos epifitos empleando el índice de similitud de Jaccard mostró que las zonas verdes de la ZMVT presentan una baja similitud promedio (ISj=0.30) y, por lo tanto, una mayor complementariedad promedio (C=0.70). Lo anterior indica que los sitios de estudio poseen distintas especies y, por lo tanto, una mayor diversidad beta (Cuadro 5).
Matrices de similitud y complementariedad (sombreado) para las zonas verdes de la ZMVT
| Fidel Negrete | Alameda | Reforma | Hípico | La Pilita | Santín | Tollocan | Lomas Altas | Acazulco | El Pedregal | San Miguel | Ameyalco | San Antonio | San Diego Alcalá | Cacalomacán | La Ciervita | |
| Fidel Negrete | 0.50 | 0.75 | 0.73 | 0.86 | 0.67 | 0.71 | 0.57 | 0.75 | 0.63 | 0.70 | 0.82 | 0.63 | 0.92 | 0.79 | 0.93 | |
| Alameda | 0.50 | 0.50 | 0.82 | 0.83 | 0.60 | 0.67 | 0.71 | 0.83 | 0.57 | 0.67 | 0.91 | 0.75 | 0.70 | 0.86 | 1.00 | |
| Reforma | 0.25 | 0.50 | 0.73 | 0.67 | 0.86 | 0.50 | 0.57 | 0.85 | 0.63 | 0.82 | 0.92 | 0.78 | 0.73 | 0.79 | 1.00 | |
| Hípico | 0.27 | 0.18 | 0.27 | 0.67 | 0.67 | 0.70 | 0.44 | 0.64 | 0.50 | 0.58 | 0.69 | 0.64 | 0.71 | 0.60 | 1.00 | |
| La Pilita | 0.14 | 0.17 | 0.33 | 0.33 | 0.50 | 0.25 | 0.40 | 0.70 | 0.50 | 0.63 | 0.78 | 0.71 | 0.80 | 0.75 | 1.00 | |
| Santín | 0.33 | 0.40 | 0.14 | 0.33 | 0.50 | 0.60 | 0.40 | 0.70 | 0.50 | 0.63 | 0.78 | 0.71 | 0.67 | 0.75 | 1.00 | |
| Tollocan | 0.29 | 0.33 | 0.50 | 0.30 | 0.75 | 0.40 | 0.50 | 0.73 | 0.57 | 0.67 | 0.80 | 0.75 | 0.82 | 0.77 | 1.00 | |
| Lomas Altas | 0.43 | 0.29 | 0.43 | 0.56 | 0.60 | 0.60 | 0.50 | 0.50 | 0.17 | 0.38 | 0.56 | 0.43 | 0.60 | 0.45 | 1.00 | |
| Acazulco | 0.25 | 0.17 | 0.15 | 0.36 | 0.30 | 0.30 | 0.27 | 0.50 | 0.55 | 0.62 | 0.62 | 0.67 | 0.81 | 0.71 | 1.00 | |
| El Pedregal | 0.38 | 0.43 | 0.38 | 0.50 | 0.50 | 0.50 | 0.43 | 0.83 | 0.45 | 0.25 | 0.60 | 0.50 | 0.64 | 0.71 | 1.00 | |
| San Miguel | 0.30 | 0.33 | 0.18 | 0.42 | 0.38 | 0.38 | 0.33 | 0.63 | 0.38 | 0.75 | 0.55 | 0.44 | 0.58 | 0.75 | 1.00 | |
| Ameyalco | 0.18 | 0.09 | 0.08 | 0.31 | 0.22 | 0.22 | 0.20 | 0.44 | 0.38 | 0.40 | 0.45 | 0.60 | 0.79 | 0.67 | 0.88 | |
| San Antonio | 0.38 | 0.25 | 0.22 | 0.36 | 0.29 | 0.29 | 0.25 | 0.57 | 0.33 | 0.50 | 0.56 | 0.40 | 0.85 | 0.80 | 1.00 | |
| San Diego A. | 0.08 | 0.30 | 0.27 | 0.29 | 0.20 | 0.33 | 0.18 | 0.40 | 0.19 | 0.36 | 0.42 | 0.21 | 0.15 | 0.69 | 0.95 | |
| Cacalomacán | 0.21 | 0.14 | 0.21 | 0.40 | 0.25 | 0.25 | 0.23 | 0.55 | 0.29 | 0.29 | 0.25 | 0.33 | 0.20 | 0.31 | 0.90 | |
| La Ciervita | 0.07 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.12 | 0.00 | 0.05 | 0.10 |
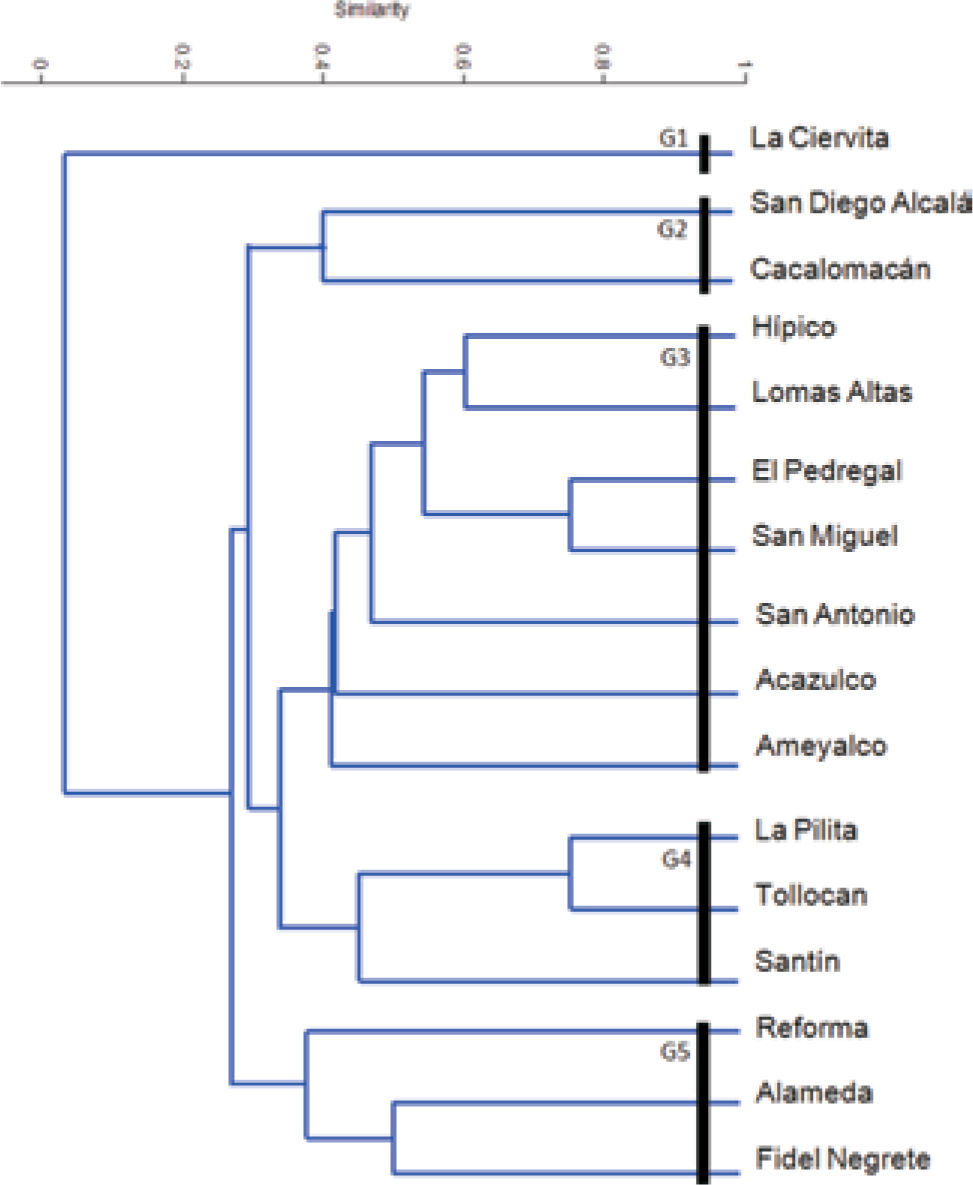
El dendrograma generado a partir del índice de Jaccard muestra 5 grupos (Fig. 8), uno (G1) conformado por La Ciervita (ISj=0.05) que se separa desde el inicio del resto de las zonas de estudio. San Diego Alcalá y Cacalomacán se agrupan en el conjunto 2 (G2; ISj=0.41) y junto con La Ciervita fueron las 3 zonas más diversas (Cuadro 4). Siete zonas verdes se agrupan en el conjunto 3 (G3), las cuales, en la mayoría de los casos, no presentan relación cercana de agrupamiento, excepto El Pedregal y San Miguel (75%; Fig. 8) que son 1 de los 2 pares de zonas más similares (75%) de todas las analizadas. El cuarto agrupamiento (G4) está conformado por Santín, La Pilita y Tollocan (ISj=0.47), cuya riqueza florística fue la más baja. En el grupo 5 se ubican Reforma, Alameda y Fidel Negrete (ISj=0.37) y corresponden a parques o camellones del centro de la ciudad, donde no se reportaron más de 5 especies de musgos (Cuadro 3).
DiscusiónEl inventario de musgos epifitos de la zona metropolitana del valle de Toluca (ZMVT) comprende 41 taxa (especies y variedades; Cuadro 1) y representa una contribución más al conocimiento de los musgos del Estado de México, los cuales han sido estudiados y colectados desde hace más de una década (Delgadillo, 2000b y 2009), aunque de forma más intensa en la zona noreste (Cárdenas, 1988,1995, 1999, 2000; Cárdenas y Delgadillo, 1992) y en el Nevado de Toluca (Cuevas, 2010). Los análisis recientes sobre la distribución de musgos en el centro de México indican que en todo el corredor florístico de Toluca se registran 136 taxa de musgos (Delgadillo, 2009). De éstas, el 23% se han recolectado específicamente como epifitas en los parques y áreas verdes de la ZMVT (Cuadro 1) y por las recolectas realizadas en el presente estudio, 10 especies más se han adicionado a la lista previa de la flora del corredor (Cuadro 1). Sin embargo, y como lo indican los estimadores de acumulación de especies (Fig. 4; Cuadro 2), aún se requieren muestreos adicionales que permitan tener un inventario más completo de las especies de musgos epifitos en las zonas urbana y suburbana del valle de Toluca.
La comparación de la riqueza de especies encontrada en este estudio, 39 especies y 4 variedades, con la de las otras 2 zonas urbanas del mismo tipo analizadas en México, muestra que la riqueza de musgos de la ZMVT es menor a la reportada para la ciudad de México (87 especies, Delgadillo y Cárdenas, 2000) y muy superior a la encontrada en la ciudad de Morelia, Michoacán (Prado, 2009). Estas diferencias se asocian a que el valle de México es la zona del país donde los musgos han sido más colectados (Cárdenas, 1988), además de que su lista florística incluye especies de diferentes sustratos y registros muy antiguos que aparentemente ya se han extinto localmente (Delgadillo y Cárdenas, 2000). Para el caso de la ciudad de Morelia sólo se reportan 7 especies de musgos y una hepática, debido a que los registros de ese estudio no son de índole completamente florístico, ya que se hicieron con el objeto de asociar la presencia de musgos epifitos como indicadores de la calidad del aire y relacionar sus preferencias para colonizar determinado tipo de árboles (Prado, 2009).
La mayor proporción de los musgos recolectados en el valle de Toluca tienen un patrón de distribución amplio (65%; Fig. 3), el elemento geográfico que también es el más numeroso en la flora de musgos mexicanos (25.8%; Delgadillo, 2000b). Se trata de organismos con amplia tolerancia ecológica y mecanismos efectivos de dispersión de estructuras de reproducción (Delgadillo, 2000a), como es el caso de B. argenteum, típico de ambientes perturbados y frecuente en todo el mundo (Lee et al., 2004), especialmente en la zona de estudio (Cuadro 3).
De las 16 familias de musgos encontradas en la ZMVT sobresale la familia Pottiaceae por ser la más diversa, abundante y ampliamente distribuida (Fig. 2). Esta familia es el principal elemento de la flora muscinal del mundo (Zander, 1996) y en México es uno de los grupos más comunes y con mayor número de especies (152; Delgadillo, 2000b y 2012); su amplia distribución se ha asociado a la capacidad que poseen muchas de sus especies para desarrollarse en hábitats muy diversos, pero generalmente extremos, en donde la desecación, el congelamiento y la perturbación son frecuentes (Zander, 1996). Adaptaciones morfológicas como la presencia de hojas con pelos hialinos en el ápice, torcidas, crispadas o enrolladas a manera de tubo (Zander, 1996), la posibilidad de sobrevivir a la desecación y continuar el metabolismo cuando la humedad nuevamente es óptima (poiquilohídrico), la facilidad para absorber agua por toda la superficie de la hoja (ectohídrico) y en algunas especies, la presencia de abundantes papilas y rizoides que facilitan el movimiento externo del agua (Cárdenas, 1995), les permite resistir la sequía, la radiación intensa y el exceso de calor que imperan en los espacios urbanos. De esta forma y como sucede en otras ciudades de México (Cárdenas y Delgadillo, 1992; Cárdenas, 1995), la prevalencia de la familia Pottiaceae en la ZMVT se asocia a la capacidad de muchas de sus especies para afrontar las condiciones de baja humedad que imperan en el valle de Toluca durante 5 o 6 meses del año, principalmente en el invierno y parte de la primavera (Conagua, 2001). Junto con las adaptaciones anteriores, las estrategias de reproducción de algunos de estos organismos también favorecen su amplia distribución y éxito en espacios perturbados: las especies que presentan formas especiales de reproducción vegetativa tienen mayores oportunidades de sobrevivir en espacios alterados que otras (Zvereva y Kozlov, 2011). En este sentido, la producción de abundantes yemas y fragmentos asexuales que muestran por ejemplo las 3 especies de Syntrichia registradas en la ZMVT han permitido su diseminación y expansión en la mayor parte del área de estudio (Cuadro 3; Fig. 5).
Syntrichia amphidiacea, S. fragilis y S. pagorum junto con F. ciliaris y L. angustata presentaron los valores de importancia más altos de todos los musgos registrados (Cuadro 3), ubicándolas como los elementos con mayor peso ecológico y que definen las colonias de musgos epifitos de la ZMVT (Cuadro 3; Fig. 5). Grupos de estas especies y de B. argenteum son frecuentes en las cortezas expuestas y soleadas de árboles nativos o introducidos, y por su alta abundancia y frecuencia en diferentes ciudades, como el Distrito Federal (Cárdenas y Delgadillo, 1992; Cárdenas, 1995), Morelia (Prado, 2009) y en los parques de Toluca (Cuadro 3; Fig. 5) se infiere que toleran condiciones de sequía y resisten la contaminación atmosférica que predomina en estas áreas. El análisis del nivel de sensibilidad y resistencia a la contaminación que pudieran tener estas y otras especies de la ZMVT, podría ayudar a entender sus patrones de distribución y facilitaría su uso como especies indicadoras de la calidad del hábitat (Bako y Afolabi, 2008; Zvereva y Kozlov, 2011).
Típicamente las zonas urbanas carecen de amplias colonias de musgos y de otras briofitas (Glime, 2007): la abundancia y diversidad briológica en ellas depende mucho de lo numerosas que sean las zonas verdes, así como de su tamaño y de su flora vascular. A pesar de que la ZMVT presenta pocas áreas verdes, sus colonias de musgos son diversas (H=2.3; S1/D=6.8), pero con diferencias notables a nivel local (Cuadro 4), sobre todo, en el tipo y abundancia de especies (Fig. 6). Lo anterior se refleja directamente en la alta proporción de pares de zonas verdes con valores relativamente bajos del coeficiente de Jaccard y la alta complementariedad entre ellas (Cuadro 5; Fig. 8). Si bien las colonias de musgos epifitos de la ZMVT presentan frecuentemente especies de amplia tolerancia ecológica, es probable que las diferencias a nivel local puedan estar influidas por la discontinuidad en las zonas analizadas, pero sobre todo, por la gama de microambientes que cada una presenta. El microclima de la parte baja del dosel de un área verde está directamente relacionado con la extensión de la cubierta vegetal y el tipo y la densidad de árboles que alberga (Georgi y Zafiriadis, 2006), así como con la influencia potencial y diferencial de las actividades humanas, que en conjunto pueden determinar no sólo la cantidad y calidad de los espacios disponibles para las briofitas, sino que también influyen en su crecimiento, desarrollo y reproducción (Schofield, 2001).
Para conocer el efecto de la condición urbana sobre la riqueza de especies de musgos epifitos de la ZMVT, los puntos de muestreo comprendieron espacios suburbanos con vegetación seminatural y hábitats completamente urbanizados. En el primer caso se trata de áreas verdes concentradas en los grupos G1, G2 y G3 del dendrograma (Fig. 8): son zonas que poseen árboles de Oyamel, Pinus y Quercus, así como topografía y características ambientales heterogéneas. Si bien presentan diferentes grados de perturbación, al encontrarse alejados del núcleo poblacional de la ciudad de Toluca, con excepción de las zonas Hípico y Lomas Altas, tienen una presión antrópica menor que el resto de los puntos de muestreo, y al mantener remanentes de los antiguos bosques de las serranías que limitan al valle, muestran un número mayor de microambientes potenciales para diferentes briofitas. Lo anterior ha permitido que sus colonias de musgos sean relativamente más diversas (Cuadro 4) que los espacios ubicados al interior de la ciudad, y que posean especies que no se reconocen frecuentemente en los parques del centro de Toluca, como Grimmia trichophylla, Homomallium mexicanum, O. pycnophyllum, entre otros (Cuadro 3). De todas estas zonas, La Ciervita (G1) y Cacalomacán (G2) sobresalen por ser las más ricas (Cuadro 4), están ubicadas por arriba de la cota de los 3 000 m y conservan remanentes importantes de bosques de Pinus y Abies que, de acuerdo con Alfaro y Castillo (1985) y De Luna (1985, 1988) son el tipo de bosques templados de México que alberga las asociaciones de musgos más diversas, tanto por las condiciones microclimáticas que resguardan como por el hecho de compartir algunos elementos con vegetación de otros pisos altitudinales (Delgadillo, 2009).
En contraste, las áreas verdes consideradas dentro de la ciudad de Toluca muestran una menor riqueza y diversidad de musgos epifitos. Esto está asociado al hecho de que la ciudad de Toluca, al concentrar más de la mitad de la población de toda la ZMVT, presenta una deficiente cobertura vegetal y baja calidad del aire (Gobierno del Estado de México, 2011). Seis de las 8 áreas verdes incluidas en el centro de la ciudad se agrupan en los conjuntos G4 y G5 del diagrama de clasificación (Fig. 8): son zonas que presentan una o 2 especies de musgos muy abundantes y frecuentes, así como una tendencia de uniformidad y baja diversidad de musgos (Cuadro 3). En los 6 casos se trata de parques urbanos ambientalmente homogéneos, con árboles ornamentales de características fenológicas similares y cuyo porte frecuentemente se modifica por la poda que hacen las autoridades municipales, lo cual no permite mantener un dosel suficientemente denso, permanente y con microambientes propicios para el desarrollo de una flora muscinal más diversa. Esto, junto con la baja conectividad entre áreas verdes y la contaminación que históricamente ha tenido y tiene la ciudad de Toluca ha disminuido el intervalo de distribución de algunas especies (por ejemplo; G. trichophylla y H. mexicanum), y al mismo tiempo ha favorecido el desarrollo de especies tolerantes a la desecación y perturbación humana, como algunas de los géneros Brachythecium, Bryum, Didymodon y, principalmente, Leskea, Fabronia y Syntrichia (Delgadillo y Cárdenas, 2000), que actualmente cubren las cortezas de la mayoría de los árboles del valle.
En concordancia como las conclusiones de varios estudios de otras partes del mundo (Rao, 1982; Giordano et al., 2004; Zvereva y Kozlov, 2011), en la ZMVT se observa una disminución de la diversidad de musgos en las zonas sometidas a una mayor presión antrópica (Cuadro 4). Es un hecho que la estructura de las colonias actuales de musgos epifitos de la ZMVT es el resultado de los cambios de distribución y abundancia de las especies en respuesta al cambio del uso de suelo y la pérdida de hábitats que prevalece en la zona. La alta diversidad y complementariedad que muestran los espacios seminaturales de la ZMVT frente a los urbanizados, apunta la necesidad de su conservación y la investigación de los factores que están determinando el reemplazo, la estructura y la distribución de sus colonias de musgos, así como el análisis detallado y multidisciplinario de la sensibilidad de algunas especies de musgos a los cambios del hábitat y la contaminación.
Al Comecyt (EDOMEX-2009-C02-132003) y a la Universidad Autónoma del Estado de México (3547/2013CHT) por el financiamiento otorgado. Al Dr. Claudio Delgadillo y a la Maestra Ángeles Cárdenas por su apoyo en la determinación y cotejo de ejemplares. Agradecemos a los revisores anónimos por la aportación de sugerencias y comentarios valiosos.