Se realizó un análisis panbiogeográfico de las especies de Piper pertenecientes al clado Enckea, con el fin de establecer una hipótesis de homología biogeográfica primaria entre áreas de bosque neotropical estacionalmente seco (BNES) de América Central, las Antillas y América del Sur. Con base en 904 registros de distribución pertenecientes a 74 especies del clado, se generaron 50 trazos individuales, 8 trazos generalizados y 4 nodos, ubicados en diferentes formaciones de BNES. Del total de especies analizadas 24 no fueron informativas en el análisis por estar representadas por un solo registro. El análisis de trazos no integró bajo una historia común el BNES. Los resultados son congruentes con distintos eventos tectónicos, los cuales influyeron de manera independiente en la diversificación de grupos de plantas y animales. Los eventos que podrían explicar la actual distribución de las especies de Enckea incluyen los levantamientos de la Sierra Madre Occidental y la Sierra Madre del Sur, el establecimiento del sistema de fallas de Motagua-Polochic, el surgimiento de la cordillera de Talamanca, el Istmo de Panamá y la fragmentación de la Panamazonía por la orogenia del norte de los Andes.
We performed a panbiogeographic analysis of the species of Piper that belong to the clade Enckea, aiming to establish a primary biogeographic homology hypothesis among Seasonal Dry Neotropical Forest (SDNF) areas of the Antilles, Central, and South America. We used 904 distribution records of 74 species to generate 50 individual tracks, 8 generalized tracks, and 4 nodes, which were located in different SDNF formations. The track analysis did not integrate the SDNF under a common origin hypothesis. Instead, the results are congruent with different tectonic events independently influencing diversification of plants and animals. The events that may explain the current distribution of species of Enckea include the rising of Sierra Madre Occidental and Sierra Madre del Sur, the stablishment of the Motagua-Polochic fault system, the rising of Cordillera de Talamanca, Panama’s Isthmus, and the fragmentation of Panamazon by Northern Andean orogeny.
La biogeografía puede ser definida como el estudio de la distribución geográfica de los seres vivos. Pero más allá de esta definición la disciplina plantea cuestionamientos tanto a nivel descriptivo como interpretativo. El reconocimiento de patrones de distribución y la búsqueda de explicaciones causales para tales patrones ayudan al entendimiento de la diferenciación biológica, entendiéndose esta última como un proceso que se expresa a través del cambio de la forma en el espacio y tiempo (Crisp et al., 2001; Posadas et al., 2006; Grehan, 2011). La implementación de un estudio panbiogeográfico, con el objetivo de examinar la evolución común de las áreas y las biotas, se puede considerar como una aproximación que no requiere necesariamente de hipótesis filogenéticas previas de los taxones y enfatiza la importancia de la distribución geográfica (Morrone, 2001a).
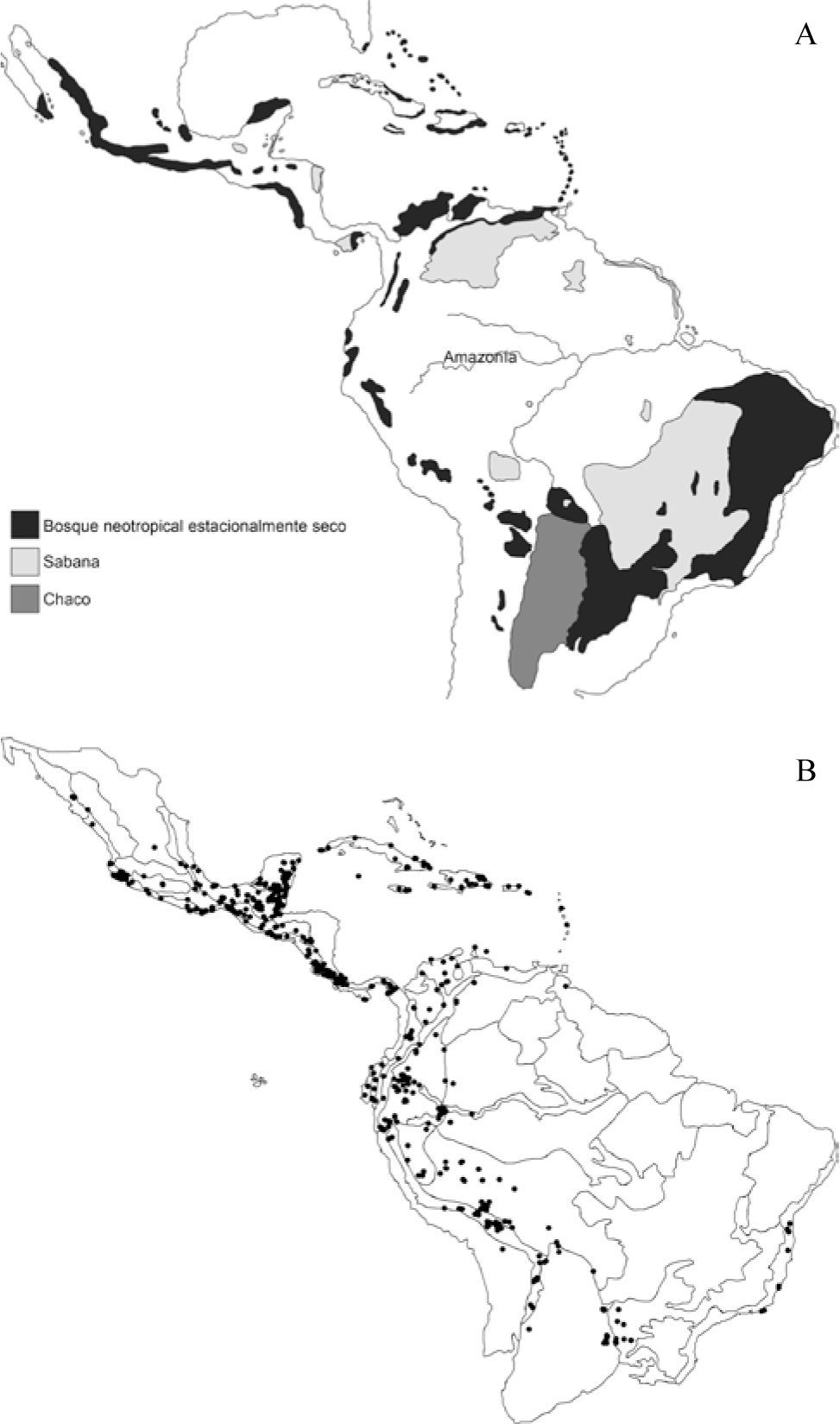
En el presente trabajo se realizó un análisis de trazos enfocado en las áreas de bosque neotropical estacionalmente seco (BNES), los cuales debido a su tipo de cobertura y grado de afinidad florística con otros biomas han sido históricamente difíciles de clasificar, delimitar, e incluso de conservar si son comparados con los bosques húmedos. El escaso conocimiento sobre la dinámica y origen de estos biomas ha incentivado la realización de diferentes estudios relacionados con la historia tectónica de las áreas geográficas donde ocurren y la biología de las especies que allí habitan (Pennington et al., 2000, 2004, 2009; Padilla y Halffter, 2007; Caetano et al., 2008). Este tipo de biomas se encuentran distribuidos en áreas disyuntas a lo largo de la región Neotropical, en zonas libres de heladas, donde la pluviosidad es inferior a 1 600mm al año, con un periodo de 5 meses donde se reciben menos de 100mm de lluvias. Durante la estación seca más del 50% de la cobertura arbórea se puede perder y el grado de deshoje aumenta con la disminución de las lluvias (Fig. 1A). Estos bosques están esencialmente compuestos por árboles que forman un dosel continuo o casi continuo, el cual se fragmenta cuando las precipitaciones llegan a los 500mm o menos (Murphy y Lugo, 1986; Bullock et al., 1995; Pennington et al., 2000, 2009).
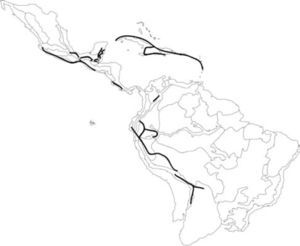
Mapa de la región Neotropical, mostrando las diferentes áreas muestreadas en el presente estudio. A, distribución actual de las formaciones de bosque neotropical estacionalmente seco (Werneck et al., 2011); B, distribución actual de las especies del clado Enckea mapeadas sobre el esquema de provincias biogeográficas utilizado en el presente estudio (Morrone, 2001b).
Investigaciones recientes han reportado la disminución de los bosques secos de América Central y del Sur, principalmente debido a intervención antrópica con fines económicos (IAVH, 1998; Padilla y Halffter, 2007). El estudio de grupos focales es una de las estrategias sugeridas para entender qué tipo de procesos han intervenido en la diversificación de sus especies y la transformación antrópica de estos ecosistemas (Pennington et al., 2004).
Piper está conformado por aproximadamente 2 000 especies y es considerado uno de los más diversos de las angiospermas (Gentry, 1982). Análisis filogenéticos recientes reconocen 11 clados dentro del género: Macrostachys, Radula, Peltobryon, Pothomorphe, Isophyllom, Enckea, Ottonia, P. cinereum/P. sanctum, Schilleria, Piper s.s y Macropiper; los cuales se distribuyen en 3 grandes regiones geográficas: Neotrópico, Asia tropical y Pacífico sur (Callejas, 1986; Jaramillo y Manos, 2001; Jaramillo et al., 2008). Algunos estudios han identificado una alta diversidad y abundancia de las especies de Piper distribuidas en los bosques húmedos (Gentry, 1982; Marquis, 2004; Jaramillo, 2006; Quijano et al., 2006). Una de las propuestas más detalladas es la de Marquis (2004), quien comparó la diversidad y abundancia del género en 38 localidades correspondientes a diferentes zonas de vida del neotrópico (bosques deciduos, semideciduos, mesofíticos, siempreverdes, montanos húmedos, galería, caatinga y varzea), encontrando que la mayor abundancia y diversidad de especies de Piper se encuentra en bosques húmedos de zonas bajas en América Central y el norte de América del Sur, lo cual fue confirmado por el análisis biogeográfico de Quijano et al. (2006). Asimismo, Gentry y Emmons (1987) afirmaron que las altas tasas de abundancia y diversidad de Piper en estos bosques son debidas a un posible origen del género en este tipo de ambientes.
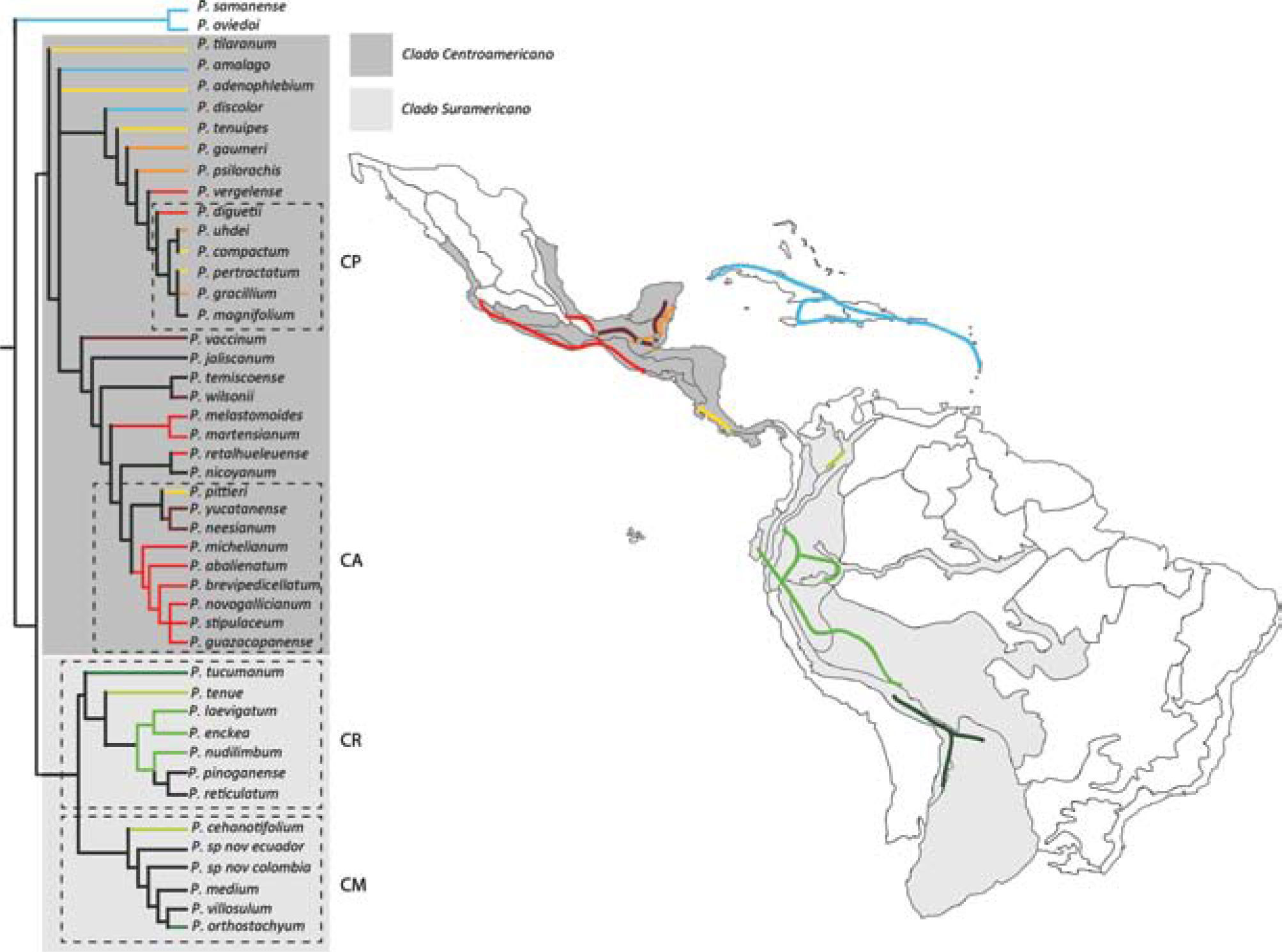
El clado Enckea está compuesto por aproximadamente 80 especies distribuidas en su mayoría en formaciones de BNES en América Central, las Antillas y América del Sur. Las especies centroamericanas se distribuyen en provincias biogeográficas de América Central; occidente del Istmo de Panamá, oriente de América Central, Península de Yucatán, Costa Pacífica Mexicana, y mucho más al norte en la Sierra Madre Occidental y Sierra Madre Oriental de México (Morrone, 2001b). Gran parte de las especies centroamericanas tienen afinidad por los BNES, donde generalmente habitan en zonas abiertas o en límites de bosque, en alturas inferiores a los 1 000m snm, con excepción de P. santarosanum y P. brevipedicellatum, las cuales se distribuyen hasta los 1 800m snm. Las especies antillanas se distribuyen en formaciones de BNES con vegetación xerofítica, matorrales xeromorfos costeros, así como en formaciones erosionadas de carso y caliza en las Antillas Mayores. Las especies sudamericanas se distribuyen en enclaves de bosque seco en los valles interandinos, a lo largo del piedemonte oriental de los Andes y un reducido número de especies habitan bosques húmedos de la provincia biogeográfica de Chocó (Fig. 1B). Análisis filogenéticos recientes realizados para Enckea (Quijano y Callejas, 2009) han corroborado su monofilia y han descrito 2 clados principales conformados por especies con distribución disyunta en América Central y del Sur, denominados clado Centroamericano y clado Sudamericano. Asimismo, dentro de cada uno de los clados mayores se resolvieron clados pequeños con distribuciones restringidas a zonas geográficas como el norte y sur del piedemonte Andino y la Amazonia en América del Sur.
Enckea es el único clado de Piper con afinidad por los BNES. Esta característica ecológica hace mucho más interesante el estudio detallado de la distribución de sus especies. Sin embargo, no existen trabajos donde se establezcan hipótesis sobre los eventos históricos que pudieron haber influido en la actual distribución de estas especies. En este estudio se implementó un análisis panbiogeográfico, con el objetivo de plantear hipótesis de homología biogeográfica primaria para las especies de Enckea presentes en estas áreas. Para ello, se consideraron los eventos influyentes en la conformación de los patrones de distribución, los cuales pueden ser de tipo tectónico, geológico y geográfico. El análisis empleó la información sobre la ubicación geográfica de los taxones como fuente de datos primaria, partiendo de la premisa que estos datos se pueden asumir como fuente empírica de información sobre procesos históricos y evolutivos (Morrone, 2004; Grehan, 2011).
Materiales y métodosÁrea de estudioPara la delimitación del área de estudio se empleó el esquema de regionalización biogeográfica que mejor se ajustó a los datos de distribución obtenidos, teniendo en cuenta la escala y el muestreo (Morrone, 2001b). Éste incluyó la región Neotropical, desde el norte de México hasta el centro de Argentina, así como las Antillas. La distribución general de las especies comprende las subregiones Caribeña, Amazónica y Chaqueña, además de una pequeña representación en la región Andina de Venezuela, Colombia, Ecuador, la Puna de Perú, Bolivia, norte de Chile y Argentina.
TaxonesComo parte inicial del análisis se realizó una revisión completa de la literatura taxonómica del género Piper, enfocada específicamente en las especies del clado Enckea, para 74 taxones. Esta revisión incluyó todos los protólogos, revisión de tipos, trabajos florísticos de diversas regiones de América Central y del Sur, además de trabajos con información acerca de morfología y biología de los taxones (Ruiz y Pavón, 1798; Humboldt, 1817; Presl y Haenke, 1830; Schlechtendal, 1831; Kunth, 1839; Miquel 1843, 1844; Hooker, 1845; Grisebach, 1859; Schmitz, 1872; Pittier, 1896; Engler, 1908; Trelease, 1921; De Candolle, 1923; Kown, 1928; Trelease, 1929; Trelease, 1936; Trelease y Yuncker, 1950; Yuncker, 1953; Standley y Steyermark, 1952; Yuncker, 1972; Howard, 1988; Steyermark y Callejas, 2003). Para la compilación de los datos de distribución, se utilizó información proveniente de material en préstamo y bases de datos en línea de las siguientes colecciones: Herbario Nacional Colombiano (COL), Field Museum of Natural History (F), Fairchild Tropical Botanical Garden (FTG), Instituto Nacional de Biodiversidad (INB), Museo Nacional de Costa Rica (CR), Royal Botanical Gardens (K), Universidad Autónoma de México (MEXU), Missouri Botanical Garden (MO), Muséum National d’Histoire Naturelle (P), Botanisches Museum Berlin (B), New York Botanical Garden (NY), Smithsonian Institution (US), Genth University (GENT), Universidad del Valle (CUVC), Universidad Nacional de Colombia (VALLE), Universidad Industrial de Santander (UIS), Herbario Universidad Católica de Oriente (HUCO) y Universidad del Cauca (CAUP). Asimismo, se realizaron colecciones de campo en Bolivia, Colombia, Costa Rica, Ecuador, México y Panamá. Se excluyeron del análisis 24 especies representadas por un solo punto de distribución, pues no sustentaron trazos individuales y sólo se conocía la distribución de la localidad tipo.
Análisis de trazosSe construyó una base de datos a partir de la cual se mapearon los puntos de distribución correspondientes a cada especie, empleando el programa Quantum GIS 1.8.0. Para la creación de los árboles de tendido mínimo correspondientes a cada taxón se utilizó el programa MartiTracks (Echeverría y Miranda, 2011), el cual emplea un parámetro de mínima distancia euclidiana que reduce la redundancia inicial del conjunto de datos de partida y facilita la construcción del trazo individual. Finalmente, con base en los trazos individuales obtenidos se identificaron los trazos generalizados empleando el método manual (Craw, 1988; Craw et al., 1999), para ello se evaluó la congruencia topológica entre pares de trazos individuales, dando como resultado las hipótesis de correspondencia espacio-temporal entre las especies distribuidas en las diferentes áreas de BNES.
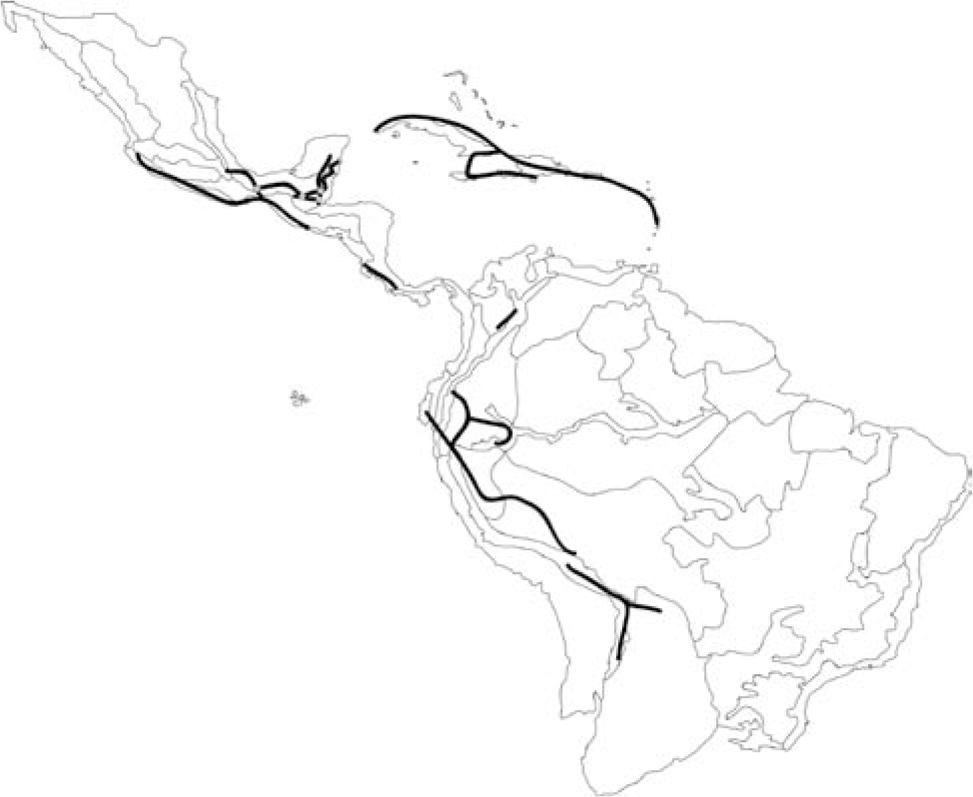
ResultadosDe las 50 especies evaluadas, 9 representaron trazos aislados que no fueron incluidos en el análisis por no contribuir a la resolución de los trazos generalizados. Estos incluyen las especies Piper villosulum, P. sp. nov. Ecuador, P. temiscoense, P. sp. nov. Colombia, P. pinoganense, P. nicoyanum, P. medium, P. magnifolium y P. jaliscanum. Además, P. reticulatum fue la única excluida debido a su distribución amplia. Finalmente, se obtuvieron 8 trazos generalizados, a partir de los 40 trazos individuales incluidos en el análisis (Cuadro 1).
Trazos generalizados obtenidos del análisis con las respectivas especies que los sustentan
| Trazos | Especies | Provincias biogeográficas | Subregión | Región/zona de transición |
| T1 | P. amalago, P. discolor, P. guanahacabibense, P. lindenianum, P. oviedoi y P. samanense | Antillas Menores, Cuba, La Española, Jamaica y Puerto Rico | Caribe | Neotropical |
| T2 | P. yucatanense, P. neesianum, P. wilsonii y P. vaccinum | Península de Yucatán y Golfo de México | Caribe | Neotropical |
| T3 | P. psilorhachis, P. uhdei, P. gracillium y P. gaumeri | Península de Yucatán y Golfo de México | Caribe | Neotropical |
| T4 | P. abalienatum, P. brevipedicellatum, P. diandrum, P. diguetii, P. guazacapanense, P. martensianum, P. melastomoides, P. michelianum, P. novogalicianum, P. retalhueleuense, P. stipulaceum y P. vergelense | Costa Pacífica Mexicana, Chiapas, Golfo de México y Sierra Madre del Sur | Caribe | Neotropical y Zona de Transición Mexicana |
| T5 | P. dissimulans, P. pertactatum, P. tilaranum, P. tenuipes, P. pittieri, P. compactum y P. adenophlebium | Este de América Central y oeste del Istmo de Panamá | Caribe | Neotropical |
| T6 | P. ceanothifolium y P. tenue | Magdalena | Caribe | Neotropical |
| T7 | P. enckea, P. laevigatum y P. nudilimbum | Pantanal, Yungas, Varzea, Napo, Cauca y Ecuador Árido | Amazónica y Caribe | Neotropical |
| T8 | P. orthosthachyum y P. tucumanum | Yungas y Chaco | Amazónica y Chaqueña | Neotropical |
Seis de estos trazos generalizados fueron identificados en formaciones de BNES, en América Central, las Antillas y los valles interandinos. Asimismo, 2 trazos generalizados corresponden a zonas de bosque húmedo tropical ubicadas en América Central y del Sur (Fig. 2). El trazo T1 está sustentado por 6 especies y se ubica en el dominio Antillano (Morrone, 2004), que incluye formaciones de BNES en las provincias de Puerto Rico, Cuba, La Española, Jamaica y las Antillas Menores. Trabajos previos han descrito la afinidad biogeográfica de estas provincias con base en datos de distribución de escarabajos y vertebrados (Rauchenberger, 1988; Crother y Guyer, 1996).
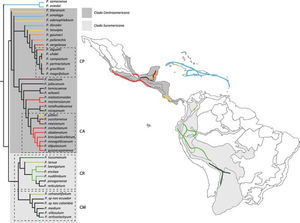
Los trazos T2 y T3 conectan las provincias de Península de Yucatán y Golfo de México en la subregión Caribe. Estos trazos están sustentados por 4 especies cada uno, distribuidas en México, Belice y Guatemala; a lo largo de la península de Yucatán, costa Caribe Mexicana y el occidente de Belice. Este patrón de distribución es congruente con el propuesto por Maya et al. (2011) para la subfamilia Charaxinae, dichos autores proponen que la distribución de este grupo de insectos está ligada a sus relaciones de herbivoría con especies como Piper yucatanense, la cual está incluida en el trazo T2 del presente trabajo. Las especies que componen este trazo son parte del denominado clado Arctottonia, dentro de uno de los 2 grupos principales del clado centroamericano de Enckea (Quijano y Callejas, 2009) (Fig. 3). Por otro lado, las especies que componen el trazo T3 son parte del clado Pseudolindenii, conformado por especies como P. uhdei y P. gracillium, las cuales se distribuyen en la provincia de Golfo de México, generalmente en zonas de bosque húmedo con densa vegetación.
Trazos generalizados obtenidos en el presente estudio y su representación en la filogenia de Enckea (Quijano y Callejas, 2009). CP: clado Pseudolindenii, CR: clado Reticulatum, CA: clado Arctotonia, CM: clado Medium.
El trazo T4 está sustentado por 12 especies distribuidas desde México hasta Guatemala y conecta las provincias de Costa del Pacífico Mexicano, Sierra Madre del Sur, Golfo de México y Chiapas. Este trazo conecta 4 de las 5 áreas de la Zona de Transición Mexicana y coincide con el trazo septentrional hallado por Morrone y Márquez (2001), donde se propone un patrón paleoamericano para explicar el origen mixto de la biota centroamericana. Según los autores esta área incluye taxones que se diversificaron en el Plioceno, antes del cierre del Istmo de Tehuantepec y con afinidades por zonas desérticas, pastizales y selvas lluviosas.
El trazo T5 lo componen 7 especies en su mayoría pertenecientes al clado centroamericano de Enckea. Éstas se distribuyen principalmente en bosques húmedos al oeste de Costa Rica y se encuentran entre las provincias biogeográficas del este de América Central y oeste del Istmo de Panamá, en la subregión Caribeña. La provincia del este de América Central se ubica desde Guatemala hasta Panamá, mientras que la provincia del oeste del Istmo de Panamá está ubicada al oeste de América Central, incluyendo la región occidental de Costa Rica y Panamá. El análisis de Quijano et al. (2006) recupera un patrón de áreas de endemismo anidadas para estas 2 provincias y muestra sus afinidades biogeográficas con el Chocó y el Darién. Asimismo, este trazo coincide con lo encontrado por Castillo y Reyes (1984) y Morrone (2001b), quienes basados en los patrones de distribución de coleópteros, definen las afinidades biogeográficas de la provincia del occidente del Istmo de Panamá con las provincias de Golfo de México y Chocó. Trabajos enfocados en la delimitación de áreas prioritarias para la conservación, como el de Myers et al. (1999), incluyen estas áreas como puntos importantes para la conservación de especies.
El trazo T6 fue el único recuperado en los Andes del Norte y se encuentra entre las vertientes oriental de la cordillera central y occidental de la cordillera oriental en Colombia. Este trazo está sustentado por 2 especies con distribución restringida al piedemonte Andino de Colombia y Venezuela; asimismo, es congruente con los resultados de análisis donde se describen las afinidades florísticas existentes entre las formaciones de bosque seco en los valles interandinos (IAVH, 1998; Pennington et al., 2000; Särkinen, 2012). Una de las especies que sustenta este trazo es P. tenue, descrita inicialmente por Kunth para el valle del río Magdalena y perteneciente al clado reticulatum (Quijano y Callejas, 2009), el cual está compuesto por especies con distribución disyunta en los valles interandinos del norte de América del Sur y la subregión Amazónica, zonas reconocidas previamente como afines desde el punto de vista florístico (Gentry, 1982; Amorim, 2001; Bornstein, 1989; Cortés y Franco, 1997; Franco y Berg, 1997).
El trazo T7 lo sustentan 3 especies distribuidas en el occidente de la subregión Amazónica, en las provincias de Pantanal, Ucayali, Yungas, Varzea y Napo. Análisis biogeográficos realizados para Cecropia, Piper y Peperomia recuperan trazos generalizados similares, los cuales relacionan las provincias del noroccidente Amazónico y el piedemonte Andino (Franco y Berg, 1997; Cortés y Franco, 1997; Quijano et al., 2006). Las especies que sustentan el trazo corresponden al clado reticulatum y se distribuyen en áreas parcialmente inundadas de la Amazonia Occidental. Finalmente, el trazo T8 lo integran 2 especies cuya distribución ha sido reportada principalmente en BNES al sur de la provincia de Yungas y el norte de la provincia de Chaco, en Bolivia y Paraguay, respectivamente. Estas provincias incluyen formaciones aisladas de BNES ubicadas en tierras bajas y valles del suroccidente de los Andes, con áreas de origen antiguo en la región del Chiquitano al oriente del estado de Santa Cruz en Bolivia (Werneck, 2011).
Se identificaron 4 nodos biogeográficos (Fig. 2): N1, N2 y N3 se componen de las intersecciones entre los trazos T2 y T3, y N4 de la intersección entre los trazos T3 y T4. Estos nodos son acordes con la alta diversidad de Enckea en el dominio Mesoamericano. Todos se localizaron al interior de la provincia de Golfo de México, en una región que puede ser considerada como de alta complejidad histórica, por estar entre algunos límites biogeográficos propuestos con dataciones relativamente recientes en tiempo geológico (Daza et al., 2010). Los nodos son reconocidos como áreas compuestas y de un alto valor para la conservación, ya que en ellos convergen múltiples especies (Craw et al., 1999; Morrone, 2001a).
DiscusiónBasados en los resultados del análisis de trazos, no fue posible integrar los distintos biomas de BNES bajo una historia común. Por el contrario, los resultados son congruentes con distintos eventos tectónicos en América Central, las Antillas y América del Sur, los cuales influyeron de manera independiente en la diversificación de grupos de plantas y animales. En América del Sur se han descrito diversos eventos que han modificado el continente hasta su forma actual, tales como la existencia de una PanAmazonía hace 20-30 Ma, el progresivo aumento de la tasa de levantamiento Andina hace 20 Ma, el levantamiento del norte de los Andes, el cual fraccionó la Amazonía y propició posibles eventos de especiación alopátrica no inferiores a 10 Ma y el periodo de cambio climático entre el Plioceno-Pleistoceno, donde el clima a lo largo del continente se tornó más seco y estacional (Hoorn et al., 2010). Los trazos T6, T7 y T8 muestran una distribución fragmentada de los BNES sudamericanos, similar a la propuesta por Prado y Gibbs (1993) en su hipótesis del Arco Pleistocénico, en la cual, con base en la distribución de diferentes especies de plantas se postula la existencia durante el Pleistoceno de una formación de bosques secos mucho más extensa que la actual, así como una conexión Amazónica, con el piedemonte Andino, como en el caso de T7 y T8. No obstante, algunos autores proponen con base en filogeografía y evidencia fósil, que aunque existieron vínculos físicos entre los fragmentos aislados de BNES durante los ciclos climáticos del Pleistoceno Superior (Ab‘Sáber, 1977, 1982), el origen y la colonización inicial de este tipo de formaciones es mucho más antigua, en el Mioceno tardío (Pennington et al., 2010).
La diversidad de plantas y animales en América del Sur se ha explicado como el resultado de una gran radiación durante épocas en las que las condiciones geofísicas permitieron ampliar el ámbito de distribución de las especies. Uno de los eventos más discutidos en la literatura, responsable del intercambio de biota entre América Central y del Sur fue el surgimiento del Istmo de Panamá datado de 7-3.5 Ma en el Plioceno. Trabajos como el de Padilla (2006), sugieren a partir de la distribución de la tribu Cantonini (Coleoptera: Scarabaeidae), 2 eventos geológicos importantes para explicar esta conexión. El primero ocurrido en el Mioceno y el segundo cuando la unión entre América Central y del Sur se restableció en el Plioceno (Hoorn et al., 2010). No obstante, trabajos como el de Echeverry y Morrone (2013), basados en lo encontrado por Kennan y Pindell (2009), reconocen un establecimiento más antiguo de las conexiones bióticas entre América Central y el norte de América del Sur, propiciado por la existencia de un arco volcánico en el Paleoceno tardío, responsable de la formación de Costa Rica y Panamá. Los trazos generalizados obtenidos para Enckea no muestran conexión entre los BNES de América Central y del Sur; no obstante, especies de bosque húmedo como P. reticulatum se distribuyen desde Costa Rica hasta Ecuador.
Los límites de los trazos T2, T3, T4 y T5 coinciden con las “barreras biogeográficas mesoamericanas” propuestas por Daza et al. (2010), donde son reconocidos 5 eventos geológicos principales que pudieron haber influido en la actual distribución de diferentes linajes de serpientes en América Central. En el caso del trazo T5 se observa que la distribución de las especies está restringida al piedemonte oriental de la cordillera de Talamaca, hacia la costa pacífica de Costa Rica y al sur del lago de Nicaragua, en un área compuesta por formaciones geológicas del Neógeno y del Cuaternario con actividad geomorfológica datada desde el Mioceno (Marshall et al., 2003; MacMillan et al., 2004). Los trazos T2 y T3 se encuentran al norte de la falla de Motagua-Polochic cerca de la Península de Yucatán, al oriente del Istmo de Tehuantepec y al norte de la depresión de Nicaragua, donde se considera ocurrieron múltiples corredores marinos durante el Plioceno, separando el norte y sur de América Central (Coates y Obando, 1996). El trazo T4 se distribuye principalmente al occidente del Istmo de Tehuantepec sobre la Sierra Madre Occidental y la Sierra Madre del Sur, incluyendo el suroccidente de América Central, en una región que se considera redujo sus zonas altas durante el Mioceno Tardío y el Plioceno (Morrone y Márquez, 2001), la presencia de especies pertenecientes al clado Arctottonia (CA), en T4 y T3, podría indicar un división oeste-este del Istmo de Tehuantepec (Fig. 3). La correspondencia de estos trazos generalizados con grandes barreras geográficas y geológicas, así como la delimitación de 4 nodos biogeográficos que incluyen los trazos T2, T3 y T4 muestra la importancia de estas áreas como zonas de convergencia tectónica, que pudieron tener influencia en la localización espacial de los actuales BNES, así como en los patrones de distribución y diversificación de Enckea en América Central. El trazo T1 obtenido en el presente análisis muestra un patrón biogeográfico antillano. Las Antillas constituyen 1 de los 5 puntos más importantes del planeta, debido a su biodiversidad, endemismo y peculiaridades de la evolución de su biota (Myers et al., 1999). Asimismo, en este conjunto de islas se evidencia la ausencia de algunos grupos taxonómicos representativos del continente cercano (Fontenla, 2006). El análisis de Duno-de Stefano et al. (2012) ha planteado una relación biogeográfica entre las Antillas y la Península de Yucatán, estimada entre el Plioceno y Holoceno, periodo inferior a los 3.7 Ma. No obstante, las afinidades florísticas de la Península de Yucatán aún son materia de continuo debate. Mientras el análisis de Lott y Atkinson (2005) muestra que las afinidades de la Península de Yucatán son mayores con respecto a los componentes continentales, otros como el de Echeverry y Morrone (2013) no muestran un patrón biogeográfico concluyente de esta península con respecto al componente continental.
Se han propuesto diferentes hipótesis que pretenden explicar el origen de la flora antillana; no obstante, este grupo de islas posee una historia compleja que implica la unión de áreas con diferentes orígenes y conexiones geológicas. Un ejemplo de esto fue la unión de Jamaica y sur de La Española en el Eoceno-Oligoceno, así como la separación de Puerto Rico y La Española, seguida de la separación de esta última del oriente de Cuba en el Oligoceno Superior-Mioceno Medio (Iturralde, 2006). Otro análisis paleográfico propone que durante la transición Eoceno-Oligoceno existieron territorios discontinuos emergidos entre América del Norte, Mesoamérica (lo que hoy constituye México, Yucatán, Honduras y Nicaragua) y las Antillas Mayores, como el elevado de Nicaragua y la Cresta de Caimán (Fontenla, 2006). El origen heterogéneo planteado para la biota antillana hace complejo explicar la distribución actual de las especies de Enckea en áreas con diferentes orígenes geológicos, pero condiciones ecológicas similares. Smith et al. (2008) proponen un origen reciente para el clado Enckea de aproximadamente 8.23 Ma; sin embargo, el registro fósil empleado para calibrar la filogenia no pertenece al género Piper. Según los autores la gran diversificación del género es posterior a un prolongado lapso de tiempo, Cretácico Superior-Eoceno, en el cual no ocurrieron eventos importantes de cladogénesis. Esta hipótesis es congruente con una colonización reciente de Enckea en las Antillas, posterior al surgimiento del Istmo de Panamá y contrasta con la hipótesis de GAARlandia (Iturralde y MacPhee, 1999), en la cual se propone una conexión anterior entre el occidente de América del Sur y las Antillas, estimada entre el Eoceno-Oligoceno (33-35 Ma). Esta hipótesis ha sido considerada como una posible explicación a la existencia de ciertos grupos de plantas y animales en este conjunto de islas (Fontenla, 2006). GAARlandia fue conformada mediante la unión de la Cresta de Aves, el nordeste de América del Sur y los actuales territorios de Puerto Rico, Islas Vírgenes, La Española en parte, y Cuba centro-oriental. El hecho que las Antillas estén conformadas por diferentes bloques geológicos, dificulta la interpretación de los patrones hallados dentro del clado. Un origen reciente para Enckea, como el propuesto por Smith et al. (2008), es problemático para explicar la distribución del clado en las Antillas, pues implica una rápida expansión de la distribución ancestral, seguida de diversificación en un tiempo relativamente corto, en el cual las conexiones cercanas entre las biotas continentales y las antillanas probablemente no ocurrieron.
La gran riqueza del clado en América Central, así como su distribución en América del Sur y las Antillas, es congruente con eventos geológicos previos al Mioceno, así como el incremento de la actividad volcánica, el levantamiento del Istmo de Panamá y la formación de zonas más áridas entre América Central y del Sur. La distribución de las especies en América del Sur fue afectada por factores como el levantamiento de los Andes del Norte, creando distribuciones disyuntas en algunas regiones de BNES que han permanecido estables hasta la época actual. La ocupación de las Antillas pudo ocurrir de 2 posibles formas; la primera, implica una colonización reciente a través de la Península de Yucatán (3.7 Ma), mientras que la segunda pudo ser debida a un proceso más antiguo durante la unión de la Cresta de Aves, el noreste de América del Sur y los actuales territorios de Puerto Rico, Islas Vírgenes, La Española y Cuba (GAARlandia). La inclusión de nuevos registros fósiles del género Piper y una nueva propuesta filogenética molecular contribuirán a una estimación más precisa de la historia biogeográfica de Enckea. De esta manera, se podrán generar hipótesis más robustas con respecto a la ocupación de las especies del clado en las formaciones de BNES.
Los autores agradecen muy especialmente al herbario de la Universidad de Antioquia (HUA) y a su grupo de trabajo por la colaboración logística y facilitar su colección de referencia para la realización del presente trabajo. A la Unidad de Investigación y Desarrollo y al herbario de la Universidad Católica de Oriente, por haber financiado el presente proyecto; al laboratorio de Biogeografía aplicada y Bioacústica del Instituto Alexander Von Humboldt, por la asesoría prestada en el mapeo de los ejemplares y a las valiosas observaciones realizadas al artículo por dos revisores anónimos. Asimismo, el segundo autor quiere agradecer a su familia y a Alejandra Ocampo por todo el apoyo que le dieron en la realización del trabajo.