Dos especies nuevas de ácaros ectoparásitos de la familia Pterygosomatidae, Geckobia aureae sp. nov. y Bertrandiella campanensis sp. nov. son descritas con base en hembras adultas. Ambas especies se encontraron asociadas al gecko Phyllodactylus microphyllus, lagartija endémica del noroeste de Perú. Bertrandiella campanensis sp. nov. constituye el primer registro del género en Perú.
Two new species of ectoparasitic mites of the family Pterygosomatidae, Geckobia aureae sp. nov. and Bertrandiella campanensis sp. nov. are described based on adult females. Both species were found associated with the gecko Phyllodactylus microphyllus, endemic lizard from northwestern Peru. Bertrandiella campanensis sp. nov. is the first record of the genus in Peru.
La familia Pterygosomatidae (Oudemans, 1910) está integrada por ácaros ectoparásitos permanentes asociados principalmente con lagartijas, en menor grado con artrópodos, y excepcionalmente una especie se ha encontrado asociada a una tortuga y otra a un ave (Bertrand y Pedrono, 1999; Bochkov y OConnor, 2006; Jack, 1964; Paredes-León, Klompen y Pérez, 2012; Prasad, 1975). Pterygosomatidae tiene una distribución mundial y está comprendida por 10 géneros y 177 especies, algunas de las cuales tienen alta especificidad hacia el huésped (Bertrand, Kukushkin y Pogrebnyak, 2013; Fajfer, 2012, 2013a, 2013b; Fajfer y González-Acuña, 2013; Fajfer y Melnikov, 2014; Paredes-León, 2013; Paredes-León, Cuervo-Pineda y Pérez, 2013).
Dentro de Pterygosomatidae, el género Geckobia Mégnin, 1878 es el que tiene la distribución geográfica más amplia y la mayor riqueza con 72 especies (Bertrand et al., 2013; Fajfer, 2012; Paredes-León, 2013) parásitas de lagartijas Gekkonidae s.l., con excepción de Geckobia enigmatica Bertrand y Pedrono, 1999 asociada a tortugas (Bertrand y Pedrono, 1999). La mayoría de las especies son parásitas monoxenas –ocurre en una sola especie huésped– o estenoxenas –en especies huésped del mismo género–, y solo 3 de ellas se consideran oligoxenas –sucede en huéspedes de 2 o más géneros de la misma familia o subfamilia– (Bertrand y Pedrono, 1999; Bochkov y Mironov, 2000). Dentro del género Geckobia, Jack (1964) propuso 2 grupos de especies (A y B) de acuerdo con el número de sedas de los tarsos de las patas i-iv y 3 grupos de especies (1, 2 y 3) con base en el número de sedas de los trocánteres a las tibias de las patas i-iv; posteriormente Bochkov y Mironov (2000) añadieron un cuarto grupo. Aparentemente, estos agrupamientos no necesariamente reflejan la filogenia, pero son muy útiles a la hora de comparar las especies (Bertrand, Pfliegler y Sciberras, 2012). En particular en América, se han registrado 8 especies: Geckobia guyanensis Floch y Abonnenc, 1944, Geckobia manaensis Floch y Abonnenc, 1945, Geckobia cayennensis Floch y Fauran, 1955 (las 3 de la Guayana Francesa); Geckobia tarentolae De la Cruz, 1973 (Cuba); Geckobia leonilae Hoffmann y Morales-Malacara, 1986 (México); Geckobia hemidactyli Lawrence, 1936 (Antigua, Brasil, Colombia, Cuba, Dominica, Granada, Guadalupe, Islas Vírgenes británicas y estadounidenses, y Puerto Rico); Geckobia keegani Lawrence, 1953 (Costa Rica y México); y Geckobia bataviensis Vitzthum, 1926 (México) (Floch y Abonnenc, 1944, 1945; Floch y Fauran, 1955; Frenkel y Vargas, 2005; De la Cruz, 1973; Hoffmann y Morales-Malacara, 1986; Martínez-Rivera, González-Negrón, Bertrand y Acosta, 2003; Paredes-León, García-Prieto, Guzmán-Cornejo, León-Regàgnon y Pérez, 2008).
Por otro lado, el género Bertrandiella Paredes-León et al., 2012 está comprendido por 5 especies altamente específicas (monoxenas o estenoxenas) a sus lagartijas huéspedes pertenecientes a las familias Phyllodactylidae, Sphaerodactylidae y Eublepharidae, todas ellas distribuidas en América (EE. UU., México, Cuba y Colombia) (Paredes-León, 2013; Paredes-León et al., 2012). Con respecto a la acarofauna de pterigosomátidos de Perú, únicamente se conoce la existencia de Pimeliaphilus triatomae Cunliffe, 1952 parasitando a la chinche Triatoma infestans (Klug, 1834) en criadero de laboratorio en Lima (Newell y Ryckman, 1966), y el registro de Geckobia sp. parasitando a la lagartija Phyllopezus maranjonensis Koch, Venegas y Böhme, 2006 en el Centro Poblado Balsas de la región Amazonas (Aguirre-Aysanoa, Montoya-Arauco, Grau-Monge, Chávez y Rojas, 2011). Por su parte, Martínez-Rivera et al. (2003) inspeccionaron lagartijas de Perú en busca de representantes del género Geckobia, pero no lograron recolectar ácaros en dichos huéspedes. Ninguna especie del género Bertrandiella ha sido registrada previamente en Perú (Paredes-León, 2013; Paredes-León et al., 2012). El presente trabajo contribuye con la descripción de 2 especies nuevas de pterigosomátidos ectoparásitos de la lagartija endémica Phyllodactylus microphyllus Cope, 1876 procedentes del cerro Campana en Trujillo, incrementando el conocimiento de la biodiversidad de Perú y de los ácaros de la familia Pterygosomatidae.
Materiales y métodosEl cerro Campana es considerado un ecosistema único, restringido y frágil, caracterizado por una flora y fauna consideradas relictas de alto endemismo y antigüedad. La importancia biológica de esta elevación radica en la variación climática que en ella se registra y que fluctúa ampliamente en el trascurso del año; la topografía del Campana es accidentada, sus proximidades están conformadas por terrazas eólicas de arena de grano fino que brindan al paisaje la apariencia de llanuras y colinas ericáceas de relieve ondulado (Quiróz-Moreno y Quiroz-Gutiérrez, 2012). Se trata de una elevación ubicada a 16.7km al norte de la ciudad de Trujillo; geográficamente se localiza entre los 8°00’18.16” S, 79°06’18.34” O y los 7°58’36.98” S, 79°06’16.18” O. Políticamente pertenece al Distrito de Huanchaco, Provincia de Trujillo, Departamento de La Libertad, Perú.
En el área de estudio, ubicada entre los 230-300m snm, las lagartijas fueron visualizadas y recolectadas del suelo y de las rocas usando la técnica de muestreo «búsqueda por encuentro visual» (Crump y Scott, 1994), estableciendo transectos de 100m de largo por 2m de ancho, los cuales fueron recorridos entre las 9 y 12h y entre las 20 y 24h. En total se recolectaron 10 lagartijas (3 machos juveniles y 7 hembras adultas), las hembras presentaron un mayor número de ácaros parásitos; después de inspeccionarse en busca de ácaros, las lagartijas fueron liberadas. Durante el 2012, el cerro Campana presentó en el aire como promedio anual una temperatura máxima de 26.4°C, mínima de 22.2°C; mientras que en el suelo hubo una temperatura máxima de 34.2°C y mínima de 25°C; la humedad relativa promedio anual máxima fue del 68% y la mínima del 61%. La presión atmosférica promedio fue de 1,013mb (Quiroz-Gutiérrez, obs. pers.).
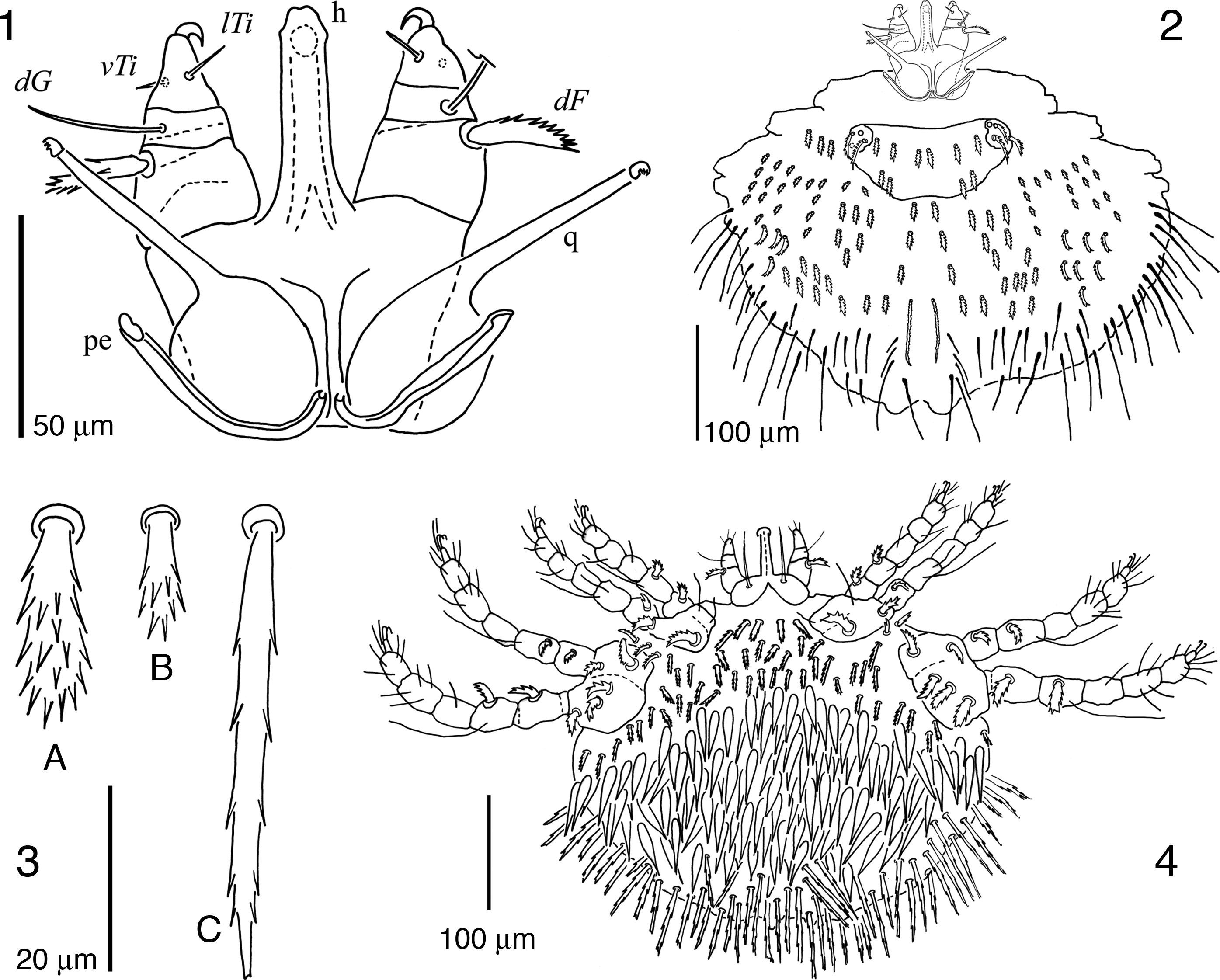
Para la recolección de ácaros se utilizó la técnica de separación directa del huésped mediante el uso de pinceles de punta fina. Los ácaros fueron recolectados del conducto auditivo externo, de la unión de las patas traseras con el cuerpo y del abdomen de las lagartijas. Los ácaros fueron aclarados con lactofenol al 2%, y con ayuda de un microscopio estereoscópico Olympus (SZ11) fueron montados entre portaobjetos y cubreobjetos usando líquido de Hoyer como preservador y se dejaron secar durante una semana. Para la descripción de los pterigosomátidos se utilizó un microscopio óptico compuesto Nikon (Optiphot-2). Las ilustraciones fueron hechas usando un tubo de dibujo adaptado al microscopio, las mediciones fueron realizadas con un objetivo graduado y están indicadas en micrómetros (μm). La nomenclatura de las sedas de las patas, del idiosoma y de los pedipalpos corresponden a la propuesta de Grandjean (1939, 1944, 1946) tal como la implementaron para los ácaros Pterygosomatidae tanto Bochkov y OConnor (2006) como Paredes-León et al. (2012); en el caso de la quetotaxia de las patas, cuando ambas sedas de un par están presentes se indican entre paréntesis con su abreviatura, y si es solo una de ellas la que está presente se mencionan de acuerdo con Grandjean (1944), ya sea que se trate de la paraxial con una comilla (’) o si se trata de la antiaxial con doble comilla (”). En las figuras 1, 7 y 8 las abreviaturas indican, h: hipostoma, pe: peritrema y q: quelícero; el resto de las abreviaturas de los nombres de las sedas utilizadas tanto en la descripción como en las figuras están detalladas en Paredes-León et al. (2013).
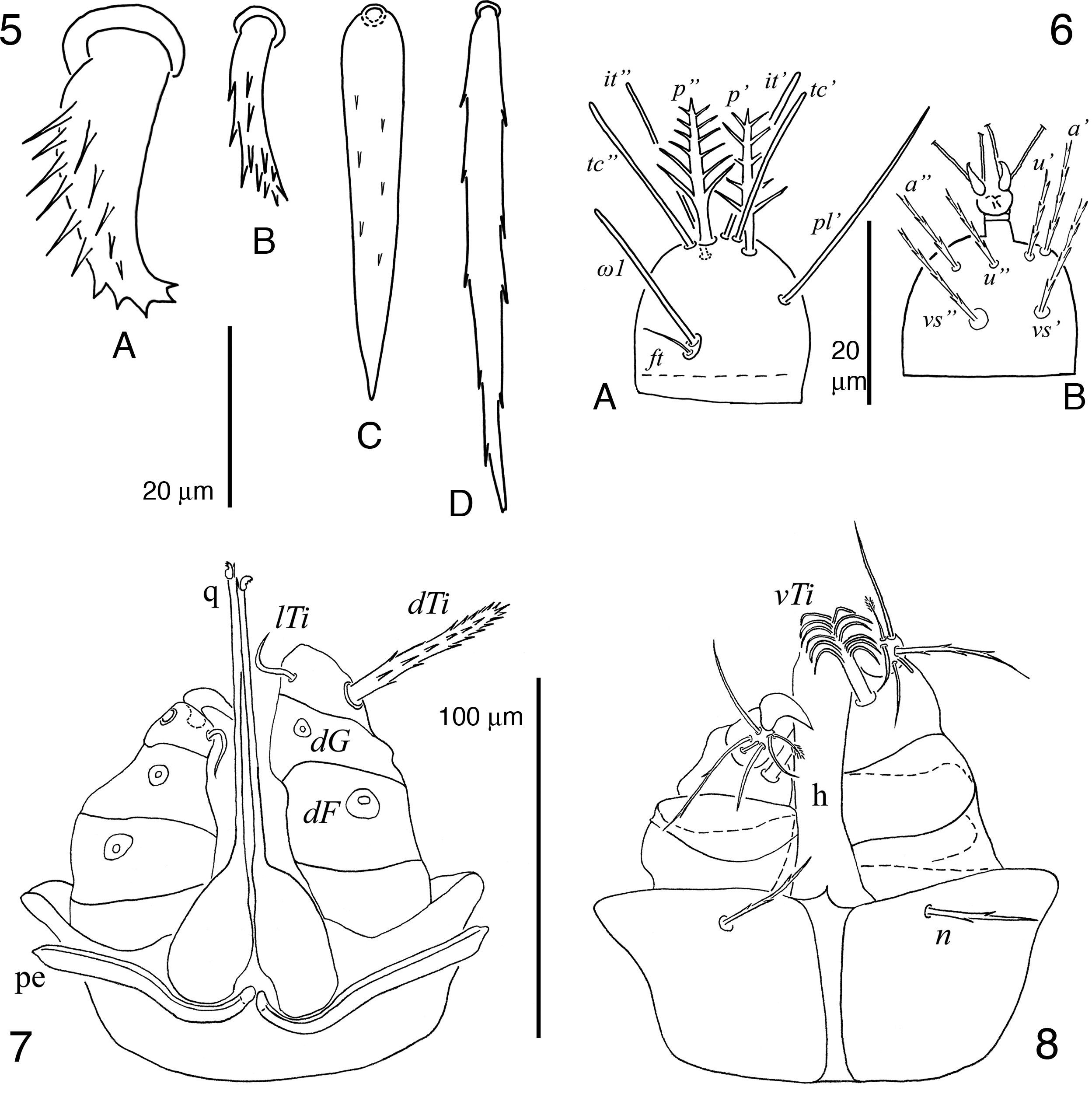
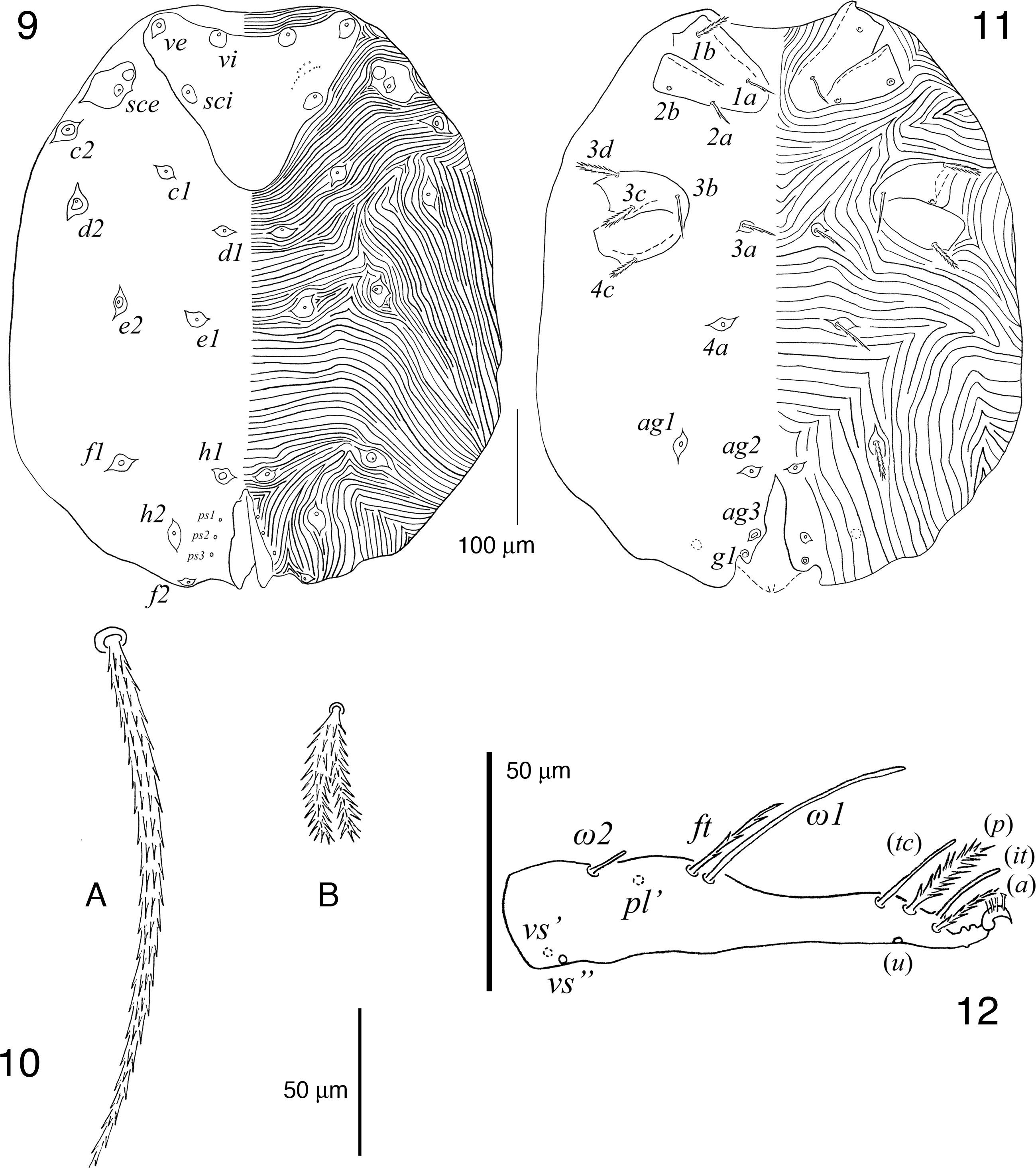
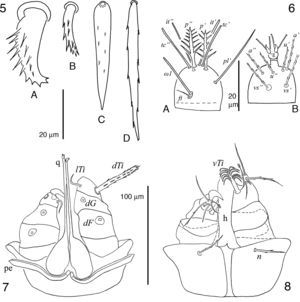
5 y 6 hembra de Geckobia aureae sp. nov.; 5A, seda de la coxa ii; 5B, seda ventral anterior del idiosoma; 5C, seda central del vientre del idiosoma; 5D, seda posterolateral del idiosoma; 6A, tarso i en vista dorsal; 6B, tarso i en vista ventral; 7 y 8 hembra de Bertrandiella campanensis sp. nov.; 7, gnatosoma en vista dorsal; 8, gnatosoma en vista ventral.
Idiosoma más ancho que largo, ventralmente con sedas centrales lanceoladas; placa prodorsal con 5 pares de sedas y un par de pequeñas placas oculares que incluyen un ojo y 3 sedas cada una; pertenece al grupo 1 de acuerdo con el número de sedas de los trocánteres–tibias de las patas i-iv (1–1–1–1, 3–2–2–2, 1(κ)–0–0–1, 5–5–5–5) y al grupo A de acuerdo con el número de sedas tarsales i-iv (14(ω1)–10(ω)–10–10).
Descripción de la hembraGnatosoma (fig. 1). Margen anterior del subcapitulum ventralmente con un par de sedas n delgadas, lisas, puntiagudas y largas, extendiéndose más allá de los pedipalpos; hipostoma tubiforme, sin dentición y terminando ligeramente ensanchado. Fémur del pedipalpo con una seda dorsal gruesa, pectinada y corta; genua con una seda dorsal delgada, lisa y más larga que la del fémur; tibia con sedas lTi y vTi delgadas, lisas, puntiagudas y cortas; uña tibial simple, curvada y corta –más corta que la longitud de la tibia–; tarso del pedipalpo con un solenidio basal pequeño, 2 sedas delgadas y lisas, y 2 sedas escasamente barbuladas. Quelíceros de longitud similar a los pedipalpos, con su base globosa y parte anterior delgada terminando en un dedo fijo membranoso y un dedo móvil curvado con 3 dientes, ambos dedos pequeños. Peritremas relativamente cortos, apenas sobrepasando la base de los quelíceros.
Idiosoma oval ligeramente más ancho que largo, siendo la parte posterior a las coxas iv la más ancha (figs. 2-5); cutícula estriada excepto en la placa prodorsal y coxas; hipertriquia presente. Dorso (fig. 2). Placa prodorsal pequeña, claramente más ancha que larga y con 5 pares de sedas gruesas, pectinadas y cortas (fig. 3A); un par de ojos presentes, cada uno asociado con 3 sedas similares a las de la placa prodorsal, aunque ligeramente más largas y ubicadas en una pequeña placa ocular adyacente y anterolateral a la placa prodorsal. Resto del dorso cubierto por 2 tipos de sedas, siendo las centrales cortas y pectinadas (fig. 3B) y las laterales delgadas, largas y finamente pectinadas (fig. 3C). Área anogenital alcanzando la parte ventral y con 8 pares de sedas periféricas a la abertura. Vientre (fig. 4). Coxas i-ii y iii-iv agrupadas, aunque no completamente fusionadas, ya que presentan una división incompleta en la parte proximal; ambos grupos coxales ubicados en la mitad anterior del idiosoma; grupo coxal i-ii bien separado del grupo coxal iii-iv por cutícula estriada que presenta 3 o 4 sedas a cada lado de esta zona intercoxal; sedas en las coxas i-iv: 2–2–2–3, siendo las de las coxas i delgadas, escasamente barbuladas y largas; mientras que las de las coxas ii-iv son gruesas, pectinadas y cortas (equivalentes a los espolones coxales denominados por Hirst, 1917) (fig. 5A). Región ventral restante cubierta más densamente que el dorso por 3 tipos de sedas: las anteriores que son pectinadas, cortas –similares a las centrales del dorso–, más delgadas que las coxales (fig. 5B) y ubicadas entre los pares de coxas i-iii y alrededor de las coxas iv; un segundo tipo de sedas lanceoladas, moderadamente pectinadas, largas y con los bordes lisos (fig. 5C), son las más numerosas y cubren toda la parte central del idiosoma; el tercer tipo de sedas se encuentran en los márgenes posterolaterales y son delgadas, largas y finamente pectinadas –similares a las laterales dorsales– (fig. 5D).
Patas cortas, siendo la pata iv más larga que las i-iii. Quetotaxia detallada como sigue, pata i: trocánter con seda v pectinada, ligeramente engrosada y corta; fémur con d escasamente barbulada, delgada y larga (alcanzando el tarso i), v’ pectinada, ligeramente engrosada y corta, y l” escasamente barbulada, delgada y corta; genua con l’ aparentemente lisa, delgada y ligeramente más larga que el artejo y microseda κ presente; tibia con d, (l) y (v) escasamente barbuladas, delgadas y largas, siendo la d la más larga y con alvéolo profundo en forma de copa; tarso con solenidio ω1 ubicado en la parte proximal del artejo y con seda acompañante ft espiniforme y reducida –menos de la mitad de la longitud del ω1–, pl’ lisa, delgada y alcanzando el pretarso (tc) e (it) tipo eupatidios y cortos apenas rebasando el pretarso, (p) cortas y plumiformes con barbas largas (fig. 6A), (a), (u) y (vs) barbuladas y cortas (fig. 6B). Pata ii: trocánter con seda v como en trocánter i, aunque ligeramente más larga; fémur con d y v” barbuladas, delgadas y largas, la d más larga alcanzando la tibia ii y la v” de la longitud del fémur ii; genua sin sedas; tibia con d, (l) y (v) como en tibia i, excepto que son más cortas –de la longitud de la tibia– y d con alvéolo normal; tarso con solenidio ω basal y corto, (tc) escasamente barbuladas y delgadas, siendo la tc’ más larga que la tc”, (p), (a), (u) y (vs) igual que en tarso i. Pata iii: trocánter con seda v como en trocánter ii; fémur con d cómo en fémur ii y v” pectinada, ligeramente engrosada y corta –más corta que el artejo–; genua sin sedas; tibia con d, (l) y (v) como en tibia i; tarso con sedas (tc), (p), (a), (u) y (vs) como en tarso ii. Pata iv: trocánter con seda v gruesa, pectinada y corta –similar a las sedas de las coxas ii-iv–; fémur con d como en fémur iii, v” gruesa, pectinada y corta –similar a las sedas de las coxas ii-iv–; genua con la v’ escasamente barbulada, delgada y corta –de la longitud del artejo–; tibia con d, (l) y (v) como en tibia III; tarso con (tc) escasamente barbuladas, delgadas y ambas largas y del mismo tamaño, rebasando el pretarso, (p), (a), (u) y (vs) como en tarso iii. Resumen del número de sedas por artejos ordenadas de la pata i a la iv, sedas especializadas (microseda κ y solenidios) indicadas aparte entre paréntesis: trocánteres 1–1–1–1, fémures 3–2–2–2, genuas 1(κ)–0–0–1, tibias 5–5–5–5 y tarsos 14(ω1)–10(ω)–10–10.
MedicionesHolotipo hembra –seguida en paréntesis por las medidas de un paratipo hembra–. Longitud del gnatosoma 86 (71); ancho de la base del gnatosoma 75 (65); longitud de la seda subcapitular n 53 (46); longitud de los quelíceros 93 (84); ancho de la base del quelícero 21(23); longitud del pedipalpo 74 (70); ancho del pedipalpo (a la altura del fémur) 26 (25); longitud de la uña tibial del pedipalpo 8 (8); longitud del peritrema (completo) 135 (120); longitud del idiosoma, excluyendo el gnatosoma, 290 (245); anchura máxima del idiosoma (posterior a las coxas iv) 370 (345); longitud de la placa prodorsal 68 (62); ancho de la placa prodorsal, a la altura del margen anterior, 125 (135); longitudes de las patas, excluyendo el pretarso: pata i 145 (140), pata ii 165 (160), pata iii 190 (185), pata iv 235 (210); longitud del solenidio ω1 del tarso i 17 (16), longitud de la seda ft del tarso I 7 (7), longitud del solenidio ω del tarso ii 8 (8).
Larva, ninfas y machoDesconocidos.
Resumen taxonómicoLocalidad tipo. Cerro Campana, Trujillo, Perú.
Serie tipo. Hembra holotipo y una hembra paratipo ex Phyllodactylus microphyllus, Perú, Departamento La Libertad, Provincia Trujillo, Distrito Huanchaco, cerro Campana, 8°00’18.16” S, 79°06’18.34” O, 650m snm, 9 de septiembre de 2011, col. C. G. Quiroz-Gutiérrez.
Depósito de ejemplares. Holotipo y paratipo en Colección Nacional de Ácaros (CNAC) del Instituto de Biología de la Universidad Nacional Autónoma de México en México, Distrito Federal. Ambos ejemplares preservados en el mismo portaobjetos (CNAC007250).
Huésped tipo. Phyllodactylus microphyllus Cope, 1876, «Central Leaf-toed Gecko».
Sitio de infestación. Ventralmente en el abdomen y patas traseras.
Especificidad de huésped. Monoxena, con base en los datos con los que se cuenta.
Etimología. Esta especie es nombrada y dedicada en honor a la señora Aurea Azucena Moreno-Rodríguez, abuela del primer autor y fallecida recientemente.
Distribución. Conocida únicamente de la localidad tipo en Perú.
Comentarios taxonómicosDe acuerdo con el número de sedas de los trocánteres-tibias de las patas i-ivG. aureae sp. nov. pertenece al grupo de especies 1 (i.e., trocánteres 1–1–1–1, fémures 3–2–2–2, genuas 1(κ)–0–0–1 y tibias 5–5–5–5); G. aureae sp. nov. difiere de las otras especies del género Geckobia pertenecientes al grupo 1 por la presencia de placa prodorsal, ya que Geckobia papuana Hirst, 1917, Geckobia gehyrae Hirst, 1926, Geckobia fitzsimonsi Lawrence, 1951, Geckobia philipinensis Lawrence, 1953, Geckobia canariensis Zapatero-Ramos, González-Santiago, Solera-Puertas y Carvajal-Gallardo, 1989 y Geckobia tinerfensis Zapatero-Ramos, González-Santiago, Solera-Puertas y Carvajal-Gallardo, 1989 carecen de placa; en Geckobia latasti Mégnin, 1878 y Geckobia loricata Berlese, 1892 la placa prodorsal es extremadamente reducida, en tanto que Geckobia malayana Hirst, 1917 presenta 2 placas en lugar de una. Geckobia aureae sp. nov. presenta las sedas medio-ventrales lanceoladas, mientras que en Geckobia tarentulae Trägårdh, 1905 tienen forma de abanico, en Geckobia turkestana Hirst, 1926 tienen forma de corazón, en Geckobia karroica Lawrence, 1936 y en G. leonilae son ramificadas o aserradas, y en Geckobia estherae Bertrand et al., 2012 son más ensanchadas y en forma de escama. Geckobia aureae sp. nov. tiene 5 pares de sedas en la placa prodorsal, excluyendo las de las placas oculares; mientras que G. hemidactyli, Geckobia hindustanica Hirst, 1926, Geckobia hewitti Lawrence, 1936, Geckobia homopholis Lawrence, 1936, Geckobia pachydactyli Lawrence, 1936, Geckobia tasmani Lawrence, 1936, Geckobia orientalis Abdussalam, 1941, Geckobia damarensis Lawrence, 1951, Geckobia uenoi Kawashima y Kamo, 1960, Geckobia crassipes Bertrand e Ineich, 1987 y Geckobia hirsti Bochkov y Mironov, 2000 tienen más de 5 pares de sedas en la placa prodorsal. Geckobia aureae sp. nov. tiene el idiosoma marcadamente más ancho que largo, mientras que en Geckobia clelandi Hirst, 1917, en Geckobia phyllodactyli Lawrence, 1936 y en Geckobia manzanelli Domrow, 1983 es casi circular, tan ancho como largo. Adicionalmente, la mayoría de las especies de Geckobia pertenecientes al grupo 1 no se distribuyen en América con excepción de G. hemidactyli y G. leonilae.
Aproximadamente 30 especies del género Geckobia no han sido asignadas a algún grupo de los propuestos por Jack (1964) y Bochkov y Mironov (2000), ya sea porque el número de sedas no fue descrito detalladamente o porque el número de sedas de las patas es diferente al de los grupos propuestos. Dentro de estas especies se encuentran algunas de las que se distribuyen en América (i.e., G. bataviensis, G. cayennensis, G. guyanensis, G. keegani y G. manaensis). Geckobia aureae sp. nov. presenta la seda v’ en las genuas iv, mientras que G. bataviensis y G. keegani carecen de sedas en las genuas iv. Adicionalmente, G. aureae sp. nov. tiene la seda v en el trocánter iv y el número de sedas de los fémures i-iv es 3–2–2–2, mientras que G. keegani carece de sedas en el trocánter iv y el número de sedas en los fémures i-iv es 2–1–1–1. Geckobia aureae sp. nov. tiene 5 pares de sedas en la placa prodorsal, mientras que G. bataviensis, G. cayennensis, G. guyanensis y G. keegani tienen más de 5 pares de sedas en la placa, y G. manaensis no tiene placa prodorsal. Con respecto a las otras 3 especies del género Geckobia registradas en América (i. e., G. hemidactyli, G. leonilae y G. tarentolae), G. aureae sp. nov. se diferencia en el número de sedas de las patas que la ubica en el grupo 1, mientras que G. tarentolae pertenece al grupo 4 que se caracteriza por el número de sedas de los trocánteres-tibias de las patas i-iv: 1–1–1–1, 3–2–2–2, 1(κ)–0–0–0, 5–5–5–5 (Paredes-León et al., 2013). Las otras 2 especies americanas (i.e., G. hemidactyli y G. leonilae) pertenecen al mismo grupo de especies (grupo 1) que G. aureae sp. nov. con las cuales ya fue comparada en párrafos anteriores.
Geckobia aureae sp. nov. junto con los datos geográficos de G. hemidactyli en Brasil (Martínez-Rivera et al., 2003; Paredes-León et al., 2013) y Geckobia sp. en Perú (Aguirre-Aysanoa, Montoya-Arauco, Grau-Monge, Chávez y Rojas, 2011) representan los registros más sureños del género Geckobia en América.
Bertrandiella campanensis Quiroz-Gutiérrez, Paredes-León, Roldán-Rodríguez et Pérez, sp. nov. (figs. 7-12)DiagnosisHembra adulta con uña tibial del pedipalpo simple, de la misma longitud de la tibia y curvada en su base; tarso del pedipalpo con un solenidio ω y 5 sedas adicionales; placa prodorsal con sedas sci ampliamente separadas entre sí; sedas idiosomales h1, h2, f2, ps2, ps3 y ag3 bifurcadas en su mitad distal; tarso I con 2 solenidios (ω1 y ω2) y con seda ft escasamente barbulada y más corta, casi la mitad de la longitud del solenidio ω1; solenidio ω2 en tarso i y solenidios en tarsos ii y iii cortos.
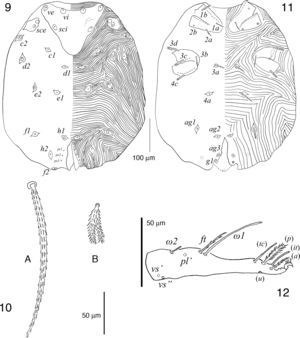
Descripción de la hembraGnatosoma (figs. 7-8). Subcapitulum simple con un par de sedas n cortas, delgadas, escasamente barbuladas y situadas cerca del margen anterior a la altura de donde inician los pedipalpos; margen anterodorsal del subcapitulum muy ensanchado y extendiéndose lateralmente, justo a la altura de la inserción de los pedipalpos; hipostoma tubiforme y sin dentición. Pedipalpos con fémur y genua más anchos que largos y cada uno de estos artejos con una seda dorsal, dF y dG, respectivamente (fig. 7); tibia tan larga como ancha, con seda dTi gruesa, pectinada y larga, lTi delgada, lisa y puntiaguda y vTi con la parte basal engrosada que se expande en su parte media y termina en un mechón de filamentos largos y finos; tarso reducido y redondeado con un solenidio basal y 5 sedas adicionales, 3 de ellas aparentemente lisas, una escasamente barbulada y otra solo barbulada distalmente (fig. 8). Quelíceros ligeramente más largos que los pedipalpos; parte proximal globosa y aproximadamente 5 veces el ancho de la parte distal; dedo fijo membranoso, espiniforme y dedo móvil curvado hacia fuera como gancho y con un par de dientes distales. Peritremas cortos, apenas alcanzando la parte proximal de los fémures pedipalpales.
Idiosoma oval, más largo que ancho, en hembras engordadas la parte más ensanchada se encuentra en el margen posterior al nivel del par de sedas dorsales f1 (figs. 9-11). Con holotriquia. Cutícula estriada excepto en la placa prodorsal, en las plaquitas de los alvéolos de las sedas, coxas y área anogenital. Dorso (fig. 9). Placa prodorsal en forma de triángulo equilátero invertido, con margen anterior cóncavo y con 3 pares de sedas (vi, ve y sci). Sedas vi, ve, sci, sce, c1, c2, d1, d2, e1, e2, f1 y ps1 pectinadas y largas (fig. 10A); sedas h1, h2, f2, ps2 y ps3 pectinadas y bifurcadas en su mitad distal (fig. 10B). Sedas c3 ausentes; sedas ps1–3 similares en longitud. Vientre (fig. 11). Fórmula de las sedas coxales i-iv: 2–2–4–2, siendo 1a, 2a, 3a, 3b y 4a delgadas y ligeramente ramificadas, mientras que 1b, 2b, 3c, 3d y 4c gruesas y pectinadas, todas ellas ubicadas en las coxas con excepción de las 3a y 4a que se ubican en el idiosoma entre las coxas iii y posteriores a las coxas iv, respectivamente. Posterior a las sedas 4a se encuentran 3 pares de sedas agenitales pectinadas (ag1–3) y un par de sedas genitales (g1), estas últimas elaboradamente pectinadas (arboriformes); seda ag3 bifurcada en su mitad distal.
Patas largas, ligeramente más cortas que el idiosoma engordado; patas iv más largas que las i-iii. Quetotaxia detallada como sigue, pata i: trocánter con seda v pectinada y gruesa; fémur con d, (l) y (v) pectinadas y largas, casi tan largas como la longitud del artejo; genua con d, (l) y (v) pectinadas y largas, casi tan largas como la longitud del artejo, microseda κ presente; tibia con d, (l) y (v) pectinadas y largas, siendo la d la más delgada y con su alvéolo profundo en forma de copa; tarso (fig. 12) con un solenidio ω2 basal y corto, solenidio ω1 anterior mucho más largo y con seda acompañante ft escasamente barbulada y más corta, casi la mitad de la longitud del solenidio ω1, pl’ y (vs) presentes, pero rotas en los ejemplares revisados, (tc) e (it) tipo eupatidios y cortos, solo ligeramente más largos que el pretarso, (p) cortas y plumiformes con barbas cortas, (a) barbuladas y cortas, y sedas (u) presentes, pero rotas en los ejemplares revisados. Pata ii: trocánter con seda v como en trocánter i; fémur con d, (l) y v” como en fémur i; genua con d, (l) y (v) como en genua i; tibia con d, (l) y (v) como en tibia i, excepto la seda d que es del mismo grosor del resto y con alvéolo normal; tarso con solenidio ω basal y corto, (tc) pectinadas, ambas largas y de la misma longitud (más de la mitad de la longitud del tarso II), (p) y (a) como en tarso i, (u) pectinadas y el doble de largo del pretarso, (vs) pectinadas y largas (más de la mitad de la longitud del tarso ii). Pata iii: trocánter con seda v como en trocánter ii; fémur con d, l’ y v’ como en fémur ii; genua con d, l’ y v’ como en genua ii; tibia con d, (l) y (v) igual que en tibia i; tarso con ω, (tc), (p), (a), (u) y (vs) igual que en tarso ii. Pata iv: trocánter con seda v como en trocánter iii; fémur con d’, l’ y v’ como en fémur iii; genua con d, l’ y v’ como en genua iii; tibia con d, (l) y (v) igual que en tibia iii; tarso con (tc), (p), (a), (u) y (vs) igual que en tarso iii. Resumen del número de sedas por artejos ordenadas de la pata i a la iv, sedas especializadas (microseda κ y solenidios) indicadas aparte entre paréntesis: trocánteres 1–1–1–1, fémures 5–4–3–3, genuas 5(κ)–5–3–3, tibias 5–5–5–5 y tarsos 14(ω1, ω2)–10(ω)–10(ω)–10.
MedicionesHolotipo hembra –seguida en paréntesis por el intervalo de medidas del holotipo y 3 paratipos hembras–. Longitud del gnatosoma 170 (120-170); ancho de la base del gnatosoma 170 (127-170); longitud de la seda subcapitular n 34 (32-37); longitud de los quelíceros 155 (121-155); ancho de la base del quelícero 31 (20-31); longitud del pedipalpo 180 (120-180); ancho del pedipalpo, a la altura del fémur, 57 (43-57); longitud de la uña tibial del pedipalpo 28 (21-28); longitud del peritrema (completo) 185 (140-185); longitud del idiosoma, excluyendo el gnatosoma, 495 (495-518); anchura máxima del idiosoma (posterior a las coxas iv) 350 (350-440); longitud de la placa prodorsal 150 (135-150); ancho de la placa prodorsal, a la altura del margen anterior, 210 (185-225); distancia entre el par de sedas vi de la placa prodorsal 50 (43-56); distancia entre el par de sedas ve de la placa prodorsal 180 (150-180); distancia entre el par de sedas sci de la placa prodorsal 130 (102-130); longitud de la seda vi 190 (160-190); longitud de la seda ve 185 (155-185); longitud de la seda sci 175 (174-175); longitud de la seda sce 180 (160-180); longitud de la seda genital (g1) 74 (50-74); longitudes de las patas, excluyendo el pretarso: pata i 510 (410-510), pata ii 475 (370-480), pata iii 475 (385-475), pata iv 525 (440-525); longitud del solenidio ω1 del tarso i 50 (39-50); longitud de la seda ft del tarso i 20 (17-25); longitud del solenidio ω2 del tarso i 6 (6-7); longitud del solenidio ω del tarso ii 11 (9-12); longitud del solenidio del tarso iii 6 (6-7).
Larva, ninfas y machoDesconocidos.
Resumen taxonómicoLocalidad tipo. Cerro Campana, Trujillo, Perú.
Serie tipo. Hembra holotipo y una hembra paratipo ex Phyllodactylus microphyllus, Perú, Departamento La Libertad, Provincia Trujillo, Distrito Huanchaco, cerro Campana, 8°00’18.16” S, 79°06’18.34” O, 650m snm, 9 de septiembre de 2011, col. C. G. Quiroz-Gutiérrez. Dos hembras paratipos, mismos datos excepto 9 de marzo de 2014.
Depósito de ejemplares. Holotipo y paratipos en CNAC (007251–007254).
Huésped tipo. Phyllodactylus microphyllus Cope 1876, «Central Leaf-toed Gecko».
Sitio de infestación. En el conducto auditivo externo.
Especificidad de huésped. Monoxena, con base en los datos con los que se cuenta, y sinoxena, ya que puede coexistir con G. aureae sp. nov. en el mismo ejemplar huésped.
Etimología. El epíteto específico hace referencia a la localidad tipo (cerro Campana).
Distribución. Conocida únicamente de la localidad tipo en Perú.
Comentarios taxonómicosLa presencia de sedas idiosomales (h1, h2, f2, ps2, ps3 y ag3) bifurcadas en su mitad distal es un carácter diagnóstico que separa a B. campanensis sp. nov. de las otras 5 especies del género, en las cuales dichas sedas no son bifurcadas (i.e., Bertrandiella tenuipes Hirst, 1917, Bertrandiella otophila Hunter y Loomis, 1966, Bertrandiella jimenezi [Paredes-León y Morales-Malacara, 2009], Bertrandiella chamelaensis Paredes-León et al., 2012 y Bertrandiella griseldae Paredes-León et al., 2013).
La hembra de B. campanensis sp. nov. es muy cercana a B. griseldae, ya que ambas presentan 2 solenidios en el tarso i. Este carácter las diferencia de las otras 3 hembras conocidas en el género (B. otophila, B. jimenezi y B. chamelaensis), porque en estas el solenidio basal ω2 del tarso i está ausente.
Bertrandiella campanensis sp. nov. se diferencia de B. griseldae en que el solenidio ω1 del tarso i tiene casi el doble de largo de la seda acompañante ft, mientras que en B. griseldae el ω1 y ft son de la misma longitud. Adicionalmente, las sedas sci en la placa prodorsal están más separadas entre sí en B. campanensis sp. nov. (102-130) que en B. griseldae (50-59). Las patas i y ii son más cortas (410-510 y 370-480, respectivamente) en B. campanensis sp. nov. que en B. griseldae (500-620 y 440-555, respectivamente); el solenidio ω del tarso ii es más corto (9-12) en B. campanensis sp. nov. que en B. griseldae (19-22).
Con respecto a B. tenuipes, que solo se conoce por un único ejemplar juvenil (deutoninfa), la hembra de B. campanensis sp. nov. se diferencia por presentar el solenidio ω2 en el tarso i, mientras que en B. tenuipes está ausente y, además, B. campanensis sp. nov. presenta el margen posterior de la placa prodorsal más agudo que en B. tenuipes. Se podrán realizar mejores comparaciones entre estadios en cuanto se recolecten deutoninfas de B. campanensis sp. nov. o adultos de B. tenuipes.
DiscusiónCon este registro se amplía la distribución latitudinal de los ácaros del género Bertrandiella desde el sur de EE. UU. (B. otophila) hasta Perú (B. campanensis sp. nov.), pasando por México (B. otophila, B. jimenezi y B. chamelaensis), Cuba (B. griseldae) y Colombia (B. tenuipes), este último era el registro neotropical más sureño (Hirst, 1917; Hunter y Loomis, 1966; Paredes-León et al., 2008; Paredes-León y Morales-Malacara, 2009; Paredes-León et al., 2013). Se corrobora la alta especificidad mostrada en los ácaros del género Bertrandiella por parasitar lagartijas Phyllodactylidae y ocasionalmente Sphaerodactylidae y Eublepharidae; también se amplía la distribución de estos ácaros al sur, lo que corrobora su restricción al continente americano.
Bertrandiella campanensis sp. nov. y G. aureae sp. nov. pueden coexistir sobre el mismo ejemplar huésped, pero en diferentes partes del cuerpo. Geckobia aureae sp. nov. en la región ventral del abdomen y patas traseras del huésped, mientras que B. campanensis sp. nov. habita la región anterior del cuerpo de la lagartija, en particular en el conducto auditivo externo, de donde pudo observarse que se trasladan hacia afuera del conducto cuando la temperatura ambiental disminuye (Quiroz-Gutiérrez, obs. pers.).
Finalmente, dadas las condiciones ambientales únicas predominantes en el cerro Campana que permiten que exista una dinámica ecológica de especies de flora y fauna de diferentes comunidades, es prioritario realizar acciones adecuadas para conservar su biodiversidad. Desafortunadamente, en la actualidad se considera que este ecosistema está en peligro de desaparecer por estar sometido a la irreversible actividad antrópica (Rodríguez-Rodríguez et al., 2012). Aunado a esto, la lagartija endémica Phyllodactylus microphyllus, con distribución limitada en el noroeste de Perú, carece de protección tanto por organismos locales como internacionales (IUCN, 2013) lo que incrementa el riesgo de subsistencia tanto de la lagartija como de sus ácaros asociados. La pérdida de una especie resulta en la pérdida de otras especies que dependen de ella (coextinción), dando lugar a efectos en cascada a través de los niveles tróficos; tales efectos son más severos en interacciones mutualistas y parásitas. Está documentado que aquellos simbiontes más especializados y específicos tienen mayor probabilidad de desaparecer si su huésped se extingue, comparado con simbiontes menos especializados y generalistas (Dunn, Harris, Colwell, Koh y Sodhi, 2009). Tales condiciones de especialización y especificidad de huésped son comunes en los ácaros pterigosomátidos como los aquí descritos (i.e., G. aureae sp. nov. y B. campanensis sp. nov.), lo que nos hace considerarlos junto con su huésped como especies coamenazadas; de hecho, algunos modelos sugieren que la coextinción puede ser la forma más común de pérdida de la biodiversidad (Dunn et al., 2009). Esperamos que este trabajo contribuya a un mejor entendimiento de la biodiversidad en la zona, y estimule el desarrollo de inventarios biológicos como un primer paso para la generación de propuestas de conservación del cerro Campana.
Se agradece a la M. en C. Griselda Montiel-Parra del Instituto de Biología, UNAM, las facilidades brindadas en el laboratorio de la CNAC para realizar esta investigación. Se agradece al Dr. Alejandro Valdez-Mondragón, editor asociado, así como a 2 revisores anónimos de la Revista Mexicana de Biodiversidad los comentarios para mejorar este manuscrito.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.