Se evaluó el efecto e interacción de 4 sistemas de cultivo y 3 dietas, en el desarrollo larval del camarón bandeado Stenopus hispidus a partir de un diseño bifactorial de 4×3 con 3 réplicas por tratamiento. Los sistemas de cultivo consistieron en: CE) sistema cilíndrico con fondo esférico, CP) sistema cilíndrico con fondo plano, RP) sistema rectangular con fondo plano y K) sistema tipo centrífuga «Kreisel». Las 3 dietas evaluadas fueron: D1) dieta líquida SaltCreek®, D2) larval AP100 Zeigler® y D3) flan de calamar. Se determinó la supervivencia y se registraron los cambios morfológicos de las larvas durante los primeros 30 días de vida para cada tratamiento y posteriormente se siguió el desarrollo de las larvas supervivientes manteniéndolas en las condiciones del tratamiento que propició los mejores resultados. La supervivencia de las larvas en el tratamiento CE/D3 (69±5.4%) fue significativamente superior a la de las otras combinaciones de sistemas de cultivo/dietas, por lo que se siguió el desarrollo larval en estas condiciones hasta el día 119, tiempo en que se registraron 6 fases de desarrollo larvario. A pesar de que no se obtuvieron poslarvas, los resultados demuestran que tanto la dieta como el sistema de cultivo son factores clave para la producción exitosa de poslarvas de Stenopus hispidus, en condiciones controladas, lo que se considera una contribución importante a la generación de biotecnología para el cultivo sustentable de especies sobreexplotadas como es el caso de este camarón.
The effect and interaction of 4 culture systems and 3 diets on the larval development of banded shrimp Stenopus hispidus was evaluated through a bifactorial 4×3 design with 3 replicates per treatment. The culture systems consisted of: CE) cylindrical system with spherical bottom, CP) cylindrical system with flat bottom, RP) rectangular system with flat bottom, and K) centrifugal system “Kreisel” type. Three diets were evaluated: D1) liquid diet SaltCreek®, D2) larval AP100 Zeigler®, and D3) squid custard. Survival and morphological changes were determined for the larvae during the first 30 days of life for each treatment and subsequently the development of the surviving larvae that led to the best results were followed in the same conditions. The survival of larvae in treatment CE/D3 (69±5.4%) was significantly higher than the other systems/diets combinations, so larval development was followed in these conditions until day 119, at which time 6 larval stages were recorded. Although no postlarvae were obtained, the results show that both diet and culture system are key to the successful production of post-larvae of Stenopus hispidus under controlled conditions, which is considered an important contribution to the biotechnology for sustainable cultivation of overexploited species as this shrimp.
El camarón bandeado Stenopus hispidus es un crustáceo decápodo que habita en todos los mares tropicales del mundo (Manning y Chace, 1990). En América se puede encontrar en los arrecifes rocosos que se distribuyen desde las costas de Carolina del Sur (EUA), hasta la bahía de Espíritu Santo en Brasil (Gregati, Pinheiro y Cobo, 2006; Kruczynski y Jenner, 1968). El camarón bandeado, al igual que otros crustáceos de arrecife, son víctimas de una captura indiscriminada debido a su alta demanda en los mercados de acuariofilia marina y a su nula producción en cautiverio. La captura de especímenes destinados a los acuarios no solo atenta contra las especies de interés, sino también contra su entorno, debido a los métodos de captura que se usan (Madduppa, von Juterzenka, Syakir y Kochzius, 2014).
Una alternativa a la explotación irracional de los arrecifes para cubrir la demanda de los mercados de acuariofilia es la incorporación de especies de ornato a la producción acuícola; lo anterior bajo esquemas de conservación y preservación de poblaciones naturales. Sin embargo, y a pesar de que se cuenta con avances importantes en el desarrollo de biotecnología para el cultivo de algunos camarones de ornato en cautiverio (Calado, Rosa, Morais, Nunes y Narciso, 2005; Gonzáles, Rosas, Millán y Velásquez, 2003; Gregati, Fransozo, López-Greco y Negreiros-Fransozo, 2010; Rhyne y Lin, 2004), las diferencias fisiológicas y anatómicas que presentan algunos especímenes, sobre todo en sus estadios larvarios, dificulta la producción masiva. Por ejemplo, es sabido que los camarones de los género Stenopus y Lysmata tienen fases de desarrollo larvario prolongadas (Fletcher, Kötter, Wunsch y Yasir, 1995), lo que incrementa los costos de su producción comercial. Algunas de las publicaciones científicas y de acuarística reportan resultados alentadores durante la producción de especies de ornato, aunque con baja supervivencia, particularmente durante los estadios larvarios, sin que especifiquen claramente cuáles son los factores ambientales y metabólicos que pueden afectar la supervivencia y los cambios morfométricos que preceden al estadio de poslarva o juvenil. Entre los factores más estudiados durante la producción masiva de estadios larvarios tanto de peces como de crustáceos, y que se considera un punto crítico, está la calidad y tamaño del alimentos usado, además de los parámetros de calidad del agua, la condición fisiológica y genética de los reproductores; asimismo, y derivado de su anatomía larvaria y movilidad, el diseño del sistema de cultivo, que puede ser un factor limitante para la supervivencia, debido a que un mal diseño puede ocasionar alta mortalidad. Por lo anterior y con el propósito de contribuir a la producción controlada de larvas y juveniles de camarones marinos de ornato, Calado, Pimentel, Vitorino, Dionisio y Dinis (2008) diseñaron y probaron 2 sistemas de cultivo para larvas de camarones marinos de arrecife, uno a base de contenedores cilíndricos con fondo esférico en sustitución de los tradicionales con fondo cónico, lo que permitió incrementar la supervivencia de las larvas de Lysmata debelius hasta la fase de poslarva de 6.50±3.79% al 33.75±4.77%. Por otra parte, el alimento y la ración alimenticia son factores que afectan significativamente la supervivencia de los estudios larvarios de la mayoría de los crustáceos. Rhyne y Lin (2004) evaluaron el efecto de la variación del régimen alimenticio en la supervivencia y tasa de metamorfosis de larvas de camarón pimienta Lysmata sp., a partir de la sustitución de la ración de Artemia por dietas balanceadas, lo que permitió incrementar la supervivencia de las larvas al 68% en comparación con las larvas alimentadas únicamente con nauplios de Artemia (49%). En contraste con los resultados anteriores, y a pesar de que existe un sinnúmero de alimentos comerciales para estadios larvarios, la Artemia es la alternativa principal para la alimentación de especies marinas. El uso de Artemia como principal fuente de alimento para especímenes acuáticos puede ocasionar deficiencias de nutrientes, que pueden solucionarse mediante técnicas de enriquecimiento de alimento vivo a partir de fuentes exógenas de ácidos grasos poliinsaturados, algunas vitaminas, probióticos o incluso con sustitutos de leche materna. Considerando el escaso desarrollo tecnológico que presenta el cultivo controlado de camarones ornamentales de arrecife, es necesario realizar estudios que contribuyan al desarrollo de biotecnología de cultivo que permita incrementar la supervivencia y velocidad de crecimiento de larvas del camarón bandeado S. hispidus a partir de evaluar la eficiencia de sistemas de cultivo y dietas experimentales, con la finalidad de lograr su aprovechamiento sustentable y disminuir con ello la presión pesquera sobre las poblaciones naturales.
Materiales y métodosSe capturaron 30 camarones (peso promedio de 1.22g) en el Sistema Arrecifal Veracruzano en el estado de Veracruz, México (19°11′33″N, 96°07′04″O), que fueron llevados al laboratorio de Cultivo de Crustáceos Nativos del Instituto Tecnológico de Boca del Río, donde se mantuvieron aislados por 30 días, con la finalidad de que se adaptaran al cautiverio y posteriormente se procedió a identificar hembras y machos con base en la pigmentación y desarrollo de las gónadas (Gregati et al., 2010). Una vez identificado el sexo de cada camarón, se formaron 10 parejas de reproductores, las cuales se mantuvieron en un sistema de recirculación, que consistió de una tina rectangular de fibra de vidrio de 2×1×0.2m (largo, ancho y alto, respectivamente) conectada a un filtro mecánico-biológico. El agua del sistema se mantuvo a una salinidad de 34.5±0.5gL–1, temperatura constante de 28.5±0.9°C y fotoperiodo natural 12:12 (luz:oscuridad). Dentro de la tina se colocaron linealmente 10 encierros de 20×15×20cm2 (largo, ancho y altura, respectivamente) hechos con malla plástica en los que se colocó una pareja por encierro, y donde permanecieron hasta su reproducción. Durante este periodo, los reproductores se alimentaron ad libitum con aproximadamente 0.2g de músculo fresco de acocil Procambarus acanthophorus y 0.1g de camaronina (Silver Cup®, Group El Pedregal, Toluca, México). Diariamente se revisaron los camarones para registrar e identificar las fases de desarrollo gonadal hasta el desove, con base en la descripción de Gregati et al. (2010). Cuando se observó la presencia de huevos oculados en la masa ovígera de las hembras, estos se transfirieron individualmente a recipientes de plástico circulares transparentes de 4L, donde permanecieron hasta la eclosión de los huevos y posteriormente se cuantificó y registró el número de larvas/hembra. Posteriormente, las hembras se regresaron al sistema de reproducción, mientras que los desoves se mantuvieron en sus respectivas unidades experimentales, bajo las mismas condiciones ambientales de los reproductores. Las larvas que se usaron para el estudio provenían de 3 desoves obtenidos en un mismo día, con el propósito de tener el número necesario de larvas de la misma edad para el estudio.
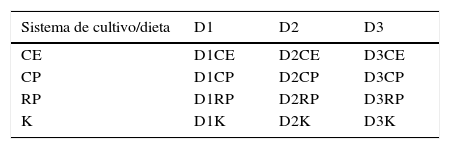
Se utilizó un diseño experimental aleatorio bifactorial de 4×3, en el que se evaluaron 4 sistemas de cultivo larvario y 3 dietas (tabla 1), por triplicado. Para el estudio se consideró mantener una densidad de 10 larvas/L, ya que, de acuerdo con Hernández (2004), esta densidad disminuye el porcentaje de encuentros antagónicos entre larvas y promueve una mayor supervivencia. Las dietas experimentales fueron: D1) dieta líquida SaltCreek® (50/15 proteína/lípidos); D2) larval AP100 Zeigler® (50/12 proteína/lípidos) y D3) flan de calamar (40/15 proteína/lípidos). Durante el estudio las dietas se complementaron con 10 nauplios de Artemia/L, previamente enriquecidos con un sustituto de leche materna (NAN® 1, Nestlé, México) (Gonzáles et al., 2003).
Diseño experimental utilizado en la evaluación de sistemas de cultivo larvario y dietas.
| Sistema de cultivo/dieta | D1 | D2 | D3 |
|---|---|---|---|
| CE | D1CE | D2CE | D3CE |
| CP | D1CP | D2CP | D3CP |
| RP | D1RP | D2RP | D3RP |
| K | D1K | D2K | D3K |
Sistemas de cultivo: CE: cilíndrico con fondo esférico; CP: cilíndrico con fondo plano; K: tipo centrífuga «Kreisel»; RP: rectangular con fondo plano,. Dietas: D1: dieta líquida para larvas de camarón (Revolution. SaltCreek®. EUA), (50.3% de proteína y 15% de lípidos); D2) suplemento alimenticio para larvas de camarón (Larval AP100. Zeigler®. EUA) (50% de proteína y 12% de lípidos); D3: flan de calamar (40% de proteína y 15% de lípidos).
El flan de calamar se elaboró de acuerdo con lo descrito por Santos-Gutiérrez, Hernández-Vergara, Mendoza-Alfaro y Pérez-Rostro (2011) y previo a su uso se realizaron los análisis proximales correspondientes mediante las técnicas de la A.O.A.C. (2000) por triplicado. Antes de cada alimentación, el flan de calamar se tamizó con una malla de 300μm para facilitar la manipulación e ingesta por las larvas. El tamaño de partícula de las dietas evaluadas se verificó en un microscopio compuesto y una cámara para microscopio (Moticam-3mp. Motic®, EUA) con el objetivo 10X y el software Motic Images-Plus (Motic®. EUA), con el propósito de que tuviera un tamaño acorde con lo recomendado para las larvas.
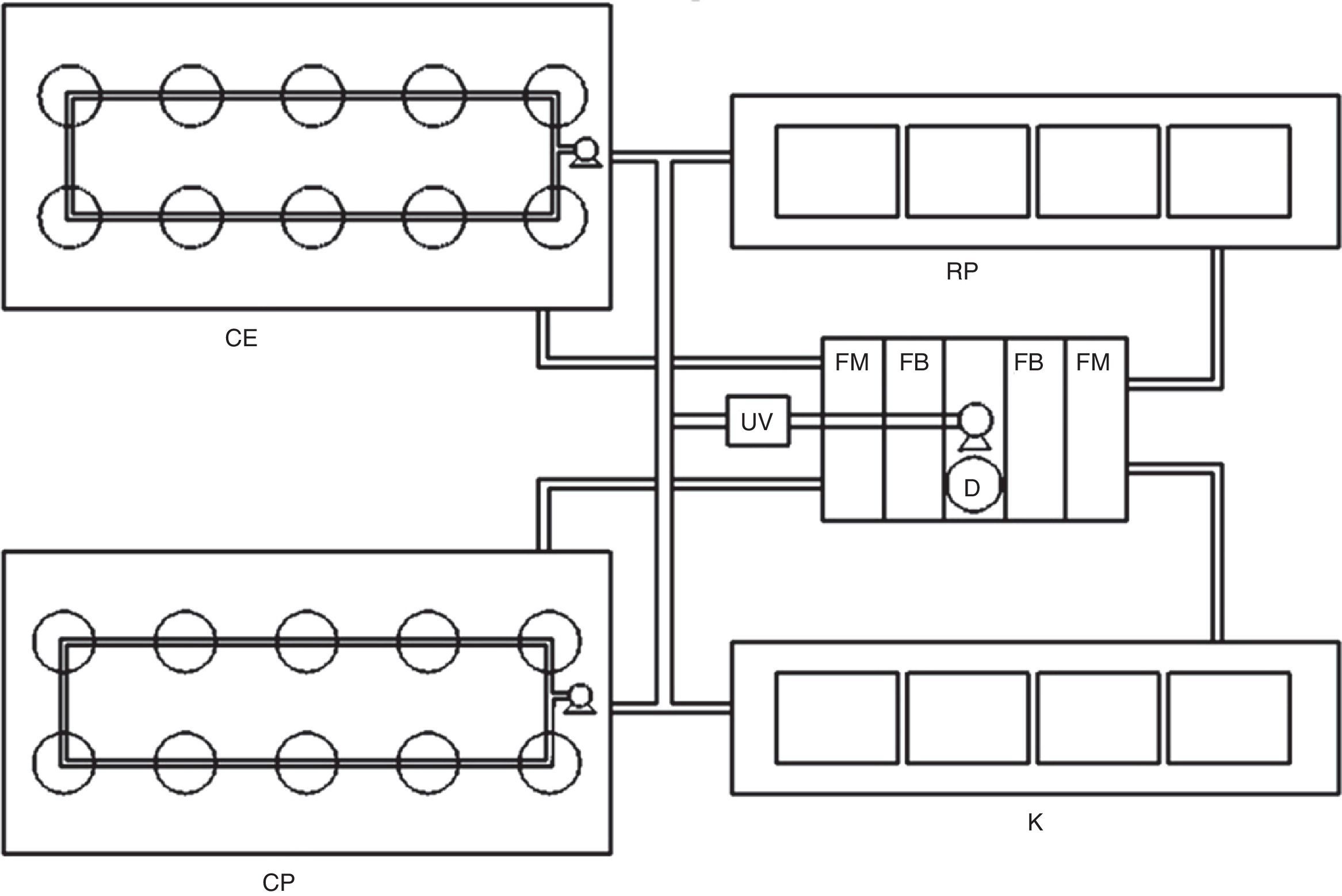
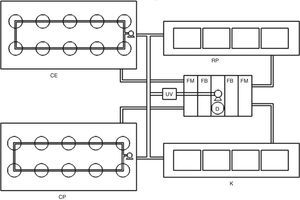
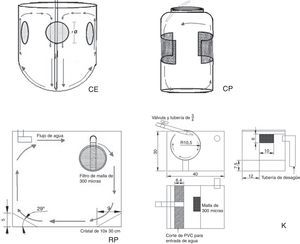
Los sistemas experimentales se instalaron en el laboratorio de Cultivo de Crustáceos del Instituto Tecnológico de Boca del Río, en el que se mantuvo un fotoperiodo natural 12:12h (luz:oscuridad) y temperatura promedio del agua de 27±3.3°C. Para mantener la calidad del agua constante y homogénea entre tratamientos, los sistemas experimentales se conectaron a un sistema hidráulico y de filtración en recirculación, con un filtro mecánico mediante fibras sintéticas y esponjas, filtración biológica con bioesferas (1″ de diámetro) y un desproteinizador tipo skimmer para acuario (STS-200. Sunny®, China), además se integró al diseño una lámpara de UV de 30watts (UVC-30. Boyu®, China). Lo anterior funcionó mediante una bomba sumergible con capacidad de 3,600L/h (Astro® 9000, China). Durante la temporada de invierno, la temperatura del agua se mantuvo constante con 4 termostatos de 300watts (Ecopet®, EUA) (fig. 1).
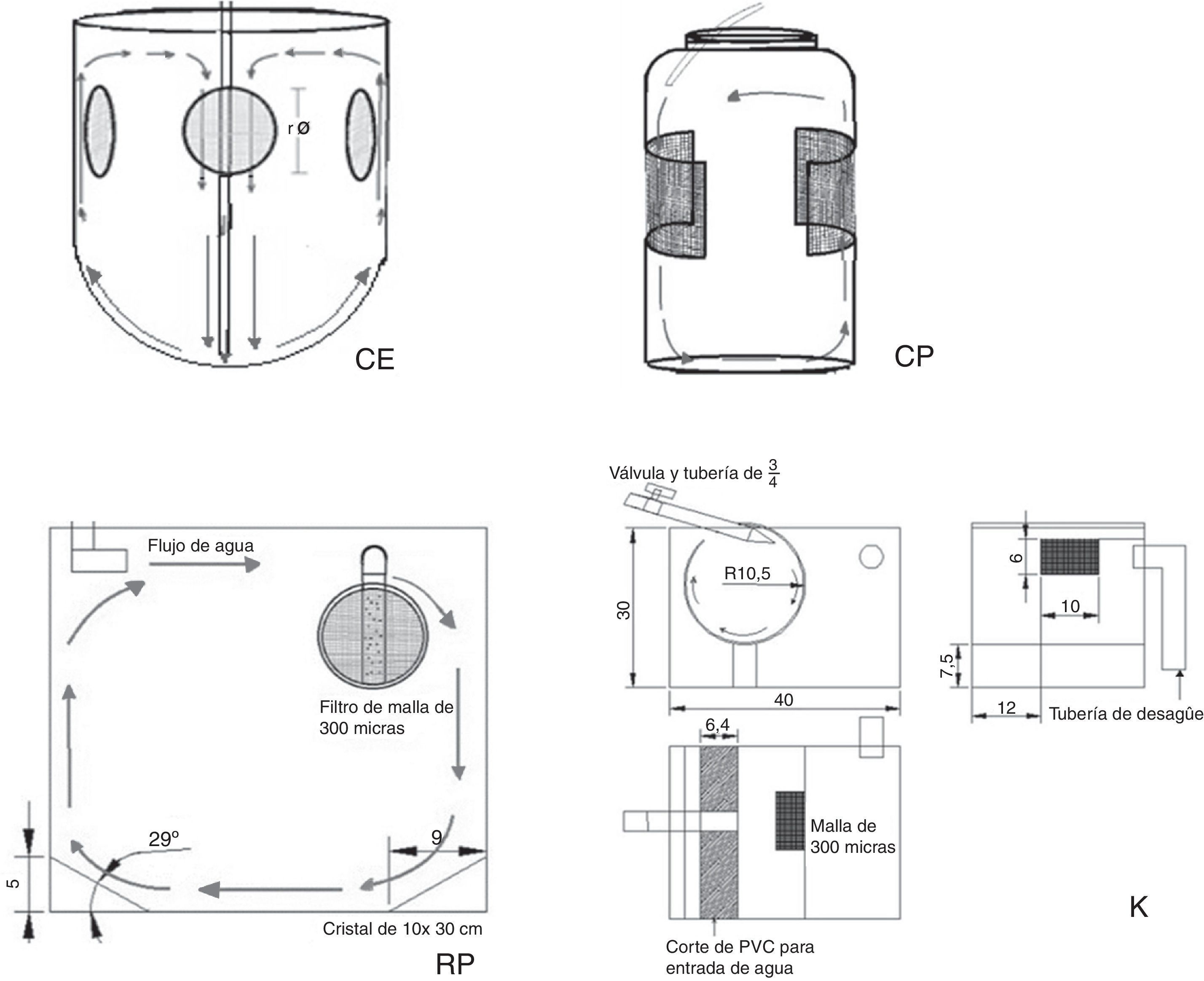
Sistema cilíndrico con fondo esférico (CE): consistió en 9 recipientes cilíndricos con fondo esférico de 2.5L con 4 perforaciones laterales de 2″ de diámetro cada uno. Cada perforación se cubrió con malla de 300μm para mantener el flujo de agua en las unidades experimentales. Las unidades experimentales se instalaron dentro de una tina rectangular de fibra de vidrio (2m de largo×1m de ancho y 0.30m de alto) con recirculación constante por medio de una bomba sumergible para acuario con capacidad de 1,400L/h (SP-2500. Resun®, China), tubería de PCV de ½″, manguera para acuario y un flujo de agua de 12mL/s. El flujo se reguló por medio de válvulas plásticas (fig. 2CE).
Sistema cilíndrico con fondo plano (CP): dentro de una tina similar a la del sistema CE, se colocaron 9 recipientes plásticos con fondo plano y capacidad de 4L con 2 perforaciones laterales de 10×10cm, cubiertos con malla de 300μm y un flujo de agua de 18mL/s, mediante una bomba sumergible para acuario con capacidad de 1,400L/h (Resun® SP-2500, China). El flujo se reguló mediante tubería de PVC de ½″, válvulas para aireación y manguera para acuario (fig. 2CP).
Sistema rectangular con fondo plano (RP): consistió en 9 peceras de cristal rectangulares de 42L distribuidas en 3 niveles. En los extremos laterales del fondo de la pecera se colocaron 2 cristales de 10×30cm que formaron un ángulo de 29°, para generar un flujo de agua homogéneo y ascendente sin «puntos muertos» en el fondo (fig. 2RP).
Unidades tipo centrífuga «Kreisel» (K): consistieron en 9 unidades de cultivo tipo «Kreisel» a partir de diseños utilizados para el cultivo de larvas de peces y zooplancton de Okamura et al. (2009) y Raskoff, Sommer, Hammer y Cross, (2003). Lo anterior a partir de secciones de tubos de PVC de 8″ de diámetro y 35cm de largo a los cuales se les realizó un corte longitudinal que permitiera el flujo del agua y un corte rectangular lateral de 6×10cm, tipo ventana, que se cubrió con una malla de 300μm para permitir el flujo de agua. Las unidades experimentales se colocaron dentro de peceras de 42L, lo que permitió mantener en recirculación el agua después de su paso por el sistema de filtración (fig. 2K).
Las larvas se alimentaron ad libitum 3 veces al día con las dietas experimentales de la siguiente maneras: se diluían ∼0.5g de cada dieta en 50mL de agua del sistema de cultivo y posteriormente se suministraron en 2 raciones (10:00 y 17:00h) de 2mL de alimento por cada 10L de agua en la unidad de cultivo. La tercera ración se suministró a las 13:00h, y consistió en 3 nauplios de Artemia/mL de agua, previamente enriquecidos con el sustituto de leche materna (NAN® 1, Nestlé, México).
Durante el estudio se mantuvo un monitoreo constante de la calidad del agua. Todos los días se registró la temperatura y oxígeno disuelto con el equipo EcoSence YSI DO 200 (Yellow Springs, OH, EUA). Las concentraciones de amonio, nitrito, nitratos, fosfatos, calcio (medidos en mg L–1) y pH se estimaron cada 2 semanas mediante pruebas colorimétricas (NutraFin kits, Hagen, Montreal, QC, Canadá).
Diariamente se revisaron las larvas con la finalidad de identificar cambios morfológicos según lo registrado por Gregati (2009) para S. hispidus y lo descrito por Seridji (1990) para larvas de S. spinosus para lo cual se capturaron 3 larvas por tratamiento, y se observaron en vivo con un microscopio compuesto a 10× y 40×. Durante la revisión se registró la longitud total (desde la punta del rostrum a la punta del telson) de las larvas y el estadio de desarrollo en que se encontraban a partir de la observación de estructuras anatómicas y cambios morfológicos que se registraron digitalmente con una cámara acoplada a un microscopio (Moticam-3mp. Motic®, EUA) y el software Motic Images-Plus (Motic®. EUA). Al final de la revisión las larvas se regresaron a su tratamiento.
Al final del periodo experimental (30 días), se determinó la supervivencia y el estadio larvario alcanzado por tratamiento. Se determinó también el estado físico de las larvas, particularmente se observó si los apéndices estaban completos.
La siguiente fase del estudio consistió en dar seguimiento al desarrollo de las larvas supervivientes al periodo experimental, para lo cual se cuantificaron, revisaron y transfirieron al sistema de cultivo larvario en el que se obtuvieron los mejores resultados y a partir del día 31 se les proporcionó el alimento experimental que promovió la mayor supervivencia y desarrollo. Las larvas permanecieron bajo estas condiciones en espera de obtener poslarvas.
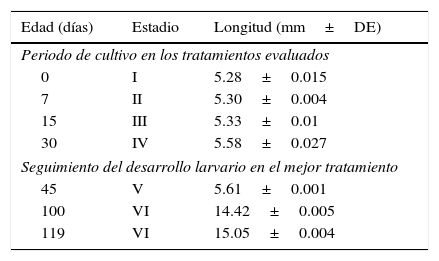
Previo al análisis estadístico, se realizaron pruebas de normalidad y homogeneidad de varianzas de todos los datos mediante las pruebas de Shapiro-Wilk y Levene, respectivamente (Sokal y Rholf, 1995; Zar, 2010), los resultados de supervivencia fueron transformados a arco seno. Posteriormente, se realizó un análisis de varianza bifactorial (Anova) con un nivel de significación del 95% y una prueba de medias de Tukey, para determinar entre qué tratamientos se presentaron diferencias. Todos los análisis se realizaron con el software Statistica V. 10. (Statsoft®).
ResultadosLos parámetros de calidad del agua del sistema de recirculación donde se mantuvieron las larvas permanecieron constantes y dentro de lo recomendado para otras especies de crustáceos ornamentales de arrecife y estenopódidos (Bauer y Holt, 1998; Calado, Vitorino, Reis, Lopes y Dinis, 2009; Lin y Shi, 2002). El amonio se mantuvo en valores promedio de 0.05±0.05mg L–1, nitritos de 0.28±0.35mg L–1, nitratos de 5±0mg L–1, fosfato de 1.75±0.86mgL–1, calcio de >400mg L–1, pH de 8.32±0.15, salinidad promedio de 35±0.5g L–1, temperatura de 27±0.82°C y la concentración de oxígeno de 4.7±0.86mg L–1.
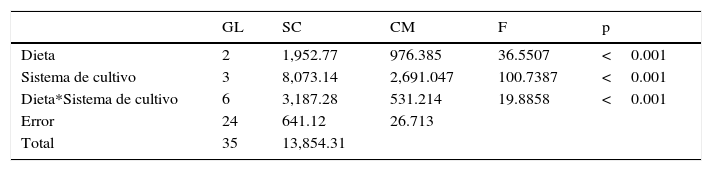
Los resultados indican que tanto el sistema de cultivo como las dietas suministradas tienen efecto sobre la supervivencia de las larvas (Anova, datos del análisis y probabilidad; tabla 2). Lo anterior se observó claramente en los resultados de las larvas que se cultivaron en el sistema RP, las cuales independientemente de la dieta suministrada presentaron un 100% de mortalidad al día 20. A diferencia de lo anterior, las larvas mantenidas en el sistema CE a las que se les suministró la dieta D3 tuvieron una supervivencia significativamente superior al resto de los tratamientos (p<0.01; 69±5.4%) (tabla 3).
Análisis de varianza de la supervivencia de larvas con relación a las dietas y sistemas de cultivo experimentales.
| GL | SC | CM | F | p | |
|---|---|---|---|---|---|
| Dieta | 2 | 1,952.77 | 976.385 | 36.5507 | <0.001 |
| Sistema de cultivo | 3 | 8,073.14 | 2,691.047 | 100.7387 | <0.001 |
| Dieta*Sistema de cultivo | 6 | 3,187.28 | 531.214 | 19.8858 | <0.001 |
| Error | 24 | 641.12 | 26.713 | ||
| Total | 35 | 13,854.31 |
Supervivencia (%±DE y resultado del análisis post-hoc) de larvas de S. hispidus en relación con el tipo de sistema de cultivo y dieta suministrada.
| Sistema de cultivo/Dieta | D1 | D2 | D3 |
|---|---|---|---|
| CE | 25.1±14.4a | 15.69±5.4a | 69.02±5.4a |
| CP | 1.48±1.5b | 5.19±1.96ab | 14.57±6.9b |
| RP | 0b | 0b | 0c |
| K | 0.15±0.1b | 0.33±0.0b | 1.80±1.2c |
Sistemas de cultivo: CE: cilíndrico con fondo esférico; CP: cilíndrico con fondo plano; K: tipo centrífuga «Kreisel»; RP: rectangular con fondo plano. Dietas: D1: dieta líquida para larvas de camarón (Revolution. SaltCreek®. EUA); D2: suplemento alimenticio para larvas de camarón (Larval AP100. Zeigler®. EUA); D3: flan de calamar.
Nota: Los datos con el mismo superíndice en columnas, no presentan diferencia estadística significativa.
Durante la revisión e identificación del desarrollo larval, se observó que algunas larvas presentaban la espina rostral y espina dorsal incompletas o rotas, particularmente en los tratamientos RP y K, donde además se observó mayor mortalidad, resultado posiblemente relacionado con la dinámica del flujo de agua.
Se observó que las larvas de S. hispidus al nacer tienen una longitud total promedio de 5.28±0.015mm y que durante las primeras 24h de vida tienen la capacidad de nadar y desplazarse por la columna de agua; sin embargo, después de 24h pierden esta capacidad y dependen de la corriente para mantenerse en la columna de agua. Asimismo, se observó que en las larvas, aunque cambian de estadio, su longitud se mantiene constante ya que después de 30 días de vida el incremento en la longitud total fue de únicamente un 5.68% en relación con la longitud inicial.
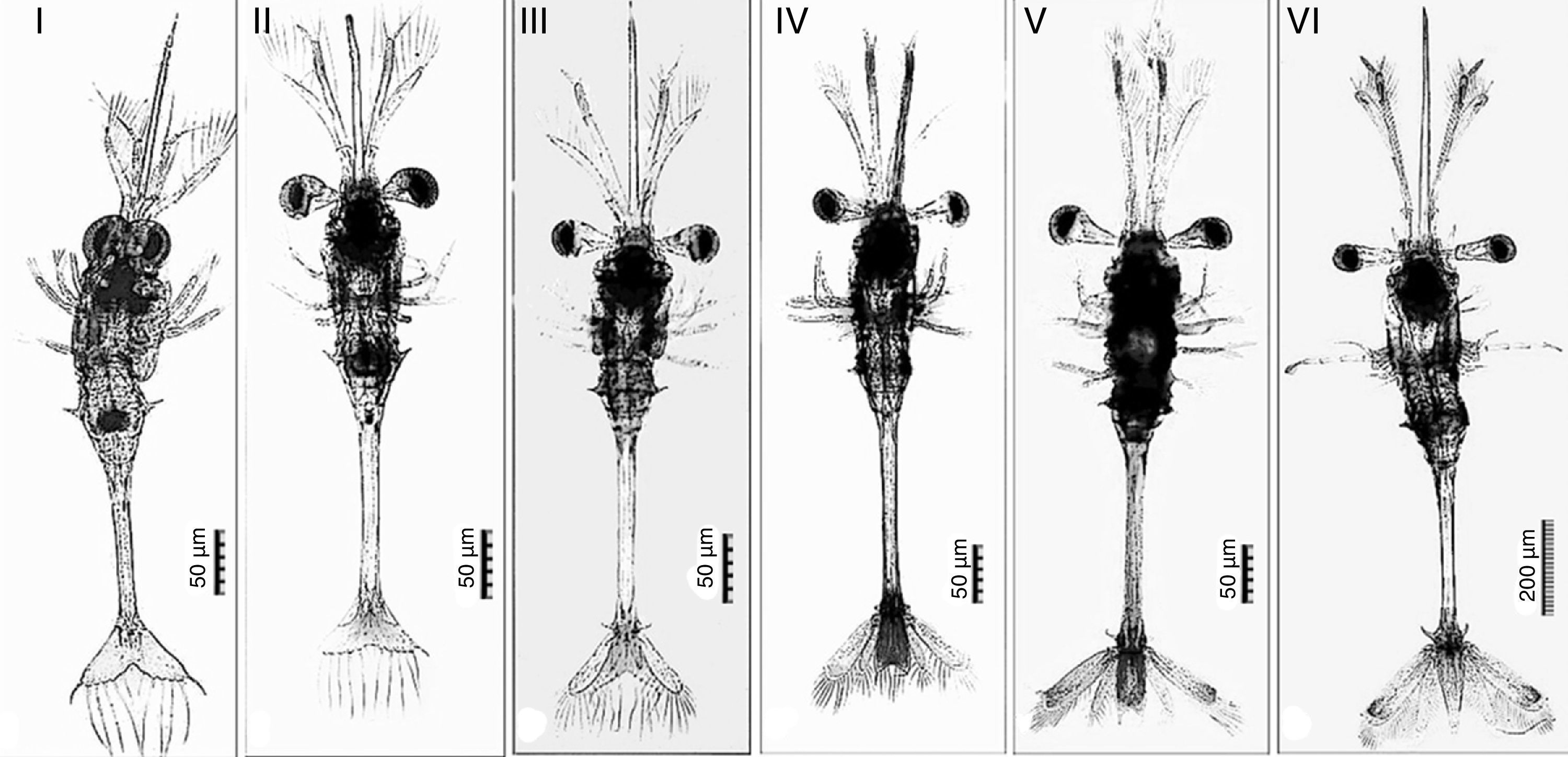
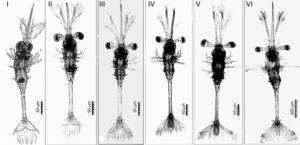
Las larvas que fueron mantenidas en los tratamientos CE, CP y K pasaron por 4 estadios larvarios durante los 30 días de cultivo, y se observó que los cambios morfológicos de las larvas fueron similares entre tratamientos (figs. 3, 4).
Estructuras morfológicas observadas durante el estudio para determinar la fase de desarrollo larvario. Z1: Larva en el primer estadio de desarrollo, Z1a: ojos sésiles, Z1b: antenas, Z1c: anténulas, Z1d: rostrum, Z1e: espina dorsal, Z1f:espinas del primer somito, Z1g: espinas del tercer somito, Z1h: espinas del tercer somito. Z2: Larva en la segunda fase de desarrollo. Z4: Larva en la cuarta fase de desarrollo con presencia de cromatóforos rojos en la puntal del rostrum y anténulas. Z6: Larva en la sexta fase de desarrollo, Z6a: tercer pereiópodo.
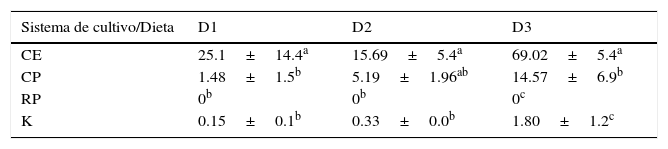
Después de 30 días de cultivo, las larvas supervivientes de todos los tratamientos se mantuvieron en las condiciones del tratamiento CE/D3, hasta una edad de 119 días, pudiéndose registrar 2 estadios más de vida, donde el cambio posiblemente más importante fue un incremento de la longitud corporal del 300% durante el día 100, permaneciendo sin cambios hasta el día 119. A partir del día 120 de estudio, se presentó una mortandad total (tabla 4).
Fases de desarrollo larval de S. hispidus obtenidas en laboratorio en base al tiempo y longitud promedio±DE.
| Edad (días) | Estadio | Longitud (mm±DE) |
|---|---|---|
| Periodo de cultivo en los tratamientos evaluados | ||
| 0 | I | 5.28±0.015 |
| 7 | II | 5.30±0.004 |
| 15 | III | 5.33±0.01 |
| 30 | IV | 5.58±0.027 |
| Seguimiento del desarrollo larvario en el mejor tratamiento | ||
| 45 | V | 5.61±0.001 |
| 100 | VI | 14.42±0.005 |
| 119 | VI | 15.05±0.004 |
Estadio I. Las larvas de S. hispidus presentan una morfología semejante a las larvas de camarones peneidos en estadio mysis. El cuerpo es translúcido, sin presencia de cromatóforos. Caparazón liso con rostrum prominente, doble de longitud en comparación con las antenas y anténulas, además de que se observan espinas que cubren la punta del rostrum. Antena con 4 segmentos distales, donde se distinguen 10 setas plumosas en el borde. Las anténulas presentan 2 segmentos, uno que representa más del 90% de la anténula y un segmento distal; una seta en la base del segmento distal y 3 más en el borde. Ojos sésiles. Presencia de toracópodos, apéndices cefálicos cortos. Pereiópodos con 3 segmentos y 5 setas plumosas a partir de la base del último segmento. Sin pleópodos. Presencia de 6 somitas abdominales, primera y quinta somita con un par de espinas laterales; tercer somita con un par de espinas laterales y una espina dorsal más larga que las laterales; segunda y cuarta somita sin espinas, y sexta somita alargada y fusionada con el telson (fig. 4Z1). Telson con forma triangular, sin presencia de urópodos; se aprecia una espina en cada extremo del telson y 5 pares de setas plumosas cubriendo el resto del telson (fig. 5T1).
Estadio II. Caparazón similar al estadio anterior, pero con la presencia de cromatóforos rojos en la punta del rostrum y en la parte inferior del tórax. Antenas similares al estadio anterior. Anténulas con 3 segmentos; la anténula incrementa su tamaño y son un 20% más largas que las antenas, además se observa la presencia de cromatóforos rojos en el segundo segmento, mientras que en el tercero (segmento distal) se mantienen las características del estadio anterior. Ojos pedunculados (fig. 4Z2). Pereiópodos similares al estadio anterior pero con presencia de cromatóforos rojos en el basipodito e isquipodito del tercer par; primer, segundo, cuarto y quinto pares de pereiópodos con 3 segmentos, tercer par con 5 segmentos. Somitas abdominales similares al estadio anterior, entre la segunda y tercera somita abdominal se observan cromatóforos rojos. Espina dorsal de la tercera somita sin cambios. Comienza el desarrollo de espinas en el exoesqueleto de la región abdominal, espinas características en adultos. Telson similar al estadio anterior, se observa el desarrollo de 2 pares más de setas plumosas, 7 pares en total, un par en el centro y otro más en los extremos, y se observa la presencia de cromatóforos rojos en la base del telson (fig. 5T2).
Estadio III. Caparazón similar al estadio anterior, las espinas que cubren la punta del rostrum son más visibles. Pereiópodos sin cambios. Antenas con forma similar al estadio anterior pero ahora con 12 setas plumosas. Anténulas, primer segmento más prolongado que el segundo, con 4 setas plumosas; segundo segmento con cromatóforos rojos, 2 pares de setas en los laterales y 3 setas más en el extremo cercano al segmento distal, el tercer segmento (distal) presenta 3 setas plumosas. Pereiópodos similares al estadio anterior. Telson con 4 pares de setas plumosas y las 2 espinas presentes en el estadio anterior; comienza a reducir su tamaño; la presencia de cromatóforos rojos se incrementa y cubren ∼80% del telson; se observa un par de espinas en la base del telson. Primer par de urópodos birrámeos con 14 setas plumosas. Comienza el desarrollo del segundo par de urópodos (fig. 5T3).
Estadio IV. Caparazón y rostrum similar al estadio anterior. Antenas con 16 setas plumosas. El primer segmento de la anténula con 10 setas plumosas, segundo y tercer segmentos similares al estadio anterior (fig. 4Z4). Pereiópodos sin cambios. Todo el telson con cromatóforos rojos y 3 pares de setas plumosas. El primer par de urópodos (exopodito) con 18 setas plumosas; el segundo par de urópodos (endopodito) tiene la mitad de tamaño que el primero con 12 setas plumosas (fig. 5T4).
Estadio V. Caparazón, antenas, anténulas y pereiópodos sin cambios. Se incrementa la cantidad de cromatóforos en la segunda y tercera somitas abdominales. Telson similar al estadio anterior. Primer par de urópodos con 19 setas plumosas; el segundo par de urópodos es más pequeños (la mitad del tamaño del primero) con 16 setas plumosas. Exopodito de mayor tamaño que en el estadio anterior y con cromatóforos rojos en la punta (fig. 5T5).
Estadio VI. Antenas con 24 setas plumosas. Se observa una pequeña espina en la punta del segundo segmento de la anténula (paralela al segmento distal). El segmento distal incrementa su tamaño (longitud similar al segundo segmento). La presencia de cromatóforos rojos en el tórax se incrementa. Se observan cromatóforos rojos en el basipodito del primero, segundo y tercer par de pereiópodos; el tercer par de pereiópodos es más largo que el resto de los apéndices (fig. 4Z6). El telson redujo su longitud transversal y la punta comenzó a tomar forma; el extremo del telson con 3 pequeñas setas y 2 espinas más que los estadios anteriores. Primer par de urópodos con 30 setas plumosas, segundo par con 34 setas plumosas (el tamaño ahora representa 2/3 con respecto al tamaño del primer par de urópodos) (fig. 5T6). La longitud total de la larva se incrementó en un 300% en relación con la longitud posteclosión.
DiscusiónEste es uno de los primeros estudios en que se evalúa tanto el alimento suministrado como el tipo de sistema de cultivo para la producción controlada de larvas de S. hispidus y en el que se observó que ambos parámetros son fundamentales para el desarrollo larval exitoso. Los resultados, a pesar de que no se obtuvieron poslarvas, indican que la especie puede adaptarse a condiciones de cautiverio y es posible obtener desoves viables en corto tiempo, y que tanto los reproductores como las larvas aceptan alimento comercial y natural.
En general, se considera que las dietas experimentales son eficientes para la alimentación de las larvas, asimismo, las 3 dietas tenían un contenido de proteína/lípidos dentro del rango recomendado para larvas de crustáceos (40-50% de proteína) (García-Galano, 2000). Sin embargo, los resultados parecen indicar que durante los primeros estadios se debe considerar además de la calidad nutrimental de las dietas, el tamaño de las partículas del mismo. Lo anterior debido a que las dietas D1 y D2 que contenían una mayor cantidad de proteína y menor tamaño de partícula (≤100μm) promovieron supervivencias estadísticamente inferiores en comparación con los tratamientos donde se suministró la dieta D3, la cual tuvo un tamaño de partícula de 350μm, lo que además permitió que las larvas las atraparan y mantuvieran entre los pereiópodos hasta su consumo. Al respecto, Piña, Nieves, Voltolina y Chavira (2004) mencionaron que el tamaño de partícula del alimento es uno de los factores con mayor importancia para la alimentación de larvas de camarones peneidos. Zhang, Lin y Creswell (1998) registraron bajas supervivencias en larvas de L. wurdemanni al alimentarlas con Chaetoceros e Isochrysis, 15.6 y 13.3%, respectivamente, debido a que son presas muy pequeñas, a diferencia de larvas alimentadas con Artemia y rotíferos (86.7 y 88.9% de supervivencia, respectivamente) los cuales tienen tallas significativamente superiores a las presas anteriores. Es importante considerar que las dietas D1 y D2 son alimentos específicos para larvas de peneidos, los cuales nacen en estadio de nauplio y con una longitud significativamente menor que la de las larvas recién eclosionadas de camarones del género Lysmata y Stenopus. Lo anterior pudo ser una de las causas de la baja supervivencia, independientemente del sistema de cultivo, mientras que el flan de calamar es una buena alternativa para el cultivo larvario de crustáceos (Alam, Ang y Begum, 1995; Alam, Ang y Cheah, 1993), particularmente de langostino malayo a partir del estadio iv, donde tienen una mayor capacidad para atraparlo y manipularlo (Santos-Gutiérrez et al., 2011).
El flan de calamar puede ser una alternativa para la alimentación de larvas de crustáceos no solo porque se le pueden incorporar ingredientes que cubran los requerimientos nutrimentales de las especies (Hien, Hai, Phuong, Ogata y Wilder, 2005), sino también por su consistencia suave y esponjosa que permite que las larvas puedan sujetar y consumir con mayor facilidad en comparación con las dietas comerciales de micropartículas. Además de lo anterior, Mallo (2005) recomienda evaluar dietas con flotabilidad y estabilidad adecuadas para larvas de camarones de arrecife, ya que los camarones sujetan a su presa mientras se mantienen suspendidas en la columna de agua (Calado et al., 2008b).
Los avances en la investigación con diferentes camarones de ornato parten del uso de presas vivas como Artemia y rotíferos como los principales alimentos (Gonzáles et al., 2003; LeVay, Jones, Puello-Cruz, Sangha y Ngamphongsai, 2001; Le Vay et al., 2002; Zhang, Lin y Creswell, 1997), lo que puede ocasionar un mayor costo de producción y de manejo debido a que se deben mantener laboratorios para la producción de alimento vivo. En este estudio se decidió complementar las dietas experimentales con nauplios de Artemia sp. enriquecidos, con base en las recomendaciones de Rhyne y Lin (2004) ya que mencionan que el uso de este invertebrado combinado con dietas comerciales (ArteMacTM), incrementó la supervivencia (99.3 y 99%, respectivamente) en larvas de crustáceos, a diferencia de las larvas alimentadas con dietas inertes (un 62.5% de supervivencia). No obstante, los resultados del presente estudio señalan que la Artemia no promovió una mayor supervivencia en las larvas de S. hispidus, sino que la mayor influencia la tuvieron las dietas experimentales, dado que a todas las larvas en los tratamientos se les proporcionó la misma cantidad de nauplios de Artemia sp. y que la variación de las dietas inertes promovieron diferentes supervivencias entre tratamientos.
Por otro lado, los resultados del presente estudio indican que además de la dieta y su tamaño de partícula, es necesario desarrollar nuevas investigaciones encaminadas al conocimiento de la dinámica ambiental asociada al ciclo de vida de la especie, en particular en lo referente a las corrientes relacionadas con la permanencia de las larvas en la columnas de agua y la dinámica asociada a la captura de presas, pues ambos aspectos pueden influir directamente en su supervivencia. Diversos son los estudios en los que se aborda el efecto del tipo de sistema de cultivo o las preferencias alimenticias de las larvas, pero no ambos elementos en su conjunto y de manera particular la dinámica del flujo de agua. En este contexto, durante el presente estudio se observó que uno de los puntos críticos para la producción controlada de poslarvas del camarón bandeado S. hispidus, es la dirección y velocidad del flujo del agua en las unidades de cultivo. El flujo de agua debe ser constante y ascendente, con la finalidad de mantener suspendidas a las larvas, sin embargo, es necesario determinar la velocidad del flujo de agua más eficiente, ya que un exceso genera daños en los apéndices y estructuras del cuerpo, como ocurrió durante el estudio, donde debido a la corriente las larvas chocaban con las paredes de la unidad de cultivo, lo que ocasionó inicialmente lesiones en la espina rostral y abdominal y posteriormente un 100% de mortandad. Por otra parte, el flujo mínimo (o generación de puntos muertos del sistema de cultivo) dificultaba la permanencia de las larvas en la columna de agua, ya que de acuerdo con lo observado, después de 24h de eclosionar, las larvas pierden la capacidad de nado y si no hay flujo en el sistema se van al fondo, y con ello disminuye su habilidad o posibilidades de alimentación, pero además al permanecer en el fondo del sistema son susceptible a infecciones por bacterias o virus y a la invasión por parásitos oportunistas como algunas especies de copépodos (en estadios de nauplio) o protozoarios (observaciones previas en laboratorio).
Por tanto, los resultados del presente estudio indican que la mayor mortalidad registrada estuvo directamente relacionada con el sistema de cultivo y el tipo de flujo y la dinámica en cada uno de ellos, principalmente en el sistema RP (un 100% de mortalidad después de 20 días de cultivo) y el «Kreisel» (0.7±0.9% de supervivencia después de 30 días de cultivo). A diferencia de lo anterior, Okamura et al. (2009) reportan una supervivencia del 50% de larvas de Alguilla japonica después de 270 días de cultivo, en sistemas «planktonkreisel» diseñado con cilindros de 20cm de radio y 15cm de ancho (Greve, 1968). Por lo anterior, podría considerarse que las dimensiones o relación 1:0.75 (radio:ancho) es más eficiente para cultivos larvarios, en comparación con la que se usó en este estudio (1:3.3, radio:ancho), ya que un espacio más estrecho puede reducir «puntos muertos» en la unidad de cultivo debido a la generación de un flujo más homogéneo.
El seguimiento de las larvas después del día 31 hasta el día 119 se considera un avance importante en el conocimiento de la biología de las larvas de S. hispidus, debido a que es un periodo significativamente superior en comparación con otros reportes previos (Calado, et al., 2008a; Gregati, 2009). Fletcher et al. (1995) mencionan que el desarrollo larvario de S. hispidus ocurre entre 120 y 210 días, sin embargo, no existe información concisa de la duración y descripción del desarrollo completo de la especie, ni las condiciones en las que ocurre este proceso. Es probable que la metamorfosis de larvas a poslarvas responda a un factor de estrés o cambio ambiental que promueva el cambio de estadio, y al no presentarse, el gasto metabólico para mantenimiento puede ocasionar una alta mortandad, como ocurrió en el presente estudio. Gregati (2009) realizó la descripción de los estadios de zoea de S. hispidus que de acuerdo con sus resultados ocurrió durante los primeros 37 días, a diferencia de lo observado en el presente estudio que no fue hasta el día 119.
Además de la información que se obtuvo durante la presente investigación referente a la interacción del sistema de cultivo y alimento, dinámica del flujo y tamaño de las partículas, es importante destacar las observaciones referentes al tamaño de las larvas de S. hispidus (longitud total de 5.28±0.015mm) al nacer y sus ventajas biotecnológicas. A diferencia de lo anterior, se reporta que las larvas de L. seticaudata nacen con una longitud de entre 3.09 y 3.24mm (Calado, Bartilotti, Narciso y dos Santos, 2004), mientras que las larvas en zoea I de Hippolyte williamsi presentan una longitud total promedio de 1.76mm (Albornoz y Wehrtmann, 1997). El tamaño de las larvas de camarón bandeado puede considerarse una ventaja al momento de la primera alimentación exógena ya que puede aceptar una amplia variedad de alimentos, a diferencia de las larvas de menor tamaño que son alimentadas exclusivamente con fitoplancton (Manning y Chace, 1990). Se observó además un incremento en el tamaño del tercer par de pereiópodos en las larvas con más de 100 días de edad. Lo anterior sugiere que a partir de esta edad las larvas cambian de hábitos alimenticios y adquieren la capacidad de atrapar presas de mayor tamaño, similar a lo observado en larvas del género Lysmata, en las cuales el desarrollo del quinto par de pereiópodos contribuye en su alimentación y defensa (Rufino y Jones, 2001). Todo lo anterior se considera una contribución importante al conocimiento biológico de la especie y al desarrollo de biotecnología para su cultivo sustentable.
A Conacyt por la beca núm. 325072, así como a TNM por el apoyo para el proyecto 5240.14-P.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.