México es un país con una riqueza natural extraordinaria; sin embargo, a pesar de 2 siglos de trabajo en sistemática, se conoce solamente una fracción del total de las especies que existen en el país. Un problema de suma importancia es que esta gran diversidad biológica se está perdiendo con un aumento en la tasa de extinción de especies que es órdenes de magnitud mayor que la tasa natural. El presente suplemento se editó considerando que el seguimiento continuo del estudio de la biodiversidad de México puede ser un elemento útil para evaluar el balance entre lo que se conoce y lo que se desconoce en términos de riqueza de especies, y que éste análisis permanente puede orientar los esfuerzos futuros. Lejos de incluir todos los taxa posibles, presenta un análisis de 56 grupos biológicos en los que da cuenta de 94 412 especies en México, que representan el 8.59% del total mundial de los grupos examinados, con un endemismo promedio de 39.7%. Se deriva también, de los datos aquí publicados, que en promedio la biota de México puede ser 3.3 veces más grande que lo que ahora se conoce.
Mexico is a country with an extraordinary natural wealth; however, after 2 centuries of taxonomic work only a fraction of the total number of species that occur in the country is known. A major problem is that we are loosing this enormous biological wealth with increasing extinction rates that are now orders of magnitude larger than the natural rates. This supplement was edited considering that the continuous monitoring of Mexican biodiversity can be a useful tool to evaluate the balance between what we know and what we ignore about the number of species, and that the ongoing analysis could help directing future studies. Far from including all possible taxa, an analysis is presented of 56 biological groups that account for 94 412 species in Mexico which represent 8.59% of the world’s total for those groups, with an average endemism of 39.7%. It is estimated from the data here published that Mexico’s biota could be, on average, 3.3 times larger than what is now known.
La conciencia de que la diversidad biológica existe y de que es algo que se debe registrar, caracterizar, comprender y preservar, se desarrolla recientemente. Hace tan sólo 32 años, en 1982, existía en México el Programa Nacional de Desmonte (Pronade), auspiciado por la Secretaría de Agricultura y Ganadería, cuyo objetivo fue el desmonte de tierras ociosas, en su mayoría selva alta perennifolia y selva mediana perennifolia y caducifolia, para su aprovechamiento en la agricultura y ganadería (Bravo-Peña et al., 2010). Este programa había comenzado en 1972 y a su término, 10 años después, era responsable del desmonte de más de 400 000 ha en Jalisco, Veracruz, Campeche, Yucatán, Quintana Roo, Sinaloa, Nayarit, Oaxaca, San Luis Potosí, Tamaulipas y Chiapas (Secretaría de la Presidencia, 1976). Sin embargo y afortunadamente para este país, las proyecciones de la época que llamaban al desmonte total de unos 24 millones de ha, lo que corresponde al 12% del territorio nacional, nunca se alcanzaron. Los resultados de la conversión de las “tierras ociosas” fueron que los habitantes de las regiones en donde ocurrió el desmonte perdieron el sustento que les daban los bosques y las selvas, y años después terminaron más pobres y con menores posibilidades de obtener productos y beneficios de su entorno natural.
Otro ejemplo de cómo ha cambiado la escala de valores sobre el entorno natural, es que en la década de 1950 se estableció una campaña desde el gobierno mexicano dirigida a erradicar a los depredadores del ganado en el norte de México, específicamente a los lobos, osos, pumas y coyotes, siguiendo políticas implementadas en los Estados Unidos desde finales del siglo XIX. Después de más de una década, el programa logró parcialmente su objetivo, pues en 1964 se cazó al último oso pardo (Ursus arctos nelsoni) de que se tenga registro en territorio nacional y hacia la década de 1980 al lobo mexicano (Canis lupus bailey) se le declaró extinto en estado silvestre (Ceballos y Oliva, 2005).
En 1985, el término “biodiversidad” fue utilizado por primera vez por Walter Rosen del Nacional Research Council de los Estados Unidos como una contracción de diversidad biológica (Krishnamurthy, 2003). El término tuvo un éxito inmediato en cuanto a su uso generalizado, puesto que identificaba de manera precisa un concepto que empezaba a cobrar importancia y vigencia globalmente. Ahora que el término se ha situado de una manera preponderante en nuestro vocabulario y en nuestra percepción, sabemos que la biodiversidad puede tener varias dimensiones.
La “biodiversidad” se refiere a todas las formas en que la vida se manifiesta en la Tierra. En su sentido más amplio, la biodiversidad no se limita al número de especies que han existido en la historia de la vida, sino que también incluye desde la variación genética en individuos y poblaciones, hasta la diversidad de ecosistemas y biomas (Wilson, 1988). Por ejemplo, las diferentes variedades de una misma especie, como el maíz (Zea mays), que han sido desarrolladas por la cuidadosa selección de campesinos por miles de años, así como la variedad de bosques de coníferas o selvas húmedas del mundo, todo ello está contenido en el concepto de biodiversidad.
A pesar de los más de 300 años de trabajo sistemático desarrollado por miles de científicos para conocer la variedad de la vida en el planeta, seguimos lejos de alcanzar una idea precisa de su dimensión. En la actualidad, se han descrito alrededor de 1 millón 740 mil especies en el mundo (WCU, 2010); sin embargo, las estimaciones de la riqueza total de especies, descubiertas y por descubrir, van desde los 7 hasta los 100 millones, lo que muestra nuestro profundo desconocimiento sobre la riqueza natural (Chapman, 2009). Una serie de estudios que dan idea de la dimensión del problema son los datos de Reaka-Kudla (1997, 2001) que calculó el número de especies que existen en los arrecifes de coral del mundo. Basándose en proyecciones que toman en cuenta lo que ahora se conoce y el error en el cálculo del área que cubren los arrecifes, probablemente subestimado, se tiene que se conocerían unas 90 000 especies, que representarían entre el 2 y el 10% de la diversidad real. Estos datos sugieren entonces que podría haber entre 1 y 5 millones de especies conocidas y desconocidas en los arrecifes del mundo. En el escenario más conservador, si ya se ha perdido irreversiblemente el 5% de los arrecifes del mundo, usando la relación del número de especies/área, se habrían perdido ya entre 10 000 y 13 000 especies (Reaka-Kudla, 2001). Otra muestra de ello, es la expedición oceánica del Sorcerer II, que en 2006 realizó muestreos en la superficie de los océanos en Canadá, Sudamérica, Australia, África y el Atlántico, obteniendo más de 200 litros de agua para inventariar microorganismos. Como resultado de los análisis, sólo en una muestra del mar de los Sargazos, en el Atlántico norte, los investigadores encontraron unos 1.2 millones de genes, que infieren la presencia de unas 1 800 especies de bacterias (Gross, 2007).
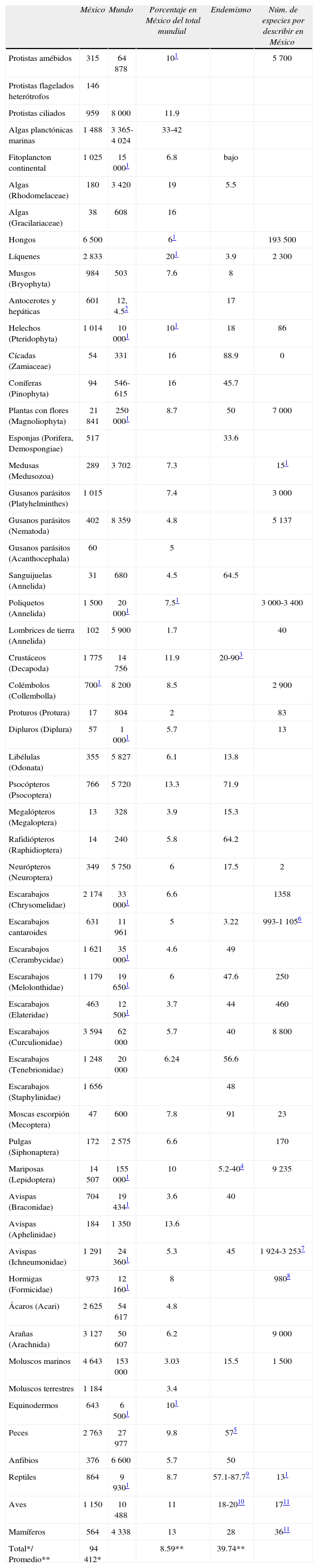
Para México, la situación del conocimiento de su biodiversidad no es muy diferente. Siendo uno de los 17 países megadiversos, es decir, que en conjunto reúne entre el 65 y 70% de la riqueza mundial de especies (Mittermeier et al., 1997); inicialmente, se estimó que México poseía entre el 10 y el 12% de la diversidad del mundo (Sarukhán et al., 2009). Estos cálculos se irán ajustando conforme avanza el conocimiento de la biota del país. En los 56 artículos que se presentan en este suplemento, que aunque por supuesto no agotan todos los grupos biológicos existentes, se da cuenta de 94 412 especies registradas en México (Cuadro 1) y se estima que esta cifra representa el 8.59% del total mundial para los grupos examinados. En un estudio previo, Llorente-Bousquets y Oceguera (2008) estimaron que habría unas 109 000 especies de todos los grupos taxonómicos en el país, lo que ahora contrasta con los resultados obtenidos en este suplemento.
Número de especies descritas de diferentes grupos taxonómicos para México y el mundo (referencias de este suplemento), porcentaje de especies que se distribuyen en México del total mundial, endemismo presentado como porcentaje y estimación del número de especies que faltarían por describir de México y el porcentaje que representa del total ahora conocido
| México | Mundo | Porcentaje en México del total mundial | Endemismo | Núm. de especies por describir en México | |
| Protistas amébidos | 315 | 64 878 | 101 | 5 700 | |
| Protistas flagelados heterótrofos | 146 | ||||
| Protistas ciliados | 959 | 8 000 | 11.9 | ||
| Algas planctónicas marinas | 1 488 | 3 365-4 024 | 33-42 | ||
| Fitoplancton continental | 1 025 | 15 0001 | 6.8 | bajo | |
| Algas (Rhodomelaceae) | 180 | 3 420 | 19 | 5.5 | |
| Algas (Gracilariaceae) | 38 | 608 | 16 | ||
| Hongos | 6 500 | 61 | 193 500 | ||
| Líquenes | 2 833 | 201 | 3.9 | 2 300 | |
| Musgos (Bryophyta) | 984 | 503 | 7.6 | 8 | |
| Antocerotes y hepáticas | 601 | 12, 4.52 | 17 | ||
| Helechos (Pteridophyta) | 1 014 | 10 0001 | 101 | 18 | 86 |
| Cícadas (Zamiaceae) | 54 | 331 | 16 | 88.9 | 0 |
| Coníferas (Pinophyta) | 94 | 546-615 | 16 | 45.7 | |
| Plantas con flores (Magnoliophyta) | 21 841 | 250 0001 | 8.7 | 50 | 7 000 |
| Esponjas (Porifera, Demospongiae) | 517 | 33.6 | |||
| Medusas (Medusozoa) | 289 | 3 702 | 7.3 | 151 | |
| Gusanos parásitos (Platyhelminthes) | 1 015 | 7.4 | 3 000 | ||
| Gusanos parásitos (Nematoda) | 402 | 8 359 | 4.8 | 5 137 | |
| Gusanos parásitos (Acanthocephala) | 60 | 5 | |||
| Sanguijuelas (Annelida) | 31 | 680 | 4.5 | 64.5 | |
| Poliquetos (Annelida) | 1 500 | 20 0001 | 7.51 | 3 000-3 400 | |
| Lombrices de tierra (Annelida) | 102 | 5 900 | 1.7 | 40 | |
| Crustáceos (Decapoda) | 1 775 | 14 756 | 11.9 | 20-903 | |
| Colémbolos (Collembolla) | 7001 | 8 200 | 8.5 | 2 900 | |
| Proturos (Protura) | 17 | 804 | 2 | 83 | |
| Dipluros (Diplura) | 57 | 1 0001 | 5.7 | 13 | |
| Libélulas (Odonata) | 355 | 5 827 | 6.1 | 13.8 | |
| Psocópteros (Psocoptera) | 766 | 5 720 | 13.3 | 71.9 | |
| Megalópteros (Megaloptera) | 13 | 328 | 3.9 | 15.3 | |
| Rafidiópteros (Raphidioptera) | 14 | 240 | 5.8 | 64.2 | |
| Neurópteros (Neuroptera) | 349 | 5 750 | 6 | 17.5 | 2 |
| Escarabajos (Chrysomelidae) | 2 174 | 33 0001 | 6.6 | 1358 | |
| Escarabajos cantaroides | 631 | 11 961 | 5 | 3.22 | 993-1 1056 |
| Escarabajos (Cerambycidae) | 1 621 | 35 0001 | 4.6 | 49 | |
| Escarabajos (Melolonthidae) | 1 179 | 19 6501 | 6 | 47.6 | 250 |
| Escarabajos (Elateridae) | 463 | 12 5001 | 3.7 | 44 | 460 |
| Escarabajos (Curculionidae) | 3 594 | 62 000 | 5.7 | 40 | 8 800 |
| Escarabajos (Tenebrionidae) | 1 248 | 20 000 | 6.24 | 56.6 | |
| Escarabajos (Staphylinidae) | 1 656 | 48 | |||
| Moscas escorpión (Mecoptera) | 47 | 600 | 7.8 | 91 | 23 |
| Pulgas (Siphonaptera) | 172 | 2 575 | 6.6 | 170 | |
| Mariposas (Lepidoptera) | 14 507 | 155 0001 | 10 | 5.2-404 | 9 235 |
| Avispas (Braconidae) | 704 | 19 4341 | 3.6 | 40 | |
| Avispas (Aphelinidae) | 184 | 1 350 | 13.6 | ||
| Avispas (Ichneumonidae) | 1 291 | 24 3601 | 5.3 | 45 | 1 924-3 2537 |
| Hormigas (Formicidae) | 973 | 12 1601 | 8 | 9808 | |
| Ácaros (Acari) | 2 625 | 54 617 | 4.8 | ||
| Arañas (Arachnida) | 3 127 | 50 607 | 6.2 | 9 000 | |
| Moluscos marinos | 4 643 | 153 000 | 3.03 | 15.5 | 1 500 |
| Moluscos terrestres | 1 184 | 3.4 | |||
| Equinodermos | 643 | 6 5001 | 101 | ||
| Peces | 2 763 | 27 977 | 9.8 | 575 | |
| Anfibios | 376 | 6 600 | 5.7 | 50 | |
| Reptiles | 864 | 9 9301 | 8.7 | 57.1-87.79 | 131 |
| Aves | 1 150 | 10 488 | 11 | 18-2010 | 1711 |
| Mamíferos | 564 | 4 338 | 13 | 28 | 3611 |
| Total*/ Promedio** | 94 412* | 8.59** | 39.74** |
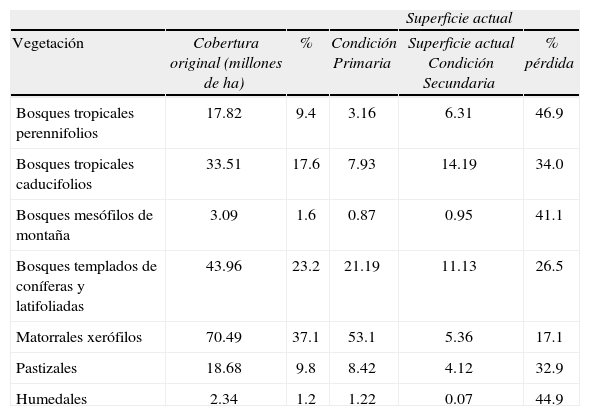
Con respecto a otros niveles de organización biológica, México también es un país particularmente rico en términos de sus ecosistemas terrestres, costeros y marinos. Para los ecosistemas terrestres existen diversos sistemas de clasificación que varían según la especificidad con que describen los componentes bióticos y la estructura fisonómica de las comunidades vegetales (Miranda y Hernández, 1963; Rzedowski, 1978; Inegi, 2005). Challenger y Soberón (2008) los engloban en 7clases: bosques tropicales perennifolios, bosques tropicales caducifolios, bosques mesófilos de montaña, bosques templados de coníferas y latifoliadas, matorrales xerófilos, pastizales y humedales. Bajo esta clasificación, los matorrales xerófilos son las comunidades vegetales de mayor extensión del territorio y los bosques mesófilos y los humedales los de distribución más restringida y con mayor vulnerabilidad (Cuadro 2).
Extensión original de los diferentes ecosistemas en México, superficie actual en condición primaria (inalterada), secundaria (alterada) y porcentaje de superficie perdida (Challenger y Soberón, 2008)
| Superficie actual | |||||
| Vegetación | Cobertura original (millones de ha) | % | Condición Primaria | Superficie actual Condición Secundaria | % pérdida |
| Bosques tropicales perennifolios | 17.82 | 9.4 | 3.16 | 6.31 | 46.9 |
| Bosques tropicales caducifolios | 33.51 | 17.6 | 7.93 | 14.19 | 34.0 |
| Bosques mesófilos de montaña | 3.09 | 1.6 | 0.87 | 0.95 | 41.1 |
| Bosques templados de coníferas y latifoliadas | 43.96 | 23.2 | 21.19 | 11.13 | 26.5 |
| Matorrales xerófilos | 70.49 | 37.1 | 53.1 | 5.36 | 17.1 |
| Pastizales | 18.68 | 9.8 | 8.42 | 4.12 | 32.9 |
| Humedales | 2.34 | 1.2 | 1.22 | 0.07 | 44.9 |
Con respecto a la biodiversidad oceánica, en la zona económica exclusiva de México existen 6 provincias marinas, que incluyen 24 ecorregiones en su clasificación más desagregada: Baja California Pacífico, Golfo de California, Región Panámica del Océano Pacífico, Suroeste del Golfo de México, Banco de Campeche y Caribe Mexicano. A pesar de ser el duodécimo país a nivel mundial con mayor superficie marina y una enorme riqueza ecosistémica y específica, el conocimiento que se tiene sobre su biodiversidad es, en general, bastante pobre; con excepción de las especies de interés comercial (Hendrickx, 1995). La biodiversidad costera es mejor conocida que la oceánica o de plataforma continental. Se han hecho grandes recopilaciones para un gran número de grupos biológicos tanto para la costa del golfo de México y Caribe, como para la del Pacífico (Salazar-Vallejo y González, 1993; Hendrickx et al., 2005; Laguarda-Figueras et al., 2009; Felder y Camp, 2009), pero aún así, cada nuevo estudio revela la presencia de nuevas especies o de especies que nunca habían sido registradas antes en aguas mexicanas (Hendrickx et al., 2007; Bastida-Zavala et al., 2013; Merino-Virgilio et al., 2013; Vassallo et al., en prensa).
Tendencia actual de la pérdida de la biodiversidadLa época actual está marcada por una profunda crisis ambiental que se caracteriza, entre otros aspectos, por una erosión y pérdida de la biodiversidad mundial a una tasa sin precedentes. La magnitud del problema es tal, que se ha considerado que estamos transitando por la sexta extinción masiva; es decir, un proceso en el que la tasa de extinción de especies es varios órdenes de magnitud más acelerada que en un periodo “normal”. La última extinción masiva ocurrió hace 65 millones de años, cuando desaparecieron los dinosaurios (Wake y Vradenburg, 2008).
De acuerdo con Ceballos et al. (2010), la tasa de extinción “natural” es de 1 especie que se extingue entre 10 000 especies cada 100 años, mientras que la tasa de extinción actual estimada a partir de las especies extintas desde que se tiene registro histórico extraído de las listas de la IUCN es unas 6 500 veces más acelerada. En la región neotropical, la tasa de extinción de vertebrados es unas 280 veces más acelerada que la tasa natural (Ceballos y Ortega-Baes, 2011). Para ponerlo en perspectiva, hace aproximadamente 12 mil años se extinguieron más del 85% de los mamíferos del mundo mayores a 45kg, la llamada “megafauna” (Gill et al., 2009), posiblemente por un efecto combinado de un calentamiento global que marcó el final de la última era del hielo y la expansión del hombre por el mundo. La ola de extinción actual es varios órdenes de magnitud más alta que la que acabó con la megafauna y además involucra a todos los grupos taxonómicos del planeta.
Las tasas de extinción más altas, sin embargo, se registran en la biota dulceacuícola, debido a que el agua dulce es un recurso limitado con una demanda creciente. El 2.5% de toda el agua del planeta es agua dulce, de este total el 68.7% se encuentra capturado como hielo y el 29.9% se encuentra en el subsuelo; de manera que solamente el 0.26% se encuentra en lagos, ríos y otros cuerpos de agua en donde se encuentra la mayor parte de la biota dulceacuícola (Carpenter et al., 2011). Se estima que entre un tercio y la mitad de las especies dulceacuícolas de peces y anfibios han desaparecido o están casi extintas en muchas regiones del mundo (Jelks et al., 2008; Sodhi et al., 2008). Para los cangrejos de agua dulce, que con 1 280 especies representan una quinta parte de todos los cangrejos, se estima que una sexta parte (283 especies) tiene un riesgo de extinción muy alto (Cumberlidge et al., 2009).
Se sabe que en México se han extinguido por lo menos 135 especies, incluyendo 26 plantas, 15 mamíferos, 19 aves, 43 peces, 29 anfibios y 3 crustáceos; más de la mitad de éstas eran endémicas, lo que significa que su pérdida es definitiva (Baena y Halffter, 2008; IUCN, 2013). Varias de estas especies presentaban distribuciones geográficas naturales muy pequeñas o restringidas a cuevas o islas; una condición que las hizo particularmente vulnerables. Sin embargo, el número real de especies endémicas de México que se han extinguido podría ser mucho mayor, simplemente porque un gran número de localidades o ecosistemas en donde se presentaban ciertas especies han sido totalmente transformadas o han desaparecido.
Amenazas a la biodiversidadLos factores que se han identificado como amenazas para la biodiversidad y causales directos de la extinción de especies varían según el grupo taxonómico, pero entre ellos se cuentan: la destrucción de sus hábitats, la contaminación, la sobreexplotación, la introducción de especies exóticas y más recientemente, el cambio climático. En especies terrestres (i.e., plantas, anfibios, reptiles, aves y mamíferos), una causa generalizada es la pérdida de sus hábitats por cambios en la cobertura del terreno. Las especies que son de distribución restringida y especialistas a ciertos tipos de ambientes, como algunas especies de plantas que están asociadas a manantiales, o anfibios estrictos a algún bosque mesófilo, por ejemplo, son los que se ven más severamente afectados, porque cambios relativamente pequeños en esos sitios pueden tener impactos muy importantes en las poblaciones de esas especies. El cambio en la cobertura del terreno provoca cambios en la temperatura del suelo, disponibilidad de alimento, refugios, sitios para la reproducción, entre otros, además de causar la fragmentación y reducción del área habitable, lo que ha llevado a la extinción local de algunas poblaciones, como los grandes carnívoros (e.g., lobo, jaguar, puma) en la región central del país o incluso de algunas especies, como se piensa que es el caso para el carpintero imperial (Campephilus imperialis) en los bosques de la sierra Madre Occidental (Baena y Halffter, 2008).
En México, la pérdida de áreas naturales es un problema central en la conservación de la biodiversidad. De acuerdo con los números de Challenger y Soberón (2008), alrededor del 50% del territorio ya ha perdido su cobertura vegetal original; de estas zonas perturbadas, el 22% presenta cobertura de vegetación secundaria. Es decir, cerca del 27% del territorio ya ha sido profundamente transformado a zonas agrícolas, de pastizales para el ganado o zonas urbanas. Los tipos de vegetación más afectados por la deforestación son los bosques tropicales perennifolios, los humedales y los bosques mesófilos de montaña, con más del 40% de su superficie ya totalmente transformada; mientras que los matorrales xerófilos son los menos impactados (Cuadro 2).
La tasa de deforestación, es decir, la velocidad a la que se desmontan las áreas naturales, ha sido muy problemático poder estimarla, principalmente porque la cartografía desarrollada históricamente para hacer los cálculos de cobertura de terreno ha seguido metodologías diferentes que impiden una comparación directa (Semarnat, 2006). A pesar de ello, diversos esfuerzos para estimar la tasa de deforestación en el país arrojan cifras que van de 75 mil a cerca de 2 millones de ha/año, en distintos periodos. Uno de los estudios más recientes en el que se trató de hacer una homogeneización de las fuentes muestra que la tasa de deforestación de 1976 a 1993 fue de 175 mil ha/año y de 1993 a 2000 fue de 319 mil ha/año (Velázquez et al., 2002). De acuerdo con la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO), la tasa de deforestación para México de 1990 a 2000 fue de 348 mil ha/año y de 2000 a 2005 fue de 260 mil ha/año (FAO, 2006), aunque estas estimaciones deben tomarse e interpretarse con cautela (Hoare, 2005).
La extracción por coleccionistas de ciertos grupos de plantas, como cactáceas, orquídeas y cícadas, ha diezmado poblaciones de varias especies; mientras que la explotación excesiva de especies de importancia comercial, como algunos peces de agua dulce, los ha llevado a números poblacionales tan bajos que están en alguna categoría de riesgo, como es el caso del pescado blanco de Chapala (Chirostoma promelas) (Rojas y Sasso, 2005).
El tráfico ilegal de vida silvestre es otro factor que ha afectado negativamente a las poblaciones de especies nativas. Algunas fuentes mencionan que el tráfico de vida silvestre se ubica entre las 3 primeras causas de extinción de especies a nivel mundial, junto con la pérdida de hábitat y los efectos causados por especies invasoras (IFAW, 2008; Conabio, 2010). En el mundo, existen 4 956 especies de animales reguladas contra la explotación excesiva debido al comercio internacional –incluye 602 (12%) reptiles, 1 420 (29%) aves y 572 (12%) mamíferos–, de las cuales 602 (12%) se encuentran en territorio nacional (CITES, 2013; Conabio, 2013). Por supuesto que otros grupos muy numerosos, principalmente de plantas e invertebrados, no han sido evaluados.
La contaminación y la reducción de los cuerpos de agua dulce en México han impactado negativamente a un número desconocido de especies. Un caso particularmente grave es el del lago de Xochimilco, que por encontrarse en el valle de México ha sufrido una enorme presión desde hace varios siglos y actualmente se mantiene como un conjunto de canales y lagos que representan apenas un 5% del sistema lacustre original y ha perdido una alta proporción de sus especies nativas (Zambrano et al., 2007; Contreras et al., 2009). Muchos cuerpos de agua dulceacuícolas del país de menor importancia histórica y paisajística que Xochimilco, se han perdido sin que siquiera se hayan estudiado.
En especies marinas, la sobreexplotación comercial, la contaminación de los mares y la profunda degradación de decenas de lagunas costeras –que son sitios de reproducción de un gran número de especies marinas– son las causas principales de la pérdida de diversidad biológica (Naranjo y Dirzo, 2009). Ahora se tienen enfermedades nuevas del coral que son producto de bacterias del tracto digestivo humano (Futch et al., 2010), pasando de 2 enfermedades comunes antes conocidas a 9.
Por otro lado, la introducción de especies exóticas ha sido particularmente nociva para la biodiversidad de sistemas cerrados, como islas o lagos (Aguirre-Muñoz et al., 2009). Por ejemplo, los gatos ferales en la isla Guadalupe han llevado a 2 especies endémicas de aves a la extinción y han mermado las poblaciones de otras más (Luna-Mendoza et al., 2009). La introducción de especies en sistemas dulceacuícolas como la langosta australiana, el acocil rojo, el pez diablo y en sistemas costeros como el pez león (Bortolini et al., 2007; Aguilar-Perera y Tuz-Sulub, 2010; Wakida-Kusunoki y Amador-del Angel, 2011; Torres y Álvarez, 2012) va a tener efectos desastrosos sobre la diversidad natural de muchas regiones de México, que ya empiezan a percibirse.
Últimamente, el cambio climático se ha identificado como uno de los factores causales de la extinción de poblaciones y especies, con posibles impactos profundos en las próximas décadas (Parry et al., 2007). Recientemente, se ha documentado la extinción de poblaciones de varias especies de lagartijas del género Sceloporus en las últimas 3 décadas en diferentes partes del país como consecuencia directa del calentamiento global (Sinervo et al., 2010). Las proyecciones hacia el futuro en ese estudio y otros, sugieren que una proporción importante de la biodiversidad mexicana podría verse seriamente afectada por los cambios en el clima (Peterson et al., 2002), como los bosques mesófilos de montaña (Ponce et al., 2012) y los arrecifes de coral (Hoegh-Guldberg et al., 2007).
Tareas pendientesDe acuerdo con los datos más recientes sobre el inventario nacional de especies, en el país se han descrito alrededor de 100 000 especies de todos los grupos taxonómicos en más de 200 años de colecta sistemática y se estima que ésto corresponde a entre el 30 y 50% de las especies que pueden existir en el país (Cuadro 1; artículos en este suplemento); sin embargo, estas estimaciones son conservadoras pues existen grupos taxonómicos prácticamente desconocidos en México, como virus y otros microorganismos, e incluso algunas familias de insectos y otros invertebrados o familias de plantas que han sido raramente colectadas (Llorente-Bousquets y Oceguera, 2008). Dentro del grupo de invertebrados, por ejemplo, existen por los menos 10 phyla de los que se sabe muy poco o nada acerca de su presencia en México: Nemertea, Gastrotricha, Kinorhyncha, Nematomorpha, Entoprocta, Gnathostomulida, Priapula, Loricifera, Cycliophora y Echiura. Aunque dentro de grupos relativamente bien conocidos como moluscos y crustáceos, también hay órdenes y familias enteras que no se han estudiado en México.
¿Cuantas especies faltan por catalogarse en México? Ésta sigue siendo una pregunta para la que no tenemos una respuesta precisa. En todo caso, hasta ahora había existido un consenso entre los taxónomos especialistas de muchos grupos biológicos sobre el hecho de que apenas se han descrito alrededor de la mitad de las especies de nuestro país. Los datos que se desprenden de los artículos de este suplemento sugieren que faltarían por reconocerse hasta 3.3 veces más especies de las que ahora conocemos. Destacan en estas estimaciones los números de especies de protistas amébidos, hongos, nemátodos parásitos y colémbolos, en los que faltaría reconocer desde 4.1 hasta 29 veces más especies que las actuales (Cuadro 1). Si no se consideran estos grupos en el cálculo, para el resto de los grupos examinados en este suplemento, efectivamente faltarían por describir 1.09 veces más especies de las conocidas, es decir, otro tanto. Con estos datos, uno de los grandes retos de investigación en México es completar su inventario nacional de especies, que se calcula empíricamente que estaría entre las 200 000 y 330 000 especies (Cuadro 1).
Wheeler et al. (2004) correctamente interpretaron que la nuestra es la primera generación que entiende realmente la amenaza a la biodiversidad y quizá la última que tenga oportunidad de hacer algo para frenar el deterioro ambiental y preservarla. El “impedimento taxonómico”, término acuñado para describir el problema que reside en: tener probablemente 1.8 millones de especies por describir, un grupo de taxónomos cada vez más pequeño a nivel global y una crisis ambiental que amenaza con la desaparición de miles de especies antes de que puedan ser estudiadas, descritas y catalogadas, debe de ser confrontado con nuevas ideas y nuevos esfuerzos (Wheeler, 2007).
F. Álvarez agradece a todos los autores de los artículos incluidos en este suplemento su participación para este proyecto editorial de la Revista Mexicana de Biodiversidad y a Ma. Antonieta Arizmendi, cuya ayuda editorial fue determinante para concluirlo.