Los ecosistemas urbanos y suburbanos son áreas transformadas por las actividades antrópicas que sustentan una importante diversidad biológica. La alteración del campo acústico afecta la comunicación entre animales, poniendo en riesgo la estabilidad de sus dinámicas poblacionales. Cuando la comunicación acústica se realiza a distancia, como en el caso de las aves, la señal que llega al receptor puede diferir de la emitida debido a la degradación y contaminación acústica; por lo cual las especies deben modificar sus vocalizaciones para comunicarse efectivamente. Se estudiaron las vocalizaciones del jilguero dorado (Sicalis flaveola) en 2 sitios con diferentes grados de contaminación acústica. El área con mayor contaminación acústica registró trinos más breves con frecuencias, máximas y mínimas, más elevadas; así como un preludio con frecuencias máximas más bajas. Los datos constituyen el primer aporte a la estructura de la vocalización del jilguero dorado en las áreas de estudio y brinda evidencias sobre las modificaciones que sufren por la contaminación acústica. Ninguna de las hipótesis explicativas conocidas contempla por sí sola las modificaciones encontradas; lo que nos permite decir que esta especie ajusta sus vocalizaciones a la contaminación acústica de diversas maneras simultáneamente según las posibilidades intrínsecas de la especie.
Urban and suburban ecosystems are areas that, despite of being modified by human activities, can sustain a large amount of biodiversity. Acoustic field alterations affect communication among animals, threatening the populations' stability dynamics. In birds, where acoustic communication take place at a certain distance, signals that reach the receptor may differ from those emitted, due to song degradation and acoustic pollution. In order to secure communication, species have to modify their vocalizations in different ways. We studied songs of the Saffron finch (Sicalis flaveola) at 2 sites with different levels of acoustic pollution. At the most polluted site, songs showed shorter trills with higher frequencies (max and min), and preludes with lower maximum frequencies. This is the first contribution on the vocalization's structure of the Saffron Finch at the study area, and provides new evidence on the effects that acoustic pollution produces on it. None of known song hypothesis was able to explain by itself the changes in song structure found in this study. Thus, this species adjusts its vocalizations to acoustic pollution in different ways simultaneously, depending on the species' inner capacities.
Las vocalizaciones son esenciales para la vida de las aves, ya que son utilizadas en el reconocimiento de su pareja y congéneres, evitando endogamia e hibridación, en disputas territoriales o formando parte de los despliegues de atracción reproductiva (Tubaro y Segura, 1989). En los últimos años, el ruido antropogénico y su influencia en la comunicación acústica ha recibido gran interés, y varios estudios apuntan a cómo los animales pueden hacer frente a este nuevo impacto de origen antrópico (Brumm y Slabbekoorn, 2005). La alteración del campo acústico en los hábitats, como consecuencia de modificaciones y ruido de origen antrópico, pueden ocasionar una comunicación ineficiente (Krause, 2008).
Cuando la comunicación acústica se realiza a distancia, como en el caso de las aves, la señal que llega al receptor puede diferir considerablemente de la producida por el emisor, debido a la degradación de la misma (la señal se entremezcla con otras señales irrelevantes generadas por el viento y otras especies simpátricas, y se degrada y modifica al chocar con objetos en su camino; Simmonetti et al., 1996). Si a esto último se suman los ruidos de origen antrópico, se generan fenómenos de absorción diferencial de frecuencias, adición de ecos y fluctuaciones de amplitud, entre otros (Wiley y Richards, 1982). Estas alteraciones dificultan el desempeño del receptor respondiendo a la señal cuando ésta está ausente y a la inversa (Simonetti et al., 1996).
Si las vocalizaciones no alcanzan al receptor de manera correcta, pueden causar una baja en la eficiencia reproductiva, con la consecuente reducción del número de individuos y poniendo en riesgo la estabilidad de las poblaciones (Krause, 2008; Francis et al., 2011). Como respuesta a estas alteraciones, las especies pueden modificar la estructura de sus vocalizaciones, con el fin de asegurar la comunicación con sus congéneres según las características del ambiente donde habitan (Patricelli y Blickley, 2006; Mendes et al., 2010). Para Slabbekoorn (2003), la plasticidad en las vocalizaciones representa un mecanismo general de adaptación que permite que las especies puedan reproducirse a pesar de los altos niveles de ruido. En caso contrario, las especies podrían sufrir enmascaramiento auditivo.
Existen 5 hipótesis que explican las modificaciones que las aves presentan para adaptarse a los cambios acústicos de su ambiente: 1) adaptación acústica (AAH, por sus siglas en inglés) (Morton, 1975; Hansen, 1979), propone que la estructura del hábitat ha dado forma a la evolución de las propiedades acústicas en los cantos. Con base en los diferentes patrones de degradación acústica que existen en relación con la estructura del hábitat, la AAH predice que las vocalizaciones con bajas frecuencias, anchos de banda estrechos, elementos de larga duración, al igual que los intervalos entre los mismos deben ser frecuentes en hábitats con cobertura herbácea. Por otro lado, anchos de banda amplios, las modulaciones de alta frecuencia en trino, elementos e intervalos de corta duración, deben ser frecuentes en los hábitats con una vegetación más compleja (Morton, 1975); 2) detección alertada (Richards, 1981), establece que la diferenciación estructural del canto ha evolucionado como una adaptación de la comunicación a distancia en un ambiente ruidoso (Kroodsma, 1989; Catchpole y Slater, 1995), explicando que cuando las señales se presentan en su forma degradada, la respuesta al canto completo debería ser superior a la de la introducción o el trino por separado; 3) estimación de la distancia (Morton, 1986), indica que el empleo de cantos degradados puede significar en el receptor de la señal, que el emisor está lejos y no constituye una amenaza pudiendo no tener que ver tanto con la detectabilidad, sino más con un problema de estimación de distancias; 4) integrativa (Richards, 1981), según la cual, ambas partes del canto son igualmente informativas y detectables, por lo que cualquier parte de la vocalización puede ser modificada, y 5) aditiva (Date et al., 1991), que menciona que la respuesta a un canto completo y normal será mayor que la respuesta a cualquiera de los componentes aislados de éste, porque tendría mayor cantidad de información y sería más detectable. Sin embargo, y dado a que no todas las especies poseen las mismas capacidades de aprendizaje, ni idéntica plasticidad genética para realizar los mismos cambios a las vocalizaciones, es de esperar que las especies no respondan de manera estandarizada a las perturbaciones, sino que realicen sólo aquellos cambios que sean capaces de efectuar (Slabbekoorn, 2003).
Si bien las vocalizaciones pueden variar dentro de una misma especie dependiendo de la ubicación geográfica (Morton, 1975; Hansen, 1979), y en respuesta a cambios en el ambiente acústico causados por perturbaciones humanas (Warren et al., 2006; Wood y Yezerinac, 2006), estudios de este tipo no se han realizado hasta el momento en el jilguero dorado (Sicalis flaveola). Se espera encontrar modificaciones en las vocalizaciones que permitan diferenciarlas de los ruidos antrópicos, lo que podría lograrse por una reducción en la duración de los elementos de su canto, o mediante un incremento en las frecuencias utilizadas. El objetivo del presente estudio es describir las características estructurales de las vocalizaciones de los machos de jilguero dorado y sus diferencias entre sitios con diferentes grados de contaminación sonora; así como evaluar si las respuestas efectuadas se ajustan a las hipótesis explicativas de dichas variaciones.
Materiales y métodosEspecie de estudioCon una amplia distribución en Sudamérica, el jilguero dorado es común en zonas rurales, abiertas y semiabiertas. Es un ave que presenta dimorfismo sexual, siendo el macho de color amarillo-oro con la zona dorsal estriada de negro y la zona frontal de la cabeza con tonos anaranjados. La hembra es más pálida que el macho y carece totalmente de coloración amarilla (Raffaele et al., 1998; Ruiz, 2002), al igual que los juveniles, posee un dorso gris parduzco, estriado de negro y una zona ventral de color blanquecina con pecho y flancos estriados (Narosky e Yzurieta, 2010).
Área de estudioEl muestreo se llevó a cabo en 2 ambientes asociados al río Paraná Medio, con distintos grados de contaminación acústica y separados entre sí por unos 40km. La Reserva Universitaria El Pozo, 31°38' S, 60°40' O (sitio 1) protege el ecosistema de galería paranaense donde se encuentran representadas especies vegetales como: sauce (Salix humboltiana), aromito (Acacia caven), aliso de río (Tessaria integrifolia), helechos de agua (Azola sp. y Salvinia sp.) y repollito de agua (Pistia stratiotes). Posee un tamaño relativamente pequeño, 12 ha y está ubicada en una zona periurbana que presenta un alto grado de contaminación acústica por estar situada al borde de avenidas, rutas, zonas urbanizadas y áreas recreacionales. El sitio 2, denominado Parque escolar rural Enrique Berduc (31°43' S, 60°18' O), comprende un área de bosques riparios con bajos niveles de contaminación acústica. En este área abundan especies vegetales como: el arrayán del norte (Eugenia uniflora) y el laurel (Laurus nobilis), así como lianas y enredaderas, acompañadas por numerosas plantas epífitas. En las zonas con menor caudal de agua, zona del monte xerófilo, se encuentran especies vegetales como el espinillo (Acacia caven), ñandubay (Prosopis affinis), tala (Celtis tala), moye (Schinus molle) y pasionarias (Passiflora caerulea).
Con el fin de determinar la densidad de la vegetación, se estimó el índice de vegetación de diferencia normalizada (NDVI, por sus siglas en inglés) para cada área de estudio a partir de imágenes MODIS MOD13Q1 (resolución espacial de 250m y temporal de 16 días, ORNLDAAC, 2011). El sitio perturbado arrojó un valor de 0.60, mientras que el sitio no perturbado un valor de 0.78; lo que indica que los sitios no presentan diferencias en cuanto a su vegetación, excluyendo este factor como causal de diferencias en las vocalizaciones.
Muestreo acústicoEl llamado y el canto son 2 clases de vocalizaciones típicas de las aves cuya distinción es evidente. Los llamados a menudo aparecen como simples elementos del canto de los pájaros, son señales breves emitidas durante cualquier época del año por el macho o la hembra de la mayoría de las especies. Por su parte, el canto es una señal prolongada emitida en algunas especies sólo por el macho durante el periodo de reproducción (Tirado et al., 2004). Las grabaciones se realizaron durante la temporada estival comprendida (septiembre-marzo), cada 7 días entre las 07:00 y las 12:00h, periodos de mayor actividad de las aves (Duellman y Trueb, 1986; Ralph et al., 1995; Ordano, 1999; Parris et al., 1999). El tiempo de duración en las grabaciones fue de 10 minutos por individuo o hasta registrar 10 vocalizaciones completas.
Los registros fueron realizadas mediante el uso de un micrófono direccional Sennheiser ME-66 con un condensador K6-C y un grabador digital Korg MR-1 000, el cual no utiliza algoritmos de compresión que eliminen frecuencias, en formato WAV, 192 kHz, 16-bits. El análisis y procesamiento de las grabaciones se realizó mediante el uso del programa Sound Analysis Pro 1. 4 (Tchernichovski et al., 2000), con el cual se analizó la estructura del canto y sus parámetros; duración de trino y preludio, frecuencia máxima y mínima en trino y preludio, número de sílabas, duración en trino y preludio. Del mismo modo, y en cada sitio, se reprodujo una serie de 10 vocalizaciones pregrabadas del jilguero dorado mediante un parlante JBL-Platinum Series. Las variaciones en la frecuencia máxima registrada fue utilizada para determinar la existencia de una degradación diferencial del sonido (Morton, 1975). Dichas grabaciones se realizaron a 8m de distancia y en línea recta del punto de emisión (Morton, 1975).
Tratamiento estadísticoSe realizaron análisis de normalidad (Kolmogorov-Smirnov) y homosedasticidad (Levene) a los datos. Dada la normalidad de los mismos, se llevaron a cabo análisis de varianza (Anova) para detectar diferencias significativas entre sitios. Además, se realizó un análisis de función discriminante simultáneo (AFDs) mediante el uso del software Infostat 2012 (Di Rienzo et al., 2012) para determinar si la estructura de las vocalizaciones predice satisfactoriamente las categorías definidas inicialmente; individuos que vocalizan en sitios perturbados acústicamente vs aquellos que lo hacen en sitios poco perturbados. En este análisis se incluyó la totalidad de vocalizaciones medidas (N=52) y se puso a prueba la habilidad de las características de las vocalizaciones para asignar los individuos a sus categorías de ambiente correspondiente. Las diferencias fueron consideradas significativas a p<0.05. Los valores fueron expresados como el promedio±DE (desviación estándar).
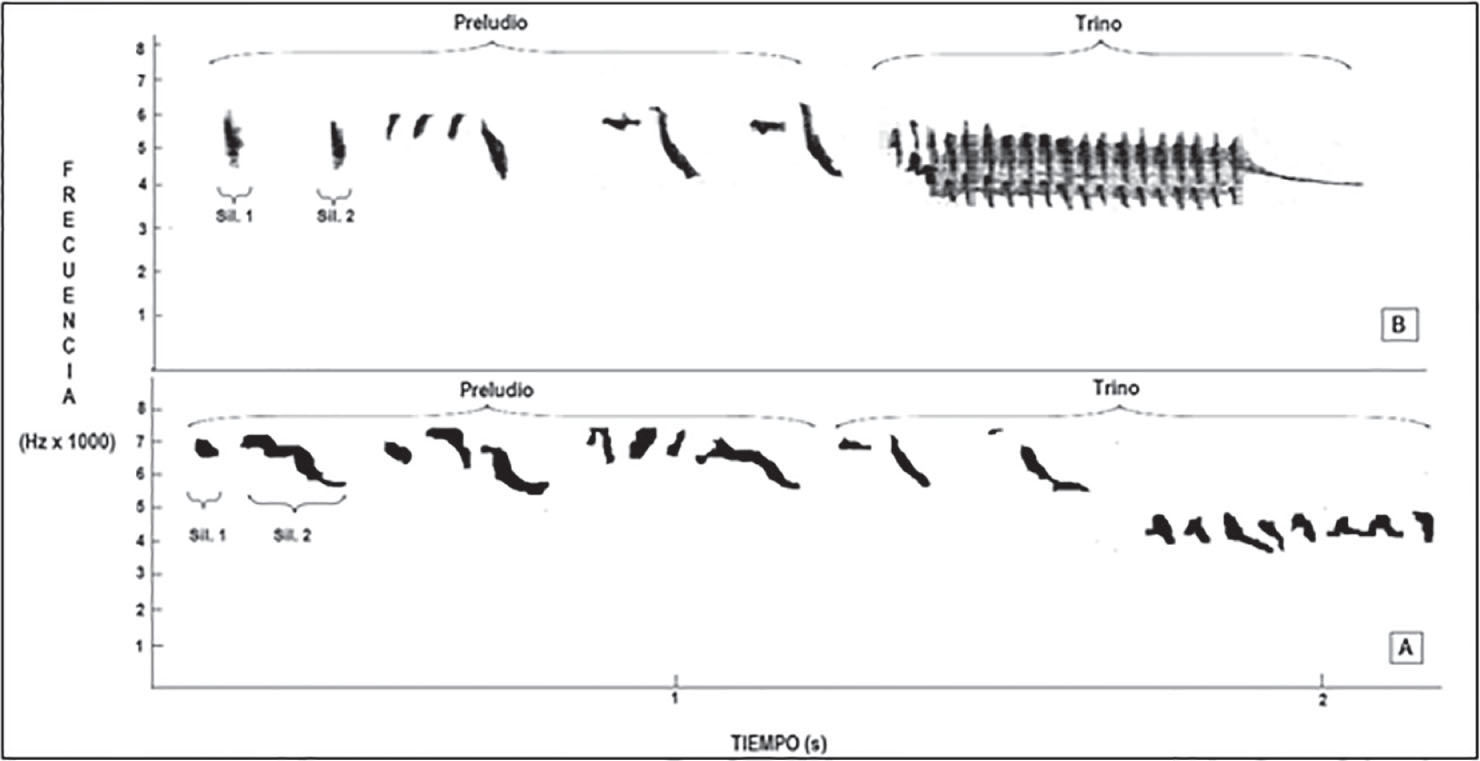
ResultadosSe analizaron 52 vocalizaciones independientes, de las cuales 27 pertenecen al sitio perturbado y las 25 restantes al sitio con menor contaminación sonora. Para los 2 sitios en conjunto, la vocalización del jilguero dorado estuvo compuesta por 2 partes, un preludio compuesto por 6 a 9 sílabas y un trino constituido por entre 12 y 15 sílabas (Figs. 1A, B). Los valores obtenidos para cada una de las porciones de las vocalizaciones en los diferentes sitios pueden observarse en el Cuadro 1.
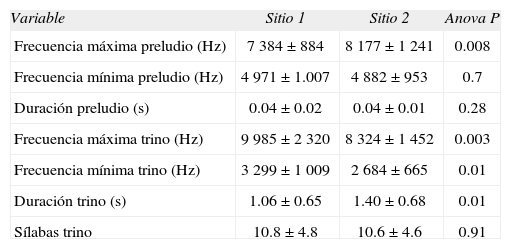
Valores de las diferentes partes de la estructura vocal de los machos de jilguero dorado en ambientes perturbados acústicamente (sitio 1) y con baja perturbación acústica (sitio 2). Valores de P resultantes de análisis de la varianza entre valores obtenidos en cada sitio para cada variable estudiada
| Variable | Sitio 1 | Sitio 2 | Anova P |
| Frecuencia máxima preludio (Hz) | 7 384±884 | 8 177±1 241 | 0.008 |
| Frecuencia mínima preludio (Hz) | 4 971±1.007 | 4 882±953 | 0.7 |
| Duración preludio (s) | 0.04±0.02 | 0.04±0.01 | 0.28 |
| Frecuencia máxima trino (Hz) | 9 985±2 320 | 8 324±1 452 | 0.003 |
| Frecuencia mínima trino (Hz) | 3 299±1 009 | 2 684±665 | 0.01 |
| Duración trino (s) | 1.06±0.65 | 1.40±0.68 | 0.01 |
| Sílabas trino | 10.8±4.8 | 10.6±4.6 | 0.91 |
Los sitios estudiados presentaron diferentes intensidades de ruido, siendo para el sitio 1 de 80.65dB, con una frecuencia máxima de 5 844 y mínima de 1 823. En el sitio 2 la intensidad de ruido fue de 54.6dB, mientras que las frecuencias máxima y mínima fueron de 4 590Hz y 1 147Hz, respectivamente (Fig. 2). La degradación del sonido no difirió significativamente entre sitios arrojando frecuencias máximas de 9 177±479Hz para el sitio 1 y 9 156±622Hz para el sitio 2 (Anova; F=0.007; df=19;p< 0.93).
En el análisis de funciones discriminantes realizado sobre las diferentes características estructurales de las vocalizaciones, la única función discriminante resultante que incluyó a las 7 variables consideradas arrojó un valor Lambda de Wilk de 0.565 (χ2=26.51; df=7; p<0.001) y explicó el 77% de la varianza (eigenvalue= 0.769, correlación canónica= 0.659). De las variables consideradas, las que se asociaron fuertemente con la función discriminante fueron, en orden al grado de asociación a la función: frecuencia máxima de trino (r=0.495), frecuencia máxima de preludio (r=0.443), frecuencia mínima de trino (r=0.415) y duración de trino (r=0.401). Al comparar la clasificación generada por la validación cruzada, 75% de los casos correctamente clasificados, se evidencia que la precisión se incrementó en más de un 25% a la generada por azar (50%), lo que valida la función discriminante utilizada.
DiscusiónLos datos obtenidos ponen de manifiesto diferencias en las vocalizaciones del jilguero dorado entre los sitios estudiados, en donde la duración del trino fue significativamente menor en el sitio perturbado acústicamente. Por su parte, las frecuencias máximas del trino fueron significativamente mayores en este ambiente, contrariamente a lo sucedido en el preludio. Si bien, el incremento en las frecuencias máximas del trino fue la variable que permitió diferenciar con mayor potencia entre las vocalizaciones de cada sitio, la frecuencia máxima de preludio, así como la frecuencia mínima y la duración de trino tuvieron casi la misma relevancia. Por lo tanto, se puede decir que los resultados no satisfacen en su totalidad las predicciones planteadas.
Con base en los resultados obtenidos se evidencia que ninguna de las hipótesis explicativas de las variaciones en las vocalizaciones de las aves (adaptación acústicaMorton, 1975; Hansen, 1979; detección alertada,Richards, 1981; estimación de la distancia,Morton, 1986; integrativa,Richards, 1981; aditiva,Date et al., 1991) puede explicar por sí solas las diferencias encontradas en este estudio. Las especies se encuentran limitadas por la plasticidad de sus vocalizaciones y su capacidad de aprendizaje (Slabbekoorn, 2003), así como por otros factores morfológicos y fisiológicos al momento de generar una respuesta ante un determinado tipo de perturbación acústica (Palacios y Tubaro, 2000; Podos y Nowicki, 2004; Nelson et al., 2005). Se han registrado diferentes adaptaciones al ruido antrópico en diferentes especies: incremento de las frecuencias en toda la vocalización en Parus major (Slabbekoorn, 2003) y Troglodytes troglodytes (Mendes et al., 2010), aumento de la frecuencia mínima en Melospiza melodia (Wood y Yezerinac, 2006), incremento de la redundancia de la señal (Fringillia coelebs-Brumm y Slater, 2006), incremento de la intensidad (Luscinia megarhynchos-Brumm, 2004) y la no vocalización en momentos con alto nivel de ruido (Erithacus rubecula-Fuller et al., 2007). Más aún, las respuestas pueden variar dentro de una misma especie, hecho que fue observado en Turdus merula, el cual varió la duración de las notas de su canto, la energía empleada en cada rango de frecuencias, y generó cambios temporales, dependiendo de los picos de contaminación sonora (Mendes et al., 2010).
Una de las modificaciones más frecuentes a los ambientes ruidosos es el aumento en la frecuencia de la señal en alguna porción de la vocalización, ya que beneficia la transmisión en estos ambientes (ejemplo, Slabbekoorn, 2003; Nemeth y Brumm, 2009). Vocalizar a frecuencias más elevadas, en aquellas especies que pudieran realizarlo, permitiría diferenciar su vocalización de los sonidos antrópicos que generalmente están compuestos por señales de baja frecuencia (Francis et al., 2011).
En el presente estudio, encontramos que el jilguero dorado utiliza un conjunto de respuestas para enfrentar el sonido antrópico. El incremento de las frecuencias mínimas del trino como respuesta a estos ruidos ha sido documentada en otras especies como Carpodacus mexicanus (Fernández-Juricic et al., 2005) y M. melodia (Wood y Yezerinac, 2006). Del mismo modo, el aumento de las frecuencias máximas también ha sido registrado en poblaciones de P. major y T. merula que habitan áreas urbanas (Slabekoorn y Peet, 2003; Slabekoorn et al., 2012; Nemeth et al., 2013). Sin embargo, el jilguero dorado incrementó simultáneamente la frecuencia mínima y máxima del trino; algo que no había sido registrado en forma conjunta con anterioridad, ya que cuando se aumentaba una de las frecuencias la otra permanecía constante disminuyendo así el ancho de banda (Patricelli y Blickley, 2006).
Las variaciones en la estructura temporal de las vocalizaciones es también una opción a la hora de adaptarse a ambientes urbanos (Patricelli y Blickley, 2006). Ha sido demostrado que vocalizar cuando el ruido antrópico es menos severo (Fuller et al., 2007; Nemeth et al., 2013) o incrementar las repeticiones y duración de las vocalizaciones aumentan la detectabilidad de las mismas (Brumm y Slabbekoorn, 2005; Warren et al., 2006). Sin embargo, algunos estudios han encontrado lo contrario, es decir, que se acortan las vocalizaciones reduciendo el número de notas o elementos (Fernández-Jurisic, 2005; Wood y Yezerinac, 2006). Según Fernández-Jurisic (2005) esta disminución de la duración puede ser consecuencia del costo extra que significa aumentar la amplitud en otras secciones del canto. Sin embargo, en el caso del jilguero dorado, se ha notado una reducción en la duración del trino, pero no una disminución en el número de elementos del mismo. Esto podría representar una estrategia novedosa de reducción en donde se disminuyen los espacios “interelementos” en lugar de reducir el número de notas en sí. La ventaja de este mecanismo podría radicar en que no se reduce la información enviada (el trino contiene la mayor parte de la información biológica del canto-Simonetti et al., 1996), sino que se acortan los espacios entre los fragmentos informativos.
Por otro lado, se detectó una disminución significativa de las frecuencias máximas del preludio, algo que podría constituir una “desadaptación” a los ambientes con ruidos antrópicos. Posiblemente, y dado que la generación de señales acústicas más intensas y de frecuencias más altas son costosas energéticamente (Oberweger y Goller, 2001; Thomas, 2002; Ward et al., 2003), esta disminución en las frecuencias máximas podría compensar el costo asociado a utilizar más energía en trino que es donde aumentan las frecuencias. Considerando que el preludio suele ser la porción de la vocalización que no posee información biológica (Simonetti et al., 1996), el que esta parte de la vocalización sea un poco menos detectable no debe representar una pérdida significativa en la comunicación.
Los datos del presente trabajo constituyen los primeros aportes sobre la estructura de la vocalización de S. flaveola en el área de estudio. Se brinda, además, evidencia de que algunas especies de aves modifican sus vocalizaciones en ambientes acústicamente perturbados de diversas maneras según las capacidades intrínsecas de cada especie. Esta plasticidad en las vocalizaciones aumenta las posibilidades de adaptación y subsistencia en ambientes ruidosos y consecuentemente una mayor eficiencia reproductiva. De no lograrse esta adaptación se generarían efectos negativos sobre la distribución, la densidad y diversidad de las poblaciones de aves, así como en las relaciones predador presa (Barber et al., 2010; Bayne et al., 2008; Francis et al., 2011).
Al Dr. Walter Sione por su colaboración con los índices de vegetación de diferencia normalizada (NDVI). Este proyecto fue financiado por la Universidad Autónoma de Entre Ríos (UADER) (PIDP N° 784/06).