En este estudio se describe la composición y estructura de las comunidades de peces de las bahías Maguey y Cacaluta. La caracterización de la ictiofauna se realizó a través de censos visuales por transectos, los cuales se efectuaron en febrero, abril y julio de 2004. En ambas localidades se censaron 2 874 individuos, pertenecientes a 42 especies. Las familias mejor representadas fueron Pomacentridae y Labridae. Thalassoma lucasanum, Chromis atrilobata, Stegastes acapulcoensis y Microspathodon dorsalis fueron las especies dominantes. La composición, riqueza de especies, abundancia, diversidad y dominancia presentó una marcada diferenciación espacial, lo que permitió distinguir 3 componentes ícticos en cada localidad: el componente arenoso, rocoso y coralino. El componente coralino se caracterizó por registrar la mayor riqueza de especies, abundancia y diversidad, lo cual es resultado de la alta complejidad estructural de los ambientes que lo integraron. El componente arenoso se caracterizó por presentar la mayor dominancia. La mayor abundancia se registró en la época de secas, determinada principalmente por el incremento en la abundancia de C. atrilobata y T. lucasanum. La mayor riqueza de especies y diversidad se presentaron en la época de lluvias, probablemente como resultado de las altas temperaturas y alta producción de los procesos costeros regionales.
This study describes the composition and structure of the fish communities in Maguey and Cacaluta Bays. Ichthyofauna was characterized using transect visual census in February, April and July of 2004. A census was taken in both localities of 2 874 individuals belonging to 42 species. Pomacentridae and Labridae were the families that were most represented. Thalassoma lucasanum, Chromis atrilobata, Stegastes acapulcoensis and Microspathodon dorsalis were the dominant species. Composition, species richness, abundance, diversity and dominance presented notable spatial differentiation, making it possible to distinguish 3 ictic components in each locality: sandy, rocky and coralline. The coralline component registered the greatest species richness, abundance and diversity due to the high structural complexity of its environment. The sandy component presented the greatest dominance. The dry seasons presented the greatest abundance, primarily determined by the increase in the abundance of C. atrilobata and T. lucasanum. The greatest species richness and diversity was present during rainy seasons, likely due to high temperatures and high production associated with regional coastal processes.
Los arrecifes coralinos han sido considerados como uno de los ecosistemas más diversos del planeta, en los cuales se estima que existen de 600 000 a 9 millones de especies (Reaka-Kudla, 1997; Small et al., 1998), entre los que destaca el grupo de los peces como uno de los más diversos, ya que alrededor de 6 000 a 8 000 especies de peces habitan y dependen de estos ecosistemas (Moberg y Rönnbäck, 2003; Mumby et al., 2004).
La alta diversidad de peces en estos sistemas es a menudo explicada bajo el contexto de los numerosos microhábitats y refugios que proporcionan, los cuales son resultado de la complejidad estructural característica de estos ecosistemas (Bell et al., 1991; Sebens, 1991;Friendlander y Parrish, 1998; Bellwood y Wainwright, 2002). La complejidad estructural está conformada por diversos atributos, de entre los que destacan la cobertura coralina y rugosidad. Estos atributos han mostrado influencia directa en la determinación de la abundancia y riqueza de especies de la ictiofauna (Bell y Galzin, 1984; Sano et al., 1987; Beukers y Jones, 1997; Lewis, 1997; Lirman, 1999; Garpe y Öhman, 2003; Nanami et al., 2005; Brokovich et al., 2006).
En el Pacífico mexicano, las principales formaciones coralinas se localizan en las islas Revillagigedo, bahía de Banderas, cabo Pulmo y bahías de Huatulco (Calderón et al., 2009), y se consideran a estas últimas de relevancia en el ámbito nacional por la alta riqueza de especies coralinas (Reyes-Bonilla y Lípez-Pérez, 1998; López-Pérez y Hernández-Ballesteros, 2004) y especies de peces (Tapia-García et al., 2006; López-Pérez et al., 2010). En este contexto, la ictiofauna de la región ha sido poco estudiada, destacando localidades como las bahóas Maguey, Órgano y Violín por no existir información respecto a la estructura de la comunidad.
Las bahías Maguey y Cacaluta se ubican dentro del Parque Nacional Huatulco y forman parte de un área marina prioritaria de acuerdo con la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. Con base en esta designación se favorece la realización de actividades científicas, educativas y de recreo, compatibles con la conservación de los elementos naturales que alberga; sin embargo, esta designación multiusos a menudo incorpora componentes recreacionales y turísticos que representan un riesgo para este parque, lo que se ha manifestado en problemas de la calidad ambiental (Magaña-Melgoza y Vega-González, 1991; Luna-Vargas, 1993), degradación (López-Pérez et al., 2002) y deterioro sobre las comunidades coralinas (Conanp, 2003).
Ante la carencia de información referente a la estructura de la comunidad de peces y su relevancia en la dinámica del ecosistema, se planteó como objetivo principal establecer la estructura de la comunidad de peces con base en la composición de especies, diversidad y abundancia en las bahías Maguey y Cacaluta.
Materiales y métodosLas bahías Maguey y Cacaluta se encuentran integradas en el complejo denominado “Bahías de Huatulco”, el cual se localiza en la costa de Oaxaca entre los paralelos 15°40'48” y 15°45'36” N, 96°14'24” y 96°07'13” O, entre Puerto Ángel y el río Copalita (Conanp, 2003) (Fig. 1). La cobertura coralina del complejo es de aproximadamente de 45.9 hectáreas, está compuesta de 17 arrecifes bordeantes y se reportan 16 especies de corales hermatípicos (Glynn y Leyte-Morales, 1997; López-Pérez y Hernández-Ballesteros, 2004; Tapia-García et al., 2007a). Todas las formaciones coralinas corresponden a la clasificación de arrecifes bordeantes o de franja.
Localización geográfica de las bahías Cacaluta (a) y Maguey (b), y distribución de los puntos de muestreo. Cacaluta: ambiente rocoso (T1), ambiente coralino (T2, T3 y T4) y ambiente arenoso (T5). Maguey: ambiente rocoso (T1), ambiente rocoso-coralino (T2), ambiente coralino (T4) y ambiente coralino-rocoso (T5) y arenoso (T3).
El clima en la región es de tipo cálido subhúmedo con lluvias en verano, y se observan 2 épocas climáticas bien marcadas: la de secas (noviembre-abril) y la de lluvias (mayo-octubre). De octubre a abril se presenta una surgencia eólica en la parte central del golfo de Tehuantepec, lo que determina una variación de la temperatura superficial del agua de mar entre 18 y 25° C, y de mayo a octubre domina la corriente costera de Costa Rica, la cual determina temperaturas superiores a los 24° C (Tapia-García et al., 2007b).
La caracterización de la comunidad de peces se realizó a través de la técnica de censos visuales (Sale, 1980; Brock, 1982; Buckley y Hueckel, 1989), por medio de transectos de una longitud de 10m. La elección de este método fue determinada por su carácter no destructivo, aunado a que proporciona descripciones cualitativas y cuantitativas de la estructura íctica (Ackerman y Bellwood, 2000; Chávez-Comparan y Macías Zamora, 2006). En cada bahía se ubicaron los transectos de acuerdo con los ambientes observados; arenoso, rocoso, coralino y mixtos; ya establecidos se procedió a obtener su ubicación geográfica mediante la utilización de un geoposicionador satelital Garmin modelo e-Trex Legend. Posterior a la colocación del transecto se colocaron 2 buzos, 1 de cada lado del transecto a una distancia de 2.5m entre transecto y buzo, y aproximadamente se consideró un campo de visión de otros 2.5m de distancia del lado opuesto del transecto, cubriendo un total de 100m2, en un tiempo no mayor a 5 minutos. Dos observadores, previamente entrenados, de acuerdo con lo propuesto por Sale y Douglas (1981) y Sale y Sharp (1983), realizaron el registro de las especies presentes, número de individuos por especie y observaciones generales; como tipo de sustrato, profundidad e incidencia del oleaje; con el objetivo de obtener una caracterización general de cada punto de muestreo, la cual fue información base para la denominación de los ambientes muestreados. Los censos se efectuaron en febrero y abril, época de secas, así como en julio, época de lluvias, del 2004. Los transectos en bahía Cacaluta se distribuyeron de la siguiente forma: ambiente rocoso (T1), ambiente coralino (T2, T3 y T4) y ambiente arenoso (T5) (Fig. 1). En Maguey, se distribuyeron en ambiente rocoso (T1), ambiente rocoso-coralino (T2), ambiente coralino (T4), ambiente coralino-rocoso (T5) y arenoso (T3) (Fig. 1). Al finalizar cada censo se repitió nuevamente el recorrido de forma detallada en el transecto para la búsqueda de especies crípticas, y de la misma forma se realizó una paneo con una videocámara Sony modelo TRV950, como respaldo a las observaciones realizadas. Las especies que implicaban algún problema para su identificación fueron fotografiadas con una cámara digital Canon modelo Power Shot G10. Ambos archivos, videos y fotos, constituyen parte de la colección digital de especies del laboratorio de Ictiología y Ecología Costera de la Universidad Autónoma Metropolitana-Unidad Iztapalapa. Las especies censadas fueron identificadas de acuerdo con los trabajos de Allen y Robertson (1994), Amezcua-Linares (1996) y Fischer et al. (1995). Se elaboró un listado sistemático acorde con Nelson (2006).
Para evaluar la eficiencia del muestreo por localidad (N=15), se realizaron curvas de acumulación de especies mediante estimadores no paramétricos (Chao 1, Chao 2, Jacknife 1, Jacknife 2, Bootstrap). Las curvas se construyeron con 10 000 aleatorizaciones mediante el programa EstimateS v8.2 (Colwell, 2006). Los parámetros de riqueza de especies (S), abundancia (N), diversidad (H'n) (Shannon y Wiener, 1963) y dominancia (D') fueron estimados. El análisis espacial y temporal de estos parámetros por localidad, se efectuó mediante análisis de varianza de una vía, con el objeto de detectar diferencias significativas. Si la diferenciación era significativa (p<0.05), se efectuaban pruebas de comparación múltiple (Tukey), con el afán de identificar el origen específico de ésta. En este sentido, si los datos no cumplían con los supuestos de normalidad (prueba de Shapiro-Wilk, p>0.05) y homocedasticidad (prueba de Levene, p>0.05), se efectuó la transformación más adecuada. El análisis de los parámetros entre localidades se realizó mediantepruebas de t, cuando los datos cumplieron el supuesto de normalidad (prueba de Shapiro-Wilk, p>0.05). Si este supuesto no se cumplía, se aplicó la prueba U de Mann-Whitney. Estos análisis se realizaron mediante el paquete estadístico PAST v 2.15 (Hammer et al., 2001).
La evaluación del grado de similitud de la ictiofauna respecto a transectos-meses y localidad, se realizó mediante el índice de Bray-Curtis (Clarke y Warwick, 1994). La representación gráfica de la similitud se efectuó a través de un análisis de clasificación —dendrograma— con el algoritmo de ligamiento promedio no-ponderado —Upgma—. Además del análisis de clasificación, para la comparación de localidades, se realizó una ordenación mediante un escalamiento multidimensional no métrico. La designación de las unidades de muestreo espacio-temporales para estos análisis consistió en abreviaturas, las cuales integraban el número de transecto, primera letra del mes y la primera letra de la localidad; ejemplo: T3AM corresponde al transecto 3 del mes de abril de Maguey. A la par del análisis de los dendogramas generados, se realizaron análisis de similitud —Anosim— para la identificación de diferencias significativas en términos de composición y abundancia íctica entre los transectos, meses y localidades. Todos los análisis multivariados se realizaron mediante el paquete estadístico PRIMER v6 (Clarke y Gorley, 2006).
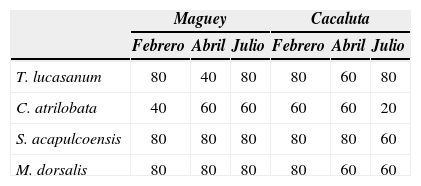
ResultadosEn Maguey se censaron 1 431 individuos, pertenecientes a 35 especies distribuidas en 21 familias, y las familias Pomacentridae y Labridae fueron las mejor representadas en cuanto a número de especies (Cuadro 1). Los estimadores de riqueza empleados, indicaron que la representatividad del muestreo osciló entre 69% y el 87% de las especies esperadas. El valor máximo de riqueza esperada (50 especies) se obtuvo con el estimador no paramétrico Jack 2. Chromis atrilobata, Thalassoma lucasanum, Stegastes acapulcoensis y Microspathodon dorsalis fueron las especies que presentaron la mayor abundancia relativa (Cuadro 2) y la mayor frecuencia de ocurrencia espacio-temporal (Cuadro 3). Espacialmente, se detectaron diferencias significativas en la riqueza de especies (p=0.00021), abundancia (p=0.0044), diversidad (p=0.0099) y dominancia (p=0.0003) (Cuadro 4), siendo el ambiente arenoso (T3) en todos los casos responsable de esta diferenciación (Tukey, p<0.03). Este ambiente se caracterizó por presentar los valores máximos de dominancia (0.8437) y los mínimos respecto a la riqueza de especies (1 especie), abundancia (6 individuos) y diversidad (0.3046 bits/individuo) (Fig. 3). La mayor riqueza de especies (16 especies) y diversidad (2.122 bits/individuo) fueron características del ambiente coralino (T4) (Fig. 3), mientras que la mayor abundancia (256 individuos) se registró en el ambiente coralino-rocoso (T2) (Fig. 3). Temporalmente, estos parámetros no fueron estadísticamente diferentes, sin embargo, se indica que la mayor riqueza de especies (X¯=9 especies) y diversidad (X¯=1.5422) se registrason en julio (Fig. 4), mientras que la mayor abundancia (X¯=139 individuos) y dominancia (X¯=0.3968=0.3968) fue característica de abril (Fig. 4). La clasificación de los transectos indicó una clara diferenciación espacial, la cual fue determinada por la nula similitud de los ambientes arenosos (T3JM, T3FM y T3AM) y rocosos (T1AM y T1JM) en relación con los ambientes restantes, así como entre ellos mismos (Fig. 5a). Respecto a los demás ambientes, 2 asociaciones destacaron por la máxima similitud entre sus elementos. La primera fue integrada por los ambientes coralino-rocoso, coralino y rocoso-coralino (T2, T4 y T5) de julio, así como la asociación de los ambientes coralino-rocoso y rocoso-coralino (T5 y T2) de febrero. Finalmente, el análisis de similitud confirmó que la composición y abundancia de la ictiofauna fue diferente entre transectos (R=0.30, p=0.003), siendo los ambientes arenosos y rocosos responsables de esta diferenciación. Temporalmente, la composición y abundancia de la ictiofauna no fue diferente (R=0.008).
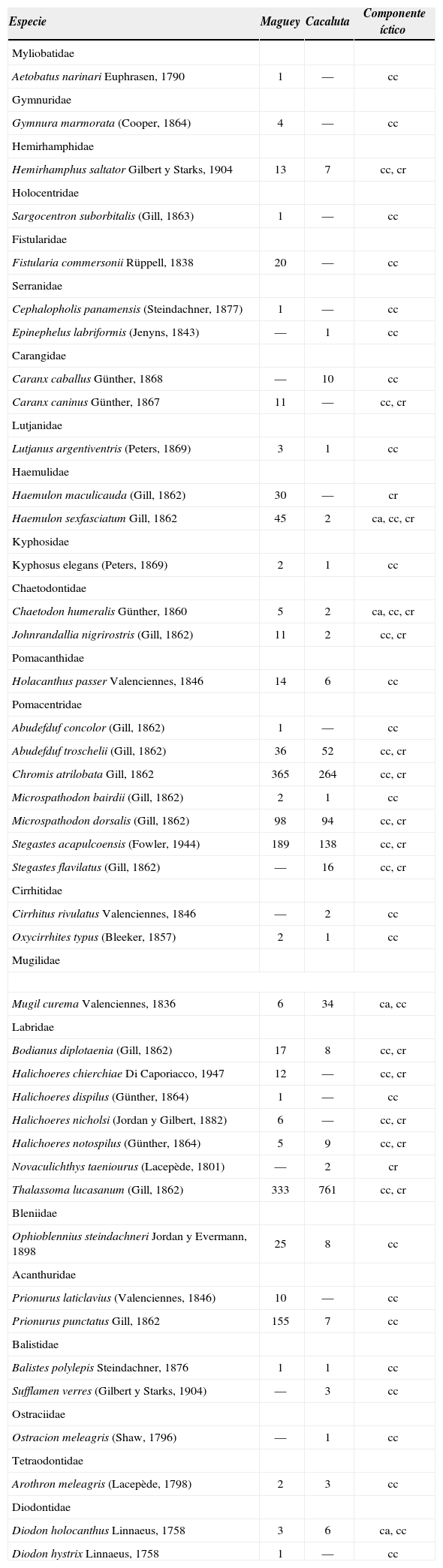
Lista sistemática y abundancia de los peces registrados en las bahías Maguey y Cacaluta —febrero, abril y julio de 2004—.Componente íctico: cc= componente coralino, cr= componente rocoso, ca= componente arenoso
| Especie | Maguey | Cacaluta | Componente íctico |
|---|---|---|---|
| Myliobatidae | |||
| Aetobatus narinari Euphrasen, 1790 | 1 | — | cc |
| Gymnuridae | |||
| Gymnura marmorata (Cooper, 1864) | 4 | — | cc |
| Hemirhamphidae | |||
| Hemirhamphus saltator Gilbert y Starks, 1904 | 13 | 7 | cc, cr |
| Holocentridae | |||
| Sargocentron suborbitalis (Gill, 1863) | 1 | — | cc |
| Fistularidae | |||
| Fistularia commersonii Rüppell, 1838 | 20 | — | cc |
| Serranidae | |||
| Cephalopholis panamensis (Steindachner, 1877) | 1 | — | cc |
| Epinephelus labriformis (Jenyns, 1843) | — | 1 | cc |
| Carangidae | |||
| Caranx caballus Günther, 1868 | — | 10 | cc |
| Caranx caninus Günther, 1867 | 11 | — | cc, cr |
| Lutjanidae | |||
| Lutjanus argentiventris (Peters, 1869) | 3 | 1 | cc |
| Haemulidae | |||
| Haemulon maculicauda (Gill, 1862) | 30 | — | cr |
| Haemulon sexfasciatum Gill, 1862 | 45 | 2 | ca, cc, cr |
| Kyphosidae | |||
| Kyphosus elegans (Peters, 1869) | 2 | 1 | cc |
| Chaetodontidae | |||
| Chaetodon humeralis Günther, 1860 | 5 | 2 | ca, cc, cr |
| Johnrandallia nigrirostris (Gill, 1862) | 11 | 2 | cc, cr |
| Pomacanthidae | |||
| Holacanthus passer Valenciennes, 1846 | 14 | 6 | cc |
| Pomacentridae | |||
| Abudefduf concolor (Gill, 1862) | 1 | — | cc |
| Abudefduf troschelii (Gill, 1862) | 36 | 52 | cc, cr |
| Chromis atrilobata Gill, 1862 | 365 | 264 | cc, cr |
| Microspathodon bairdii (Gill, 1862) | 2 | 1 | cc |
| Microspathodon dorsalis (Gill, 1862) | 98 | 94 | cc, cr |
| Stegastes acapulcoensis (Fowler, 1944) | 189 | 138 | cc, cr |
| Stegastes flavilatus (Gill, 1862) | — | 16 | cc, cr |
| Cirrhitidae | |||
| Cirrhitus rivulatus Valenciennes, 1846 | — | 2 | cc |
| Oxycirrhites typus (Bleeker, 1857) | 2 | 1 | cc |
| Mugilidae | |||
| Mugil curema Valenciennes, 1836 | 6 | 34 | ca, cc |
| Labridae | |||
| Bodianus diplotaenia (Gill, 1862) | 17 | 8 | cc, cr |
| Halichoeres chierchiae Di Caporiacco, 1947 | 12 | — | cc, cr |
| Halichoeres dispilus (Günther, 1864) | 1 | — | cc |
| Halichoeres nicholsi (Jordan y Gilbert, 1882) | 6 | — | cc, cr |
| Halichoeres notospilus (Günther, 1864) | 5 | 9 | cc, cr |
| Novaculichthys taeniourus (Lacepède, 1801) | — | 2 | cr |
| Thalassoma lucasanum (Gill, 1862) | 333 | 761 | cc, cr |
| Bleniidae | |||
| Ophioblennius steindachneri Jordan y Evermann, 1898 | 25 | 8 | cc |
| Acanthuridae | |||
| Prionurus laticlavius (Valenciennes, 1846) | 10 | — | cc |
| Prionurus punctatus Gill, 1862 | 155 | 7 | cc |
| Balistidae | |||
| Balistes polylepis Steindachner, 1876 | 1 | 1 | cc |
| Sufflamen verres (Gilbert y Starks, 1904) | — | 3 | cc |
| Ostraciidae | |||
| Ostracion meleagris (Shaw, 1796) | — | 1 | cc |
| Tetraodontidae | |||
| Arothron meleagris (Lacepède, 1798) | 2 | 3 | cc |
| Diodontidae | |||
| Diodon holocanthus Linnaeus, 1758 | 3 | 6 | ca, cc |
| Diodon hystrix Linnaeus, 1758 | 1 | — | cc |
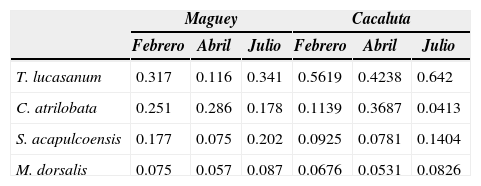
Distribución temporal de la abundancia relativa (%) de las especies dominantes en Maguey y Cacaluta
| Maguey | Cacaluta | |||||
|---|---|---|---|---|---|---|
| Febrero | Abril | Julio | Febrero | Abril | Julio | |
| T. lucasanum | 0.317 | 0.116 | 0.341 | 0.5619 | 0.4238 | 0.642 |
| C. atrilobata | 0.251 | 0.286 | 0.178 | 0.1139 | 0.3687 | 0.0413 |
| S. acapulcoensis | 0.177 | 0.075 | 0.202 | 0.0925 | 0.0781 | 0.1404 |
| M. dorsalis | 0.075 | 0.057 | 0.087 | 0.0676 | 0.0531 | 0.0826 |
Resultados del análisis de varianza para examinar el efecto espacial sobre la riqueza de especies (S), abundancia (N), diversidad (H'n) y dominancia (D') en Maguey y Cacaluta
| Localidad | S | N | H'n | D' |
|---|---|---|---|---|
| Maguey | F(4,10)=28p=0.00021 | F(4,10)=7.56p=0.0044 | F(4,9)=13.5p=0.0099 | F(4,9)=17.25p=0.0003 |
| Cacaluta | F(4,10)=9.11p=0.0022 | F(4,10)=4.153p=0.030 | F(4,9)=11.69p=0.0008 | F(4,9)=7.768p=0.0005 |
En Cacaluta se censaron 1 443 individuos, pertenecientes a 29 especies distribuidas en 18 familias y las familias Pomacentridae y Labridae fueron las mejor representadas en cuanto a número de especies (Cuadro 1). Los estimadores de riqueza empleados indicaron que la representatividad del muestreo osciló entre 65% y el 89% de las especies esperadas. El valor máximo de riqueza esperada (44 especies) se obtuvo con el estimador no paramétrico Jack 2 (Fig. 2b). Thalassoma lucasanum, C. atrilobata, S. acapulcoensis y M. dorsalis fueron las especies que presentaron la mayor abundancia relativa (Cuadro 2), así como la mayor frecuencia de ocurrencia espacio-temporal (Cuadro 3). Espacialmente se detectaron diferencias significativas en la riqueza de especies (p=0.0022), abundancia (p=0.030), diversidad (p=0.0008) y dominancia (p=0.0005) (Cuadro 4), siendo el ambiente arenoso (T5) responsable en todos los casos de esta diferenciación (Tukey, p<0.05). En el ambiente arenoso (T5) se registraron los valores máximos de dominancia (1) y los mínimos en la riqueza de especies (1 especie), abundancia (0 individuos) y diversidad (0.15) (Fig. 3). Los valores máximos de estos últimos fueron característicos del ambiente coralino (T2) (12 especies, 253 individuos y 1.589 bits/individuo) (Fig. 3). Temporalmente, estos parámetros no fueron diferentes estadísticamente, sin embargo, se indica que la mayor riqueza de especies (X¯=7 especies) y diversidad (X¯=1.085) se registraron en julio (Fig. 4); mientras que la mayor abundancia (X¯=139 individuos) se registró en febrero, y la mayor dominancia (X¯=0.589) en abril (Fig. 4). La clasificación de los transectos indicó una clara diferenciación espacial, la cual fue determinada por la nula similitud de los ambientes arenosos (T5AC y T5JC) y rocosos (T1AC, T1FC y T1JC) respecto a ellos mismos, así como con los ambientes coralinos. Respecto a los demás ambientes, la asociación de los ambientes coralinos (T2C y T3C) de abril, así como la asociación de los ambientes coralinos (T3C y T4C) de febrero destacaron por su alta similitud (Fig. 5b). El análisis de similitud confirmó que la variación espacial en la composición y abundancia de la ictiofauna fue significativa (R=0.408, p=0.004), siendo los ambientes arenosos y rocosos responsables de esta diferenciación. Temporalmente, la composición y abundancia de la ictiofauna no fue diferente (R=0.010).
En ambas localidades se censaron 2 874 individuos, pertenecientes a 42 especies distribuidas en 22 familias (Cuadro 1). La diversidad (U=42, p=0.032) y dominancia (U=35, p=0.012) fueron estadísticamente diferentes entre localidades, lo cual fue determinado por la mayor diversidad en Maguey, así como la mayor dominancia en Cacaluta (Figs. 3, 4). La clasificación de los transectos de ambas localidades reiteró la baja similitud de los ambientes arenosos y rocosos de ambas localidades. Respecto a los demás ambientes, el conjunto de grupos conformados presentaron una alta similitud (>50%), destacando que el arreglo de los grupos no reveló un patrón evidente de diferenciación por localidad (Fig. 6a). De las asociaciones de mayor similitud destacaron las integradas por los ambientes coralino-rocosos y rocoso-coralinos (T5JM, T2JM, T2FM y T5FM), así como la del ambiente coralino-rocoso y coralino (T5AM y T4AM) en Maguey (Fig. 6a). En Cacaluta destacó la asociación de los ambientes coralinos (T4JC y T3FC) (Fig. 6a). La ordenación de los ambientes reitera la nula similitud de los ambientes arenosos y rocosos de ambas bahías, contrariamente a la clasificación, este análisis revela un arreglo de los transectos por localidad (Fig. 6b). En este sentido, el análisis de similitud confirmó la existencia de diferencias en la composición y abundancia de la ictiofauna entre localidades (R=0.105 p=0.030).
DiscusiónLa riqueza de especies determinada por localidad en este estudio es menor comparada con la reportada en las bahías La Entrega (51 especies), San Agustín (64) y Cacaluta (58) (Ramos-Santiago, 2004; Ramírez-Gutiérrez et al., 2007; López-Pérez et al., 2008). Estas diferencias son resultado del menor esfuerzo de muestreo en el presente estudio (15 transectos por localidad), comparado con el realizado en Cacaluta (90 transectos), La Entrega (45) y San Agustín (45). Lo anterior fue confirmado con la evaluación del esfuerzo de muestreo, el cual en ambas localidades presentó una representatividad menor al 80%, sugiriendo un porcentaje no satisfactorio frente a la riqueza real de especies (Soberón y Llorente, 1993).
Las familias mejor representadas en ambas localidades fueron Pomacentridae y Labridae con un total de 7 especies y 4 géneros. Este patrón es consistente con el encontrado en otras localidades de bahías de Huatulco (Ramos-Santiago, 2004; Ramírez-Gutiérrez et al., 2007; López-Pérez et al., 2010) y en otras regiones del Pacífico, como en los arrecifes del golfo de California (Pérez-España et al., 1996; Villarreal-Cavazos et al., 2000), Nayarit (Galván-Villa et al., 2010), Jalisco (Galván-Villa et al., 2011), Costa Rica (Espinoza y Salas, 2005) y Panamá (Benfield et al., 2008). Estas familias se encuentran dentro de las 10 dominantes en los arrecifes de los océanos Índico, Pacífico y Atlántico, a lo cual Sale (1991) sugiere que esta dominancia es atribuida a la evolución paralela que han tenido con los corales actuales desde principios del terciario.
Thalassoma lucasanum, C. atrilobata, S. acapulcoensis y M. dorsalis fueron las especies con la mayor abundancia y presencia espacio-temporal, lo cual coincide con el patrón registrado para otras localidades de Huatulco (Ramos-Santiago, 2004; Ramírez-Gutiérrez et al., 2007), revelando el carácter de especies dominantes para esta área. Este patrón es similar con el registrado para otras regiones del Pacífico mexicano (Pérez-España et al., 1996; Villarreal-Cavazos et al., 2000; Álvarez-Filip et al., 2006).
Como resultado de la clara diferenciación espacial en ambas localidades respecto a la composición, estructura, riqueza de especies, abundancia, diversidad y dominancia de la ictiofauna, se diferenciaron 3 componentes ícticos: el componente íctico arenoso, el rocoso y el coralino.
El componente íctico arenoso se caracterizó por presentar la menor riqueza de especies, abundancia, diversidad y la mayor dominancia, lo cual probablemente es resultado de su escasa complejidad estructural determinada por la escasa profundidad (<1.5m), nula heterogeneidad y baja exposición al oleaje. Esta condición limita el número de refugios y recursos, propiciando altas tasas de competencia y depredación (Hixon y Beets, 1993). Aunado a esta condición, se indica que la presencia de turistas en estos ambientes es constante, lo cual propicia cambios en la conducta de los peces. El componente arenoso de Maguey fue representado únicamente por Mugil curema, Chaetodon humeralis y Haemulon sexfaciatum, presentando estas 2 últimas amplias diferencias respecto a su abundancia. En Cacaluta, sólo se registró a Diodon holocanthus en el fondo arenoso.
El componente íctico rocoso se caracterizó por presentar valores intermedios de riqueza de especies, abundancia y diversidad. Las características de los ambientes rocosos en ambas localidades fueron baja exposición al oleaje y moderada heterogeneidad; determinada por conglomerados de roca ígnea y metamórfica de diversos tamaños. En ambas localidades, este componente fue integrado por más de 12 especies, destacando que T. lucasanum, C. atrilobata, S.acapulcoensis y M. dorsalis registraron valores medios de abundancia.
Finalmente, el componente íctico coralino se caracterizó por registrar la mayor riqueza de especies, abundancia y diversidad. Estos ambientes presentaron características comunes como la dominancia del sustrato coralino, alta exposición al oleaje, así como profundidades mayores a 3m. La conjunción de estas características proporciona una mayor complejidad estructural, lo que se refleja en el gran número de especies que integraron el componente íctico en Maguey (30 especies) y Cacaluta (27), indicando que la mayor complejidad estructural sustenta un mayor número de especies (Friedlander y Parrish, 1998; Jones y Syms, 1998; Sano, 2000; Gratwicke y Speight, 2005). Respecto a la cobertura coralina, ésta ha sido considerada como uno de los elementos de mayor relevancia en la determinación de la complejidad estructural (Bell y Galzin, 1984) y, por lo tanto, en la riqueza de especies, abundancia y diversidad (Sano, 2000; Garpe y Ohman, 2003). En este sentido, la cobertura coralina provee abundantes refugios para peces residentes (Munday, 2000; Nanami et al., 2005), reduce la competencia por el gran número de recursos discretos, alimento y microhábitats, que proporciona (Levin et al., 2000; Nanami y Nishihira, 2001), así como disminuye las tasas de depredación (Hixon y Menge, 1991; Hixon y Beets, 1993; Almany, 2004).
Diversos estudios han demostrado que existen variaciones en la riqueza y abundancia de la ictiofauna relacionadas con diferentes grados de exposición al oleaje y profundidad (Galzin, 1987; Williams, 1991; Öhman et al., 1997; Friedlander y Parrish, 1998; Ferreira et al., 2001; Garpe y Öhman, 2003; Russ, 2003; Brokovich et al., 2006). Lo anterior coincide con los resultados del presente estudio respecto a la abundancia, ya que ésta fue mayor en el ambiente coralino y coralino-rocoso (T4 y T5) de Maguey, así como el ambiente coralino (T2) de Cacaluta. La abundancia en estos ambientes fue determinada por T. lucasanum y C. atrilobata. En este contexto, Floeter et al. (2004) y Galván-Villa et al. (2010) indican que la dependencia de C. atrilobata a las características de estos ambientes está determinada por la diversidad y abundancia de sus recursos alimenticios, zooplancton oceánico.
Temporalmente, no se detectaron variaciones significativas en la composición, estructura, abundancia, diversidad y dominancia. Lo anterior es resultado de la escasa variabilidad mensual de la abundancia y riqueza de especies, así como la constante representación de las especies dominantes en los meses analizados (Cuadro 3). Aunado a ésto, en este estudio no se observaron las especies Selar crumenophthamus y Sardinops caeruleus (Ramos-Santiago, 2004; Ramírez-Gutiérrez et al., 2007). Estas especies determinan cambios significativos en la abundancia y presencia de especies residentes, propiciando cambios en los valores de riqueza de especies, abundancia y diversidad (Ramírez-Gutiérrez et al., 2007). La presencia de estas especies se encuentra asociada a aspectos alimentarios, ya que suelen acercarse a la zona costera formando grandes cardúmenes en los meses donde el efecto de los vientos “tehuanos” transporta agua rica en nutrientes (marzo a abril), de esta forma, elevando la producción primaria en estas bahías (Monreal-Gómez y Salas de León, 1998).
Respecto a la variación de la abundancia en los meses analizados, se indica que fue ligeramente mayor en la época de secas —febrero y abril— en ambas localidades. Lo anterior, es diferente con lo registrado por Ramos-Santiago (2004) y Ramírez-Gutiérrez et al. (2007) quienes indican que la mayor abundancia es característica de la época de lluvias. La mayor abundancia para la época de secas está determinada principalmente por el incremento en la abundancia de C. atrilobata y T. lucasanum, lo que se relaciona con la gran producción planctónica típica de esta época (Monreal-Gómez y Salas de León, 1998; Lara-Lara et al., 1998). La mayor abundancia de C. atrilobata en abril coincide con lo registrado por Ramírez-Gutiérrez et al. (2007) en San Agustín, así como en bahía Tenacatitla por Galván-Villa et al. (2011). La mayor riqueza de especies y diversidad se presentaron en la época de lluvias, coincidiendo con Ramos-Santiago (2004) y Ramírez-Gutiérrez et al. (2007). Esto probablemente sea resultado de las altas temperaturas y alta producción de los procesos costeros regionales (Lluch-Cota et al., 1997; Lara-Lara et al., 1998), propiciando incrementos en la disposición de recursos, impulsando a su vez una mayor cantidad de alimento, lo que se refleja en un incremento en el número de especies (Pérez-España et al., 1996). Por otro lado, los valores mínimos de estos parámetros fueron característicos de la época de secas coincidiendo con lo documentado por (Ramírez-Gutiérrez et al., 2007). En este contexto, Ramos-Santiago (2004) menciona un descenso en el número de especies y diversidad para esta época, con una relación positiva entre la riqueza de especies y temperatura.
López-Pérez y Hernández-Ballesteros (2004) mencionan que a pesar de la proximidad entre las localidades de bahías de Huatulco, las comunidades coralinas presentan estructuras significativamente distintas entre sí, las cuales son resultado de la amplia variabilidad en la riqueza de especies y diversidad por localidad. Coincidiendo con lo anterior, un patrón similar de diferenciación respecto a la composición, riqueza de especies y diversidad fue detectado en las localidades de Cacaluta y Maguey, destacando que la ictiofauna de esta última, fue significativamente más rica y diversa. La mayor riqueza de especies y diversidad registradas en Maguey, posiblemente sea resultado de la mayor diversidad de ambientes (rocoso, arenoso, coralino y combinación de éstos). La combinación de sustratos, rocoso y coralino en un mismo ambiente, determina que confluyan especies de peces características de estos sustratos, influyendo de forma directa en el incremento de la riqueza y diversidad de la comunidad de peces (Öhman y Rajasuriya, 1998; Nanami y Nishihira, 2002).
Durante los últimos años se ha observado un deterioro en la calidad ambiental de las bahías de Huatulco relacionado con su gran atractivo para el turismo (Magaña-Melgoza y Vega-González, 1991; Luna-Vargas, 1993), esta situación ha impactado negativamente en las comunidades de arrecifes de coral (Conanp, 2003; López-Pérez y Hernández-Ballesteros, 2004) y muy probablemente en las comunidades de peces que las integran. Ante este hecho es de vital importancia que exista información suficiente sobre el estado ecológico actual de los peces y arrecifes coralinos, que sirva como un punto de referencia ante el impacto de las actividades humanas que sufre en la actualidad y que probablemente se incrementen en un futuro inmediato si no se toman las precauciones necesarias que eviten un deterioro de estos sistemas. Ante este panorama, la información obtenida con esta investigación, representa una base sólida para la posible toma de decisiones que se realizará para el manejo de estos ecosistemas prioritarios de México.
Este trabajo se realizó a través del proyecto de investigación “Diagnóstico ecológico de los sistemas acuáticos de México, como base para su gestión ambiental” del departamento de Hidrobiología de la Universidad Autónoma Metropolitana-Unidad Iztapalapa. A la Universidad Autónoma Metropolitana por darle las facilidades al primer autor para realizar los estudios de doctorado. A las autoridades del Parque Nacional Huatulco, en especial a su directora Arqueól. Silvia Niembro Rocas por el gran apoyo brindado y disposición para la autorización y ejecución del presente estudio. A los revisores que ayudaron con sus comentarios y sugerencia a mejorar significativamente la calidad del escrito.