Se evaluaron las variables ambientales asociadas a la fructificación, fenología, abundancia, frecuencia de hallazgo y productividad relativa de hongos silvestres comestibles terrícolas y lignícolas en bosques de Nothofagus de la región andino-patagónica de Argentina. Las mediciones se efectuaron durante los otoños de 2010, 2011 y 2012. Las especies micorrícicas Cortinarius magellanicus y C. xiphidipus se asociaron a una mayor profundidad del mantillo, en tanto la especie saprófita Lycoperdon sp. lo hizo a valores comparativamente más bajos de profundidad. La totalidad de las especies terrícolas se desarrollaron en sitios de cobertura arbórea alta, superior al 76%. De las especies lignícolas, Aleurodiscus vitellinus y Clitocybula dusenii fructificaron en lugares abiertos, y Fistulina antarctica, F. endoxantha y Grifola gargal bajo cobertura alta. Fistulina antarctica se asoció a un estado de degradación bajo, y C. dusenii a un estado de degradación alto de la madera. Las especies con periodo de fructificación más largo fueron F. antarctica, Ramaria patagonica, C. magellanicus y A. vitellinus, desde mediados de marzo a mediados de abril. Las especies más productivas en términos de peso fresco en las 3 temporadas fueron R. patagonica y F. antarctica. La información aportada es fundamental para establecer pautas de aprovechamiento del recurso en función de su disponibilidad, asegurando su uso sustentable.
We assessed the environmental variables associated with fructification, phenology, abundance, frequency and relative productivity of lignicolous and terrestrial wild edible fungi from Nothofagus forests in the Andean-Patagonia region of Argentina. The study was carried out during autumn 2010, 2011 and 2012. The mycorrhizal species Cortinarius magellanicus and C. xiphidipus were associated with a deep litter layer, whereas the saprophytic Lycoperdon sp. showed lower litter depth values. All the terrestrial species developed under high canopy cover (above 75%). Lignicolous species such as Clitocybula dusenii and Aleurodiscus vitellinus were more frequently observed in open places, whereas Fistulina. antarctica, F. endoxantha and Grifola gargal seem to prefer high canopy cover. Fruiting of F. antarctica was associated with low wood degradation stage, vs. high wood degradation stage in the case of C. dusenii. F. antarctica, Ramaria patagonica, C. magellanicus and A. vitellinus were found to have longer fruiting periods, from mid-March to mid-April. The most productive species in terms of fresh weight were R. patagonica and F. antarctica. The information provided here is critical to establish guidelines for harvesting these species based on their availability, ensuring their sustainable use.
El consumo de hongos silvestres comestibles (HSC) es una práctica que se remonta a los albores de la civilización, y se ha desarrollado y mantenido en países de distintas partes del mundo, destacándose China, Japón, Estados Unidos, España e Italia, entre otros (Wang, 1987; Boa, 2004). En Latinoamérica, México y en menor medida Guatemala y Honduras, poseen un arraigado conocimiento micológico (Ruán-Soto et al., 2004), y la gran riqueza de especies presentes se ha incorporado en múltiples actividades como la cocina, la medicina tradicional y, particularmente en los rituales religiosos (Villarreal y Pérez-Moreno, 1989). Estudios recientes confirman que los hongos son una importante fuente de alimentos e ingresos tanto en países en desarrollo como desarrollados, especialmente, en aquellos con un gran recurso forestal (Hosford et al., 1997; Wong et al., 2001; Boa, 2004). En la región andino-patagónica de Argentina, el consumo y aprovechamiento de HSC se limita actualmente casi en forma exclusiva a especies de Morchella spp. y, en mucho menor escala a Cyttaria darwinii Berk. y C. hariotii E. Fisch. (Deschamps, 2002; Boa, 2004). Otra especie ampliamente utilizada es Suillus luteus (L.) Roussel, asociada a plantaciones de coníferas exóticas (Barroetaveña, 2006; De Michelis y Rajchenberg, 2007). Sin embargo, los bosques nativos, mayormente dominados por Nothofagus spp., albergan numerosas especies de macromicetos (Singer, 1969; Valenzuela-Flores, 1993, 2003), muchos de ellos aún no estudiados y con potencial valor comestible. Algunas de estas especies, como F. antarctica Speg., G. gargal Singer, R. patagonica (Speg.) Corner, han sido ya señaladas como buenas candidatas para consumo humano (Gamundí y Horak, 1993; Barroetaveña y Rajchenberg, 2008), pero se desconocen los aspectos relacionados a su fenología, a las variables ecológicas asociadas a su fructificación, así como su disponibilidad y productividad relativa.
El estudio de la ecología de los HSC, principalmente aquellas especies con alto valor comercial como Cantharellus cibarius Fr., Tricholoma magnivelare (Peck) Redhead y Morchella spp. (Pilz et al., 1998, 1999, 2004), ha permitido generar herramientas y políticas de aprovechamiento sustentable y monitoreo de sus poblaciones (Pilz y Molina, 2002). En este sentido, la fructificación y el desarrollo de los hongos comestibles en ambientes boscosos está condicionada por diversas variables ambientales como la cobertura y la composición de especies arbóreas y del sotobosque, lo cual determina la cantidad de luz que ingresa al interior del bosque, así como la temperatura, el contenido de materia orgánica y la humedad del suelo (Vogt et al., 1992; Bergemann y Largent, 2000; Pilz et al., 2004). El conocimiento de la fenología de estas especies, de las variables ambientales relacionadas con su fructificación y de su abundancia permite determinar su disponibilidad temporal y caracterizar los hábitats donde se distribuyen, información necesaria para evaluar la factibilidad de realizar su aprovechamiento como recurso alimenticio y, eventualmente, sugerir opciones de manejo para incrementar su productividad, en el marco de lo que se ha denominado micosilvicultura (Savoie y Largeteau, 2011).
Por lo antes mencionado, este estudio tuvo como objetivos: a) identificar las variables ambientales asociadas con la fructificación de especies comestibles silvestres seleccionadas de los bosques andino-patagónicos; b) describir su fenología; c) determinar frecuencia y abundancia de sus cuerpos fructíferos y d) estimar su productividad relativa.
Materiales y métodosEspecies estudiadas. Para la descripción de las variables ambientales asociadas a la fructificación de hongos silvestres reportados como comestibles y, potencialmente comestibles con buena abundancia de fructificación (Gamundí y Horak, 1993; Barroetaveña y Rajchenberg, 2008) se seleccionaron 11 especies, que crecen en bosque de Nothofagus spp. sobre tierra o madera: 3 especies terrícolas micorrícicas: Cortinarius magellanicus Speg., C. xiphidipus M. M. Moser y E. Horak y R. patagonica; 3 especies terrícolas saprófitas: Macrolepiota procera (Scop.) Singer, Lepista nuda (Bull.) Cooke y Lycoperdon sp.; y 5 especies lignícolas: A. vitellinus (Lev.) Pat., C. dusenii (Bres.) Singer, F. antarctica, Fistulina endoxantha Speg. y G. gargal. El estudio de la fenología, la determinación de su frecuencia de hallazgo y abundancia, así como la estimación de la productividad relativa se restringió a 7 especies de las 11 mencionadas anteriormente: Aleurodiscus vitellinus, C. dusenii, C. magellanicus, C. xiphidipus, F. antarctica, Lycoperdon sp. y R. patagonica. Sitios de estudio. La recopilación de datos sobre las variables ambientales asociadas a la fructificación de las diferentes especies, se llevó a cabo en 11 rodales de Nothofagus sp., ubicados en un gradiente geográfico desde los 43°20'08” S y 71°45'06” O a los 39°25'28” S y 71°19'00” O, en territorios de las provincias de Chubut, Río Negro y Neuquén en Argentina (Cuadro 1). En todos los casos, se escogieron bosques libres de invasión por coníferas exóticas y sin intervención por ganado. Para la descripción fenológica, la medición de la frecuencia de hallazgo, abundancia y la estimación de la productividad relativa se trabajó en el rodal S1, ubicado en el Parque Nacional Los Alerces, provincia de Chubut (Cuadro 1), que presentaba una alta diversidad de HSC.
Sitios de estudio con indicación de su ubicación geográfica (GPS), la especie arbórea dominante y las especies de hongos comestibles presentes
| Sitio de muestreo | Ubicación geográfica Lat. S; Long. O | Especie arbórea dominante | Especie de hongo comestible |
|---|---|---|---|
| S1. Río Arrayanes (PNLA; Chubut)* | 42°39'49”; 71°41'06” | Nothofagus dombeyi | Av; Cd; Cm; Cx; Fa; Lyc; Rp |
| S2. A ° Colehual (PNLA; Chubut) | 42°30'01”; 71°32'11” | Nothofagus antarctica | Fa; Lyc; Rp |
| S3. Río Rivadavia (PNLA; Chubut) | 42°36'01”; 71°39'16” | Nothofagus dombeyi | Av; Cd; Cm; Cx; Fa; Mp; Lyc; Rp |
| S4. Los Cipreses (Chubut) | 43°13'16”; 71°32'35” | Nothofagus antarctica | Fa; Lyc; Rp |
| S5. Bagilt (Chubut) | 43°20'08”; 71° 45'06” | Nothofagus pumilio | Fa; Lyc; Rp |
| S6. Los Hitos (PNLP; Chubut) | 42°12'10”; 71°51'10” | Nothofagus dombeyi | Av; Cd; Cm; Cx; Fa; Mp; Lyc; Rp |
| S7. Cajón del Azul (Río Negro) | 41°12' 10”; 71°45'11” | Nothofagus dombeyi | Av; Cd; Cm; Cx; Fa; Mp; Lyc; Rp |
| S8. C ° Perito Moreno (Río Negro) | 41°25'12”; 71°60'13” | Nothofagus pumilio | Fa; Lyc; Rp |
| S9. Siete Lagos (PNNH; Neuquén) | 40°38'70”; 71°45'06” | Nothofagus dombeyi | Av; Cd; Cm; Cx; Fa; Lyc; Ln; Rp |
| S10. Lago Queñi (PNL; Neuquén) | 40°08'52”; 71°42'16” | N. obliqua/ N. alpina | Av; Cd; Cm; Cx; Fa; Fe; Gg; Ln; Lyc; Rp |
| S11. Lago Quillén (PNL; Neuquén) | 39°25'28”; 71°19'00” | Nothofagus obliqua | Av; Cd; Cm; Cx; Fa; Fe; Gg; Ln; Lyc; Rp |
PNLA: Parque Nacional Los Alerces; PNNH: Parque Nacional Nahuel Huapi; PNL: Parque Nacional Lanín; Av: Aleurodiscus vitellinus; Cd: Clitocybula dusenii; Cm: Cortinarius magellanicus; Cx: Cortinarius xiphidipus; Fa: Fistulina antarctica; Fe: Fistulina endoxantha; Gg: Grifola gargal; Mp: Macrolepiota procera; Ln: Lepista nuda; Lyc: Lycoperdon sp.; Rp: Ramaria patagonica. S1–S11: indica sitios de muestreo. *Sitio donde se realizó la descripción fenológica, la medición de la frecuencia temporal y abundancia, y la estimación de la productividad relativa.
Caracterización de las variables ambientales asociadas a la fructificación de los HSC. Los muestreos se realizaron durante los otoños de 2010, 2011 y 2012. En recorridos sucesivos se ubicaron parches de fructificación en el suelo y troncos o árboles con fructificaciones de los hongos candidatos. De cada especie se relevaron al menos 16 parcelas en rodales diferentes o distantes al menos 30m entre sí, en temporadas diferentes. Para los hongos de suelo se delimitó una parcela cuadrangular de 0.5m de lado alrededor de cada colección. Se registró el porcentaje de cobertura arbórea (CA) mediante la toma de fotografías hemisféricas desde el centro de la parcela, las que fueron analizadas con el software Gap Light Analyzer GLA version 2.0 (Frazer et al., 1999). Se estimó la cobertura de especies herbáceas (Ch) y de arbustos (Ca), la cobertura de madera en el suelo (Cmd) y la cobertura de mantillo (Cmant), esta última considerada como la capa de desechos orgánicos que yacen sobre la superficie del suelo mineral; en todos los casos se utilizó la escala de Braun-Blanquet (1979). La profundidad del mantillo (Pm) se determinó introduciendo un cuchillo hasta el estrato de suelo mineral y midiendo luego con una cinta métrica (Bergemann y Largent, 2000), y el contenido de humedad del suelo (% H) a 20cm, se determinó usando un sensor de humedad del suelo (TDR Imko GMBH). Se tomó una muestra de suelo a una profundidad de 20cm y en laboratorio se analizó su textura (% arcilla, % arena y % limo) (Bouyoucos, 1927), en cuanto al contenido de materia orgánica (% MO) se obtuvo por el método de ignición de Davies (1974). Para los hongos lignícolas se determinaron la especie forestal sobre la que estaba fructificando, la cobertura arbórea y el estado de degradación de la madera subyacente. Para este último parámetro se establecieron 3 categorías según Greslebin (1998): Estado 1; estado de degradación bajo, madera casi inalterada, corteza casi intacta, la hoja del cuchillo penetra hasta 0.5 cm; Estado 2; estado de degradación medio, madera alterada, corteza alterada, la hoja del cuchillo penetra de 0.5 a 1 cm con facilidad; y Estado 3; estado de degradación alto, madera muy alterada, corteza muy alterada, el cuchillo penetra con facilidad más de 1cm.
Análisis estadístico. Para identificar las variables ambientales asociadas con la fructificación de los HSC, se utilizaron 2 técnicas de análisis multivariado exploratorio: análisis de componentes principales (ACP) para las especies de hongos terrícolas y análisis de correspondencia múltiple (ACM) para las especies lignícolas. En el ACP se realizó una preselección de variables, descartando aquellas que presentaron una contribución menor a la variabilidad total y se incluyó como variable clasificatoria la presencia de especies terrícolas, usando un valor de r del 40%. El análisis ACM incluyó como variables cualitativas al estado de degradación del sustrato, la especie vegetal del sustrato y la cobertura arbórea y como variable clasificatoria a las especies de hongos lignícolas. Se utilizó la matriz de desviaciones Chi cuadrado para evaluar la existencia de asociaciones entre las variables estudiadas y la presencia de especies. En ambos análisis los datos fueron previamente estandarizados. Los análisis estadísticos se realizaron mediante el paquete estadístico InfoStat versión 2011 (Di Rienzo, 2011).
Descripción de la fenología. En cada visita se registró la fecha y la presencia de cada especie a fin de determinar el inicio y la duración del periodo de fructificación de cada una. Se realizó un total de 5 visitas quincenales por año durante 2010, 2011 y 2012, cuyos periodos fueron: quincena 1 (mediados de marzo), quincena 2 (finales de marzo); quincena 3 (mediados de abril), quincena 4 (finales de abril) y quincena 5 (mediados de mayo). En cada temporada, durante las 5 quincenas, se recopiló información de las temperaturas promedio y precipitaciones de estaciones meteorológicas cercanas al sitio de estudio. Se calcularon las temperaturas promedio y las precipitaciones acumuladas por quincena a fin de relacionarla con la fenología.
Frecuencia de hallazgo y abundancia. En cada una de las visitas quincenales anteriormente detalladas, 2 personas recorrieron el rodal durante 3h, registrando el número de veces en que detectaban colecciones de cada una de las especies de HSC. Así, el dato de frecuencia por visita se expresó como el número de colecciones observadas/6 h de recorrido. Para analizar la frecuencia en la temporada, se sumaron las frecuencias quincenales de cada año y se establecieron 3 clases de frecuencia de manera arbitraria, dividiendo en 3 el rango de frecuencias observadas. Así, baja: fructificación entre 1 y 14 veces; intermedia: fructificación entre 15 y 28 veces y alta: fructificación entre 29 y 42 veces. Las colecciones de cada especie, representadas por 1 o más ejemplares creciendo sobre el mismo pie o tronco, en el caso de las especies lignícolas; o bien solitarios, en grupos, formando anillos o en racimos, en el caso de los hongos terrícolas, detectadas en cada visita fueron contabilizadas a fin de obtener un valor de abundancia anual.
Estimación de la productividad relativa. Se estimó en relación con el esfuerzo de búsqueda, adaptando la metodología de Claridge et al. (2000). Para ello, se cronometró el tiempo de búsqueda en cada visita (3h), multiplicado por el número de colectores (2), contabilizando el total de fructificaciones detectadas de cada especie. Para poder convertir el número de ejemplares de cada especie a un dato de peso fresco, se cuantificaron, cosecharon y pesaron 5 colecciones por especie a fin de obtener un valor promedio de la relación peso fresco / Núm. de fructificaciones. Se registró, además, el tamaño aproximado de las fructificaciones a fin de establecer una relación con el peso fresco de cada una de ellas. El dato de productividad se expresó en kg de peso fresco por tiempo de búsqueda de una persona en una temporada.
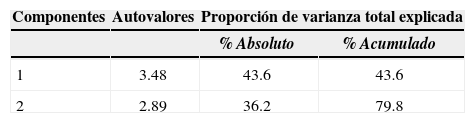
ResultadosVariables ambientales asociadas a la fructificación de los hongos comestibles terrícolas. El ACP permitió asociar la fructificación de algunas especies con variables ambientales asociadas a los 2 primeros componentes, que explicaron el 79.80% de la variabilidad total (Cuadro 2). Cortinarius xiphidipus y Lycoperdon sp. se ubicaron en los extremos del primer componente, asociado positivamente con las variables de contenido de materia orgánica, profundidad de mantillo y cobertura de madera en el suelo, y negativamente con el contenido de humedad (Cuadro 3; Fig. 1). Cortinarius magellanicus y L. nuda se ubicaron en los extremos del segundo componente, asociado positivamente con cobertura arbórea, cobertura arbustiva y cobertura herbácea, y negativamente con cobertura de mantillo (Cuadro 3; Fig. 1). En tanto M. procera y R. patagonica no presentaron correlación con ninguna de las variables consideradas (Fig. 1). Las variables edáficas % arcilla, % limo, % arena no fueron incluidas en el ACP, debido a que todas las muestras de suelo correspondieron a la misma clase textural franco arenosa (Irisarri et al., 2007), por lo que no actuarían como condicionantes de la fructificación para las especies bajo estudio.
Autovalores y proporción de la varianza explicada para los 2 primeros componentes del análisis de componentes principales de las variables ambientales asociadas a la fructificación de especies de hongos comestibles terrícolas
| Componentes | Autovalores | Proporción de varianza total explicada | |
|---|---|---|---|
| % Absoluto | % Acumulado | ||
| 1 | 3.48 | 43.6 | 43.6 |
| 2 | 2.89 | 36.2 | 79.8 |
Autovectores del análisis de componentes principales de las variables ambientales asociadas a la fructificación de especies de hongos comestibles terrícolas
| Componentes | ||
|---|---|---|
| 1 | 2 | |
| % MO | 0.524 | −0.109 |
| % H | −0.420 | 0.173 |
| CA | 0.284 | 0.393 |
| Ca | −0.111 | 0.473 |
| Ch | −0.017 | 0.569 |
| Cmant | 0.105 | −0.467 |
| Cmd | 0.457 | 0.130 |
| Pm | 0.486 | 0.145 |
% MO: porcentaje de materia orgánica; % H: porcentaje de humedad en el suelo; CA: cobertura arbórea; Ca: cobertura arbustiva; Ch: cobertura herbácea; Cmant: cobertura de mantillo; Cmd: cobertura de madera en el suelo; Pm: profundidad del mantillo. Se muestran en gris los autovectores altamente correlacionados con las componentes 1 y 2.
Proyección del ACP para las 2 primeras componentes. Cm: Cortinarius magellanicus; Cx: Cortinarius xiphidipus; Ln: Lepista nuda; Lsp: Lycoperdon sp.; Mp: Macrolepiota procera; Rp: Ramaria patagonica; CA: cobertura arbórea; Ca: cobertura arbustiva; Ch: cobertura herbácea; Cmd: cobertura de madera en el suelo; Cmant: cobertura de mantillo; % H: porcentaje de humedad en el suelo; % MO: porcentaje de materia orgánica; Pm: profundidad del mantillo.
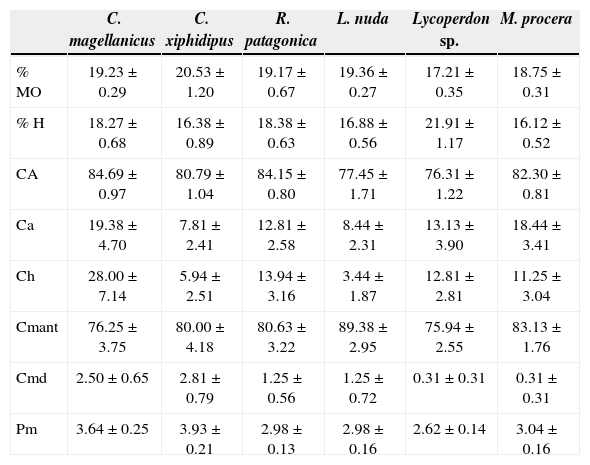
Los suelos asociados a las especies saprófitas y micorrícicas registraron valores elevados de materia orgánica (Cuadro 4). Sin embargo, el análisis por componentes principales señala a las especies C. xiphidipus y Lycoperdon sp. como las más influenciadas por este factor (Fig. 1).
Valores medios de las variables ambientales asociadas a cada una de las especies de hongos comestibles terrícolas (n=16)
| C. magellanicus | C. xiphidipus | R. patagonica | L. nuda | Lycoperdon sp. | M. procera | |
|---|---|---|---|---|---|---|
| % MO | 19.23±0.29 | 20.53±1.20 | 19.17±0.67 | 19.36±0.27 | 17.21±0.35 | 18.75±0.31 |
| % H | 18.27±0.68 | 16.38±0.89 | 18.38±0.63 | 16.88±0.56 | 21.91±1.17 | 16.12±0.52 |
| CA | 84.69±0.97 | 80.79±1.04 | 84.15±0.80 | 77.45±1.71 | 76.31±1.22 | 82.30±0.81 |
| Ca | 19.38±4.70 | 7.81±2.41 | 12.81±2.58 | 8.44±2.31 | 13.13±3.90 | 18.44±3.41 |
| Ch | 28.00±7.14 | 5.94±2.51 | 13.94±3.16 | 3.44±1.87 | 12.81±2.81 | 11.25±3.04 |
| Cmant | 76.25±3.75 | 80.00±4.18 | 80.63±3.22 | 89.38±2.95 | 75.94±2.55 | 83.13±1.76 |
| Cmd | 2.50±0.65 | 2.81±0.79 | 1.25±0.56 | 1.25±0.72 | 0.31±0.31 | 0.31±0.31 |
| Pm | 3.64±0.25 | 3.93±0.21 | 2.98±0.13 | 2.98±0.16 | 2.62±0.14 | 3.04±0.16 |
% MO: porcentaje de materia orgánica; % H: porcentaje de humedad en el suelo; CA: cobertura arbórea; Ca: cobertura arbustiva; Ch: cobertura herbácea; Cmant: cobertura de mantillo; Cmd: cobertura de madera en el suelo; Pm: profundidad del mantillo.
Las especies micorrícicas C. magellanicus y C. xiphidipus fueron detectadas en sitios con una profundidad del mantillo elevada (Cuadro 4) y asociadas positivamente con la presencia de madera en el suelo (Fig. 1). En tanto la especie saprófita Lycoperdon sp. se correlacionó negativamente con profundidad del mantillo (Fig. 1).
En cuanto a la cobertura arbórea tanto las especies micorrícicas como saprófitas consideradas en este trabajo presentaron valores elevados de cobertura, por encima del 76% (Cuadro 4). Por otro lado, los valores de humedad del suelo registrados tanto para las especies saprófitas como para las micorrícicas estuvieron en un rango de 12.1–27.5%, mostrando una baja variabilidad entre las especies.
La cobertura de plantas herbáceas resultó baja, con un máximo del 28%, para 5 de las 6 especies de hongos terrícolas, a excepción de C. magellanicus, la cual aparece asociada a alta cobertura de herbáceas (Cuadro 4; Fig. 1), principalmente constituida por helechos.
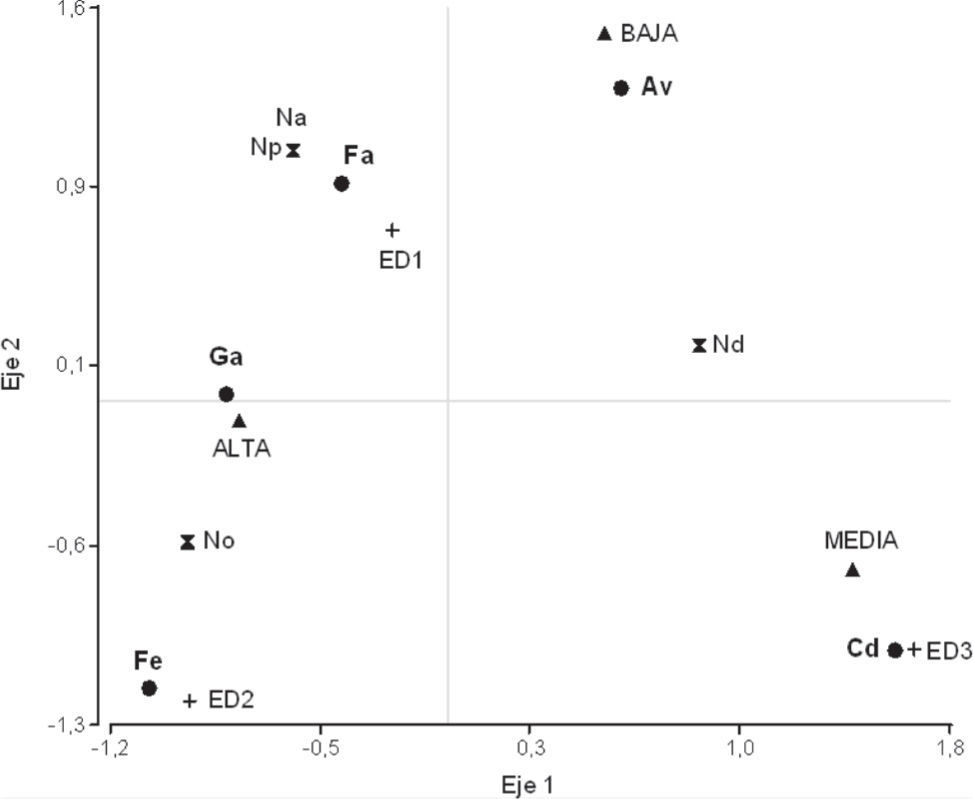
Variables ambientales asociadas a la fructificación de los hongos comestibles lignícolas. El ACM, con una inercia total acumulada del 53.09%, permitió establecer diferentes asociaciones entre las variables ambientales y la presencia de las especies lignícolas. El primer eje, con una inercia del 30.64%, mostró una clara asociación entre las variables cobertura alta y la especie arbórea Nothofagus obliqua (Mirb.) Oerst. con G. gargal (Fig. 2). El segundo eje con una inercia del 22.45%, asoció a la especie F. antarctica con las especies arbóreas N. pumilio (Poepp. y Endl.) Krasser y N. antarctica (G. Forst.) Oerst. y estado de degradación 1, y a A. vitellinus con una cobertura arbórea baja (Fig. 2). En tanto las especies C. dusenii y F. endoxantha, se asociaron a una cobertura media y un estado de degradación 3 en el primer caso, y a un estado de degradación 2 y a la especie arbórea N. obliqua en el segundo (Fig. 2).
Proyección del ACM para los 2 primeros ejes. Av: Aleurodiscus vitellinus; Cd: Clitocybula dusenii; Fa: Fistulina antarctica; Fe. Fistulina endoxantha; Gg: Grifola gargal. ALTA: cobertura arbórea alta; BAJA: cobertura arbórea baja; MEDIA: cobertura arbórea media; Na: Nothofagus antarctica; Nd: Nothofagus dombeyi; No: Nothofagus obliqua; Np: Nothofagus pumilio; ED1: estado de degradación 1; ED2: estado de degradación 2; ED3: estado de degradación 3.
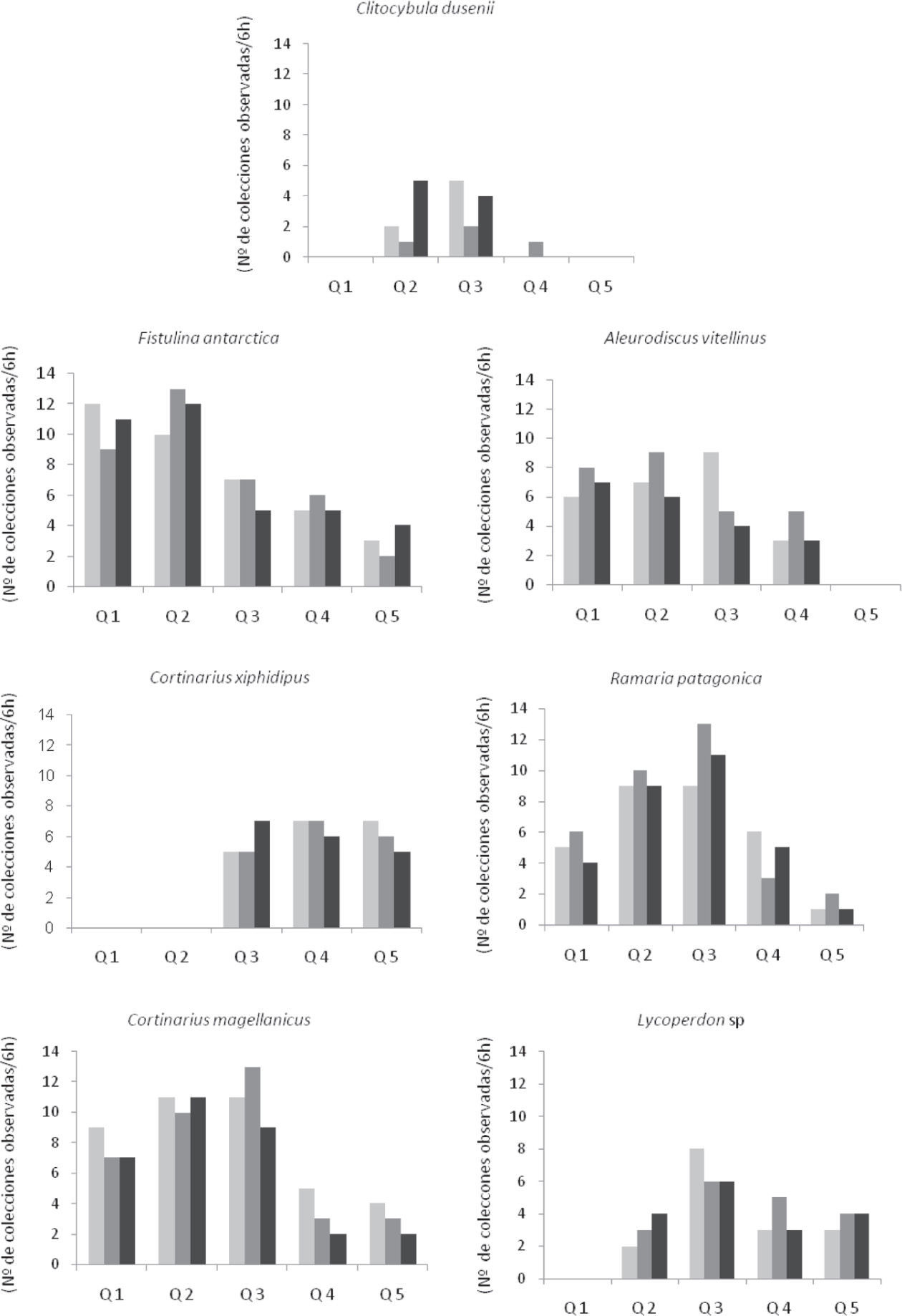
Fenología. De las 7 especies estudiadas, las de mayor periodo de fructificación fueron C. magellanicus, F. antarctica y R. patagonica seguidas por A. vitellinus. Más tardíamente fructificaron Lycoperdon sp., C. dusenii y C. xiphidipus. Los patrones temporales de fructificación detallados por especie se presentan en la figura 3.
Los datos sobre las precipitaciones recopilados en las 3 temporadas, indican que en los años 2010 y 2012 ocurrió la mayor cantidad de lluvias (193.2mm y 134.4mm acumulados, respectivamente). Las quincenas más lluviosas fueron variables en los 3 años, destacando la 2 (finales de marzo) en 2010, la 4 (finales de abril) en 2011 y la 3 (mediados de abril) en 2012 (Fig. 4).
Precipitación acumulada por quincena (barras) y temperatura promedio (líneas) para 3 temporadas de muestreo en los años 2010, 2011 y 2012. Quincena 1: mediados de marzo; quincena 2: finales de marzo; quincena 3: mediados de abril; quincena 4: finales de abril; quincena 5: mediados de mayo.
Los valores de temperatura registrados para las 5 quincenas fueron variables durante las 3 temporadas de muestreo, oscilando entre 8 y 15°C en 2010, entre 6 y 14°C en 2011 y entre 7 y 14°C en 2012 (Fig. 4).
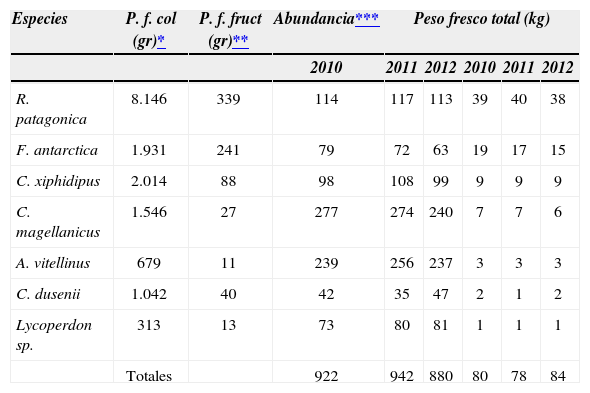
Frecuencia de hallazgo y abundancia. A lo largo de las quincenas la especie más frecuente en el inicio de la temporada fue F. antarctica, seguida por C. magellanicus y A. vitellinus. A finales de marzo las especies más frecuentes fueron F. antarctica, C. magellanicus, R. patagonica y A. vitellinus. Las especies micorrícicas C. magellanicus y R. patagonica fueron las más frecuentes a mediados de abril, en tanto que C. xiphidipus fructificó con mayor frecuencia entre finales de abril y mediados de mayo (Fig. 3). Al considerar la frecuencia de fructificación por temporada, las especies con frecuencia alta fueron F. antarctica, C.magellanicus y R. patagonica, detectándose entre 30 y 40 veces. En tanto las especies de frecuencias intermedias durante las 3 temporadas fueron A. vitellinus, C. xiphidipus y Lycoperdon sp. detectadas entre 16 y 27 veces. Por último, entre las especies raras o de baja frecuencia figuró C. dusenii en los 3 años, observada entre 4 y 7 veces. Sin embargo, los datos sobre frecuencia de hallazgo por temporada no siguieron el mismo patrón de abundancia para las especies en estudio. En orden decreciente las especies más abundantes fueron C. magellanicus, A. vitellinus, R. patagonica, C. xiphidipus, Lycoperdon sp., F. antarctica y C. dusenii en las 3 temporadas (Cuadro 5).
Productividad relativa de 7 especies de hongos comestibles silvestres durante 3 años de muestreo
| Especies | P. f. col (gr)* | P. f. fruct (gr)** | Abundancia*** | Peso fresco total (kg) | ||||
|---|---|---|---|---|---|---|---|---|
| 2010 | 2011 | 2012 | 2010 | 2011 | 2012 | |||
| R. patagonica | 8.146 | 339 | 114 | 117 | 113 | 39 | 40 | 38 |
| F. antarctica | 1.931 | 241 | 79 | 72 | 63 | 19 | 17 | 15 |
| C. xiphidipus | 2.014 | 88 | 98 | 108 | 99 | 9 | 9 | 9 |
| C. magellanicus | 1.546 | 27 | 277 | 274 | 240 | 7 | 7 | 6 |
| A. vitellinus | 679 | 11 | 239 | 256 | 237 | 3 | 3 | 3 |
| C. dusenii | 1.042 | 40 | 42 | 35 | 47 | 2 | 1 | 2 |
| Lycoperdon sp. | 313 | 13 | 73 | 80 | 81 | 1 | 1 | 1 |
| Totales | 922 | 942 | 880 | 80 | 78 | 84 | ||
P.f: peso fresco en gramos estimado para el total de colecciones detectadas durante 5 quincenas, con un tiempo de búsqueda de 6h por visita.
Estimación de la productividad relativa. La producción relativa de biomasa total en relación con el mismo tiempo de búsqueda fue variable en las diferentes temporadas de recolección, siendo de 80kg para el año 2010, alcanzando 78kg en 2011 y disminuyendo a 74kg en 2012. La productividad relativa de biomasa por especie durante los 3 años se presenta en el Cuadro 2. Al analizar la productividad promedio de 3 años de biomasa de cada especie, R. patagonica representó un 50% de la productividad total, seguida en abundancia por F. antarctica (22%), C. xiphidipus (12%) y C. magellanicus (9%) (Fig. 5).
DiscusiónEl estudio de las variables ambientales permitió establecer asociaciones estrechas entre dichas variables y la presencia de las especies de hongos comestibles tanto terrícolas como lignícolas. La profundidad del mantillo resultó ser una variable asociada, principalmente a la fructificación de las especies micorrícicas C. magellanicus y C. xiphidipus, que presentaron los mayores valores (Cuadro 4), lo cual coincide con lo documentado por Bergemann y Largent (2000) para la especie micorrícica Cantharellus formosus Corner, con valores que no superaban los 5cm. La calidad y la cantidad de mantillo en el suelo es un factor importante para la formación de micorrizas en el bosque, aunque muchos grupos de hongos micorrícicos no fructifican donde hay grandes cantidades debido a una inadecuada aireación del suelo (Bergemann y Largent, 2000). Sin embargo, en el caso de C. xiphidipus, todas las especies de esta sección (estirpe Xiphidipus; Moser y Horak, 1975) se caracterizan por un estípite largo, radicante, lo cual probablemente constituya una adaptación a la presencia de capas de hojarasca o de cenizas volcánicas profundas, frecuentes en los bosques andino-patagónicos. Por otra parte, la especie saprófita Lycoperdon sp. se correlacionó negativamente con esta variable, fructificando en sitios con una profundidad de mantillo baja, en contraposición con lo planteado por Vogt et al. (1992), que afirman que las especies saprófitas se desarrollan sobre grandes cantidades de desechos orgánicos.
Si bien se registraron, en general, valores elevados de materia orgánica en los suelos asociados a todas las especies (Cuadro 4), coincidiendo con lo registrado para suelos del sector oeste de la región andino-patagónica (La Manna et al., 2012), la especie micorrícica C. xiphidipus se asoció a valores comparativamente más altos de este factor, en tanto Lycoperdon sp. lo hizo a valores más bajos (Fig. 1; Cuadro 4). El contenido de materia orgánica favorece la capacidad de retención de agua y la disponibilidad de nutrientes, al mismo tiempo que influye sobre la formación de micorrizas (Bergemann y Largent, 2000). La presencia de madera en el suelo también se asoció positivamente con las especies micorrícicas C. magellanicus y C. xiphidipus. La madera caída alberga gran cantidad de raíces micorrizadas (Harvey et al., 1996) y constituye un reservorio de humedad en el suelo que favorece la fructificación (Luoma et al., 2004). Los resultados de la mediciones de la humedad del suelo sustentan lo antes planteado para C. xiphidipus, ligado a la presencia de madera en el suelo y asociado a valores más bajos de contenido de humedad (12.1–24.3%). Lycoperdon sp., asociado a sitios con menor profundidad de mantillo y contenido de materia orgánica, lo hizo a valores más altos (14.50–27.50%). El rango de variabilidad de este parámetro entre especies fue estrecho, indicando una íntima vinculación con la fructificación de los HSC, como se ha registrado para otros bosques (Vogt et al., 1992).
La totalidad de las especies terrícolas se desarrollaron en sitios con cobertura arbórea alta, superior al 76%, en coincidencia con la presencia de fructificaciones asociadas, generalmente a sitios cerrados y húmedos, documentada por Gamundí y Horak (1993). Estos resultados coinciden parcialmente con los de Santos-Silva et al. (2011) quienes encontraron una fuerte asociación entre las especies micorrícicas y la alta cobertura arbórea, menor para especies saprófitas, aunque aclarando que este último resultado pudo estar condicionado por la alta proporción de especies lignícolas y gasteroides, estas últimas no incluidas en nuestro estudio. La cobertura de plantas herbáceas, sin embargo, resultó en general, baja, con un máximo del 30% para 5 de las 6 especies de hongos terrícolas, en comparación con lo documentado por Barroetaveña et al. (2008) para parches de fructificación de S. luteus en plantaciones de pino, que presentaron valores de 60%.
En relación con las especies R. patagonica y M. procera se sugiere la realización de estudios sobre variables ambientales diferentes a las evaluadas aquí, debido a que las relevadas en este estudio no se asociaron claramente con su fructificación.
La cantidad de lluvias recibidas y las temperaturas medias en cada una de las 5 quincenas a lo largo de los 3 años de muestreo, se relacionaron en algunos casos de manera directa con la abundancia de fructificaciones terrícolas. La especie R. patagonica produjo 52 fructificaciones en la quincena 3 de la temporada 2012, cuando los valores de precipitación acumulada quincenal fueron más altos y las temperaturas oscilaron entre 9.5 y 12.5°C (Fig. 4). En tanto que para C. magellanicus y Lycoperdon sp., se registró el mayor número de fructificaciones (93 y 29, respectivamente) en la quincena 3 del año 2010, a valores bajos de precipitación y a una temperatura inferior a los 10°C (Fig. 1). En particular, C. xiphidipus fue abundante durante la última quincena del año 2011, cuando se registró el menor valor de precipitación quincenal y la temperatura no superó los 7°C (Fig. 4). La presencia de un estípite largo le permite a esta especie explorar el suelo a una mayor profundidad, donde la humedad se conserva por más tiempo, lo cual puede explicar su mayor abundancia en periodos de baja precipitación. Las especies lignícolas A. vitellinus y F. antarctica fueron más abundantes en las primeras 2 quincenas, aunque las precipitaciones variaron de un año a otro (Fig. 4), mientras que C. dusenii fue más abundante en la quincena 3, también con niveles variables de precipitación (Fig. 4). Este comportamiento irregular de la fructificación de las especies lignícolas en relación con las precipitaciones puede deberse a que reciben la humedad desde el tronco o la rama en descomposición, la cual funciona como reservorio de agua, mientras que las terrícolas dependen mucho más de las precipitaciones puntuales para su fructificación. Estos resultados pueden estar condicionados por los valores de precipitación y las temperaturas del verano previo, tal como documentaron Agerer (1985) y Straatsma et al. (2001).
Integrando la información surgida del análisis ACM y otras características observadas en los sitios de estudio con trabajos anteriores, se observó que F. antarctica se desarrolló sobre troncos vivos de varias especies de Nothofagus (N. pumilio, N. dombeyi y N. antarctica) produciendo pudrición castaña en la madera, tal como documentaron Gamundí y Horak (1993) y Rajchenberg y Greslebin (1995), asociada a una cobertura arbórea alta (80.23–87.56%) y a un estado de degradación bajo (Fig. 2). Además, F. endoxantha descrita como de baja abundancia, creciendo sobre troncos vivos de N. alpina y N. obliqua provocando pudriciones castañas (Rajchenberg y Greslebin, 1995), se encontró asociada, principalmente, a N. obliqua con un estado de degradación medio (Fig. 2). Aleurodiscus vitellinus se registró, principalmente, creciendo bajo una cobertura arbórea baja (63.89–67.85%) (Fig. 2), sobre troncos y ramas de árboles muertos de N. dombeyi, aunque ha sido registrado asociado a ramas de N. dombeyi, N. betuloides y N. pumilio, sobre madera viva y muerta y sobre corteza (Gamundí y Horak, 1993; Greslebin, 1998). Grifola gargal, asociada a cobertura arbórea alta (82.56–86.89%), apareció en forma restringida sobre ramas y fustes de árboles en pie o caídos de N. obliqua (Fig. 2), ocasionándoles una pudrición blanca alveolar en el duramen, tal como documentan Pozzi et al. (2009). Clitocybula dusenii apareció asociada, principalmente, a N. dombeyi, aunque también se la cita para N. pumilio (Gamundí y Horak, 1993), fructificando sobre troncos caídos muy degradados y bajo valores medios de cobertura arbórea (72.87–76.43%).
Los resultados obtenidos en este trabajo ponen de manifiesto la importancia del abordaje de múltiples aspectos asociados a la fructificación y a las características de los HSC. Para algunas especies se observó que no existía relación entre el número de fructificaciones y su productividad (Cuadro 5). En particular, A. vitellinus, que registró un alto número de colectas, posee fructificaciones pequeñas y su peso fresco aproximado no superó los 3kg por temporada, mientras que R. patagonica y F. antarctica cobran importancia por el tamaño y peso fresco de sus fructificaciones, a pesar de presentar un menor número de recolectas (Cuadro 5). Analizando la fenología de las diferentes especies estudiadas, el momento de cosecha recomendado es variable según las especies, desde mediados de marzo hasta mediados de mayo para F. antarctica, R. patagonica, C. magellanicus y A. vitellinus, desde finales de marzo hasta finales de abril para Lycoperdon sp. y C. xiphidipus, en tanto que para C. dusenii, que aparece en un corto periodo, sería desde finales de marzo hasta mediados de abril.
La detección de rangos de valores estrechos para determinadas variables ambientales asociadas a la fructificación de las especies de HSC estudiadas, como la presencia de madera en el suelo, el porcentaje de materia orgánica, la profundidad y cobertura del mantillo, y la cobertura arbórea, sugieren que la fructificación de estas especies se vería afectada por cambios no necesariamente drásticos de estos parámetros. En tal sentido, las diferentes intervenciones que se realizan en los bosques andinopatagónicos, como la extracción de leña, el aprovechamiento forestal o el pastaje de ganado vacuno generan impactos en estos ambientes, que afectarían la productividad de los HSC, tal como se ha registrado para bosques del noroeste de Estados Unidos bajo manejo silvícola (Colgan et al., 1999; Luoma et al., 2004). Por ello, son necesarios futuros estudios tendientes a dilucidar la presencia de las especies de HSC en bosques intervenidos, que sirvan de insumo básico para planificar armoniosamente sus diferentes usos, y establecer medidas que contribuyan a la conservación de las especies fúngicas perjudicadas. Las intervenciones en los ambientes donde crecen estas especies y el potencial aprovechamiento de las mismas en actividades económicas novedosas para la región, como son la micogastronomía y el micoturismo, requerirán de un conocimiento acabado de su biología, a fin de establecer pautas de aprovechamiento en función de su disponibilidad, asegurando un uso sustentable del recurso.