La quitridiomicosis es una enfermedad causada por el hongo patógeno Batrachochytrium dendrobatidis (Bd), el cual afecta la piel de los anfibios y puede ABSprovocar la muerte. El declive de las poblaciones de anfibios como resultado del efecto de este patógeno se presentó simultáneamente en varias partes del mundo a partir de la década de 1980. En México se identificó una oleada epidémica por Bd en la década de 1970, la cual concuerda con el declive de poblaciones de salamandras (caudados) en el sur del país. Nuestro trabajo presenta una revisión sobre el estado actual del conocimiento de la quitridiomicosis como uno de los factores causales del declive de las poblaciones de anfibios a nivel mundial y se analiza la información recabada al momento sobre la presencia de este patógeno en México. A la fecha, se ha registrado la infección en 50 especies de anfibios que se distribuyen, principalmente en las regiones montañosas del centro y sur del país, y se ha determinado que las familias Hylidae y Plethodontidae son las más afectadas. Diversos autores han propuesto que el cambio climático global ha jugado un papel fundamental en la presencia y virulencia del género Batrachochytrium, ya que el incremento de temperatura induce un desequilibrio en la relación patógeno-hospedero provocando mayor virulencia de Bd y/o mayor susceptibilidad a la infección en los anfibios. Sobre este tema, analizamos las temperaturas registradas de 1964 a 1989 en las zonas donde el declive de caudados fue más drástico. No se encontró una asociación clara entre el declive de salamandras con la temperatura. Por otro lado, se determinó que al igual que otros países, el comercio internacional, la introducción y desplazamiento de la “rana toro” Lithobates catesbeiana son importantes para la dispersión del patógeno.
Chytridiomycosis is a disease caused by the fungal pathogen Batrachochytrium dendrobatidis (Bd), which affects the skin of amphibians and may cause deathABS. The decline of amphibian populations as a result of the effect of this pathogen occurred simultaneously in various parts of the world from the early 1980's. In Mexico the epidemic wave of Bd was identified in the 1970's, which is consistent with the decline of salamander (caudate) populations in the southern part of the country. Our work presents a review of the state of knowledge of chytridiomycosis as a factor in the decline of amphibian populations worldwide and the information gathered until now of the presence of this pathogen in Mexico. To date, there has been infection in 50 Mexican amphibian species that are mainly distributed in the mountainous regions of central and southern Mexico, and was determined that the families Hylidae and Plethodontidae are the most affected. Several authors have suggested that global climate change has played a key role in the occurrence and virulence of Batrachochytrium because the temperature increase induces an imbalance in the pathogen-host relationship to increased virulence of Bd and/or increased susceptibility to infection in amphibians. On this matter, we analyzed the reported temperatures of 1964-1989 in areas where the decline of caudates was more drastic. We found no relationship between the decline of salamanders with temperature. However, the international trade, the introduction and displacement of the “bullfrog” Lithobates catesbeiana are important factors for the spread of the pathogen.
En la década de 1980 herpetólogos de diversos países registraron disminuciones drásticas de poblaciones de anfibios, en lugares donde los efectos antropogénicos comunes como la destrucción del hábitat, la contaminación, sobreexplotación y la introducción de especies introducidas no eran evidentes (Crump, Hensley y Clark, 1992; Berger, Speare y Hyatt, 1999; Bosch, 2003; Pounds, Fogden, Savage y Gorman, 1997; Stuart et al., 2004; Young, Stuart, Chanson, Cox y Boucher, 2004). Los casos más conocidos de este declive sucedieron en Costa Rica y Australia (Berger et al., 1998; Crump et al., 1992), en donde en una temporada reproductiva se encontraron miles de individuos muertos (Bufo periglenes y Reobatrachus silus, respectivamente) (Berger et al., 1998; Crump et al., 1992; Pounds et al., 1997), y al año siguiente estas especies estaban prácticamente extintas (Berger et al., 1998; Crump et al., 1992; Pounds et al., 1997).
En un inicio, los científicos argumentaron que uno de los efectos del cambio climático era el incremento de la temperatura en los hábitats donde viven los anfibios (Pounds y Crump, 1994) y que el gran declive de anfibios pudo ser ocasionado por condiciones climáticas inusuales. Heyer, Rand, Da Cruz y Peixoto (1988) sugirieron que la extinción del anuro Fritziana ohausi en el sureste de Brasil en 1979 y la drástica disminución en las poblaciones de los anuros Centrolenella eurygnatha, Ololygon perpusilla, Adenomera marmorata, Eleutherodactylus guentheri, E. parvus e Hylodes phyllodes estaban asociados a una inusual helada en ese año. Hacia finales de siglo, se propuso que el declive podría explicarse por una enfermedad infecciosa (Crump et al., 1992; Laurance, McDonald y Speare, 1996). En 1999, Longcore, Pessier y Nichols encontraron zoosporangios característicos de hongos de la clase Chytridiomicota en la piel de individuos muertos de las especies Dendrobates azureus y Litoria caerulea, originarios de Centroamérica y Australia, pero viviendo en cautiverio en Estados Unidos. Los autores describieron al patógeno y lo llamaron Batrachochytrium dendrobatidis (Bd). Una vez identificado, se realizaron búsquedas exhaustivas en varias especies de anfibios y su presencia fue registrada en poblaciones de Australia, África, Norteamérica, Centroamérica y el Caribe (Burrowes, Joglar y Green, 2004; Hero y Shoo, 2003; Lips, 1999; Lips, Green y Papendick, 2003; Muths, Corn, Pessier y Green, 2003; Young et al., 2001).
Hoy en día, se ha registrado el patógeno prácticamente en todo el mundo (Fisher, Garner y Walker, 2009; Olson et al., 2013), desde los desiertos costeros hasta los bosques de alta montaña (Bradley, Rosen, Sredl, Jones y Longcore, 2002; Luja, Rodríguez-Estrella, Ratzlaff, Parra-Olea y Ramírez-Bautista, 2012; Ron, 2005). Sin embargo, dados los requerimientos térmicos del patógeno, los registros más comunes de infección se presentan en localidades montañosas en altitudes entre 1,000 y 3,500 m snm, las cuales a su vez, son zonas de alto endemismo y diversidad de anfibios (Berger et al., 2004; Ron, 2005; Young et al., 2004). Hasta el momento se ha registrado la infección en más de 516 especies de anfibios en 15 biomas (Gower et al., 2013; Olson et al., 2013).
La quitridiomicosis y su agente patógeno: Batrachochytrium dendrobatidisEl hongo quitridiomiceto, B. dendrobatidis, presenta formas de vida saprófitas o parasíticas y se caracteriza por tener una fase móvil infectiva y una fase sésil (Longcore et al., 1999; Voyles, Rosenblum y Berger, 2011). El ciclo de infección inicia con la llegada de las zoosporas móviles que se alojan en la piel de anfibios adultos, o bien, en las partes bucales de las larvas; ambos sitios poseen queratina, la cual es degradada por Bd para obtener sus nutrientes (Berger, Hyatt, Speare y Longcore, 2005). Después de un periodo de motilidad de 24 h, las zoosporas se enquistan y crecen finos rizoides a su alrededor, induciendo la formación de un esporangio joven; este crece y el citoplasma desarrolla divisiones mitóticas para formar las zoosporas que después serán liberadas, incrementando la abundancia de Bd en los anfibios (Berger, Hyatt et al., 2005; Berger, Speare y Skerratt, 2005). Las células huésped de Bd se ubican en el estrato córneo de la epidermis, el cual es la capa más superficial; sin embargo, también se han localizado zoosporangios de Bd en el estrato más interno, sugiriendo que el patógeno se desplaza hasta la capa más profunda de la piel para después proliferar en el estrato córneo (Berger, Hyatt et al., 2005; Berger, Speare et al., 2005).
La enfermedad provocada por este patógeno se conoce como quitridiomicosis y sus síntomas visibles son: la hiperqueratinización, decoloración, ulceración y erosión del estrato córneo de la piel, inapetencia, posturas anormales y ausencia de comportamiento de escape (Berger et al., 1999; Fellers, Green y Longcore, 2001; Pessier, Nichols, Longcore y Fuller, 1999). Algunas de las afecciones provocadas por la enfermedad y que en algunos casos provoca mortalidad incluyen: 1) desequilibrio osmótico originado por las perforaciones en la piel donde se sitúan los tubos de descarga de los zoosporangios o por la hiperqueratosis de la piel, en especies más vulnerables este desorden ocasiona un desbalance de electrolitos severo que redunda en un fallo cardiaco (Berger et al., 1999; Pessier et al., 1999; Voyles et al., 2007); 2) un bloqueo del intercambio de gases causado por la hiperplasia de la piel (Berger et al., 1998; Pessier et al., 1999) y 3) la liberación por parte del patógeno de enzimas proteolíticas tóxicas para los anfibios (Bosch, 2003). Por otro lado, Fites et al. (2013) encontraron que algunas micotoxinas secretadas por el patógeno inhiben la proliferación de linfocitos y causan la apoptosis de estos, provocando el incremento de la infección cuando los anfibios no presentan una respuesta eficaz por parte de macrófagos y otras células del sistema inmune innato.
Origen de Batrachochytrium dendrobatidisDespués que Bd fue descrito se inició un gran debate sobre su origen, y se propusieron 2 hipótesis principales: la hipótesis del patógeno endémico (Rachowicz et al., 2005) y la del patógeno incipiente (Daszak, Cunningham y Hyatt, 2000, 2003; Laurance et al., 1996; Rachowicz et al., 2005). La primera postula establece que Bd estaba presente históricamente en las localidades y un cambio en las condiciones ambientales (cambio climático) causó una disrupción en la relación parásito-huésped, volviendo a los anfibios susceptibles a la infección y a Bd más virulento. Por otro lado, la hipótesis del patógeno incipiente establece que Bd se originó en algún sitio geográfico particular y que se dispersó y arribó recientemente a nuevas áreas, causando una epidemia entre las especies de anfibios más vulnerables (Daszak et al., 2000, 2003; Laurance et al., 1996; Rachowicz et al., 2005).
Las primeras evidencias obtenidas para este tema fueron las espacio-temporales (Kilpatrick, Briggs y Daszak, 2010). Los registros más antiguos de Bd en ejemplares de colección corresponden a aquellos de Andrias japonicus colectados en Japón en 1902 (Goka et al., 2009) y a ejemplares de Xenopus laevis colectados en África en 1938 (Weldon, Du Preez, Hyatt, Muller y Speare, 2004), mientras que el registro más antiguo en otros continentes como América o Australia data de la década de 1980 (James et al., 2009). Diversos autores postularon que Bd fue transportado en la década de 1930 cuando miles de ejemplares de X. laevis fueron trasladados alrededor del mundo con fines farmacéuticos (James et al., 2009). Estos datos espacio-temporales proveen de evidencia clara y contundente de que Bd se estableció y dispersó por regiones geográficas en donde no se encontraba históricamente (Cheng, Rovito, Wake y Vredenburg, 2011; Lips, Diffendorfer, Mendelson III y Sears, 2008).
Por otro lado, se han llevado a cabo múltiples estudios a nivel molecular (Farrer et al., 2011; Rosenblum et al., 2013; Schloegel et al., 2009; Schloegel et al., 2012) que sugieren que la diversidad de Bd es mucho más grande de lo que se había considerado inicialmente, e incluye linajes de Bd endémicos y genéticamente aislados, cuyo ancestro común data de hasta 100,000 años (Rosenblum et al., 2013). Todos estos estudios en conjunto sugieren que este hongo quitridial ha infectado anfibios mucho antes que la gran pandemia del siglo xx (Blaustein y Wake, 1990).
Se han caracterizado múltiples linajes genéticamente divergentes de Bd. Farrer et al. (2011) encontraron que el linaje común “global panzootic lineage: BdGPL” emergió en 5 continentes durante el siglo xx y está claramente asociado a los episodios epizoóticos de Norteamérica, Centroamérica, el Caribe, Australia y Europa. Ellos también documentan 2 linajes nuevos, el “Cape lineage (BdCAPE)” y el “Swiss lineage (BdCH)”, los cuales presentan diferencias en caracteres morfológicos comparados con el BdGPL. Farrer et al. (2011) encontraron que cepas de BdGPL tienen evidencia de recombinación genómica, por lo que postularon que el contacto entre cepas genéticamente aisladas de Bd generó recombinación resultando en una cepa hipervirulenta y la cual provocó la crisis de la biodiversidad contemporánea a través de su diseminación.
Factores causales a la quitridiomicosisIndependientemente de las teorías del origen de Bd se han encontrado 2 factores que están asociados a la prevalencia de este patógeno y a la respuesta de las comunidades de anfibios en diferentes partes del mundo:
I. Cambio climático global. Uno de los efectos del cambio climático es el incremento de la temperatura en los hábitats donde viven los anfibios (Pounds y Crump, 1994). Esta aseveración fue realizada por Pounds y Crump (1994) cuando encontraron que la desecación y el aumento de temperatura provocaron la muerte masiva de individuos adultos del género Atelopus en Costa Rica. Sin embargo, no descartaron que hubiera interacción con otro factor, por lo que postularon por primera vez la hipótesis de epidemia ligada al clima. Esta señala qué condiciones fisiológicas no letales, pero sí estresantes pueden alterar el comportamiento y el sistema inmunitario comprometiendo la vitalidad del individuo. También señala que, al incrementarse la temperatura, los anfibios se agregan y hacinan en un mismo hábitat, lo que promueve el acercamiento del parásito a los huéspedes. Recientemente Rohr y Palmer (2013) señalaron que la variabilidad climática tiene efectos directos sobre la pérdida de biomasa y la mortalidad en anfibios, ya que determinaron que a pesar de que los anfibios pueden presentar una gama de adaptaciones de comportamiento, como el forrajeo para resguardarse de condiciones cálidas, se presenta una elevada tasa de pérdida de masa y de mortalidad cuando la temperatura se incrementa a 27 °C y la humedad es baja. Por lo anterior, sugirieron que el cambio climático moderado puede causar declives poblacionales y que el efecto se incrementaría cuando se presenta sinergia de varios factores estresantes.
Por otra parte, Pounds et al. (2006) confirmaron que en altitudes intermedias el cambio climático es un factor clave para la desaparición de poblaciones de anfibios, ya que promueve un gradiente termal cercano al intervalo de 17 a 25 °C, el cual es adecuado para el crecimiento del patógeno. Los autores explicaron que en lugares con vegetación predominante de bosques nublados el aumento de temperatura provoca un incremento de nubosidad que impide la entrada de radiación solar, lo que trae como consecuencia la existencia de temperaturas templadas durante el día, mientras que en la noche las temperaturas son más cálidas, debido a que la nubosidad impide el escape de calor. De igual forma, en zonas tropicales y húmedas el incremento de temperatura provoca mayor evaporación de las aguas marinas y en consecuencia un aumento de nubosidad, lo cual impide que los rayos del sol calienten el suelo, favoreciendo de igual manera, el crecimiento del patógeno (La Marca et al., 2005; Pounds et al., 2006). Un ejemplo de sinergia entre el clima y Bd se ha descrito para Eleutherodacylus coqui en Puerto Rico. En estas ranas de desarrollo directo los niveles más altos de infección de Bd se registran en la época fría y seca del año. En esta época, las ranas tienden a agruparse en los sitios húmedos del bosque donde el hongo es más abundante (Longo, Burrowes y Joglar, 2010). Por lo tanto, el aumento de la sequía pronosticado para el Caribe como tendencia del cambio climático global, representa una amenaza contundente para especies como esta.
Recientemente Hof, Araujo, Jetz y Rahbek (2011) evaluaron si la diversidad de anfibios se podría ver afectada por la interacción espacial entre cambio climático y la quitridiomicosis entre los años 1980 a 2080. En cuanto al cambio climático, estos autores encontraron que las zonas geográficas potencialmente más afectadas o amenazadas para los anuros son: el norte de los Andes, el Amazonas y el cerrado en Sudamérica, el Subsáhara tropical en África y en una pequeña región del sureste de Asia. Para las salamandras las zonas con efectos del cambio climático se encuentran en el noroeste de América, en el norte de Centroamérica y en el sureste de Europa; mientras que para el grupo de las cecilias las zonas con efectos del cambio climático se presentan en el norte de Sudamérica. La presencia de la quitridiomicosis se localizó en áreas con climas templados en regiones montañosas y regiones costeras, por lo que determinaron pocos sobrelapamientos de áreas con presencia de cambio climático y quitridiomicosis, sugiriendo que la quitridiomicosis tiene una asociación fuerte con condiciones de elevada humedad y bajas temperaturas; mientras que los efectos del cambio climático son prominentes en áreas cálidas y húmedas, por tanto, estos factores no se encuentran actuando juntos en la mayoría de las áreas geográficas provocando por separado el declive de poblaciones de anfibios.
II. Comercio internacional e introducción de especies exóticas. Diversos estudios señalan que la aparición del patógeno en algunas regiones de Asia, Australia, Europa, Norte y Sudamérica ha sido provocada por el comercio y consecuente introducción de especies exóticas infectadas (Bai, Garner y Li, 2010; Fisher y Garner, 2007; Laurance et al., 1996; Lips et al., 2008;). Los anuros Lithobates catesbeiana, X. laevis y Rhinella marina han sido determinados como vectores de la enfermedad, debido a que: 1) se comercian e introducen en diversos hábitats (Bai et al., 2010; Schloegel et al., 2009); 2) son especies que se infectan y toleran la infección, por lo que a lo largo del tiempo provocan una alta prevalencia de Bd en los ecosistemas (Bai et al., 2010; Schloegel et al., 2009); 3) pueden coexistir con otras especies, mientras compiten con ellas (Bai et al., 2010) y 4) son asintomáticas, por lo que el comprador no advierte signos de enfermedad y obtiene animales que infectan los materiales utilizados para el cautiverio que ocuparán otros individuos (Daszak et al., 2004). Organismos de la rana toro infectados por Bd se han encontrado en países como Estados Unidos, Canadá, Brasil, Uruguay, Reino Unido, Francia, Italia y China (Bai et al., 2010; Garner et al., 2006; Peterson, Wood, Hopkins, Unrine y Mendoza, 2007).
Por otra parte, Kilburn, Ibáñez y Green (2011) comprobaron que otros vertebrados pueden ser vectores de la enfermedad. Ellos detectaron al patógeno en la piel de los reptiles Anolis humilis, A. linotus, Pliocercus euryzonus, Imantodes cenchoa y Nothopsis rugosus en Panamá, por lo que sugirieron que esas especies son hospederas del patógeno y que, por lo tanto, están vinculadas con la dispersión y prevalencia de la enfermedad en los ecosistemas de ese país. De igual manera, se ha planteado que otros posibles agentes de dispersión son las aves Branta canadensis y Anser domesticus, ya que el patógeno presenta una elevada afinidad y adhesión al tejido queratinoso de los dígitos de esas aves, por lo que podría dispersarse hasta 30km en cada vuelo (Garmyn et al., 2012).
Respuestas de los anfibios para combatir la infección por BdSe han detectado 3 respuestas principales para la regulación de la infección por Bd por parte de los anfibios. La primera consiste en un incremento en la tasa de muda de piel, la cual contribuye a desechar las zoosporas del organismo (Bovero et al., 2008; Davidson et al., 2003; Padgett-Flohr y Hayes, 2011). Davidson et al. (2003) señalan que esta respuesta se presenta tanto en anuros como en caudados y funciona como una estrategia para controlar la infección por Bd. Sin embargo, sugieren que es más eficaz en los caudados y concluyen que las especies que muestran esta estrategia pueden actuar como reservorios de la enfermedad y que, por lo tanto, juegan un rol importante en el sostenimiento de la infección en los ecosistemas (Bovero et al., 2008; Davidson et al., 2003; Padgett-Flohr y Hayes, 2011).
La segunda respuesta sucede cuando las células de la primera fase de actividad del sistema inmune (fase innata) detectan la entrada de las zoosporas al organismo y activan al sistema nervioso, el cual estimula glándulas de la piel para que sinteticen y secreten péptidos antimicrobiales (Rollins-Smith y Conlon, 2005). Diversos autores señalan que los péptidos antimicrobiales de las familias caerina, citropina, uparina y dahelina son eficaces para reconocer e inducir la disrupción de la membrana celular del patógeno y eliminar la infección (Wiesner y Vilcinskas, 2010). Hasta el momento, se ha comprobado que algunas especies de las familias Alytidae, Bombinatoridae, Hylidae, Hyperoliidae, Leiopelmatidae, Leptodactylidae, Myobatrachidae, Pipidae y Ranidae secretan los péptidos eficaces para eliminar la infección por Bd; asimismo, se ha descubierto que algunas especies de las familias Bufonidae, Ceratophyridae, Dicroglossidae, Eleutherodactylidae, Microhylidae, Pelobatidiae, Pyxicephalidae, Rhacophoridae y Scaphiopodidae presentan péptidos que no provocan la disrupción membranal de Bd (Conlon, 2011).
Igualmente se ha sugerido el combate de la infección por parte de la segunda fase de respuesta del sistema inmune (fase adaptativa) a través del incremento linfocitos T y B, así como de los anticuerpos IgM, IgX e IgY (Ramsey, Reinert, Harper, Woodhams y Rollins-Smith, 2010; Rollins-Smith, Ramsey, Pask, Reinert y Woodhams, 2011; Voyles et al., 2011). Sin embargo, se ha observado que esta fase se altera en el estadio metamórfico debido a que se presenta una destrucción de hasta 40% de linfocitos, con el fin de permitir la reorganización de tejidos (Conlon, 2011; Rollins-Smith, 1998; Rollins-Smith et al., 2011). Esto explicaría por qué en algunas especies se ha demostrado que los juveniles de los anuros representan la etapa más vulnerable a la quitridiomicosis (Longo y Burrowes, 2010).
Otra posible respuesta de defensa por parte de los anfibios es la conducta de termorregulación. Por ello, algunos individuos infectados con Bd podrían modificar su comportamiento desplazándose de un microhábitat fresco a uno más caluroso (Richards-Zawacki, 2009). Actualmente, no se cuenta con otros estudios que respalden la conducta de termorregulación en anfibios infectados, pero es un hecho que poblaciones silvestres con climas más calurosos exhiben más resistencia a la infección por Bd, en comparación con las poblaciones infectadas en climas templados o en zonas montañosas tropicales (Burrowes, Longo, Joglar Cunningham, 2008; Puschendorf et al., 2011).
Por último, se ha detectado que algunas bacterias de los géneros Arthrobacter, Bacillus, Kitasatospora, Lysobacter, Paenibacillus, Pedobacter, Pseudomonas, Streptomyces y Janthinobacterium se encuentran en la piel de estos vertebrados y adquieren un papel fundamental en el combate de la infección, ya que producen los metabolitos 2,4-diacetilfloroglucinol, indol-3-carboxaldehído y violaceína, los cuales actúan eliminando directamente al patógeno o provocando un movimiento de aislamiento de las zoosporas (Brucker, Baylor et al., 2008; Harris, James, Lauer, Simon y Patel, 2006; Lauer et al., 2007; Woodhams et al., 2007). Particularmente se ha encontrado que algunas salamandras combaten de manera eficaz la infección por Bd, debido a que presentan la bacteria Janthinobacterium lividum. Esta bacteria es la más efectiva para producir el metabolito violaceína (Brucker, Harris et al., 2008; Harris, Lauer, Simon, Banning y Alford, 2009). Sin embargo, estudios recientes demostraron que la inoculación de Atelopus zeteki con J. lividum no fue efectiva para evitar su mortandad por quitridiomicosis (Becker et al., 2011). Por lo tanto, aunque el uso de probióticos puede ser prometedor como medida de manejo y prevención de quitridiomicosis en algunos ecosistemas, es evidente que hacen falta más estudios sobre la interacción de los mecanismos del sistema inmune de los anfibios y las bacterias simbióticas para combatir la infección por Bd.
La quitridiomicosis en MéxicoLos registros de quitridiomicosis en México datan de la década de 1980, cuando Scott (1993) observó una mortalidad masiva en individuos postmetamórficos de la especie Lithobates tarahumare distribuidos desde Arizona hasta Sonora. Scott (1993) sugirió que esto era provocado por un agente infeccioso, sin embargo, no determinó el patógeno causal de dicha mortalidad hasta que Hale, Rosen, Jarchow y Bradley (2005) detectaron al patógeno en la parte norte del país en ejemplares de colección colectados en 1981. Por otro lado, un declive dramático de las poblaciones de salamandras de los géneros Bolitoglossa, Thorius, Pseudoeurycea y Chiropterotriton en los estados de Chiapas, Oaxaca, Veracruz, Hidalgo y Nuevo León fue documentado por Parra-Olea, García-Paris y Wake (1999) y Rovito, Parra-Olea, Vásquez-Almazán, Papenfuss y Wake (2009). Los autores señalaron que el declive debió de haber ocurrido a finales de los años 70 y principios de los 80. Posteriormente, Cheng et al. (2011) corroboraron la presencia de Bd en ejemplares colectados entre 1972 y 1974 en poblaciones de salamandras pletodóntidas en los estados de Oaxaca, Hidalgo y Veracruz.
De acuerdo con el trabajo de Cheng et al. (2011), la infección por el quitridio estaba presente desde 1972 a 1989 en Veracruz, desde 1974 a 1981 en Oaxaca y desde 1974 a 1982 en Hidalgo, por lo que concluyeron que los eventos de declive de anuros y salamandras pletodóntidas en el sur del país registrados entre 1970 y 1980 por Parra-Olea et al. (1999) y Rovito et al. (2009) tienen relación con la onda epidémica de Bd en esas regiones, y que, por lo tanto, la presencia del patógeno pudo haber mermado otras poblaciones de anfibios en México. Adicionalmente, los autores realizaron experimentos de tolerancia máxima de la infección en el anuro Plectrohyla matudai y en los pletodóntidos Pseudoeurycea leprosa y Bolitoglossa rufescens. Los resultados indicaron que en ambas salamandras la infección incrementó rápidamente y que los individuos sucumbieron cuando la infección alcanzó niveles promedio de 37,841 zoosporas; mientras que los anuros persistieron con bajos niveles de infección durante los 50 días de duración del experimento. Otro trabajo de detección de Bd en pletodóntidos de México, fue el realizado por Van-Rooij et al. (2011). En este trabajo, los autores encontraron que el 48% de los 33 individuos de las especies Bolitoglossa platydactyla, B. rufescens, Pseudoeurycea belli, P. cephalica, P. leprosa y P. longicauda presentaron la infección con Bd. Además, registraron que el 50% de las salamandras infectadas exhibieron pérdida de cola, por lo que sugirieron que la infección por Bd puede inducir esta respuesta.
Por otra parte, Muñoz-Alonso (2010) realizó un muestreo de anfibios a lo largo de 3 transectos al este del istmo de Tehuantepec y obtuvo 1,106 frotis de piel correspondientes a 77 especies de anfibios. Los resultados del análisis de detección mostraron que 24 especies de anfibios pertenecientes a las familias Bufonidae, Hylidae, Leptodactylidae, Microhylidae, Plethodontidae y Ranidae, es decir, el 21% de las especies analizadas, presentaron la infección; por su parte, el análisis estadístico mostró que la familia Hylidae presenta una tendencia significativa a estar más infectada por Bd en comparación con las otras familias.
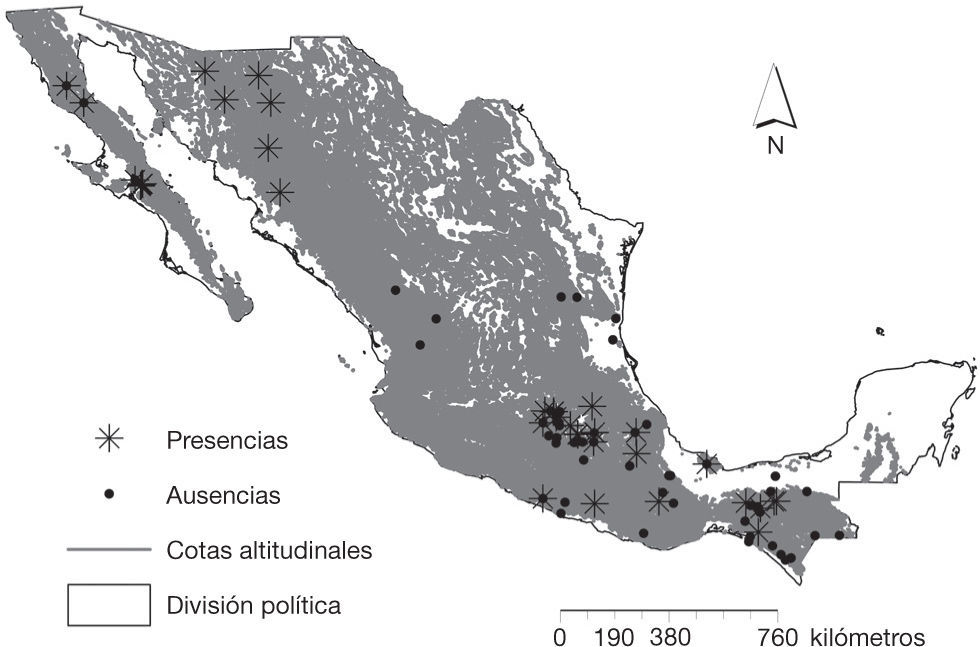
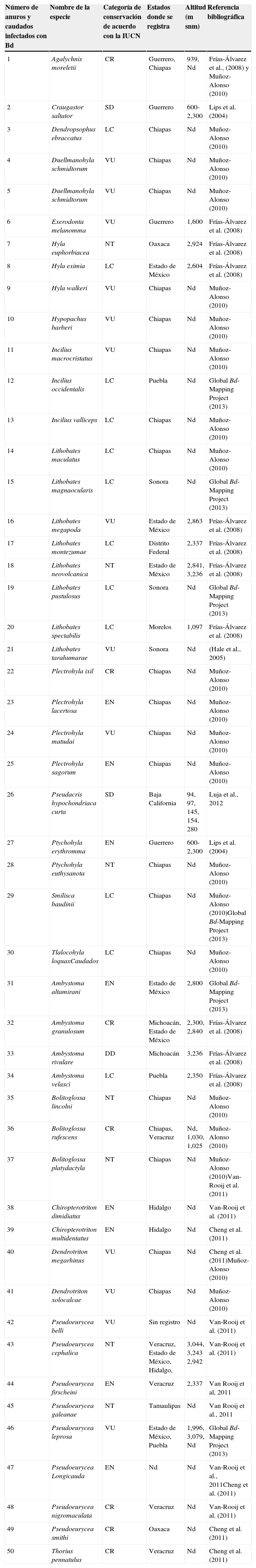
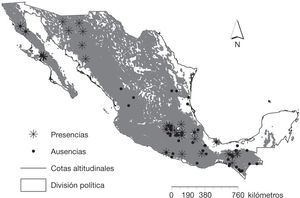
Hasta el momento se ha registrado la presencia de Bd a todo lo largo de la República Mexicana, en 13 de los 32 estados que la conforman (Cheng et al., 2011; Frías-Álvarez et al., 2008; Global Bd mapping proyect, 2013; Lips, Mendelson III, Muñoz- Alonso, Canseco-Márquez y Mulcahy, 2004; Luja et al., 2012; Muñoz-Alonso, 2010; Van-Rooij et al., 2011) (fig. 1; tabla 1).
Especies de anfibios infectados por Bd en México hasta el año 2013.
| Número de anuros y caudados infectados con Bd | Nombre de la especie | Categoría de conservación de acuerdo con la IUCN | Estados donde se registra | Altitud (m snm) | Referencia bibliográfica |
|---|---|---|---|---|---|
| 1 | Agalychnis moreletii | CR | Guerrero, Chiapas | 939, Nd | Frías-Álvarez et al., (2008) y Muñoz-Alonso (2010) |
| 2 | Craugastor saltator | SD | Guerrero | 600-2,300 | Lips et al. (2004) |
| 3 | Dendropsophus ebraccatus | LC | Chiapas | Nd | Muñoz-Alonso (2010) |
| 4 | Duellmanohyla schmidtorum | VU | Chiapas | Nd | Muñoz-Alonso (2010) |
| 5 | Duellmanohyla schmidtorum | VU | Chiapas | Nd | Muñoz-Alonso (2010) |
| 6 | Exerodonta melanomma | VU | Guerrero | 1,600 | Frías-Álvarez et al. (2008) |
| 7 | Hyla euphorbiacea | NT | Oaxaca | 2,924 | Frías-Álvarez et al. (2008) |
| 8 | Hyla eximia | LC | Estado de México | 2,604 | Frías-Álvarez et al. (2008) |
| 9 | Hyla walkeri | VU | Chiapas | Nd | Muñoz-Alonso (2010) |
| 10 | Hypopachus barberi | VU | Chiapas | Nd | Muñoz-Alonso (2010) |
| 11 | Incilius macrocristatus | VU | Chiapas | Nd | Muñoz-Alonso (2010) |
| 12 | Incilius occidentalis | LC | Puebla | Nd | Global Bd-Mapping Project (2013) |
| 13 | Incilius valliceps | LC | Chiapas | Nd | Muñoz-Alonso (2010) |
| 14 | Lithobates maculatus | LC | Chiapas | Nd | Muñoz-Alonso (2010) |
| 15 | Lithobates magnaocularis | LC | Sonora | Nd | Global Bd-Mapping Project (2013) |
| 16 | Lithobates megapoda | VU | Estado de México | 2,863 | Frías-Álvarez et al. (2008) |
| 17 | Lithobates montezumae | LC | Distrito Federal | 2,337 | Frías-Álvarez et al. (2008) |
| 18 | Lithobates neovolcanica | NT | Estado de México | 2,841, 3,236 | Frías-Álvarez et al. (2008) |
| 19 | Lithobates pustulosus | LC | Sonora | Nd | Global Bd-Mapping Project (2013) |
| 20 | Lithobates spectabilis | LC | Morelos | 1,097 | Frías-Álvarez et al. (2008) |
| 21 | Lithobates tarahumarae | VU | Sonora | Nd | (Hale et al., 2005) |
| 22 | Plectrohyla ixil | CR | Chiapas | Nd | Muñoz-Alonso (2010) |
| 23 | Plectrohyla lacertosa | EN | Chiapas | Nd | Muñoz-Alonso (2010) |
| 24 | Plectrohyla matudai | VU | Chiapas | Nd | Muñoz-Alonso (2010) |
| 25 | Plectrohyla sagorum | EN | Chiapas | Nd | Muñoz-Alonso (2010) |
| 26 | Pseudacris hypochondriaca curta | SD | Baja California | 94, 97, 145, 154, 280 | Luja et al., 2012 |
| 27 | Ptychohyla erythromma | EN | Guerrero | 600-2,300 | Lips et al. (2004) |
| 28 | Ptychohyla euthysanota | NT | Chiapas | Nd | Muñoz-Alonso (2010) |
| 29 | Smilisca baudinii | LC | Chiapas | Nd | Muñoz-Alonso (2010)Global Bd-Mapping Project (2013) |
| 30 | Tlalocohyla loquaxCaudados | LC | Chiapas | Nd | Muñoz-Alonso (2010) |
| 31 | Ambystoma altamirani | EN | Estado de México | 2,800 | Global Bd-Mapping Project (2013) |
| 32 | Ambystoma granulosum | CR | Michoacán, Estado de México | 2,300, 2,840 | Frías-Álvarez et al. (2008) |
| 33 | Ambystoma rivulare | DD | Michoacán | 3,236 | Frías-Álvarez et al. (2008) |
| 34 | Ambystoma velasci | LC | Puebla | 2,350 | Frías-Álvarez et al. (2008) |
| 35 | Bolitoglossa lincolni | NT | Chiapas | Nd | Muñoz-Alonso (2010) |
| 36 | Bolitoglossa rufescens | CR | Chiapas, Veracruz | Nd, 1,030, 1,025 | Muñoz-Alonso (2010) |
| 37 | Bolitoglossa platydactyla | NT | Chiapas | Nd | Muñoz-Alonso (2010)Van-Rooij et al. (2011) |
| 38 | Chiropterotriton dimidiatus | EN | Hidalgo | Nd | Van-Rooij et al. (2011) |
| 39 | Chiropterotriton multidentatus | EN | Hidalgo | Nd | Cheng et al. (2011) |
| 40 | Dendrotriton megarhinus | VU | Chiapas | Nd | Cheng et al. (2011)Muñoz-Alonso (2010) |
| 41 | Dendrotriton xolocalcae | VU | Chiapas | Nd | Muñoz-Alonso (2010) |
| 42 | Pseudoeurycea belli | VU | Sin registro | Nd | Van-Rooij et al. (2011) |
| 43 | Pseudoeurycea cephalica | NT | Veracruz, Estado de México, Hidalgo, | 3,044, 3,243 2,942 | Van-Rooij et al. (2011) |
| 44 | Pseudoeurycea firscheini | EN | Veracruz | 2,337 | Van Rooij et al, 2011 |
| 45 | Pseudoeurycea galeanae | NT | Tamaulipas | Nd | Van Rooij et al., 2011 |
| 46 | Pseudoeurycea leprosa | VU | Estado de México, Puebla | 1,996, 3,079, Nd | Global Bd-Mapping Project (2013) |
| 47 | Pseudoeurycea Longicauda | EN | Nd | Nd | Van-Rooij et al., 2011Cheng et al. (2011) |
| 48 | Pseudoeurycea nigromaculata | CR | Veracruz | Nd | Van-Rooij et al. (2011) |
| 49 | Pseudoeurycea smithi | CR | Oaxaca | Nd | Cheng et al. (2011) |
| 50 | Thorius pennatulus | CR | Veracruz | Nd | Cheng et al. (2011) |
Las categorías de conservación señaladas son las registradas en el libro rojo de la IUCN (2013), y se escriben con las siguientes abreviaturas: en peligro crítico (CR), en peligro de extinción (EN), preocupación menor (LC), poco amenazado (NT), vulnerable (VU), datos deficientes (DD) y sin datos (SD).
Estos registros corresponden a 50 especies de anfibios distribuidas desde el desierto costero (Luja et al., 2012) hasta el bosque de alta montaña (Frías-Álvarez et al., 2008; Lips et al., 2004); desde el nivel del mar (Luja et al., 2012) hasta una altitud de 2,336 m snm (Frías-Álvarez et al., 2008). De acuerdo con la Unión Internacional para la Conservación de la Naturaleza (UICN, 2013) 13 de estas especies son vulnerables, 8 se encuentran en peligro de extinción y 7 en peligro crítico (tabla 1).
Factores causales a la quitridiomicosis en MéxicoCon respecto al cambio climático global en México, Pavía, Grae y Reyes (2006) evaluaron el cambio de la temperatura ambiental en México entre los periodos de 1940 a 1969 y de 1970 a 2004. Para ello, utilizaron datos de temperaturas máximas y mínimas de 1,400 estaciones meteorológicas de todo el país. Estos autores encontraron que a partir de 1970 se presentó un incremento significativo de temperatura en el sur de México y que este fue más marcado en la estación de verano. De igual manera, los brotes epidemiológicos del quitridio en México y el declive de anfibios sucedieron a partir de esa década (Cheng et al., 2011). Esta información podría sugerir que el cambio de temperatura en el país provocó una disrupción en la relación parásito-huésped propiciando el declive de pletodóntidos registrado por Parra-Olea et al. (1999) y Rovito et al. (2009). De acuerdo con Pounds y Crump (1994), la disrupción pudo llevarse a cabo porque el aumento de temperatura provocó estrés fisiológico en las salamandras, haciéndolas más vulnerables a la infección.
Con el fin de apreciar el intervalo de la temperatura a partir de 1970 en los sitios con declive de anfibios y prevalencia de Bd, se obtuvo el registro de la temperatura promedio anual en las localidades del Parque Nacional El Chico en Hidalgo, cerro Chicahuaxtla en Veracruz y cerro San Felipe en Oaxaca. Los datos de temperatura promedio anual fueron tomados de Cicese (2014) y corresponden a las estaciones meteorológicas: El Chico en Hidalgo; Coscomatepec (DGE) en Veracruz; presa El Estudiante, Santo Domingo Barrio y Oaxaca en Oaxaca. En el Parque Nacional El Chico la temperatura entre 1964 a 1988 se mantuvo en un intervalo de entre 18.89 a 21.96 °C. En la localidad del cerro Chicahuaxtla la temperatura osciló de 16.42 a 22.43 °C en el periodo de 1964 a 1989. En lo que respecta a la localidad de cerro San Felipe los valores de temperatura durante el periodo de 1955 a 1984 oscilaron entre 19.37 a 21.72 °C. Lo anterior sugiere que no hubo un cambio dramático en el promedio de temperatura, pero el quitridio pudo prevalecer con un crecimiento adecuado en esos sitios, debido a que la temperatura óptima para el crecimiento del patógeno se encuentra entre 17 y 23 °C (Piotrowski, Annis y Longcore, 2004). Al respecto Cheng et al. (2011) encontraron que en los 3 lugares el patógeno se detectó en 5 especies de pletodóntidos a partir de 1972. Por ejemplo, en el Parque Nacional El Chico se detectó a Bd en Chiropterotriton multidentatus en 1974 con un valor de 3% de prevalencia y en 1982 la prevalencia fue de 14% en C. dimidiatus. En el cerro Chicahuaxtla la presencia de Bd se detectó en 1972 con un 2% de prevalencia en Thorius pennatulus; en 1976 la infección se detectó en Pseudoeurycea nigromaculata con una prevalencia de 50% y en 1989 la prevalencia en T. pennatulus fue de 50%. En el cerro San Felipe los valores de prevalencia en Pseudoeurycea smithi fueron de 3% en 1974, 5% en 1976 y 54% en 1981. Estos datos sugieren que el declive de salamandras puede estar asociado al incremento en la prevalencia de la quitridiomicosis, pero no con el clima.
En lo concerniente a las especies invasoras como vectores de la enfermedad en México, se han registrado poblaciones exóticas de L. catesbeiana desde la primera mitad del siglo xx (Smith y Taylor, 1948). Actualmente existe una importación de la especie desde China y muchos de los individuos importados se encuentran infectados por Bd, por lo que son una fuente de transmisión de la enfermedad (Bai et al., 2010). Al respecto Luja et al. (2012) corroboraron que la presencia de Bd en diferentes oasis aislados en el estado de Baja California fue ocasionada por el constante desplazamiento de individuos infectados de la especie L. catesbeiana. En total se han encontrado poblaciones silvestres y de cautiverio de este anuro en los estados de Aguascalientes, Baja California, Chihuahua, Estado de México, Distrito Federal, Michoacán, Morelos, Puebla, Sonora, Veracruz y Yucatán (Casas-Andreu, Aguilar-Miguel y Cruz-Aviña, 2001; Conabio, 2013). En las poblaciones en cautiverio no se han tomado las medidas necesarias para impedir que los individuos escapen y se trasladen a hábitats silvestres (Casas-Andreu et al., 2001), por tanto, se introduce la enfermedad a nuevos sitios.
Consideraciones finalesLa quitridiomicosis es una enfermedad infecciosa y emergente de la piel de los anfibios que surgió simultáneamente en todos los continentes a partir de la década de 1970. Las evidencias muestran que el patógeno estuvo presente desde la primera parte del siglo xx en Asia y África. Hasta el momento las hipótesis del origen del patógeno han sido respaldadas por trabajos en diferentes partes del mundo. Se ha documentado que el cambio climático global ha traído condiciones que favorecen el crecimiento del patógeno, y se ha postulado que la dispersión de diversas cepas de Bd ha sido ocasionada por la introducción y desplazamiento de especies vectoras o por medios abióticos como corrientes de agua, suelo húmedo o neblina. Asimismo, se ha determinado que estrategias fisiológicas y conductuales de los anfibios podrían favorecer la resistencia o la tolerancia a la infección de Bd.
En México la oleada epidémica de Bd inició en 1972 y de acuerdo con los estudios de extensión del patógeno en América por Lips et al. (2008) la dispersión del patógeno presentó una dirección hacia el sur. Hasta el momento se ha registrado la infección en 50 especies mayoritariamente distribuidas en las regiones montañosas del noroeste, centro y sur del país. Es importante señalar que 7 de esas especies se encuentran en peligro crítico de acuerdo con la UICN (2013), por lo que se deben de tomar medidas de conservación sobre sus poblaciones. En la tabla 1 se localiza el estatus de conservación de las especies infectadas por Bd en el país. Se ha constatado el declive de caudados por Bd en México, debido a los registros de monitoreo por Parra-Olea et al. (1999) y Rovito et al. (2009) en el Parque Nacional El Chico, Hidalgo, cerro Chicahuaxtla, Veracruz y cerro San Felipe, Oaxaca, y por la detección del patógeno Bd en esos lugares realizada por Cheng et al. (2011).
Por otra parte, se ha documentado que el cambio climático global ha provocado la presencia de brotes epidemiológicos en varias regiones. Con respecto a México, el cambio significativo de temperatura fue evaluado a partir de 1970, lo cual coincide con el inicio de la oleada epidémica de Bd en el sur del país. El registro de la temperatura en los sitios con declive y prevalencia del patógeno sugiere que la temperatura permitió su supervivencia, pero no hay una asociación clara con el incremento en la prevalencia de Bd. Aún no se puede comprobar que el cambio climático global se encuentre relacionado con la aparición y virulencia de Bd en México, debido a que no se cuenta con datos suficientes de número de individuos infectados y grado de infección en los sitios monitoreados por Parra-Olea et al. (1999) y Rovito et al. (2009). Por lo anterior, es necesario realizar un análisis de detección histológica de Bd en los anfibios colectados durante el siglo xx, con el fin de determinar la relación entre las condiciones ambientales que se presentaron después del cambio climático y la prevalencia del patógeno.
La familia Plethodontidae es importante para el análisis de la quitridiomicosis, ya que refleja el efecto de la enfermedad en las poblaciones de anfibios completamente terrestres y porque se ha determinado que toleran altos grados de infección, por lo que pueden ser vectores del patógeno y causantes de la prevalencia de la infección en los ecosistemas. Recientemente se descubrió un nuevo quítrido, Batrachochytrium salamandrivorans (Martel et al., 2013) de elevada virulencia con especificidad aparente a los caudados en Europa. Este nuevo descubrimiento trae consigo varias incógnitas; por ejemplo, dada la especificidad a los caudados, emerge la necesidad de revisar si este estuvo involucrado en las extinciones y declinaciones observadas en México. Por otro lado, plantea la posibilidad de nuevas cepas emergentes en los diferentes grupos o en las diferentes regiones geográficas, por tanto, hay que estudiar a detalle las características genéticas y morfológicas de la cepa de Bd que infecta las poblaciones naturales de anfibios de México.
Adicionalmente, este trabajo sugiere que la dispersión del patógeno en México fue facilitada por la introducción y desplazamiento de L. catesbeiana ocurrido en la primera mitad del siglo xx. Es necesario obtener el cultivo de cepas de Bd provenientes de este anuro, con el fin de determinar los genotipos, conocer su virulencia y las posibles rutas de entrada y dispersión del patógeno.
Finalmente, en México los estudios futuros sobre la quitridiomicosis deberían centrarse en: 1) aislar las cepas de Bd de poblaciones de anfibios silvestres, ya que solo se cuenta con la cepa MexMkt que fue aislada de anfibios de comercio (Longo et al., 2013); 2) determinar las diferencias en la virulencia de la cepas del patógeno en una muestra representativa de las especies y poblaciones de anfibios, con el fin de establecer las zonas y poblaciones que son más susceptibles a la enfermedad; 3) identificar el impacto de la variabilidad ambiental en la virulencia de Bd y en las especies de anfibios; 4) identificar las estrategias que los anfibios pudieran estar realizando para combatir la infección y 5) estudiar detalladamente la respuesta inmune entre parásito-hospedero, con el fin de encontrar vías que beneficien los mecanismos que promuevan resistencia a la infección por Bd. Adicionalmente, se debe alertar e informar a la población acerca de las medidas de prevención y de desinfección de los materiales utilizados en el cautiverio de los anfibios. Es prioritario realizar estas medidas en Oaxaca, Chiapas y Veracruz, porque son los estados con más diversidad y endemismos de anfibios en México.
AgradecimientosLa primera autora establece que este artículo es un requisito para la obtención del grado de Doctora en Ciencias del Posgrado en Ciencias Biológicas de la UNAM y, por lo tanto, le agradece al Posgrado en Ciencias Biológicas de la UNAM por colaborar en sus estudios, así como al Conacyt por otorgarle la beca con número (CVU/Becario) 2 05284/202580 durante sus estudios de doctorado. GP-O agradece a proyecto PAPIIT-UNAM IN209914.