La deforestación alrededor de grandes concentraciones urbanas usualmente crea un paisaje fragmentado con reducidas áreas naturales. El estudio de la biodiversidad en estos remanentes provee herramientas útiles para el diseño de estrategias de conservación que permiten maximizar la persistencia de la diversidad local y favorecen su conectividad. Inventarios focalizados en grupos taxonómicos particulares, han sido propuestos como un mecanismo útil que permite una aproximación al conocimiento del estado de la biodiversidad en un área determinada, siendo las mariposas uno de los grupos taxonómicos más empleados para este tipo de estudios. En el presente trabajo se estudió la diversidad y composición de la comunidad de mariposas del bosque de niebla de la reserva El Romeral ubicada al suroccidente de la ciudad de Medellín, en el valle de Aburrá, Colombia. Se registraron 75 especies de 5 familias de mariposas, un número mayor que las registradas en bosques similares asociados a zonas periurbanas. Además, El Romeral sólo comparte un 50% de las especies con la principal área forestal periurbana ubicada al oriente del valle, indicando que cada uno de los remanentes de bosque circundantes a la ciudad puede tener una composición única de especies, siendo complementarias y útiles para la conservación a nivel regional
Deforestation around large urban centers usually creates a fragmented landscape with reduced natural areas. Biodiversity studies in these forest remnants provide useful tools for designing conservation strategies that maximize the persistence of local diversity and promote their connectivity. Inventories focused on particular taxa have been proposed as a useful mechanism that allows a better knowledge of the state of biodiversity in a given area, the butterflies are one of the taxonomic groups more frequently used for these studies. In this paper, we study the diversity and composition of the butterfly community in the cloud forest of the reserve El Romeral located southwest of the Medellín City in the Aburrá Valley, Colombia. We recorded 75 species belonging to 5 butterfly families, more than recorded for similar forests associated with periurban areas. El Romeral shares only 50% of the species with the main periurban forest located east of the valley, indicating that each of the surrounding forest remnants of the city may have a unique composition of species being complementary and useful for regional conservation.
En los Andes tropicales la sustitución de las áreas naturales hacia paisajes dominados por la actividad humana ha llevado a la eliminación de organismos nativos y a la reducción de las áreas de bosque natural, de tal forma que para algunas regiones sólo persisten unos pocos remanentes de hábitat natural que juegan un importante papel en el mantenimiento de la diversidad de especies nativas (Kintz et al., 2006; La Torre-Cuadros, 2007; Richter, 2008). Este fenómeno de fragmentación es especialmente marcado en las zonas circundantes a las grandes concentraciones urbanas. El valle de Aburrá, en el departamento de Antioquia, Colombia, tiene una población aproximada de 3.5 millones de habitantes, es un ejemplo de paisaje fragmentado, donde la vegetación natural ha quedado reducida a una serie de fragmentos de bosques de tamaño variable (González, 2003; Corantioquia, 2004).
Una manera de incrementar el conocimiento de la diversidad en zonas periurbanas es a través de los inventarios de diversidad focalizados en grupos taxonómicos particulares en determinada área (Duelli y Obrist, 2003; Mac Nally y Fleishman, 2004; Niemi y McDonald, 2004), proporcionando herramientas para estrategias de conservación que permiten maximizar la persistencia de la biodiversidad local y su conectividad (Margules et al., 2002; Hilty et al., 2006; Gradstein, 2008). Las mariposas son uno de los taxones más empleados en este tipo de estudios, tanto en ecosistemas tropicales (Brown y Freitas, 2000, 2002; Cleary, 2004; Miller et al., 2011) como templados (MacNally y Fleishman, 2004; Ward y Larivière, 2004; Rossi y Van Halder, 2010). El uso de las mariposas en estudios de diversidad se debe, principalmente, a que su riqueza, composición y abundancia están relacionadas con características abióticas y bióticas del hábitat como la estructura del paisaje, diversidad, composición y estructura vegetal, interacciones tróficas de la comunidad y/o variaciones climáticas (Parmesan et al., 1999; Brown y Freitas, 2000; Cleary, 2004; Walla et al., 2004; Fleishman et al., 2005a, 2005b; Menéndez et al., 2007; Brereton et al., 2011). Además, es un grupo que refleja sensiblemente cambios producidos por perturbaciones en su hábitat (Brown, 1997; New, 1997; Andrade, 1998). Para los Andes tropicales diversos estudios han mostrado una enorme riqueza de mariposas en la región, que varía en su composición a medida que se asciende en altitud (Arias y Huertas, 2001; Viloria, 2002; Pyrcz, 2004; Pyrcz et al., 2009; Pyrcz y Garlacz, 2012). En tierras altas por encima de los 2 000 m snm, el grupo dominante en términos de riqueza y abundancia son los Satyrinae (Satyrini, Pronophilina) (García-Pérez et al., 2007), que presentan gran afinidad y restricción ecológica (Viloria, 2007; Pyrcz et al., 2009), por lo cual muchos estudios en zonas elevadas se concentran exclusivamente en este grupo (Pyrcz y Wojtusiak, 2002; Prieto, 2003; Pyrcz et al., 2009).
En este estudio analizamos la diversidad y composición de la comunidad de mariposas del bosque de niebla de la reserva El Romeral, al suroccidente del valle de Aburrá, y se comparan los resultados de estudios similares en otras áreas periurbanas. Asimismo, se contribuye al conocimiento zoogeográfico de las mariposas de tierras altas en América y se resalta la importancia de este relicto de bosque para el valle de Aburrá.
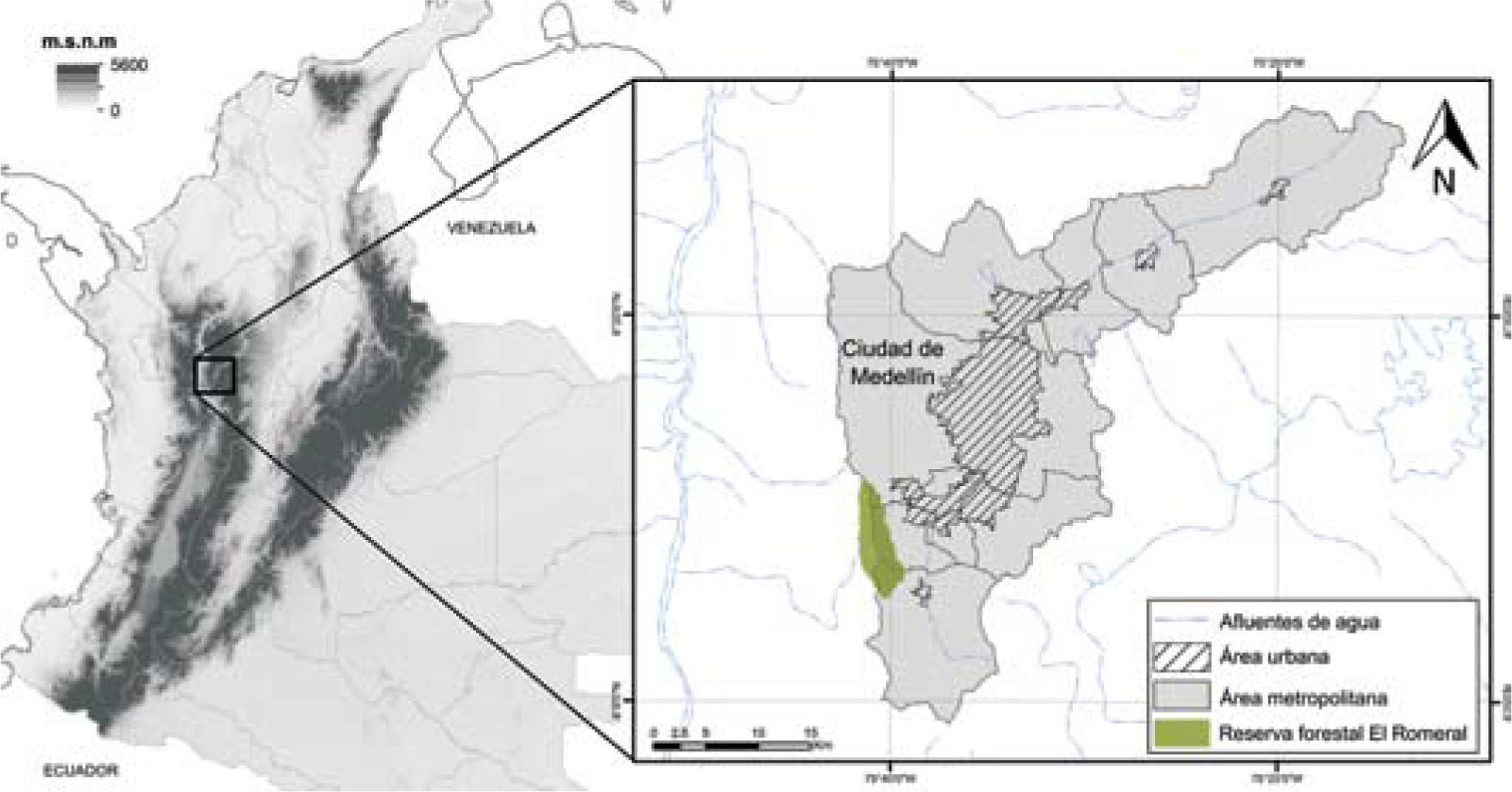
Materiales y métodosZona de estudioLa reserva forestal El Romeral está ubicada al suroccidente del valle de Aburrá (Fig. 1) sobre la cordillera Central, entre los paralelos 6°05’ a 6°13’ N y los meridianos 75°39’ y 75°43’ O, en jurisdicciones de los municipios de Medellín, Caldas, Heliconia, Angelópolis y La Estrella. Abarca una extensión total de 5 171 hectáreas y su altura máxima es de ca. 2 900 m snm en el Alto El Romeral (Corantioquia, 2004). Esta reserva, junto con el cerro del Padre Amaya y El Alto Las Baldías, conforman el Distrito de Manejo Integrado del Área de Reserva de la Ladera Occidental del Valle de Aburrá (DMI AROVA), y forma parte de los ecosistemas estratégicos del área metropolitana de Medellín (Uribe, 2011). La zona se caracteriza por una alta precipitación, con un promedio anual por encima de los 2 000 mm, presentando constantes lluvias en la zona, siendo los meses más húmedos mayo y octubre, y los menos húmedos de diciembre a febrero (Corantioquia, 2004). En la reserva, el bosque de niebla se encuentra en las zonas altas por encima de los 2 500±100 m snm, que de acuerdo con el sistema de clasificación de zonas de vida de Holdridge (1967) hace parte del bosque muy húmedo montano bajo (bmh-MB). En la parte más alta, por encima de los 2 800 m snm, se distribuye el bosque pluvial montano (bp-M). El estudio se realizó en la zona que corresponde al bosque de niebla, entre los 2 500 y los 2 900 m snm.
MuestreoEl trabajo de campo fue realizado durante 13 días de recolecta entre febrero del 2010 y marzo del 2011, abarcando los diferentes ciclos de lluvias para la zona, con un equipo de 6 personas. Las recolectas fueron realizadas entre las 8:00 y las 17:00, para un total de 702 horas de muestreo efectivo mediante búsqueda activa con redes entomológicas. Además, se emplearon 12 trampas Van Someren-Rydon (DeVries, 1987) con 11 días de actividad; 12-14 de junio, 19-20 de septiembre del 2010, 29-31 de enero y 5-7 de marzo del 2011; cebadas de manera alterna con pescado o fruta en descomposición (banano, azúcar y cerveza). Las trampas fueron dispuestas entre 1 y 3 m sobre el nivel del suelo y se colocaron cada 100 m snm en la vertiente, y con una distancia de 100 m lineales en la parte alta y plana de la montaña. Los ejemplares capturados fueron guardados independientemente en sobres de papel; los puntos de recolecta para cada ejemplar fueron georreferenciados mediante un GPSmap Garmin® 60CSx. Todos los ejemplares capturados están amparados bajo el permiso de recolecta número 2-2011-15, otorgado por la autoridad ambiental Corporación Autónoma Regional de Antioquia (Corantioquia).
El material recolectado fue examinado en el Laboratorio de Biología y Sistemática de Insectos, de la Universidad Nacional de Colombia, sede Medellín y en el Zoological Museum of the Jagiellonian University en Cracovia, Polonia. Posteriormente, los ejemplares fueron depositados en la colección del Museo Entomológico Francisco Luis Gallego (MEFLG) de la Universidad Nacional de Colombia, sede Medellín. Los ejemplares, en su mayoría, fueron identificados hasta especie, pero en algunos casos la identificación fue sólo a nivel de género morfoespecie. Para especies taxonómicamente complejas se realizaron disecciones de los genitales del macho, siguiendo el procedimiento estándar de maceración de la estructura en KOH al 10% y preservando permanentemente la genitalia en glicerol.
Análisis de datosSe obtuvieron los índices de diversidad en términos de números equivalentes (números de Hill) (Jost, 2006), diversidad de orden 0 (0D) o riqueza de especies, orden 1 (1D), que es el exponencial de la entropía del índice de Shannon, y orden 2 (2D), que es el inverso del índice de Simpson. Los órdenes de estas medidas de diversidad tienen diferentes niveles de sensibilidad a la abundancia relativa de cada especie, 0D considera a todas las especies con igual frecuencia, 1D pesa moderadamente la abundancia de las especies y puede ser interpretado como un índice que tiene en cuenta las especies típicas y, finalmente, 2D incluye sólo aquellas especies más abundantes, la relación de cambio entre cada uno de estos índices permite construir un perfil de diversidad donde las comunidades más equitativas presentan un reducido cambio entre cada orden de diversidad (Gotelli y Chao, 2013). A partir de los datos de abundancia, se estableció el modelo de distribución de que más se ajustaba al ensamblaje, mediante una prueba de χ2 en el programa PAST ver. 2.17c (Hammer et al., 2001) y para comparar la similitud entre la composición de especies de El Romeral y otras localidades se empleó el índice de similitud de Sørensen.
Se calcularon estimadores de las diversidades estudiadas, para la riqueza de especies (0D) se empleó bootstrap en el programa EstimateS 8.2.0 (Colwell et al., 2012); éste emplea la proporción de unidades de muestreo que contienen a cada especie (Moreno 2001), tomando todas las especies capturadas. En la diversidad 1D se utilizó el estimador de Chao y Shen (2003) basado en el ajuste Horvitz-Thompson, que permite una estimación del índice de diversidad de Shannon cuando el número de especies y las abundancias reales de éstas son desconocidas, empleando datos de la cobertura de muestreo (Chao y Shen, 2003). Para 2D el MVUE (Minimum Variance Unbiased Estimator) (Eq. 2.27 de Magurran, 1988), un estimador no sesgado que es relativamente invariante al tamaño de la muestra (Gotelli y Chao, 2013). Igualmente, se estimó la cobertura del muestreo que representa la fracción de las abundancias totales de la comunidad que están representadas en el muestreo (Chao y Shen, 2003), esto debido a que la representatividad de una muestra no sólo depende de las especies que faltan, sino también de sus abundancias promedio (Moreno et al., 2011). Estos últimos 3 análisis fueron realizados en el programa SPADE (Chao y Shen, 2010). Finalmente, se realizó una curva de rarefacción basada en la muestra, para observar la tendencia en la acumulación de especies, realizado en el programa PAST ver. 2.17c (Hammer et al. 2001).
ResultadosComposición, riqueza y diversidad del ensamblaje de mariposasSe recolectó un total de 1 081 individuos pertenecientes a 75 especies de 5 familias de lepidópteros: Hesperiidae, Pieridae, Riodinidae, Lycaenidae y Nymphalidae (Cuadro 1). El grupo dominante fue Satyrinae con 42 especies, y dentro de éste, Pronophilina con 38 especies. La riqueza reportada para esta subtribu es mayor a la de otras localidades similares, por ejemplo, en el bosque periurbano del suroriente de Bogotá, entre los 2 600 y 3 200 m snm, Mahecha-Jiménez et al. (2011) registraron 13 especies de Pronophilina. Vélez et al. (2009) en el área periurbana del oriente del valle de Aburrá, entre los 2 200 y 2 600 m snm, encuentran 20 especies de la subtribu.
Especies de mariposas capturadas y su abundancia en el bosque de niebla de la reserva El Romeral, al suroccidente del valle de Aburrá, Colombia
| Taxones | Abundancia | |
| Hesperiidae | ||
| Eudaminae | Entheus matho Goldman y Salvin, 1879 | 1 |
| Hesperiinae | Wahydra sp. 1 | 3 |
| Wahydra sp. 2 | 2 | |
| Zalomes biforis (Weymer, 1890) | 1 | |
| Psoralis degener (Plötz, 1882) | 3 | |
| Heteropterinae | Dalla hesperioides (C. Felder y R. Felder, 1867) | 10 |
| Dalla sp. 1 | 1 | |
| Dalla sp. 2 | 1 | |
| Pieridae | ||
| Pierinae | Hesperocharis marchalii (Guérin-Méneville [1844]) | 1 |
| Leodonta tagaste colombiana Constantino y Salazar, 2004 | 1 | |
| Leptophobia aripa aripa (Boisduval, 1836) | 1 | |
| Leptophobia eleusis (Lucas, 1852) | 1 | |
| Leptophobia helena smithii (W. F. Kirby, 1881) | 1 | |
| Leptophobia penthica Kollar, 1850 | 3 | |
| Riodinidae | ||
| Riodininae | Mesosemia cordillerensis (Salazar y Constantino, 1993) | 1 |
| Mesosemia mevania Hewitson [1857] | 2 | |
| Lycaenidae | ||
| Theclinae | Johnsonita auda (Hewitson, 1867) | 1 |
| Johnsonita pardoa (D‘Abrera, 1995) | 1 | |
| Micandra aegides (C. Felder y R. Felder, 1865) | 1 | |
| Penaincisalia loxurina (C. Felder y R. Felder, 1865) | 1 | |
| Nymphalidae | ||
| Danainae | Pteronymia veia (Hewitson, 1853) | 1 |
| Patricia dercyllidas (Hewitson, 1864) | 5 | |
| Oleria makrena (Hewitson [1854]) | 1 | |
| Oleria sp. 1 | 1 | |
| Heliconiinae | Altinote eresia (C. Felder y R. Felder, 1862) | 3 |
| Altinote ozomene (Godart, 1819) | 17 | |
| Altinote trinacria (Talbot, 1932) | 4 | |
| Heliconius clysonymus clysonymus Latreille [1817] | 1 | |
| Biblidinae | Epiphile epimenes Hewitson, 1857 | 1 |
| Limenitidinae | Adelpha corcyra (Hewitson, 1847) | 3 |
| Nymphalinae | Eresia polina laias Goldman y Salvin, 1879 | 1 |
| Hypanartia kefersteini (Doubleday [1847]) | 1 | |
| Vanessa braziliensis (Moore, 1883) | 3 | |
| Satyrinae | Morpho sulkowskyi Kollar, 1850 | 10 |
| Euptychiina | Euptychoides griphe (C. Felder y R. Felder, 1867) | 7 |
| Forsterinaria rustica villarresi (Dognin, 1887) | 21 | |
| Hermeuptychia harmonia (Butler, 1867) | 2 | |
| Pronophilina | Corades chelonis rectilinea Pyrcz, 2005 | 9 |
| Corades chirone Hewitson, 1863 | 5 | |
| Corades cybele cybele Butler, 1866 | 3 | |
| Corades medeba columbina Staudinger, 1894 | 4 | |
| Daedalma dinias salmoni Pyrcz, 2011 | 37 | |
| Eretris apuleja subrufescens (Grose-Smith y W. F. Kirby, 1895) | 46 | |
| Eretris ocellifera ocellifera (C. Felder y R. Felder, 1867) | 15 | |
| Eretris porphyria pseudoperija Pyrcz, 1999 | 37 | |
| Junea dorinda n.spp. (C. Felder y R. Felder, 1862) | 1 | |
| Lasiophila prosymna dirempta Thieme, 1907 | 30 | |
| Lasiophila zapatoza n. sp. (Westwood, 1851) | 19 | |
| Lymanopoda alboncincta alboncincta (Hewitson, 1861) | 12 | |
| Lymanopoda labda (Hewitson, 1861) | 42 | |
| Lymanopoda obsoleta (Westwood, 1851) | 21 | |
| Manerebia germaniae germaniae Pyrcz y Hall, 2006 | 18 | |
| Manerebia inderena antioquiana Pyrcz y Willmott, 2006 | 25 | |
| Mygona irmina (Doubleday [1849]) | 1 | |
| Panyapedaliodes drymaea atropulla Pyrcz y Viloria, 2005 | 2 | |
| Panyapedaliodes jephtha (Thieme, 1905) | 3 | |
| Pedaliodes baccara baccara Thieme, 1911 | 158 | |
| Pedaliodes hebena Pyrcz y Viloria, 1999 | 5 | |
| Pedaliodes montagna Adams y Bernard, 1981 | 8 | |
| Pedaliodes rodriguezi Pyrcz y Andrade, 2013 | 78 | |
| Pedaliodes obstructa Pyrcz y Viloria, 1999 | 74 | |
| Pedaliodes peucestas peucestas (Hewitson, 1862) | 72 | |
| Pedaliodes phrasicla (Hewitson, 1847) | 2 | |
| Pedaliodes pisonia (Hewitson, 1862) | 4 | |
| Pedaliodes poesia (Hewitson, 1862) | 7 | |
| Pedaliodes pollonia Adams, 1986 | 32 | |
| Pedaliodes praemontagna Pyrcz y Viloria, 2007 | 121 | |
| Pedaliodes praxithea (Hewitson, 1870) | 2 | |
| Pedaliodes transmontana Pyrcz y Viloria, 1999 | 1 | |
| Pedaliodes simpla costipunctata Weymer, 1912 | 22 | |
| Proboscis propylea (Hewitson, 1857) | 4 | |
| Pronophila epidipnis orcheswitsoni Adams y Bernard, 1981 1979 | 21 | |
| Pronophila orcus orcus (Latreille, 1811) | 2 | |
| Pseudomaniola loxo (Dognin, 1891) | 1 | |
| Steroma bega andensis C. Felder y R. Felder, 1867 | 18 |
Las zonas boscosas al oriente (Vélez et al., 2009) y al occidente (este trabajo) del valle de Aburrá albergan una riqueza complementaria, ya que solo comparten un 50% del total de especies y presentan un índice de similitud de Sørensen de 0.35. Sin embargo, hay una diferencia altitudinal entre los 2 remanentes y se sabe que Pronophilina presenta una mayor diversidad a alturas entre los 2 600 y 3 000 m snm (Adams, 1985, 1986; Pyrcz 2004; Pyrcz et al., 2009), lo que podría explicar que la riqueza de esta subtribu sea mayor en el occidente. La baja similitud en la composición del ensamblaje de mariposas entre el occidente y el oriente de valle de Aburrá sugiere que ambos bosques periurbanos son importantes para la conservación de este grupo de lepidópteros a nivel regional.
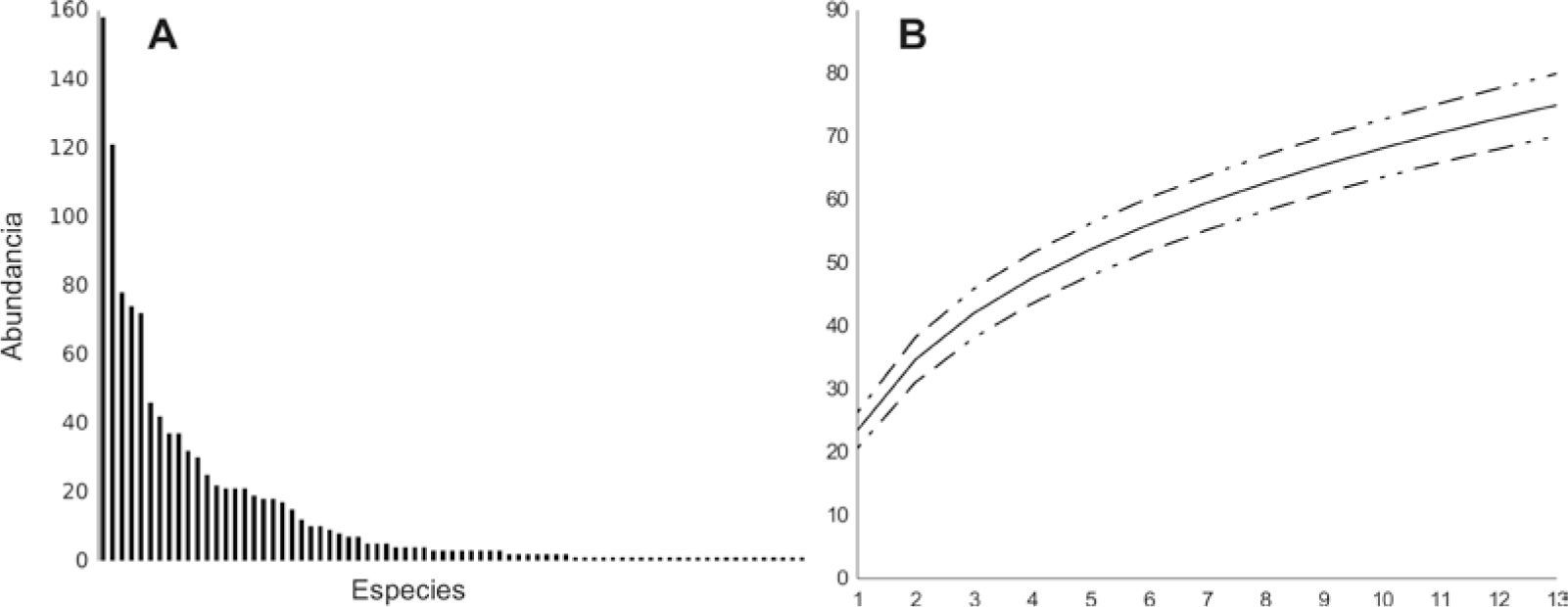
La diversidad 1D (Cuadro 2) es de 24.54 especies efectivas, y 2D de 14.53 especies efectivas. Esta amplia diferencia entre la diversidad 0D (riqueza) y el número de especies efectivas de las diversidades 1D y 2D, indica que este ensamblaje presenta algunas especies abundantes y un gran número de especies raras. Esto se ve reflejado en las abundancias relativas de cada especie, donde 5 especies (Pedaliodes baccara, P. praemontagna, Pedaliodes n. sp., P. obstructa y P. peucestas) representan el 47% de todos los individuos capturados, mientras que otras 47 especies son el 8.7% de las capturas (Fig. 2A). Este patrón de la distribución de la abundancia de especies corresponde, principalmente, a un modelo de distribución de serie logarítmica (p=0.8135) y en parte a la serie log-normal (p=0.1973). Aunque estos modelos han sido ampliamente debatidos (Williamson y Gaston, 2005; Ferreira y Petrere, 2008), estarían correspondiendo a comunidades donde se presenta una subdivisión jerárquica del nicho y pueden estar indicando que una pequeña fracción de especies están usando una amplia fracción y los recursos disponibles (Sugihara, 1980; McGill et al., 2007), además, acorde con lo propuesto por Hill y Hamer (1998), las comunidades que se ajustan a modelos de distribución de tipo de serie logarítmica presentan algún nivel de perturbación.
En comparación con las Pronophilina reportadas por Mahecha-Jiménez et al. (2011), donde se tiene una diversidad 1D de 8.09 y 2D de 6.20 especies efectivas, en El Romeral la diversidad de las Pronophilina es más del doble (1D=19.28 y 2D=13.49 especies efectivas). El estudio de Mahecha-Jiménez et al. (2011) muestra que la proporción de cada una de las especies registradas en el suroriente de Bogotá es mayor en comparación a El Romeral que presenta una baja frecuencia de muchas de las especies, estas diferencias suscitan varias preguntas: ¿Hasta qué punto el remanente de bosque de El Romeral constituye un hábitat adecuado en el que puedan subsistir poblaciones viables de estas especies de mariposas?, ¿El Romeral podría, en un corto tiempo, llegar a los niveles bajos de diversidad que registró Mahecha-Jiménez et al. (2011) para el remanente estudiado en Bogotá? La realización de estudios poblacionales, y la implementación de un programa de monitoreo de largo plazo y a mayor escala espacial, podrían ayudar a resolver estas incógnitas. En el contexto del cambio climático este tipo de evaluaciones serían de utilidad para la conservación de la diversidad, más aún, sabiendo de la afinidad y restricción ecológica de los pronofilinos de alta montaña (Viloria, 2007; Pyrcz et al., 2009), los cuales pueden servir como organismos indicadores.
La estimación de la diversidad 0D, 1D y 2D para las mariposas de la zona sugieren un alcance del muestreo de 87, 86 y 88%, respectivamente, faltando conocer por lo menos un 14% de la diversidad. Viendo estos estimativos en relación con la curva de rarefacción (Fig. 2B), la cual tiene una reducida pendiente que indica una lenta acumulación de especies con la inclusión de nuevos muestreos. Además, la cobertura de muestreo indica que esta diversidad no obtenida representa el 2.3% de los individuos totales (Cuadro 2). Estos resultados implican que faltó capturar individuos de especies con bajas densidades poblacionales, que sin duda, es un gran esfuerzo adicional de muestreo para su captura y concuerda con el patrón encontrado en la curva de rarefacción. También se puede observar que la cobertura de muestreo es un factor determinante para la mejor precisión en la estimación de la diversidad (Brose et al., 2003).
El bosque periurbano al suroccidente del valle de Aburrá (El Romeral) registra niveles importantes de diversidad, además de la complementariedad que muestra con el área forestal al oriente del valle, indicando que cada una de las áreas boscosas circundantes a la ciudad puede contribuir a la conservación de este grupo de lepidópteros a nivel regional. La implementación de estrategias como el Distrito de Manejo Integrado del Área de Reserva de la Ladera Occidental del Valle de Aburrá (DMI AROVA) es un primer paso que propicia la conexión entre los remanentes de bosque que circundan el occidente valle de Aburrá. Aunque la realización de estudios que permitan determinar el impacto que tiene la actividad humana en la presencia de diferentes especies en los remanentes de bosque del valle, es una tarea aún pendiente, que propiciaría el desarrollo de estrategias de manejo y conservación más ajustadas a la historia natural de la región y su realidad actual.
Los autores agradecen el financiamiento del proyecto a la Corporación Universitaria Lasallista (FCAA-07 2010) y a la Fundación BBVA (Proyecto MARIPOSA: BIOCON08_021). A Corantioquia por el apoyo administrativo. A Carlos Prieto por su apoyo taxonómico en la identificación de las especies; a Diana Janeth Suárez, Alejandra Clavijo, Duverney Chaverra, Daniela Agudelo, Andrés Rojas, Valeria Hincapié, Estiven Galeano, Andrea Lorena García-Hernández por su apoyo en la recolecta de ejemplares. A Matthias Rös; así como a Federico Escobar y a 2 revisores anónimos por los comentarios y sugerencias realizadas al manuscrito.