El concepto de especie propuesto por De Queiroz (1998) proporciona un contexto para inferir la separación de linajes a partir de la integración de diferentes fuentes de información. La mayoría de las especies del género Phymaturus fueron descritas con base en unos pocos caracteres morfológicos y la validez de algunas de ellas ha sido cuestionada. Investigaciones recientes revalidan algunas especies antiguas, mientras que otras sugieren sinonimias entre algunas recientemente descritas. En el presente trabajo se implementa por primera vez para este género la aproximación metodológica de la morfometría geométrica para evaluar la variación de la forma entre las especies del grupo Phymaturus calcogaster, con el objetivo de aportar una nueva fuente de evidencia al análisis de las hipótesis de especie. También se analizan caracteres morfométricos lineales típicamente utilizados para la descripción de especies. Los resultados de estas 2 aproximaciones metodológicas complementarias se discuten desde una perspectiva integradora, ya que proporciona un nivel de confianza mayor en las hipótesis de especies que aquellas propuestas con base en un solo tipo de evidencia. Nuestros resultados aportan evidencia independiente que apoya las hipótesis de especies propuestas con base en morfología clásica, y también es congruente con los linajes identificados con base en datos moleculares.
The species concept of De Queiroz (1998) provides a context to infer different lineages based on different integrated sources of information. Most species of the genus Phymaturus were described based on a few morphological characters and the validity of some have been questioned. Recent research revalidated some old species, while others suggest synonyms for some recently described. In this paper, we use the methodological approach of geometric morphometry to evaluate the variation in shape among species of the Phymaturus calcogaster group with the objective to provide a new source of evidence for the analysis of these species’ hypothesis. We also studied linear morphometric analysis typically used to describe species. We discuss the results of these 2 complementary methodological approaches with an integrative perspective. We consider that it provides a higher level of confidence in the species’ hypothesis than those proposals based on a single type of evidence. Our results provide independent evidence that supports the previously proposed species based on classical morphology, and they are also consistent with the lineages identified based on molecular data.
La taxonomía tradicional se ha basado principalmente en patrones aparentes de no superposición (gaps) de caracteres morfológicos como un criterio para delimitar especies en su forma más comúnmente conocida (Sites y Marshall, 2004; Wiens y Servedio, 2000). En los últimos años ha tomado fuerza el concepto de especie propuesto por De Queiroz (1998), que nos proporciona un contexto para inferir la separación de linajes a partir de la integración de diferentes fuentes de información. Este concepto unificador y pluralista fomenta el uso y desarrollo de un amplio marco de métodos para inferir límites de especies (De Queiroz, 2007). La complejidad de la biología de las especies requiere que los límites sean estudiados desde perspectivas múltiples y complementarias para elaborar hipótesis de especies más sólidas (Padial y de la Riva, 2007). Esta tendencia de integrar diferentes fuentes de evidencia para hipotetizar especies fue desarrollada por Dayrat (2005), quien la denominó taxonomía integral. En este marco conceptual las especies se consideran hipótesis, y las hipótesis de especies más estables son aquellas avaladas por diferentes tipos de caracteres independientes (Padial y de la Riva, 2007). Sin embargo, a pesar de la amplia gama de métodos disponibles (Marshall y Sites, 2003; Sites y Marshall, 2003, 2004), la mayoría de las especies aún se reconocen utilizando un enfoque único e incluso un solo tipo de dato (Minoli, Morando y Avila, 2014).
Recientemente, en un complejo de especies de lagartijas distribuido en Perú perteneciente al género Liolaemus (Aguilar et al., 2013) se utilizaron 3 líneas de evidencia (molecular mitocondrial, morfología clásica y modelado de nicho) para evaluar los límites de especies dentro del marco de este nuevo enfoque integral. Los resultados obtenidos en este trabajo permitieron describir 3 especies nuevas que se confundían con especies descritas con base en caracteres morfológicos convencionales. En otras especies del mismo género, Minoli et al. (2014) utilizaron morfometría clásica, geométrica y modelado de nicho para estudiar límites de especies en el grupo de lagartijas Liolaemus fitzingerii, pero no encontraron evidencia para diferenciar 2 de las 5 especies estudiadas.
Al igual que en Liolaemus, en el género Phymaturus la mayoría de las descripciones de especies se realizaron con base en unos pocos caracteres morfológicos (Minoli et al., 2014), en algunos casos solo con base en diferencias cromáticas y con patrones de distribución geográfica aparentemente discontinuos (Avila, Pérez, Pérez y Morando, 2011; Avila, Pérez, Minoli y Morando, 2014). Algunas investigaciones recientes revalidan especies antiguas, otras sugieren sinonimias entre especies recientemente descritas (Lobo y Quinteros, 2005a, b; Lobo, Abdala y Valdecantos, 2010; Lobo, Cruz y Abdala, 2012) y otras han propuesto un número elevado de especies candidatas (Lobo, Abdala y Valdecantos, 2012; Morando, Avila, Pérez, Hawkins y Sites, 2013), por lo que su diversidad aún es desconocida y discutida (Avila et al., 2014).
Phymaturus comprende un grupo de especies estrictamente saxícolas con una distribución restringida a afloramientos rocosos de origen tectónico o volcánico, con grietas profundas, que se encuentran desde el sur de la Puna hasta la zona central de Patagonia en Argentina y en la región central de los Andes en Chile (Cei, 1986, 1993). En contraste con su grupo hermano Liolaemus, Phymaturus presenta características morfológicas y de historia natural que se pueden considerar conservadas (Cruz et al., 2009; Espinoza, Wiens y Tracy, 2004). Todas las especies presentan cabeza y cuerpo aplanado, cola con apariencia espinosa por sus escamas puntiagudas dispuestas en círculos, extremidades cortas y pliegues en la piel de cuello y cuerpo (Etheridge, 1995), son vivíparas y herbívoras (Cei, 1986, 1993; Lobo et al., 2010; Núñez et al., 2010). Dentro de Phymaturus se reconocen 2 grandes clados: palluma, con distribución geográfica más norte, desde la región altoandina de Catamarca hasta la región central de Neuquén, y patagonicus, con una distribución sur, desde la Payunia de Mendoza hasta las mesetas y sierras volcánicas del centro del Chubut, con un área de solapamiento entre ambos que comprende el sur de Mendoza y norte de Neuquén (Etheridge, 1995; Lobo et al., 2012b; Morando et al., 2013). En el clado patagonicus, Morando et al. (2013) reconocen 5 grupos con base en datos de secuencias de genes mitocondriales y nucleares, 3 de ellos con alto soporte estadístico: indistinctus, payuniae y spurcus; los 2 restantes con soporte moderado: somuncurensis y calcogaster. Además, Morando et al. (2013) proponen 11 especies candidatas para este clado; 2 de ellas —Phymaturus sp. 11 y Phymaturus sp. 21— fueron descritas recientemente con base en características morfológicas, P.camilae Scolaro et al., 2013 y P.yachanana Avila et al., 2014, respectivamente. Estas especies, junto a P.patagonicus Koslowsky, 1898 y P.calcogaster Scolaro y Cei, 2003, y otras 2 especies candidatas (Phymaturus sp. 14, y Phymaturus sp. 15) conforman el grupo calcogaster (Morando et al., 2013).
El objetivo de este trabajo es aportar una fuente de evidencia nueva al análisis de las 4 especies descritas del grupo Phymaturus calcogaster. Se implementa la aproximación metodológica de la morfometría geométrica (Adams, Rohlf y Slice, 2004; Bookstein, 1991; Kaliontzopoulou, 2011; Zelditch, Swiderski, Sheets y Fink, 2004) para evaluar la variación de la forma entre estas especies y se comparan los resultados con los obtenidos con análisis de caracteres morfométricos lineales, típicamente utilizados para la descripción de especies. Se discuten los resultados de estas 2 aproximaciones metodológicas complementarias con una perspectiva integradora, ya que proporciona un nivel de confianza mayor en las hipótesis de especies (Dayrat, 2005; Padial y de la Riva, 2007).
Materiales y métodosEn total se examinaron 123 ejemplares adultos de Phymaturus patagonicus (23 machos, 15 hembras), P.calcogaster (33 machos, 17 hembras), P.camilae (9 machos, 6 hembras) y P.yachanana (13 machos, 7 hembras). Los ejemplares fueron recolectados a mano o lazo, sacrificados con una inyección en la zona pericardial de tiopental sódico Abbot®/Pentovet®, fijados en formalina (10-20%) y posteriormente almacenados en etanol (70%). Los especímenes de referencia fueron depositados en la colección herpetológica LJAMM-CNP del IPEEC, Centro Nacional Patagónico, Puerto Madryn, Argentina (CENPAT-CONICET, http://www.cenpat.edu.ar/nuevo/colecciones03.html). Además se revisó material depositado en las siguientes colecciones herpetológicas: José Miguel Cei, Universidad Nacional de San Luis, San Luis, Argentina (DC-JMC); José Alejandro Scolaro, Centro Nacional Patagónico, Puerto Madryn, Argentina (JAS-DC); Museo de Ciencias Naturales, Universidad Nacional de Salta, Argentina (MCN), y Museo de La Plata, Universidad Nacional de La Plata, La Plata, Argentina (MLP.S/R) (Anexo).
Morfometría linealSe utilizaron las variables morfométricas comúnmente usadas como caracteres diagnósticos (Etheridge, 1995; Lobo y Quinteros, 2005a, b; Lobo et al., 2012b): longitud hocico-cloaca (LHC, desde el extremo anterior del hocico hasta el borde posterior de las escamas precloacales), longitud de la cabeza (LC, desde el extremo anterior del hocico hasta el margen anterior de la cavidad auricular), ancho de la cabeza (AC, tomado a la altura de las regiones temporales, el sitio más ancho de la cabeza), alto de la cabeza (AlC, tomado a la altura de las escamas frontoparietales, el sitio más alto de la cabeza, entre la órbita y la apertura timpánica), distancia entre narinas (DEN, longitud entre las narinas), longitud narina ojo (LNO, largo entre la narina hasta la comisura del ojo), longitud rostral-pineal (LRP, largo entre la escama rostral y la pineal), distancia axila-ingle (DAI, desde la axila de la extremidad anterior hasta la ingle de la extremidad posterior), longitud tercer dedo-codo (L3DC, largo de la extremidad anterior desde el codo hasta la uña del tercer dedo), longitud de la tibia (LT, largo entre el talón y la rodilla), longitud cuarto dedo-talón (L4DT, largo del pie desde el talón hasta la uña del cuarto dedo). Las medidas se registraron con un calibre digital Mitutoyo® de precisión 0.01mm. Teniendo en cuenta que varios autores (e.g., Boretto y Ibargüengoytia, 2009; Medina, Avila y Morando, 2013; Valdecantos y Lobo, 2007) demostraron que los caracteres morfométricos pueden estar afectados por el dimorfismo sexual, se incluye el factor sexo en los análisis. Para explorar los datos se calculó la media, la desviación estándar, y los valores mínimos y máximos para cada variable. Para eliminar información redundante se realizó un análisis de correlación entre las 11 variables lineales, de las cuales descartamos 4: LC, LRP, L3DC, L4DT. Con las variables seleccionadas se realizó un análisis de varianza multivariado (Mancova) utilizando LHC como covariables; al ser significativo, se realizaron contrastes a posteriori. Se corrió un análisis discriminante lineal (ADL) para establecer las diferencias entre taxa y los errores de clasificación. Los análisis morfométricos se realizaron con el programa estadístico INFOSTATversión 2014.
Morfometría geométricaPara captar la variación de la forma se fotografió la vista dorsal de la cabeza de los ejemplares con una cámara digital (Lumix Fz 60, resolución 16MP24X) manteniendo la misma distancia y ángulo para todas las fotografías; las imágenes se agruparon por especies en archivos (.tps) con ayuda del software TPSutil v. 1.52 (Rohlf, 2012). Con el programa Make-Fan6 (Sheets, 2005) se dibujaron radios equidistantes que sirvieron como líneas guía para digitalizar el contorno. Ocho hitos (L) y 13 semihitos (Sl) se digitalizaron en el lado derecho de la cabeza (fig. 1) con el programa tpsDig2 v. 2.16 (Rohlf, 2010b). Para el ajuste generalizado de procrustos se utilizó TPSRelw v. 1.49 (Rohlf, 2010a) para los semihitos, y MorphoJ v. 2.0 (Klingenberg, 2011) para los hitos, eliminando de esta forma los efectos de traslación, rotación y escala (Rohlf y Slice, 1990). Se utilizó el programa MorphoJ v. 2.0 (Klingenberg, 2011) para realizar los análisis estadísticos y los gráficos. Se realizó una prueba de valores atípicos para eliminar los ejemplares que se desvían considerablemente de la media. Para probar el efecto de alometría, se realizó una regresión entre las variables de forma y tamaño del centroide, considerando un umbral del 4% de predicción de la variación total (Drake y Klingenberg, 2008; Zelditch et al., 2004).
Vista dorsal de la cabeza con a)8 hitos y b)13 semihitos.
1: punta del hocico (extremo anterior de la escama rostral); 2: margen posterior de la narina derecha; 3: borde anterior del ojo derecho (primera escama supraocular); 4: borde posterior del ojo derecho (última escama supraocular); 5: escama superciliar media (a la altura de la línea media entre la primera y última escama supraocular); 6: escama circumorbital media (a la altura de la línea media entre la primera y la última escama supraocular); 7: ojo pineal; 8: escama del pliegue nucal (a la altura de la escama pineal); 9-21, semihitos.
Evaluamos el dimorfismo sexual entre machos y hembras de cada especie mediante un análisis de función discriminante (AFD) para la forma y una prueba t para el tamaño. Realizamos un análisis de variación canónica (AVC) para determinar las características de la forma que mejor distinguen a los 4 grupos establecidos a priori (Klingenberg y Monteiro, 2005). Para evaluar la significancia del AVC realizamos pruebas de permutaciones de distancias de a pares (10,000 iteraciones) y determinamos el porcentaje de organismos clasificados correctamente para cada especie con un análisis de función discriminante (AFD).
ResultadosMorfometría linealLas medidas calculadas para cada variable muestran superposición entre las especies (tabla 1). Se detectaron diferencias significativas entre las especies (Mancova, lambda de Wilks=0.14, F=6.42, p<0.0001). En los contrastes a posteriori, tanto hembras y machos de P.patagonicus presentaron diferencias significativas del resto de las especies. Los machos de P.calcogaster no se diferencian de los machos de P.yachanana y P.camilae, y las hembras de estas 3 especies no presentaron diferencias entre sí (tabla 2a, b).
Relación de medidas para las especies descritas del grupo Phymaturus calcogaster: media, desviación estándar (DE), mínimo (min.) y máximo (máx.).
| Variables | Medidas | P. calcogaster | P. camilae | P. patagonicus | P. yachanana |
|---|---|---|---|---|---|
| LHC | Media±DE | 87.91±4.68 | 88.24±5.83 | 87.87±4.91 | 83.48±5.71 |
| (min.-max.) | (77.44-97.94) | (75.88-94.72) | (78.09-97.08) | (73.5-93.11) | |
| LC | Media±DE | 14.96±0.81 | 15.1±0.98 | 15.15±0.79 | 14.62±0.9 |
| (min.-max.) | (13.59-16.91) | (12.99-16.42) | (13.13-16.45) | (12.87-16.36) | |
| AC | Media±DE | 15.52±1.06 | 15.63±1.14 | 15.61±0.9 | 14.69±0.89 |
| (min.-max.) | (13.44-17.76) | (12.83-16.79) | (13.44-17.42) | (12.8-16.05) | |
| ALC | Media±DE | 8.98±0.58 | 9.09±0.73 | 9.4±0.57 | 8.37±0.64 |
| (min.-max.) | (7.69-10.38) | (7.52-10.09) | (7.82-10.31) | (6.89-9.53) | |
| DEN | Media±DE | 2.5±0.28 | 2.78±0.32 | 2.37±0.28 | 2.38±0.27 |
| (min.-max.) | (1.9-3.03) | (2.24-3.26) | (1.84-2.92) | (1.84-2.85) | |
| LNO | Media±DE | 4.69±0.34 | 5.19±0.44 | 4.63±0.61 | 4.72±0.43 |
| (min.-max.) | (3.98-5.5) | (4.08-5.74) | (3.48-5.86) | (3.87-5.43) | |
| LRP | Media±DE | 10.69±0.64 | 11.17±0.61 | 10.91±0.77 | 10.58±0.61 |
| (min.-max.) | (9.72-12.16) | (9.84-12.1) | (7.99-11.94) | (9.3-12.03) | |
| DAI | Media±DE | 43.67±3.85 | 41.79±4.55 | 44.94±4.13 | 40.85±4.02 |
| (min.-max.) | (37.02-52.62) | (35.81-50.61) | (35.7-55.84) | (33.68-48.72) | |
| L3DC | Media±DE | 25.83±1.48 | 25.61±1.35 | 27.12±1.37 | 24.88±1.59 |
| (min.-max.) | (22.07-30.64) | (23.27-27.87) | (23.93-29.64) | (21.45-28.76) | |
| LTP | Media±DE | 16.48±1.25 | 16.51±1.3 | 16.88±1.14 | 16.27±1.26 |
| (min.-max.) | (13.98-19.37) | (13.39-18.1) | (15-19.64) | (13.88-19.08) | |
| L4DT | Media±DE | 23.26±1.4 | 23.6±1.65 | 24.36±1.01 | 22.59±1.55 |
| (min.-max.) | (20.74-28.14) | (20.89-26.73) | (21.84-26.42) | (19.66-26.04) |
AC: ancho cabeza; ALC: alto cabeza; DAI: distancia axila-ingle; DEN: distancia entre narinas; L3DC: largo tercer dedo-codo; L4DT: largo cuarto dedo-talón; LC: largo cabeza; LHC: longitud hocico-cloaca; LNO: largo narina-ojo; LRP: largo rostral-parietal; LTP: largo tibia-peroné.
a)Resultados del análisis Mancova. Se muestran los valores del estadístico lambda de Wilks, del estadístico F con sus respectivos grados de libertad y la significancia estadística (p); b)contraste a posteriori.
| a, | |||||
|---|---|---|---|---|---|
| F.V. | Lambda de Wilks | F | gl(num) | gl(den) | p |
| Especie | 0.36 | 7.49 | 18 | 314 | <0.0001 |
| LHC | 0.18 | 81.74 | 6 | 111 | <0.0001 |
| b | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Especie | AC | ALC | DEN | LNO | DAI | LTP | n | |||||
| P. patagonicus_H | 14.83 | 9.05 | 2.25 | 4.52 | 46.01 | 15.96 | 15 | A | ||||
| P. patagonicus_M | 15.97 | 9.55 | 2.43 | 4.67 | 43.59 | 17.33 | 23 | B | ||||
| P. calcogaster_M | 15.85 | 9.19 | 2.52 | 4.74 | 42.4 | 16.77 | 33 | C | D | |||
| P. yachanana_M | 15.5 | 8.86 | 2.45 | 4.84 | 42.5 | 17.19 | 13 | C | ||||
| P. camilae_M | 16.07 | 9.39 | 2.84 | 5.19 | 40.52 | 16.84 | 8 | D | ||||
| P. calcogaster_H | 14.6 | 8.46 | 2.42 | 4.53 | 44.89 | 15.63 | 17 | E | ||||
| P. yachanana_H | 14.56 | 8.19 | 2.42 | 4.78 | 44.3 | 16.08 | 7 | E | ||||
| P. camilae_H | 14.67 | 8.39 | 2.68 | 5.11 | 42.98 | 15.78 | 6 | E | ||||
AC: ancho cabeza; ALT: alto cabeza; DAI: distancia axila-ingle; DEN: distancia entre narinas; LNO: largo narina-ojo; LTP: largo tibia-peroné.
Letras distintas indican diferencias significativas del contraste a posteriori, con un p ≤ 0.05.
Medias con una letra en común no son significativamente diferentes (p>0.05).
El análisis discriminante (ADL) presentó un error de clasificación total del 37.70%, siendo la más alta para P.yachanana (hembras 57.14%, machos 7.69%), seguido de P.calcogaster (hembras 41.18%, machos 51.52%), P.camilae (hembras 12.50%, 50% machos) y P.patagonicus (hembras 33.33%, machos 34.78%). La variabilidad explicada por los 2 primeros ejes canónicos fue del 83.78%, siendo AC, ALC y DAI las variables más explicativas para ambos ejes (tabla 3). En el gráfico de dispersión se observa que las elipses de confianza de las hembras de P.calcogaster se solapan parcialmente con P.camilae y P.yachanana, mientras que estas últimas se traslapan completamente entre sí. En los machos, la superposición es menor, las elipses de P.camilae y P.yachanana no se superponen y el contacto con P.calcogaster es leve. En P.patagonicus no se observa superposición entre las elipses de machos y hembras con las otras especies (fig. 2).
Los resultados de la regresión multivariada fueron significativos (p=0.01), con un 2.41% de predicción, por lo que utilizamos los datos crudos para los análisis posteriores. A nivel intraespecífico, no se observó dimorfismo sexual en el tamaño (prueba t, p>0.05) ni en la forma de la cabeza, ya que el análisis discriminante (AFD) no separó los grupos (p>0.05) por sexo (fig. 3). Al no detectarse diferencia significativa en los análisis de dimorfismo sexual, se analizaron machos y hembras en conjunto para cada especie en los análisis posteriores.
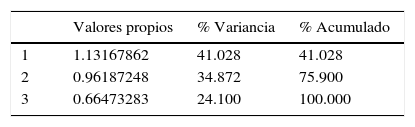
A nivel interespecífico, el análisis de variación canónica (AVC) infirió diferencias significativas (p<0.05) en la distancia Mahalanobis entre grupos. En el gráfico de dispersión, las especies formaron grupos aislados, con apenas una superposición de P.camilae con P.calcogaster (fig. 4); el primer eje discriminó a P.patagonicus y a P.calcogaster de P.camilae, mientras que el segundo separó a P.yachanana. La primera variable canónica (CV1) representó el 41.02% de la varianza, y la variable canónica CV2, el 34.87% (tabla 4).
Diferencias interespecíficas entre especies del grupo calcogaster. El gráfico de deformación ilustra los cambios de la forma de la cabeza a lo largo de los ejes; la línea de puntos corresponde a la configuración de hitos y semihitos y la línea gris representa la variación de ese cuadrante. P.camilae (rombo, contorno: punto-guión), P.yachanana (triángulo, contorno: puntos), P.patagonicus (cuadrado, contorno: guiones) y P.calcogaster (círculo, contornos: línea sólida).
En el gráfico de deformación se observa la variación de la forma en cada eje (fig. 4). En el CV1 la región temporal de la cabeza (Sl: 13-16) es más angosta en P.patagonicus; en P.camilae, P.calcogaster y P.yachanana la región occipital es más amplia (Sl: 18-21). A la altura de los ojos, la zona de escamas circumorbitales anteriores (L: 3 y 6) se ensancha en P.camilae y P.calcogaster, mientras que en P.patagonicus se ensancha la región posterior de los parpados (L: 4 y 5). En el CV2, la región de las escamas supraoculares posteriores (L: 4 y 6) es menor en P.yachanana y la región más occipital es cóncava (Sl: 19-21). El error de clasificación entre pares de especies (AFD) fue de 13.7%, siendo P.calcogaster quien presentó mayor error (21.56%: 11 de 51 ejemplares), seguido por P.patagonicus (10.25%: 4 de 39 ejemplares), P.camilae (6.66%: 1 de 15 ejemplares) y P.yachanana (5.26%: 1 de 19 ejemplares).
DiscusiónEn la actualidad se dispone de técnicas y métodos novedosos que permiten generar y analizar diferentes tipos de datos para delimitar especies; las hipótesis de especies avaladas con datos de diferentes fuentes de información tienen un nivel de confianza mayor que aquellas apoyadas por un solo tipo de evidencia (Dayrat, 2005; Padial y de la Riva, 2007). Dentro del contexto de la taxonomía integral, el objetivo de este trabajo fue aportar información independiente para analizar las hipótesis de especie de lagartijas del grupo Phymaturus calcogaster (Morando et al., 2013). Se utilizaron datos morfométricos clásicos, y por primera vez para este género se implementó la aproximación metodológica de la morfometría geométrica para estudiar las variaciones fenotípicas de las 4 especies descritas formalmente para este grupo: P.camilae, P.yachanana, P.patagonicus y P.calcogaster. De acuerdo con la filogenia molecular de Morando et al. (2013), estos 4 taxa y otras 2 especies candidatas (P. sp. 12 y P. sp. 17) pertenecen al clado calcogaster, el cual tuvo un apoyo moderado en el árbol de especies BEST (figura 6 en Morando et al., 2013; p=0.70). Estas especies han sido descritas con base en morfología externa y coloración, y solo algunas con base en diferencias moleculares (Avila et al., 2014).
La taxonomía tradicional comúnmente utiliza medidas de resumen para evaluar diferencias entre especies (Minoli et al., 2014), pero en nuestros resultados no se pudieron detectar diferencias morfométricas claras (tabla 1). En los últimos años el uso de análisis multivariados para la diferenciación y descripción de especies se ha incrementado (e.g., en lagartijas: Breitman, Morando y Avila, 2013; Medina et al., 2013; Minoli et al., 2014), ya que este tipo de análisis permite describir y analizar muchas variables en conjunto. Los resultados del análisis de varianza multivariado concuerda en parte con los obtenidos en los análisis comparativos llevados a cabo en las descripciones formales de P.camilae (Scolaro, Jara y Pincheira-Donoso, 2013) y P.yachanana (Avila et al., 2014), donde las especies descritas presentan diferencias significativas con P.patagonicus, pero esto no ocurre en P.calcogaster. Nuestros resultados muestran diferencia significativa entre las medias de las especies, pero en los contrastes a posteriori solo P.patagonicus se diferencia completamente del resto (tabla 2a, b). Lo mismo se observa en el análisis discriminante (ADL), donde machos y hembras de P.patagonicus forman grupos aislados, mientras que en P.camilae, P.calcogaster y P.yachanana las hembras se superponen en gran parte y los machos en menor medida (fig. 2). Esta discriminación puede ser errónea, ya que el análisis presentó un error de clasificación del 37.7% total y mayor al 50% para P.yachanana, P.camilae y P.calcogaster.
En contraste con los datos lineales, en morfometría geométrica el objeto en estudio no se describe en términos de sus dimensiones, sino con respecto a la relación espacial entre sus partes, preservando así las propiedades geométricas de las estructuras analizadas (Adams et al., 2004; Bookstein, 1991; Kaliontzopoulou, 2011; Toro-Ibacache, Manríquez-Soto y Suazo-Galdames, 2010). Este método demostró ser una poderosa herramienta para captar la variación de la forma entre especies cercanamente relacionadas (e.g., Florio, Ingram, Rakotondravony, Louis y Raxworthy, 2012; Kaliontzopoulou, Carretero y Llorente, 2012) e incluso poblaciones de una misma especie (e.g., Kaliontzopoulou, Carretero y Llorente, 2010; Vidal, Ortiz, Ramírez y Lamborot, 2005; Vidal, Veloso y Méndez, 2006). Si bien fue demostrado que esta técnica es capaz de detectar dimorfismo sexual (Podarcis: Kaliontzopoulou, Carretero y Llorente, 2007, y Liolaemus: Vidal, 2011; Vidal et al., 2005), en nuestro grupo de estudio los análisis morfogeométricos no detectaron diferencias entre sexos en el tamaño de la cabeza, ni en la forma (fig. 3), a diferencia de lo observado en caracteres morfométricos clásicos (Cei y Castro, 1973; Ibargüengoytia, 2004; Scolaro et al., 2013). En lagartijas, el tamaño de la cabeza es un rasgo sobre el que opera la selección sexual (Kaliontzopoulou et al., 2007, 2012); los machos presentan cabezas más grandes que las hembras, pero hasta el momento existen pocos estudios sobre el efecto de la forma en el dimorfismo sexual.
A nivel interespecífico, a diferencia de lo observado con datos lineales, las especies del grupo P.calcogaster fueron discriminadas efectivamente entre sí, ya que en el gráfico del análisis de variación canónica solo se observó una pequeña superposición entre P.calcogaster y P.camilae (fig. 3), y el error de clasificación entre pares de especies fue bajo. La discrepancia en los resultados de ambos métodos puede ser debido a que el tamaño y la forma son diferentes rasgos y su selección puede verse afectada por diferentes fuerzas evolutivas (Kaliontzopoulou et al., 2007). Las variaciones morfológicas interespecíficas pueden estar sometidas a diferentes procesos de selección, pueden estar influenciadas por muchos aspectos biológicos, etológicos y/o ecológicos, pero hasta el momento poco se conoce sobre la variación del hábitat y la competencia trófica del género Phymaturus (Cei, 1986, 1993; Espinoza et al., 2004; Lobo et al., 2010; Núñez et al., 2010). Esta variación también puede estar afectada por la distribución de las especies: estudios previos han demostrado que las variables morfológicas continuas presentan una gran variación latitudinal y que la influencia del ambiente genera una alta plasticidad fenotípica (Cruz, Fitzgerald, Espinoza y Schulte, 2005; Minoli et al., 2014; Pincheira-Donoso, Tregenza y Hodgson, 2007). Este podría ser el caso de P.patagonicus y P.yachanana, que se encuentran a latitudes diferentes. En cambio, las áreas de distribución de P.calcogaster y P.camilae se encuentran en latitudes similares, por lo que esto no parecería ser la principal fuente de variación entre estas últimas. En cuanto al hábitat, en un estudio reciente Debandi, Corbalan, Scolaro y Roig-Juñent (2011) revelan que las diferencias ecológicas encontradas entre los 2 grupos principales de Phymaturus se deben más a la disponibilidad de hábitat en sus respectivas regiones que a diferencias en las preferencias de hábitat. Al no hallarse diferencias entre los 2 grandes grupos de este género, cabría esperar que tampoco las haya entre especies más cercanamente relacionadas. Sin embargo, son necesarios estudios más detallados que evalúen las preferencias de hábitat en función de su disponibilidad en estas especies. Específicamente, el tamaño y la forma de la cabeza están relacionados con las preferencias en la dieta, por ejemplo, el tamaño de la presa (Florio et al., 2012; Kaliontzopoulou et al., 2012); sin embargo, esto usualmente se asocia con organismos omnívoros o carnívoros. En Phymaturus todas las especies conocidas son herbívoras (Cei, 1986, 1993; Espinoza et al., 2004; Lobo et al., 2010; Núñez et al., 2010), por lo cual no necesariamente se podría hacer la misma asociación. La mayor variación de la forma se observó en la región temporal, en la occipital y en los párpados (tabla 4, fig. 4), lo que consideramos poco probable que haya evolucionado por selección natural relacionado con adaptaciones a la dieta.
Los resultados de la morfometría geométrica, a diferencia de las variables métricas, fueron consistentes con lo observado en la filogenia molecular del grupo. Los datos moleculares muestran que las especies del clado calcogaster están estrechamente relacionadas, especialmente P.calcogaster, P.camilae y P.yachanana. Algunos autores sugieren que la radiación del grupo patagonicus fue rápida, por lo que sus divergencias son recientes y no se espera una diferenciación morfológica marcada (Díaz-Gómez, 2008; Morando et al., 2013).
Si bien ambos tipos de datos morfométricos utilizados en este trabajo permitieron diferenciar las 4 especies descritas para el grupo Phymaturus calcogaster, los análisis geométricos las definieron más claramente y con menor error de clasificación que los realizados con datos lineales. Estos resultados muestran que la morfometría geométrica es una herramienta muy útil para delimitar especies a partir de la variación de la forma y avala de manera independiente las hipótesis de especies propuestas con morfología clásica, reconocidas con datos moleculares en el grupo Phymaturus calcogaster (Morando et al., 2013).
Coincidimos con Lobo et al. (2012b) en que la sistemática de Phymaturus no debe limitarse solo al conocimiento de su diversidad, sino también a la validación de las hipótesis de especies descritas en la literatura. El aumento en la diversidad del género en los últimos 10años conduce a discusiones sobre la validez de las especies descritas; algunas investigaciones revalidan especies antiguas (Lobo y Quinteros, 2005b) y otras sugieren sinonimias (Lobo et al., 2010, 2012a), además de las muchas especies candidatas que quedan por validar (Lobo et al., 2012a; Morando et al., 2013).
El problema de la validación de especies en Phymaturus (Lobo et al., 2010, 2012b) demuestra la necesidad de integrar diferentes fuentes de datos para elaborar hipótesis más sólidas sobre límites entre especies, por lo que una aproximación integral debería volverse una práctica generalizada en la taxonomía del género (Dayrat, 2005; Padial y de la Riva, 2007).
A P.C. Escudero, C.D. Medina, I. Minoli, C.H.F. Pérez y M. Olave por la asistencia en los trabajos de campo y en el procesado del material. A M. Quinto Sánchez e I. Minoli por asesorarnos en la implementación de los análisis de morfometría geométrica. A P.C. Escudero por sus útiles comentarios para mejorar el manuscrito. A F. Lobo, A. Brigada, J.A. Scolaro y J. Williams por facilitarnos la revisión de los ejemplares de las colecciones a su cargo. Agradecemos a las autoridades de las Direcciones de Fauna de las provincias de Río Negro y Chubut por los permisos de colecta emitidos durante varios años. Este trabajo recibió apoyo financiero de subsidios del CONICET-PIP, PIA y PEI, Agencia Nacional de Promoción de Ciencia y Tecnología-Foncyt (Argentina) y National Sciences Foundation-PIRE (EE.UU.). Los comentarios de 2 revisores anónimos y el soporte editorial de J. Rogelio Cedeño-Vázquez ayudaron a mejorar la versión final del manuscrito. M.A. González Marín es becaria del Área de Vacancia Geográfica del CONICET.
| Especie | Ejemplares |
|---|---|
| P. calcogaster | MCN 4295-4298, 4301-4304; JAS 1095-1097, 1154-1156; LJAMM-CNP 6550-6553, 6855-6857, 8125-8128, 8130-8132, 8138-8140, 8142, 8144, 13235-13237, 15384-15389; MLP.S 5130, 5132-5135, 5352-5354 |
| P. camilae | LJAMM-CNP 6106; JAS 1957-1962, 2078-2080, 2101, 2118, 2125 |
| P. patagonicus | JAS 1124-1126, 1160-1164; LJAMM-CNP 3205-3210, 14219, 15151-15167; DC-JMC 332, 333, 335, 842; MLP.S 777, 778 |
| P. yachanana | LJAMM-CNP 3233, 3235, 3237, 3238, 3259-3263, 3317-3319, 6555, 8203-8205, 14366-14368; MLP.S 2636 |
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.