Se proporcionan nuevos registros de la almeja asiática Corbicula fluminea (O. F Müller, 1774) para los humedales de las cuencas Papaloapan, Grijalva y Usumacinta. Se recolectó un total de 1,668 organismos en 7 localidades de la cuenca Papaloapan, 16 en Grijalva y 24 en Usumacinta, resultado de recolectas desde junio de 2011 hasta septiembre de 2015. Se registra su distribución en humedales ribereños, lacustres y estuarinos, en una diversidad de fondos desde limos hasta arenas, rocas y en sustratos con vegetación. Las mayores abundancias se presentaron para los humedales lacustres y en la cuenca del río Usumacinta. Se contribuye con el registro de 47 localidades en humedales de las cuencas del sureste, incrementando el conocimiento del estado que guardan las especies invasoras en el sureste de México, aun cuando hasta el momento no se han valorado los impactos ecológicos y económicos de las mismas.
First records of the Asian clam Corbicula fluminea (O. F. Müller, 1774) are provided for wetlands in the Papaloapan, Grijalva and Usumacinta basins. A total of 1,668 individuals were colected in 7 localities in Papaloapan, 16 in Grijalva and 24 in Usumacinta basins, sampling was performed from June 2011 to September 2015, in riverine, lacustrine and estuarine wetlands, in a variety of substrates from silt to sand and rocks, and substrates with vegetation. The highest abundances were in lacustrine wetlands and in the Usumacinta watershed. This study contributes with records in 47 localities and also, to the knowledge of exotic species in southern Mexico even when the ecological and economic impacts that this species may cause have not been assessed so far.
La introducción de especies exóticas en ambientes acuáticos es una preocupación mundial. Estas especies ocasionan diversas alteraciones y daños ecológicos, como los relacionados con la pérdida de biodiversidad, alteración en tramas tróficas y ciclos de nutrientes, así como el detrimento sanitario, lo cual se encuentra ampliamente documentado (Goldburg y Triplett, 1997), pero también se conocen daños económicos (Pimentel, 2011; Pimentel, Zúñiga y Morrison, 2005). Entre las especies de moluscos invasores de mayor importancia a nivel mundial se encuentran la almeja cebra Dreissena polymorpha (Pallas, 1771), la almeja quagga Dreissena rostriformis bugensis (Andrusov, 1897) y la almeja asiática Corbicula fluminea (O. F. Müller, 1774). Esta última especie ocasiona daños obstruyendo los canales de riego y tuberías de agua potable (Paunović et al., 2007), sin dejar de lado los problemas ecológicos. Tan solo para EUA los costos asociados a pérdidas por la invasión de esta especie ascienden a mil millones de dólares por año (Isom, 1986; OTA, 1993).
Las poblaciones de C. fluminea en México se han registrado hacia la costa del Pacífico (Baja California, Sonora, Sinaloa y Colima), cuencas del occidente (Jalisco y Nayarit) y Golfo de México (Tamaulipas, Veracruz y Chiapas) (Contreras-Arquieta y Contreras-Balderas, 1999; Fox, 1970; Hillis y Mayden, 1985; Torres-Orozco y Revueltas-Valle, 1996).
El sureste de México posee una importante red de ecosistemas fluviales y humedales en donde destacan los humedales de las cuencas de los ríos Papaloapan y Grijalva-Usumacinta (Barba-Macías, Rangel-Mendoza y Ramos-Reyes, 2006). En esta región se ha documentado en los últimos años la presencia de varias especies invasoras de moluscos, donde se destacan Tarebia granifera (Lamarck, 1822) y Melanoides tuberculata (Müller, 1774) (Aguirre-Muñoz et al., 2009; Albarrán-Melze, Rangel-Ruiz y Gamboa-Aguilar, 2009; Barba-Macías, Magaña y Juárez-Flores, 2014; Contreras-Arquieta y Contreras-Balderas, 1999; Cruz-Ascencio, Florido, Contreras-Arquieta y Sánchez, 2003; López-López, Sedeño-Díaz, Tapia y Oliveros, 2009; Naranjo-García y Olivera-Carrasco, 2014; Rangel-Ruiz, Gamboa-Aguilar, García-Morales y Ortiz-Lezama, 2011; Ramírez-Herrera y Urbano, 2014). C. fluminea ha tenido una dispersión geográfica amplia e importante en las últimas décadas (McMahon, 2002). Este trabajo contribuye con la ampliación de nuevos registros de la distribución de la almeja asiática C. fluminea en humedales de las cuencas Papaloapan, Grijalva y Usumacinta en el sureste mexicano.
Los organismos fueron capturados en muestreos diurnos resultado de recolectas entre los años 2011 al 2015, realizados con un esfuerzo multihábitat que incluyó el empleo de una draga Petite Ponar de 3kg (0.025m2), un nucleador metálico de 0.30m de diámetro (0.004m2), una red de arrastre tipo cuchara con una abertura de malla de 0.5mm (0.087m2), una red de arrastre tipo Renfro con luz de malla de 1mm (50m2) y una red chinchorro playero luz de malla de 3cm (62m2); todos los muestreos fueron por triplicado. Los sitios muestreados fueron humedales ribereños, lacustres y estuarinos en las cuencas de los ríos Papaloapan, Grijalva y Usumacinta (tabla 1). Los organismos recolectados fueron envasados y fijados en formol al 4% y se transportaron al laboratorio para su posterior procesamiento. Las muestras están conservadas en etanol al 70% y se encuentran depositadas en la Colección de Referencia de Fauna Acuática de El Colegio de la Frontera Sur, Unidad Villahermosa.
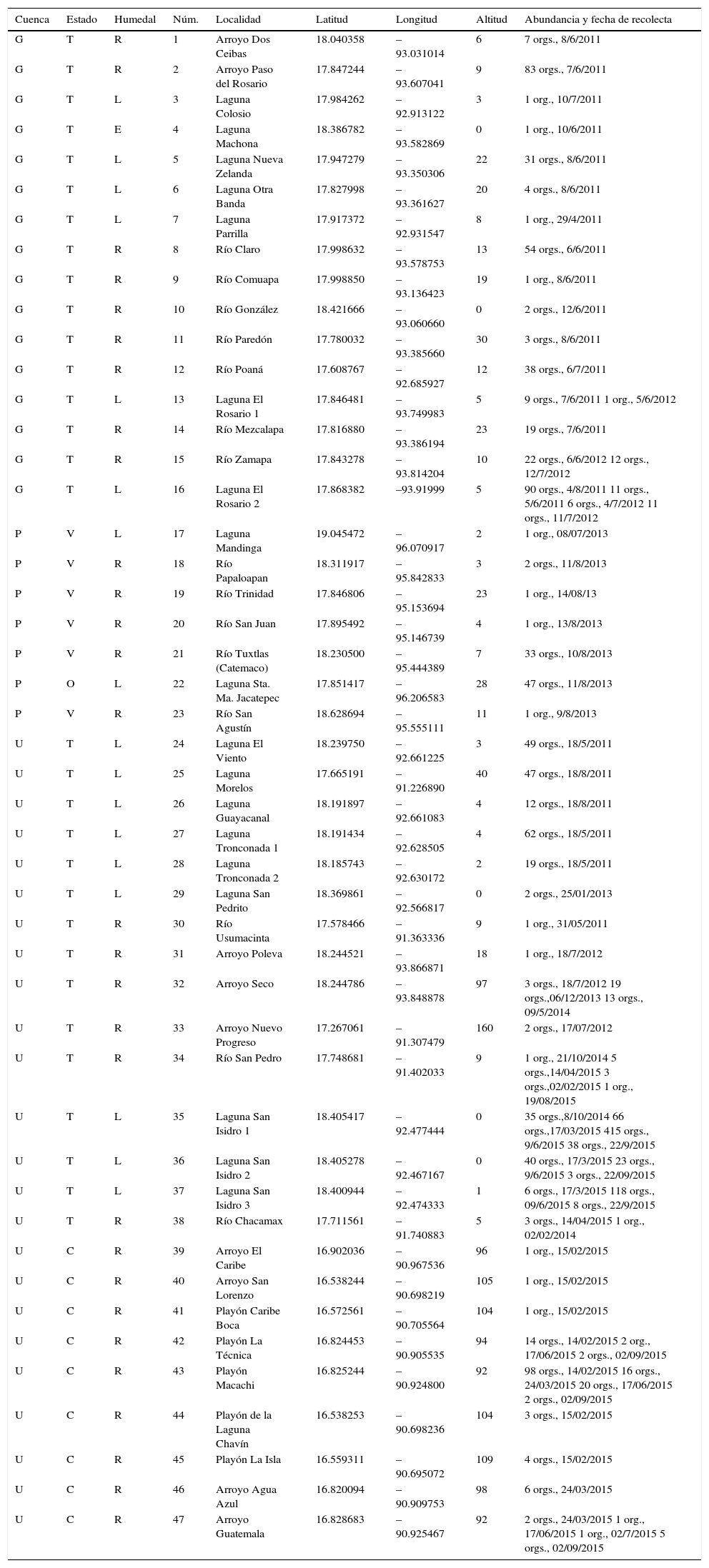
Registros de Corbicula fluminea por cuenca, abundancia y fecha de recolecta.
| Cuenca | Estado | Humedal | Núm. | Localidad | Latitud | Longitud | Altitud | Abundancia y fecha de recolecta |
|---|---|---|---|---|---|---|---|---|
| G | T | R | 1 | Arroyo Dos Ceibas | 18.040358 | –93.031014 | 6 | 7 orgs., 8/6/2011 |
| G | T | R | 2 | Arroyo Paso del Rosario | 17.847244 | –93.607041 | 9 | 83 orgs., 7/6/2011 |
| G | T | L | 3 | Laguna Colosio | 17.984262 | –92.913122 | 3 | 1 org., 10/7/2011 |
| G | T | E | 4 | Laguna Machona | 18.386782 | –93.582869 | 0 | 1 org., 10/6/2011 |
| G | T | L | 5 | Laguna Nueva Zelanda | 17.947279 | –93.350306 | 22 | 31 orgs., 8/6/2011 |
| G | T | L | 6 | Laguna Otra Banda | 17.827998 | –93.361627 | 20 | 4 orgs., 8/6/2011 |
| G | T | L | 7 | Laguna Parrilla | 17.917372 | –92.931547 | 8 | 1 org., 29/4/2011 |
| G | T | R | 8 | Río Claro | 17.998632 | –93.578753 | 13 | 54 orgs., 6/6/2011 |
| G | T | R | 9 | Río Comuapa | 17.998850 | –93.136423 | 19 | 1 org., 8/6/2011 |
| G | T | R | 10 | Río González | 18.421666 | –93.060660 | 0 | 2 orgs., 12/6/2011 |
| G | T | R | 11 | Río Paredón | 17.780032 | –93.385660 | 30 | 3 orgs., 8/6/2011 |
| G | T | R | 12 | Río Poaná | 17.608767 | –92.685927 | 12 | 38 orgs., 6/7/2011 |
| G | T | L | 13 | Laguna El Rosario 1 | 17.846481 | –93.749983 | 5 | 9 orgs., 7/6/2011 1 org., 5/6/2012 |
| G | T | R | 14 | Río Mezcalapa | 17.816880 | –93.386194 | 23 | 19 orgs., 7/6/2011 |
| G | T | R | 15 | Río Zamapa | 17.843278 | –93.814204 | 10 | 22 orgs., 6/6/2012 12 orgs., 12/7/2012 |
| G | T | L | 16 | Laguna El Rosario 2 | 17.868382 | –93.91999 | 5 | 90 orgs., 4/8/2011 11 orgs., 5/6/2011 6 orgs., 4/7/2012 11 orgs., 11/7/2012 |
| P | V | L | 17 | Laguna Mandinga | 19.045472 | –96.070917 | 2 | 1 org., 08/07/2013 |
| P | V | R | 18 | Río Papaloapan | 18.311917 | –95.842833 | 3 | 2 orgs., 11/8/2013 |
| P | V | R | 19 | Río Trinidad | 17.846806 | –95.153694 | 23 | 1 org., 14/08/13 |
| P | V | R | 20 | Río San Juan | 17.895492 | –95.146739 | 4 | 1 org., 13/8/2013 |
| P | V | R | 21 | Río Tuxtlas (Catemaco) | 18.230500 | –95.444389 | 7 | 33 orgs., 10/8/2013 |
| P | O | L | 22 | Laguna Sta. Ma. Jacatepec | 17.851417 | –96.206583 | 28 | 47 orgs., 11/8/2013 |
| P | V | R | 23 | Río San Agustín | 18.628694 | –95.555111 | 11 | 1 org., 9/8/2013 |
| U | T | L | 24 | Laguna El Viento | 18.239750 | –92.661225 | 3 | 49 orgs., 18/5/2011 |
| U | T | L | 25 | Laguna Morelos | 17.665191 | –91.226890 | 40 | 47 orgs., 18/8/2011 |
| U | T | L | 26 | Laguna Guayacanal | 18.191897 | –92.661083 | 4 | 12 orgs., 18/8/2011 |
| U | T | L | 27 | Laguna Tronconada 1 | 18.191434 | –92.628505 | 4 | 62 orgs., 18/5/2011 |
| U | T | L | 28 | Laguna Tronconada 2 | 18.185743 | –92.630172 | 2 | 19 orgs., 18/5/2011 |
| U | T | L | 29 | Laguna San Pedrito | 18.369861 | –92.566817 | 0 | 2 orgs., 25/01/2013 |
| U | T | R | 30 | Río Usumacinta | 17.578466 | –91.363336 | 9 | 1 org., 31/05/2011 |
| U | T | R | 31 | Arroyo Poleva | 18.244521 | –93.866871 | 18 | 1 org., 18/7/2012 |
| U | T | R | 32 | Arroyo Seco | 18.244786 | –93.848878 | 97 | 3 orgs., 18/7/2012 19 orgs.,06/12/2013 13 orgs., 09/5/2014 |
| U | T | R | 33 | Arroyo Nuevo Progreso | 17.267061 | –91.307479 | 160 | 2 orgs., 17/07/2012 |
| U | T | R | 34 | Río San Pedro | 17.748681 | –91.402033 | 9 | 1 org., 21/10/2014 5 orgs.,14/04/2015 3 orgs.,02/02/2015 1 org., 19/08/2015 |
| U | T | L | 35 | Laguna San Isidro 1 | 18.405417 | –92.477444 | 0 | 35 orgs.,8/10/2014 66 orgs.,17/03/2015 415 orgs., 9/6/2015 38 orgs., 22/9/2015 |
| U | T | L | 36 | Laguna San Isidro 2 | 18.405278 | –92.467167 | 0 | 40 orgs., 17/3/2015 23 orgs., 9/6/2015 3 orgs., 22/09/2015 |
| U | T | L | 37 | Laguna San Isidro 3 | 18.400944 | –92.474333 | 1 | 6 orgs., 17/3/2015 118 orgs., 09/6/2015 8 orgs., 22/9/2015 |
| U | T | R | 38 | Río Chacamax | 17.711561 | –91.740883 | 5 | 3 orgs., 14/04/2015 1 org., 02/02/2014 |
| U | C | R | 39 | Arroyo El Caribe | 16.902036 | –90.967536 | 96 | 1 org., 15/02/2015 |
| U | C | R | 40 | Arroyo San Lorenzo | 16.538244 | –90.698219 | 105 | 1 org., 15/02/2015 |
| U | C | R | 41 | Playón Caribe Boca | 16.572561 | –90.705564 | 104 | 1 org., 15/02/2015 |
| U | C | R | 42 | Playón La Técnica | 16.824453 | –90.905535 | 94 | 14 orgs., 14/02/2015 2 org., 17/06/2015 2 orgs., 02/09/2015 |
| U | C | R | 43 | Playón Macachi | 16.825244 | –90.924800 | 92 | 98 orgs., 14/02/2015 16 orgs., 24/03/2015 20 orgs., 17/06/2015 2 orgs., 02/09/2015 |
| U | C | R | 44 | Playón de la Laguna Chavín | 16.538253 | –90.698236 | 104 | 3 orgs., 15/02/2015 |
| U | C | R | 45 | Playón La Isla | 16.559311 | –90.695072 | 109 | 4 orgs., 15/02/2015 |
| U | C | R | 46 | Arroyo Agua Azul | 16.820094 | –90.909753 | 98 | 6 orgs., 24/03/2015 |
| U | C | R | 47 | Arroyo Guatemala | 16.828683 | –90.925467 | 92 | 2 orgs., 24/03/2015 1 org., 17/06/2015 1 org., 02/7/2015 5 orgs., 02/09/2015 |
C: Chiapas; E: estuarino; G: Grijalva; L: lacustre; O: Oaxaca; P: Papaloapan; R: ribereño; T: Tabasco; U: Usumacinta; V: Veracruz.
Se recolectó un total de 1,668 organismos de la almeja asiática C. fluminea en 4 estados (Oaxaca con 47 organismos, Veracruz con 39, Tabasco con 1,403 y Chiapas con 179) registrados en 47 localidades, 7 en la cuenca del Papaloapan con un total de 86 organismos, 16 en la cuenca Grijalva con 454 organismos y 24 localidades en la cuenca Usumacinta con 1,128 organismos.
La distribución de los registros de C. fluminea de acuerdo con el tipo de humedal fue de la siguiente manera: en 29 localidades ribereñas, 17 lacustres y una estuarina. En la cuenca Papaloapan se encontró en 5 localidades ribereñas con 38 organismos, y en 2 localidades lacustres con 48; en la cuenca Grijalva se encontró en una localidad en humedal estuarino con un organismo, 6 localidades lacustres con 212 organismos y 9 localidades ribereñas con un total de 241 organismos y, por último, en la cuenca Usumacinta, donde la distribución por tipo de humedal fue en 9 localidades lacustres con 896 organismos y 15 localidades ribereñas con 232 organismos (tabla 1).
Se han monitoreado varias localidades durante distintos años y en algunos sitios su densidad permanece elevada, se encuentra en una gran variedad de sustratos que van desde fondos rocosos, arenosos y limosos, en sustratos con materia orgánica y restos de vegetación, y en vegetación flotante. Sin embargo, latitudinalmente se encuentra mejor representada en zonas de planicie (<20m) como varias localidades de la Reserva de la Biosfera Pantanos de Centla, lo cual concuerda con otros estudios debido a que en estas zonas se presenta un incremento de sólidos disueltos y material en suspensión, característico de las zonas bajas de las cuencas de la zona centro-sur del Golfo de México (Bello, Lozano, Ramírez, Aquino y Castillo, 2009).
Entre los impactos documentados del bivalvo C. fluminea se encuentra la obstrucción de tuberías en sistemas de enfriamiento (Apablaza, 1984), lo que impide el flujo de agua en canales de irrigación y abastecimiento, además de que ocasiona la destrucción del concreto, compiten por el espacio y el alimento disponibles con almejas Unionidae nativas (Britton y Fuller, 1979) y alteran el sustrato de las especies nativas (Paunović et al., 2007). Aun cuando no existen registros de afectación a infraestructuras y tuberías en la zona de estudio, las condiciones que se presentan en los humedales de estas cuencas son propicias para su desarrollo, principalmente por la variación de los flujos y la persistencia del nivel del agua en las crecidas e inundaciones, altas temperaturas, una variedad de sustratos y un alto contenido de nutrientes, como está reportado para otros estudios (Sousa, Rufino, Gaspar, Antunes y Guilhermino, 2008).
Las cuencas aquí analizadas son áreas amplias de importancia agrícola y asentamientos humanos, además de que son las cuencas con los mayores flujos hídricos del país, así como extensas áreas de humedales. Los ríos Papaloapan y Grijalva se encuentran regulados por los sistemas de presas asentados, a diferencia del río Usumacinta, el cual hasta ahora no está represado. Este trabajo contribuye con 47 nuevos registros de la almeja asiática C. fluminea en humedales de las cuencas Papaloapan, Grijalva y Usumacinta, las más importantes del sureste mexicano.
Los autores agradecen la disponibilidad de información del material biológico y registros de la Colección de Referencia para Fauna Acuática de ECOSUR, Unidad Villahermosa.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.